Журнал физической химии, 2019, T. 93, № 4, стр. 536-538
Кинетика хемосорбции диоксида углерода композиционным поглотителем в замкнутом объеме
Ю. А. Суворова a, b, *, А. А. Тарова a, b
a ОАО Корпорация “Росхимзащита”
Тамбов, Россия
b Тамбовский государственный технический университет
Тамбов, Россия
* E-mail: syvorovaya@mail.ru
Поступила в редакцию 19.07.2018
Аннотация
Экспериментально исследована кинетика хемосорбции СО2 композиционным поглотителем в замкнутом объеме при поддерживаемой объемной доле СО2 в воздухе от 0.2 до 2.6%. Установлено, что процесс хемосорбции СО2 композиционным поглотителем описывается уравнением Таммана. Для расчета процесса хемосорбции предложено кинетическое уравнение в виде зависимости степени превращения от скорости поглощения. Показано, что коэффициенты кинетического уравнения линейно зависят от объемной доли СО2 в воздухе.
В системах жизнеобеспечения человека для очистки воздуха от диоксида углерода СО2 широко применяются химические поглотители на основе гидроксидов щелочных и щелочноземельных металлов, в частности, известковые химические поглотители на основе гидроксида кальция Са(ОН)2. Системы очистки воздуха замкнутого объема с применением таких поглотителей могут быть организованы без затрат энергии на принудительную подачу воздуха в адсорбер. Для этого химический поглотитель в виде подвесных конструкций размещают в помещении. Для использования в таких системах разработан композиционный известковый поглотитель в виде листового материала толщиной около 1 мм, состоящий из гидроксида кальция Са(ОН)2, гидроксида калия КОН, воды и полимерного связующего [1].
При проектировании систем очистки воздуха необходимо учитывать кинетические закономерности процесса хемосорбции СО2 химическим поглотителем. Взаимодействие СО2 с известковыми химическими поглотителями представляет собой гетерогенный процесс контактирования газовой, жидкой и твердой фаз с протеканием химических реакций
(1)
${\text{2KOH}}({\text{ж }}) + {\text{C}}{{{\text{O}}}_{{\text{2}}}}({\text{г }}) \to {{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}({\text{ж }}) + {{{\text{H}}}_{{\text{2}}}}{\text{O}}({\text{ж }}),$(2)
$\begin{gathered} {{{\text{K}}}_{{\text{2}}}}{\text{C}}{{{\text{O}}}_{{\text{3}}}}({\text{ж }}) + {\text{Ca}}{{\left( {{\text{OH}}} \right)}_{{\text{2}}}}({\text{т в }}{\text{.}}) \to \\ \to \;{\text{2KOH}}({\text{ж }}) + {\text{CaC}}{{{\text{O}}}_{{\text{3}}}}({\text{т в }}.), \\ \end{gathered} $Математическое описание процесс взаимодействия СО2 с известковыми химическими поглотителями получил в работе [4]. В работе [1] кинетику хемосорбции СО2 композиционного известкового поглотителя с полимерным связующим исследовали в аппарате проточного типа на образцах массой 3 г, при этом оценочным критерием сорбционной емкости являлся химический анализ образцов после испытаний. Данный метод дает достаточно высокую погрешность (около 10% при степени превращения менее 0.8, и до 20% при степени превращения более 0.8) и не отображает процессы, происходящие в замкнутом объеме без принудительной подачи воздуха в адсорбер.
Целью настоящей работы является исследование кинетики хемосорбции СО2 композиционным поглотителем в замкнутом объеме и установление кинетических закономерностей процесса для использования при расчете и проектировании изделий систем жизнеобеспечения человека.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Экспериментальные исследования проводили в испытательной замкнутой камере объемом 6 м3 при поддерживаемой объемной доле СО2 в воздухе – 0.2, 0.4, 1.0, 1.8, 2.6%; температуре воздуха в камере – 20°С; начальной относительной влажности воздуха – 70%. Выбор исследуемого диапазона объемной доли СО2 определялся реальными условиями эксплуатации химического поглотителя. Поглотитель размещали в камере в виде “подвесных листов”, масса поглотителя составляла 2.5 кг. Значение объемной доли поддерживалось подачей в камеру СО2. При проведении эксперимента осуществлялось перемешивание газовоздушной смеси в закрытой камере вентилятором с кратностью циркуляции 5 для выравнивания объемных долей СО2 в камере. Замер объемной доли СО2 осуществлялся в четырех точках, две из которых находились в зоне расположения листов поглотителя, две – в пустом объеме камеры. При этом отклонение значений объемной доли СО2 в каждой точке от условий эксперимента зафиксировано не было. В связи с этим принято допущение, что камера представляет собой реактор идеального смешения.
По мере отработки поглотителя подача СО2 в камеру уменьшалась. Испытания прекращали, когда подача СО2 приближалась к нулю.
Во время испытаний фиксировали значения параметров воздуха в камере и показания приборов, после чего рассчитывали объем поглощенного СО2Vch, дм3, используя уравнение материального баланса
(3)
${{V}_{{{\text{ch}}}}} = \text{v}\left( {\frac{{{{\varphi }^{0}} - {{\varphi }^{t}}}}{{100}}} \right) + {{V}_{{\text{e}}}},$При постоянной поддерживаемой объемной доле СО2 в воздухе разность φ0 – φt равна нулю, поэтому в данном случае слагаемое, содержащее эту разность, не учитывали.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
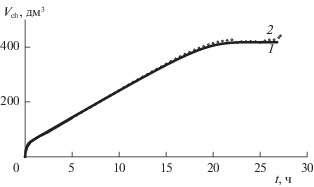
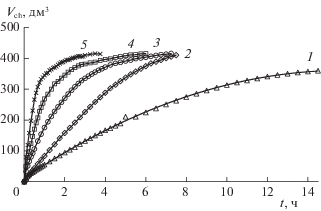
На рис. 1 представлены полученные экспериментальные кривые хемосорбции при различной объемной доле СО2 в воздухе.
Рис. 1.
Экспериментальные кривые хемосорбции при объемной доле СО2 в камере: 1 – 0.2; 2 – 0.4; 3 – 1.0; 4 – 1.8; 5 – 2.6%.
Для описания кинетики хемосорбции из ряда формальных зависимостей [5, 6] типа α = f(t), где α – степень превращения, было выбрано уравнение Таммана (4), которое с наименьшей погрешностью (не более 5%) описывает процесс кинетики хемосорбции диоксида углерода композиционным поглотителем:
где k1 и C1 – коэффициенты уравнения (4); t – время, мин.Степень превращения α в данном случае определяли как долю прореагировавшего вещества в поглотителе:
где m – масса поглотителя, m = 2.5 кг; Vr – объем СО2, который поглотитель может теоретически хемосорбировать по химической реакции, Vr = = 212 дм3/кг.Скорость хемосорбции w, дм3/(мин кг) находили по формуле:
Найденные значения скорости процесса хемосорбции аппроксимировали эмпирическими логарифмическими зависимостями: где k2 и C2 – коэффициенты уравнения.В таблице 1 приведены значения коэффициентов k1, C1уравнения (4) и k2, C2уравнения (7), рассчитанные по экспериментальным данным.
Таблица 1.
Коэффициенты k1, C1уравнения (4) и k2, C2уравнения (7)
| φ, % | k1 | С1 | k2 | С2 |
|---|---|---|---|---|
| 0.2 | 0.28 | –0.95 | –0.09 | 0.54 |
| 0.4 | 0.27 | –0.84 | –0.13 | 0.82 |
| 1.0 | 0.22 | –0.57 | –0.39 | 2.28 |
| 1.8 | 0.17 | –0.22 | –0.71 | 3.90 |
| 2.6 | 0.14 | 0.07 | –1.58 | 8.01 |
Для нахождения зависимости коэффициентов k1, C1, k2, C2 от объемной доли СО2 в воздухе преобразовали уравнения (4) и (7):
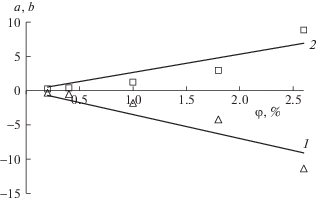
где $a = \frac{{{{k}_{2}}}}{{{{k}_{1}}}}$ и $b = {{C}_{2}} - \frac{{{{C}_{1}}{{k}_{2}}}}{{{{k}_{1}}}}$.Коэффициенты a и b уравнения (8) вычисляли, используя данные таблицы. Зависимость рассчитанных значений коэффициентов a и b от объемной доли СО2 в воздухе представлена в виде графика на рис. 2. Как видно на графике, коэффициенты a и b линейно зависят от объемной доли СО2 в воздухе, при этом:
Для оценки применимости уравнений (8)–(10) к реальным условиям эксплуатации химического поглотителя рассчитана скорость хемосорбции при постоянной подаче СО2 в замкнутый объем, что имитирует нахождение в камере одного человека. Проведено сравнение расчетных данных с экспериментальными, полученными при испытании химического поглотителя в камере объемом 6 м3 при условиях: объемный расход СО2, подаваемого в камеру – 20 дм3/ч; температура воздуха в испытательной камере – 20°С; относительная влажность воздуха – 70%; начальная объемная доля СО2 в камере – 0.8%.Для расчета процесса хемосорбции использовали систему уравнений (11), включающую продифференцированное по времени уравнение (3) и полученные формальным анализом экспериментальных данных уравнения (8)–(10), в которых скорость процесса хемосорбции представляет собой функцию зависимости от степени превращения и объемной доли СО2.
(11)
$\left. \begin{gathered} \frac{{\partial {{\varphi }^{{t + 1}}}}}{{\partial t}} = 100\left( {\frac{1}{\text{v}}\frac{{\partial {{V}_{{\text{e}}}}}}{{\partial t}} + \frac{1}{{100}}\frac{{\partial {{\varphi }^{t}}}}{{\partial t}} - \frac{1}{\text{v}}\frac{{\partial w}}{{\partial t}}} \right), \hfill \\ \frac{{\partial w}}{{\partial t}} = f(\alpha ,\varphi ). \hfill \\ \end{gathered} \right\}$Список литературы
Суворова Ю.А. Композиционные поглотители диоксида углерода с полимерным связующим: аппаратурно-технологическое оформление производства и кинетика хемосорбции. Дис. … канд. техн. наук. Тамбов: Ин-т, 2015. 212 с.
Wang T.C. 1982. Carbon dioxide scrubbing materials in life support systems. IN: The Characterization of Carbon Dioxide Absorbing Agents for Life Support Equipment. New York, ASME, 1982. P. 1–21.
Данквертс П.В. Газожидкостные реакции. М.: Химия, 1973. 296 с.
Гладышев Н.Ф., Гладышева Т.В., Путин Б.В., Путин С.Б. Известковые поглотители нового поколения. М.: Издательский дом “Спектр”, 2012. 136 с.
Кутолин С.А. Уравнения кинетики реакции в твердых телах. М.: Электроника, 1968. 102 с.
Khawam A., Douglas R. // J. Phys. Chem. B. 2006. № 110 (35). P. 17315.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии