Журнал физической химии, 2019, T. 93, № 4, стр. 543-551
Свойства мицеллярных растворов децилсульфата натрия в области относительно высоких концентраций
В. С. Кузнецов a, В. Г. Баделин b, *, Е. Ю. Тюнина b, В. П. Жердев c
a Ивановский государственный университет
153025 Иваново, Россия
b Российская академия наук, Институт химии растворов им. Г.А. Крестова
153045 Иваново, Россия
c Ивановский государственный политехнический университет
153037 Иваново, Россия
* E-mail: vgb@isc-ras.ru
Поступила в редакцию 12.02.2018
Аннотация
Методом прецизионной адиабатной дифференциальной сканирующей микрокалориметрии исследованы теплоемкостные свойства водных растворов анионного ПАВ – децилсульфата натрия в области моляльных концентраций 0.28–0.42 моль кг–1 и температур 278–363 К. Получены концентрационные и температурные зависимости удельных и кажущихся теплоемкостей растворов с интервалом в 0.01 моль кг-1, парциальных мольных теплоемкостей растворенного вещества и растворителя, а также избыточных парциальных мольных теплоемкостей. Определена граница Крафта. Анализ характерных изменений указанных свойств позволил выявить наличие структурных изменений в мицеллах децилсульфата натрия, которые соответствуют трансформации формы мицелл из цилиндрической в пластинчатую в области третьей критической мицеллярной концентрации.
Возрастающий интерес к исследованию надмолекулярных структур, которые являются основой молекулярной организации биологических систем, обусловлен возможностью моделирования различных биохимических процессов, протекающих в организме человека, на основе использования мицеллярных растворов поверхностноактивных веществ (ПАВ) [1–3]. До сих пор остаются неясными вопросы о механизме стабилизации мицелл разного размера и формы, влияния их структуры на избирательность взаимодействия и т.д. [4–7]. В связи с этим, актуальными являются структурно-термодинамические исследования растворов ионогенных ПАВ в области относительно высоких концентраций, а также их растворов, модифицированных аминокислотами. Мицеллоподобные образования, ядром которых являются ферромагнитные частицы, окруженные сложно структурированным слоем наполнителя и пластификатора, оказываются существенным элементом, определяющим взаимодействие соответствующих коллоидных растворов с активированной волокнистой основой, выполняющей роль как поверхности адгезии, так и армирующего фактора. Показано [8], что такие материалы, как элементы одежды, способны оказывать влияние на нервную и сердечно-сосудистую системы и способность адаптации человека к стрессовым состояниям. Благодаря термодинамическим расчетам, подобным излагаемым в статье, появляется возможность оценивать предполагаемую эффективность этих материалов уже на этапе подбора компонентов коллоидных смесей и типа армирующих волокон и, следовательно, уменьшить значимость эмпирических поисков.
Ранее [9] нами были определены объемные и термические свойства водных растворов децилсульфата натрия в области моляльных концентраций 0.28–0.42 m и температур 283–318 К. В результате выявлено наличие структурных изменений в мицеллах, обусловленные, по всей видимости, их трансформацией из цилиндрической в пластинчатую форму, что может соответствовать третьей критической мицеллярной концентрации (КМК3). Однако не удалось точно определить концентрационный и температурный диапазоны существования этого межмицеллярного структурного перехода. Для уверенной интерпретации структурных превращений в исследуемых растворах необходимы прецизионные измерения их теплоемкостных свойств. В центре данной работы – исследование теплоемкости водных растворов децилсульфата натрия (ДСН) в указанных выше интервалах концентраций и температур с целью определения границы Крафта, концентрационно-температурных пределов и равновесных параметров структурного перехода, идентифицируемого как перестройка цилиндрических мицелл в пластинчатые бислойные мицеллы, и соответствующего КМК3. Кроме того, вычислены температурные зависимости концентрационных констант равновесия между мицеллярными формами.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Децилсульфат натрия (фирмы “Lancaster”) и хлорид натрия NaCl (необходимый для тестирования калориметра) очищали и хранили так же, как описано в [10]. Вода, используемая для приготовления растворов, подвергалась деионизации и двойной дистилляции. Все растворы приготовлены весовым методом, используя весы Sartorius-ME215S (с точностью 1 × 10–5 г). Измерения теплоемкости водных растворов выполнены на адиабатическом дифференциальном сканирующем микрокалориметре SCAL-1 (“Биоприбор”, г. Пущино). Микро-калориметр оснащен термоэлементами Пельтье, устройством для создания постоянного давления в рабочей и следящей ячейках детектора калориметра, а также компьютерным терминалом и программным обеспечением для вычисления удельной теплоемкости. Объем каждого из двух контейнеров равен 0.337 см3. Интегральная чувствительность детектора калориметра составляет 33.218 нВт/мВ, калибровочная мощность – 25 мкВт, скорость сканирования – 0.5 К/мин, постоянная времени – 20 с. Прибор, детальное описание которого приведено в [11, 12], был протестирован по теплоемкости водных растворов хлорида натрия, рекомендованного в качестве стандарта для сканирующей калориметрии растворов [13]. Так, величина теплоемкости водного раствора NaCl (m = 0.2000 ± 0.0002 моль ⋅ кг–1) при 298.15 К составила 4.13278 ± 0.00012 Дж K–1 г–1 (с учетом среднеквадратической погрешности в серии 10 параллельных сканирований без перезарядки калориметра [12]), что согласуется с литературными данными Сp, lit = 4.13266 ± 0.075 Дж K–1 г–1 [13, 14]. Принимая во внимание влияние всех возможных факторов (колебания температуры, концентрации, скорости нагрева, калибровки прибора, др.) на процесс измерения удельной теплоемкости, совокупная стандартная погрешность полученной величины Cp не превышала ±8.08 × × 10–3 Дж K–1 г–1. Полученные экспериментальные значения удельной теплоемкости водных растворов ДСН приведены в табл. 1.
Таблица 1.
Удельные теплоемкости Cp (Дж г–1 К–1) водных растворов децилсульфата натрия при разных концентрациях и температурах
| Т, К | 0.28 m | 0.30 m | 0.32 m | 0.33 m | 0.34 m | 0.35 m | 0.37 m | 0.38 m | 0.40 m | 0.42 m |
|---|---|---|---|---|---|---|---|---|---|---|
| 278 | 4.024 | 4.014 | 4.007 | 4.002 | 3.994 | 3.988 | 3.984 | 3.987 | 3.983 | 3.968 |
| 280 | 4.021 | 4.011 | 4.004 | 3.998 | 3.991 | 3.984 | 3.980 | 3.984 | 3.978 | 3.960 |
| 283 | 4.016 | 4.007 | 3.999 | 3.994 | 3.987 | 3.980 | 3.976 | 3.979 | 3.976 | 3.954 |
| 293 | 4.008 | 3.998 | 3.991 | 3.986 | 3.979 | 3.972 | 3.968 | 3.971 | 3.967 | 3.946 |
| 298 | 4.006 | 3.996 | 3.989 | 3.984 | 3.977 | 3.970 | 3.966 | 3.969 | 3.966 | 3.944 |
| 303 | 4.006 | 3.996 | 3.989 | 3.984 | 3.977 | 3.969 | 3.966 | 3.969 | 3.966 | 3.944 |
| 308 | 4.007 | 3.996 | 3.989 | 3.985 | 3.978 | 3.970 | 3.968 | 3.970 | 3.966 | 3.945 |
| 323 | 4.014 | 4.003 | 3.995 | 3.991 | 3.986 | 3.977 | 3.976 | 3.977 | 3.973 | 3.953 |
| 333 | 4.021 | 4.011 | 4.003 | 3.998 | 3.994 | 3.984 | 3.984 | 3.985 | 3.982 | 3.960 |
| 343 | 4.031 | 4.020 | 4.012 | 4.007 | 4.003 | 3.994 | 3.993 | 3.994 | 3.991 | 3.970 |
| 353 | 4.043 | 4.032 | 4.023 | 4.019 | 4.015 | 4.005 | 4.005 | 4.006 | 4.002 | 3.982 |
| 363 | 4.056 | 4.046 | 4.038 | 4.033 | 4.029 | 4.020 | 4.020 | 4.020 | 4.016 | 3.997 |
РАСЧЕТНАЯ ЧАСТЬ
Кажущаяся мольная теплоемкость (КМТ) (ΦCp) определяется из экспериментальных значений удельной теплоемкости по уравнению [15, 16]:
(1)
$\begin{gathered} {{\Phi }_{{Cp}}} \equiv ({{C}_{{p,{\text{о б щ }}}}} - {{n}_{1}}C_{{p1}}^{{^{ \circ }}}){\text{/}}{{n}_{2}} = \\ = {{M}_{2}}{{C}_{p}} + 1000({{C}_{p}} - C_{p}^{{^{ \circ }}}){\text{/}}m, \\ \end{gathered} $Парциальная мольная теплоемкость (ПМТ) растворенного вещества (${{\bar {C}}_{{p2}}}$) и растворителя (${{\bar {C}}_{{p1}}}$) в растворе вычисляются по следующим соотношениям [15–18]:
(3)
$\begin{gathered} {{{\bar {C}}}_{{p2}}} \equiv {{(\partial {{C}_{{p,{\text{о б щ }}}}}{\text{/}}\partial m)}_{{P,T}}} = {{\Phi }_{{Cp}}} + m{{(\partial {{\Phi }_{{Cp}}}{\text{/}}\partial m)}_{{P,T}}} = \\ = (1000 + m{{M}_{2}}){{(\partial {{C}_{p}}{\text{/}}\partial m)}_{{P,T}}} + {{M}_{2}}{{C}_{p}}, \\ \end{gathered} $(4)
$\begin{gathered} {{{\bar {C}}}_{{p1}}} \equiv {{(\partial {{C}_{{p,{\text{о б щ }}}}}{\text{/}}\partial {{n}_{1}})}_{{P,T}}} = C_{{p1}}^{^\circ }-- \\ - \;({{m}^{2}}{{M}_{1}}{\text{/}}1000){{(\partial {{\Phi }_{{Cp}}}{\text{/}}\partial m)}_{{P,T}}}, \\ \end{gathered} $Избыточная парциальная мольная теплоемкость (ИПМТ) раствора $\bar {C}_{p}^{E}$ равна
(7)
$\bar {C}_{p}^{E} \equiv {{C}_{p}}_{{,m}} - C_{{p,m}}^{{{\text{и д }}}} = {{C}_{p}}_{{,m}} - (1 - {{x}_{2}})C_{{p1}}^{^\circ } - {{x}_{2}}C_{{p2}}^{*},$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Как известно [12, 20–23], в водных растворах гомологов алкилсульфатов натрия (децил- (ДСН), додецил-(ДДСН), тетрадецил-(ТДСН) и гексадецил-(ГДСН)) существуют полиморфные межмицеллярные превращения, соответствующие различным КМК. Так, для водных растворов децилсульфата натрия КМК1 = 0.029 m, КМК1–2 = = 0.12 m и КМК2 = 0.22 m. Эти равновесные концентрации соответствуют мицеллообразованию сферических мицелл (КМК1), промежуточному преобразованию формы мицелл “сфера–эллипсоид” (КМК1–2) и трансформации “эллипсоид–цилиндр” (КМК2), которые были изучены ранее [12, 24–26] методами ДСК и денсиметрии. Вместе с тем, остается открытым вопрос о существовании КМК3 для исследуемой системы ДСН–вода, хотя для водных растворов других алкилгомологов уже установлены ее значения: 0.15, 0.038 и 0.0095 моль дм–3, соответственно, для ДДСН, ТДСН и ГДСН [23].
В работе [9] были обнаружены некоторые особенности на изотермах и изоконцентратах объемных свойств растворов ДСН при концентрациях 0.33–0.35 m, что может свидетельствовать о возможных структурных изменениях, соответствующих трансформации мицелл из цилиндрической в пластинчатую форму в области КМК3, расположенной за вторым межмицеллярным переходом с КМК2, согласно принятым моделям мицеллярного полиморфизма [21, 22, 27–30]. Задачей настоящего исследования является идентификация структурных превращений в водных растворах децилсульфата натрия в указанном концентрационном и температурном интервалах и определение границ и равновесных параметров межмицеллярного перехода в области КМК3 с использованием метода ДСК.
Как известно [16, 19], если в растворах отсутствуют изменения во взаимодействиях растворенное вещество – растворитель и растворенное вещество – растворенное вещество, то теплоемкостные свойства раствора будут находиться в линейной зависимости от концентрации. Однако в реальных ионных мицеллярных растворах при изменении концентрации происходят структурные превращения, обусловленные изменениями гидрофобных и электростатических взаимодействий, такие как изменение чисел агрегации мицелл, степени связывания противоинов, лиофобизации и др., приводящие к изменению способа упаковки дифильных молекул ПАВ в мицелле и трансформации их геометрической формы в области КМК [21–23, 30]. Возрастание величин КМТ и ПМТ растворенного вещества связывают с увеличением степеней свободы и (или) интенсивности молекулярных движений, что ведет к деструктивным процессам в мицеллах, а уменьшение этих величин свидетельствует об образовании более упорядоченных структур. Минимумы на изотермах КМТ ΦCp(m) и ПМТ ${{\bar {C}}_{{p2}}}$(m) соответствуют равновесным концентрациям ионов ПАВ, в равных долях агрегированных в более “рыхлую” и более “плотную” формы мицелл. Так, в случае достижения КМК3 при относительно высокой температуре мицеллы с преимущественно “рыхлой” упаковкой периферической части представляют собой мицеллы цилиндрической формы (мицеллы Дебая), а при более низкой температуре возникают пластинчатые бислойные мицеллы с большей плотностью упаковки (мицеллы Мак-Бена) [21, 22].
Анализ и обработка экспериментальных данных УТ, представленных в таблице 1 для водных растворов ДСН, показали, что во всем изученном диапазоне параметров (m, Т) изотермы Cp(m) и изоконцентраты Cp(Т) хорошо аппроксимируются полиномами четвертой и второй степени, соответственно. При m ≈ 0.34 моль кг–1 наклон изотерм заметно уменьшается, а при m ≈ 0.4 моль кг–1, наоборот, сильно увеличивается. Это связано, по-видимому, с усилением межмицеллярного взаимодействия и, возможно, с образованием мицеллярных агрегатов, которые и являются зародышами лиомезофазы [21, 22, 29]. Такой мицеллярный раствор может быть не изотропен вследствие агрегативной хиральности амфифила и, например, может вращать плоскость поляризации света, как было выявлено для растворов додецилсульфата натрия [27].
Для водных растворов ДСН выявлена инверсия последовательности изотерм УТ Cp(m): изотерма при 303 К расположена ниже других, соответствующих более низким и более высоким температурам. Такая же особенность обнаружена и на изоконцентрационных зависимостях Cp(Т), имеющих глубокий минимум в области 303–305 К. Подобный факт говорит о преобладающем вкладе теплоемкости растворителя в общую удельную теплоемкость раствора (теплоемкость воды минимальна при 306 К [14]). Графики зависимостей Cp(m) и Cp(Т) не приводятся из-за ограниченного объема статьи. На рис. 1 представлены изотермы КМТ ДСН, имеющие два максимума и локальный минимум, положение которого, по-видимому, соответствует равновесной концентрации КМК3 (~0.35 m). Если на первом участке – от первого максимума (~0.32 m) до минимума – преобладает доля молекул в растворе, агрегированных в менее плотноупакованные (цилиндрические) мицеллы, а на втором – от минимума до второго максимума (~0.40 m) – в более плотноупакованные (пластинчатые) мицеллы, то в области минимума эти доли равны.
Рис. 1.
Изотермические зависимости кажущихся мольных теплоемкостей децилсульфата натрия в водных растворах от концентрации при температурах: 1 – 278, 2 – 279, 3 – 280, 4 – 283, 5 – 288, 6 – 293, 7 – 303, 8 – 313, 9 – 323, 10 – 333, 11 – 343, 12 – 363 К.
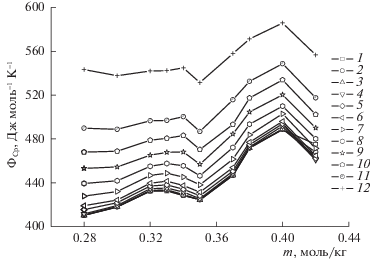
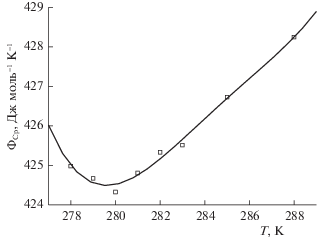
Изоконцентраты КМТ ДСН в водном растворе обнаруживают минимум при низких температурах. При этом изоконцентрата для 0.35 m водного раствора ДСН находится на графике ниже, чем изоконцентраты при 0.32 m и 0.40 m. Используя данные о КМТ для раствора ДСН при низких температурах, определена граница Крафта (ТK), характеризующая предел молекулярной растворимости коллоидного ПАВ (мицеллярные растворы существуют при температуре выше границы Крафта). В качестве примера на рис. 2 приведена изоконцентрата ΦCp (278 ≤ Т ≤ 288 К) при 0.35 m, минимум которой соответствует ТК. Данные по ΦCp(Т) для других концентраций от 0.3 до 0.4 m дают значения ТК от 279 до 280 К, что согласуется с литературными данными [30, 31].
Рис. 2.
Изоконцентрационная зависимость кажущейся мольной теплоемкости водного раствора децилсульфата натрия (m = 0.35 моль кг–1) в области низких температур.
Как известно, КМТ переходит в ПМТ (ΦCp = = Cp2) в бесконечно разбавленном растворе (m → 0), а также в экстремальных точках, в которых на изотермах КМТ (∂ΦCp/∂m)P, T = 0. Для таких же относительно высоких концентраций ПАВ, какие исследуются в настоящей работе, решающую роль для интерпретации структурных превращений играют все-таки ПМТ [16, 17].
Для вычисления ПМТ по результатам эксперимента изоконцентраты функции ΦCp аппроксимированы полиномом второй, а изотермы – шестой степени, обеспечивая приемлемую точность. Повышение степени полинома может привести к осцилляции расчетных зависимостей, появлению необоснованных экстремумов, т.е. получению физически противоречивого результата. Критерием выбора адекватной модели можно считать описание экспериментальных данных в пределах погрешностей их измерения со статистически значимыми параметрами полиномиального уравнения.
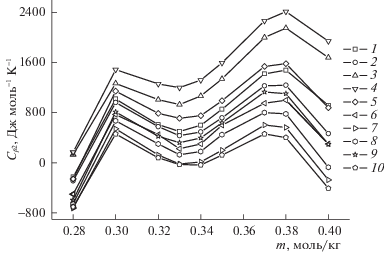
На рис. 3 представлены изотермы ПМТ ${{\bar {C}}_{{p2}}}$(m) растворенного вещества в мицеллярных растворах ДСН. Они отличаются от изотерм КМТ (рис. 1), прежде всего, сдвигом экстремумов в сторону меньших концентраций (на ≈0.02 m). Величина этого сдвига зависит от точности аппроксимации функции ΦCp(m) и вычисления производных (∂ΦCp/∂m)P, T. Вторым важным отличием изотерм ${{\bar {C}}_{{p2}}}$(m) от ΦCp(m) является температурная инверсия, которая находит отражение в расположении изотерм на графике. Полученные результаты свидетельствуют, что концентрационный интервал рассматриваемого процесса трансформации мицеллярной формы составляет 0.30–0.38 m с равновесной концентрацией 0.33 m, соответствующей значению КМК3.
Рис. 3.
Изотермические зависимости парциальных мольных теплоемкостей децилсульфата натрия в водных растворах от концентрации при температурах: 1 – 278, 2 – 280, 3 – 283, 4 – 293, 5 – 303, 6 – 313, 7 – 323, 8 – 333, 9 – 343, 10 – 363 К.
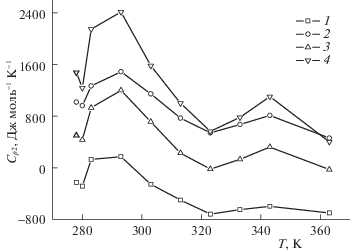
Для определения температурных параметров перехода использованы изоконцентраты ${{\bar {C}}_{{p2}}}$(Т) для моляльностей, соответствующих экстремумам изотерм ${{\bar {C}}_{{p2}}}$(m). Начальный участок (278–280 К) зависимости ${{\bar {C}}_{{p2}}}$(Т), представленной на рис. 4, соответствует, по-видимому, образованию предмицеллярных агрегатов молекул ПАВ (например, димеров) с минимумом в точке Крафта. Расположение экстремумов и характер зависимостей ${{\bar {C}}_{{p2}}}$(Т) показывает, что межмицеллярный переход происходит в интервале температур 293–343 К с равновесным значением Травн = 323 К.
Рис. 4.
Изоконцентрационные зависимости парциальных мольных теплоемкостей децилсульфата натрия в водных растворах от температуры при моляльности: 1 – 0.28, 2 – 0.30, 3 – 0.33, 4 – 0.38 моль кг–1.
ПМТ растворителя и ПМТ растворенного вещества связаны с помощью второго уравнения Гиббса–Дюгема, которое для бинарного водного раствора имеет вид
В бесконечно разбавленном растворе (m → 0) ${{\bar {C}}_{{p1}}}$ = const = $\bar {C}_{{p1}}^{^\circ }$. Если известна зависимость ${{\bar {C}}_{{p2}}}$(m), то можно вычислить ПМТ растворителя ${{\bar {C}}_{{p1}}}$(m):
(9)
${{\bar {C}}_{{p1}}}{\text{(}}m) = - (1{\text{/}}55.508)\int\limits_{{{m}_{0}}}^m {md{{{\bar {C}}}_{{p2}}}{\text{(}}m)} ,$(10)
${{{\text{(}}\partial {{\bar {C}}_{{p1}}}{\text{/}}\partial m)}_{{P,T}}} = - (m{\text{/}}55.508){{{\text{(}}\partial {{\bar {C}}_{{p2}}}{\text{/}}\partial m)}_{{P,T}}}.$Отсюда следует, что производные (∂${{\bar {C}}_{{p1}}}$/∂m)P, T и (∂${{\bar {C}}_{{p2}}}$/∂m)P, T имеют разные знаки, а, следовательно, и поведение функции ${{\bar {C}}_{{p2}}}$(m) противоположно поведению функции ${{\bar {C}}_{{p1}}}$(m). Аналогичный “зеркальный” эффект наблюдается и для изоконцентрат ПМТ растворителя ${{\bar {C}}_{{p1}}}$(Т) и растворенного вещества ${{\bar {C}}_{{p2}}}$(Т).
Для определения избыточной парциальной мольной теплоемкости (ИПМТ) были вычислены температурные зависимости мольной теплоемкости кристаллического ДСН ($C_{{p2}}^{*}$) с использованием результатов работ [12, 20]. Полученные значения $C_{{p2}}^{*}$ приведены в табл. 2. ИПМТ раствора $\bar {C}_{p}^{E}$ характеризует, как известно, изменение его теплоемкости при изотермоизобарном и изомоляльном переносе растворенного вещества из идеального раствора в реальный (ур-ние 7). На рис. 5 приведены зависимости ИПМТ от температуры $\bar {C}_{p}^{E}$(Т). При низких температурах функция $\bar {C}_{p}^{E}$ “реагирует” на мицеллообразование: при 280 К наблюдаются небольшие минимумы, соответствующие границе Крафта. Казалось бы, что значения $\bar {C}_{p}^{E}$ должны лежать в поле отрицательных величин, что, например, имеет место для ИПМТ растворов ДСН в окрестности КМК2 = 0.22 m [12]. Однако в рассматриваемом здесь случае все изоконцентраты $\bar {C}_{p}^{E}$(Т) лежат в положительной области. По-видимому, при относительно высоких концентрациях раствора разрушающее действие довольно крупных и к тому же несферических мицелл на растворитель столь велико, что появление новых степеней свободы превалирует над их потерей при указанном выше переносе вещества как результат конкуренции взаимодействий растворенное вещество – растворенное вещество, растворенное вещество – растворитель и растворитель – растворитель.
Таблица 2.
Мольные теплоемкости кристаллического децилсульфата натрия при разных температурах
| T, K | $C_{{p2}}^{*}$, Дж моль–1 К–1 |
|---|---|
| 278.15 | 370.66 |
| 280.15 | 372.41 |
| 281.15 | 373.28 |
| 283.15 | 375.46 |
| 288.15 | 379.82 |
| 293.15 | 384.62 |
| 298.15 | 389.42 |
| 303.15 | 393.78 |
| 313.15 | 403.81 |
| 323.15 | 412.11 |
| 333.15 | 421.64 |
| 348.15 | 435.60 |
Рис. 5.
Изоконцентрационные зависимости избыточных мольных теплоемкостей водных растворов децилсульфата натрия от температуры при моляльности: 1 – 0.28, 2 – 0.30, 3 – 0.33, 4 – 0.37, 5 – 0.40, 6 – 0.42 моль кг–1.
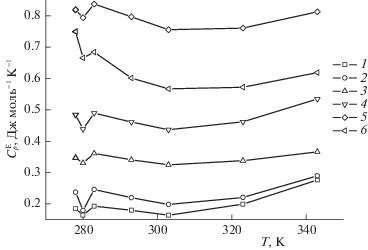
Порядок расположения изоконцентрат $\bar {C}_{p}^{E}$(Т) по мере увеличения m нарушается лишь на верхнем пределе интервала концентраций: изоконцентрата для 0.42 m лежит ниже, чем таковая для 0.40 m. По-видимому, это объясняется агрегацией пластинчатых мицелл и, соответственно, потерей степеней свободы растворенного вещества. Температура минимумов всех изоконцентрат составляет ~ 308 К, что близко к температуре минимума теплоемкости воды. Все это свидетельствует о решающей роли растворителя в структурировании раствора, в том числе в гидрофобных взаимодействиях.
При условии монодисперсности мицелл и отсутствии молекулярных форм ионных ПАВ эффект температуры на структурный переход (“пластина → цилиндр”) в области КМК3 проявляется, прежде всего, в уменьшении степени связывания (β) противоионов, увеличении площади поверхности (а) мицеллы в расчете на один поверхностно-активный ион, уменьшении фактора упаковки (q = Vc/аlc, где Vc – объем, lc – длина углеводородного радикала), уменьшении роли гидрофобных взаимодействий с одновременным увеличением электростатической составляющей энергии Гиббса перехода и статической диэлектрической проницаемости вследствие возрастания проникновения молекул воды в периферической части мицелл [21–23, 26]. Следствием этих процессов и является дезинтеграция при увеличении температуры пластинчатых мицелл с образованием цилиндрических с меньшим числом агрегации.
Ранее было показано, что в рамках квазихимического подхода процесс перестройки структуры и форм мицелл может моделироваться мономолекулярной обратимой реакцией [23, 26], при этом с увеличением температуры из “плотных” мицелл образуются “рыхлые”: в данном случае из пластинчатых мицелл – цилиндрические. Если в качестве стандартного состояния выбрать одномолярный раствор [16], то константа равновесия не будет зависеть от общей концентрации, а энергия Гиббса процесса будет определяться ее стандартным значением в расчете на одну пластинчатую мицеллу [23]:
где Kc(Т) – концентрационная константа равновесия, n – число агрегации в пластинчатой мицелле. В этом случае справедливы следующие соотношения [22, 25]:(12)
$\begin{gathered} {{K}_{{\text{c}}}} = {{С }_{{\text{ц }}}}{\text{/}}{{С }_{{{\text{п л }}}}};\quad {{С }_{{{\text{п л }}}}} + {{С }_{{\text{ц }}}} = {\text{К М }}{{{\text{К }}}_{3}}; \\ {{\alpha }_{{{\text{п л }}}}} = {{С }_{{{\text{п л }}}}}{\text{/К М }}{{{\text{К }}}_{3}} = 1{\text{/}}\left( {{{K}_{с }} + 1} \right); \\ {{С }_{{\text{ц }}}} = {{K}_{{\text{с }}}}{\text{К М }}{{{\text{К }}}_{3}}{\text{/}}\left( {1 + {{K}_{с }}} \right), \\ \end{gathered} $Используя соотношения (12), рассчитаны величины αпл, αц = 1 – αпл, Kc, Сц и Спл = КМК3 – Сц для “равновесной” (при КМК3 = 0.33 m) изоконцентраты ПМТ растворенного вещества ${{\bar {C}}_{{p2}}}$(Т) в области перехода (293 ≤ Т ≤ 343 К) (рис. 4). Полученные параметры приведены в табл. 3. Отметим, что значения Kс не являются термодинамическими константами равновесия. Это условные константы, поскольку в рамках используемого подхода принимается, что при 293 К все молекулы ПАВ агрегированы в более плотноупакованные пластинчатые мицеллы (αпл = 1), а при 343 К – в цилиндрические (αпл = 0). Эти константы следует отнести к равновесной концентрации 0.33 m. Как видно из рис. 4, в интервалах температур 293–323 К и 323–343 К значения ${{\bar {C}}_{{p2}}}$ (Т) изменяются в первом приближении линейно. Следовательно, можно считать, что и доли ионов ПАВ изменяются линейно, пропорционально значениям ${{\bar {C}}_{{p2}}}$. Полученные результаты дают правильное представление о распределении ионов в мицеллах одной и другой геометрической формы, соответствующее распределению ПМТ.
Таблица 3.
Доли ионов, агрегированных в пластинчатые мицеллы (αпл), концентрационные константы равновесия (Кс) и молярные концентрации (Сц.) ионов, агрегированных в цилиндрические мицеллы, в водном растворе ДСН при КМК3 = 0.33 m
| T, K | αпл | Кс | Сц, моль дм–3 |
|---|---|---|---|
| 293 | 1.00 | 0 | 0 |
| 298 | 0.92 | 0.09 | 0.03 |
| 303 | 0.83 | 0.20 | 0.05 |
| 313 | 0.66 | 0.49 | 0.11 |
| 323 | 0.50 | 1.00 | 0.16 |
| 333 | 0.25 | 3.00 | 0.24 |
| 338 | 0.12 | 7.00 | 0.28 |
| 342 | 0.02 | 39.0 | 0.32 |
| 343 | 0.00 | →∞ | 0.33 |
Из табл. 2 следует, что Травн = 323 К является равновесной температурой трансформации формы мицелл: Kс = 1, значение αпл составляет 50%. При повышении температуры процесс структурной перестройки мицелл происходит неравномерно до и после точки равновесия. Температурные производные (∆αпл/∆T) = 0.0167 K–1 и (∆Сц/∆T) = 0.0055 моль дм–3 К–1 до равновесия, указывающие на дезинтеграцию пластинчатых мицелл, в 1.5 раза меньше, чем после равновесия, а образование “цилиндрических” мицелл происходит во столько же раз “быстрее” по температуре после Травн = 323 К.
Таким образом, методом ДСК определены удельные теплоемкости децилсульфата натрия в водном растворе в интервале концентраций 0.28–0.42 m и температур 278–363 К. Вычислены кажущиеся и парциальные мольные теплоемкости растворителя и растворенного вещества, а также избыточные парциальные мольные теплоемкости. Полученные данные позволили обнаружить третий межмицеллярный структурный переход в водных растворах ДСН, соответствующий изменению типа структуры мицелл от цилиндрической в пластинчатую форму. Определены важнейшие характеристики этого процесса: концентрационный интервал от 0.30 m до 0.38 m с КМК3 = = 0.33 m, температурный интервал от 293 до 343 К с Травн = 323 К. При КМК3 = 0.33 m проведена оценка концентрационных констант равновесия (Кс) в водном растворе ДСН и параметров, характеризующих долевое распределение ионов ДСН, агрегированных в цилиндрические и пластинчатые мицеллы, в процессе их структурной трансформации в растворе в зависимости от температуры.
В дальнейшем предполагается использовать полученные результаты для вычисления термодинамических функций полиморфного мицеллярного перехода с целью разработки полноценной структурно-термодинамической модели этого процесса.
Работа выполнена при финансовой поддержке частично Гранта РФФИ № 15-43-03003_р-центр_а и частично Гранта РФФИ № 15-29-01068_офи_м.
Список литературы
Cartton R.J., Hunter J.T., Muller D.S. et al. // Liq. Cryst. Rev. 2013. V. 1. № 1. P. 29.
Ali A., Bhushan V., Malik N.A., Behera K. // Colloid J. 2013. V. 75. № 4. P. 357.
Бродская Е.Н. // Коллоидн. журн. 2012. Т. 74. № 2 С. 167.
Ali A., Malik N.A., Uzair S., Ali M. // Mol. Phys. 2014. V. 112. P. 2681.
Hossain M.S., Biswas T.K., Kabiraz D.C. et al. // J. Chem. Thermodynamics. 2014. V. 71. P. 6.
Идиятуллин Б.З., Потарикина К.С., Зуев Ю.Ф. и др. // Коллоид. журн. 2013. Т. 75. № 5. С. 585–590.
Zhu L., Han Y., Tian M., Wang Y. // Langmuir. 2013. V. 29. P. 12084.
Королева С.В., Жердев В.П., Петров Д.Л. // Нанотехнологии: разработка, применение. 2016. Т. 8. № 3. С. 18.
Кузнецов В.С., Блинов В.Г., Баделин В.Г. и др.// Жидк. крист. и их практич. использ. 2017. Т. 17 (1). С. 20–33.
Кузнецов В.С., Усольцева Н.В., Быкова В.В. // Журн. физ. химии. 2002. Т. 76. С. 1077–1081.
Senin A.A., Potekhin S.A., Tiktopulo E.I., Filimonov V.V. // J. Therm. Anal. Calorim. 2000. V. 62. P. 153–160.
Кузнецов В.С., Усольцева Н.В., Жердев В.П., Быков В.В. // Коллоидн. журн. 2009. Т. 71. № 6. С. 766.
Desnoyers J.E., Visser C., Perron G., Picker P. // J. Solution Chem. 1976. V. 5. P. 605.
Clarke E.C.W., Glew D.N. // J. Phys. Chem. Ref. Data. 1985. V. 14. P. 490.
Харнед Г., Оуэн Б. Физическая химия растворов электролитов. М.: Изд-во Иностр. лит., 1952. 599 с.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высш. школа, 1982.
Биологически активные вещества в растворах: структура, термодинамика, реакционная способность / Абросимов В.К., Чумакова Р.В., Агафонов А.В. и др. М.: Наука. 2001.
Современные проблемы химии растворов / Крестов Г.А., Кесслер Ю.М., Виноградов В.И. и др./ М.: Наука, 1986.
Рид Р., Праусниц Д., Шервуд Т. Свойства газов и жидкостей. Л.: Химия, 1982.
Kusnetsov V.S., Usol’tseva N.V., Bykova V.V. et al. // Russ. J. Phys. Chem. 2002. V. 76. N. 12. P. 2080.
Холмберг К. Поверхносто-активные вещества и полимеры в растворах. М.: Бином, 2007.
Русанов А.И. Мицллообразование в растворах поверхностно-активных веществ. СПб.: Химия, 1992.
Сердюк А.И., Кучер Р.В. Мицеллярные переходы в растворах поверхностно-активных веществ. Киев: Наукова думка, 1987.
Кузнецов В.С., Усольцева Н.В., Быкова В.В., Жердев В.П. // Коллоидн. журн. 2005. Т. 67. № 5. С. 641.
Кузнецов В.С., Усольцева Н.В., Жердев В.П. // Там же. 1999. Т. 61. № 5. С. 684.
Кузнецов В.С., Усольцева Н.В., Жердев В.П., Быкова В.В. // Там же. 2010. Т. 72. № 2. С. 211.
Rusanov A.I., Nekrasov A.G. // Langmuir. 2010. V. 26 (17). P. 13767.
Saito M., Moroi J., Matuura R. // Colloid Interface Sci. 1982. V. 88. № 2. P. 578.
Усольцева Н.В. Лиотропные жидкие кристаллы: химическая и надмолекулярная структура. Иваново: Иван. гос. ун-т. 1994. 219 с.
Dörfler Y.-D. Grenzflächen und Kolloichemie. Weinheim; New York; Basel; Cambridge; Tokyo: VCH. 1994. 598 s.
Van Os N.M., Haak J.R., Reyrert L.A.M. Physico-chemical Properties of Selected Anionic, Cationic and Nonionic Surfactants. Elsevier: Amsterdam. 1993.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


