Журнал физической химии, 2019, T. 93, № 4, стр. 552-557
Связь радиояркостных и диэлектрических свойств водных растворов солей в миллиметровой области спектра
А. К. Лященко a, *, И. М. Каратаева a, В. С. Дуняшев a
a Российская академия наук, Институт общей и неорганической химии им. Н.С. Курнакова
119991 Москва, Россия
* E-mail: aklyas@mail.ru
Поступила в редакцию 14.05.2018
Аннотация
Разработан новый подход к исследованию водных растворов солей на основе их излучения в миллиметровой области спектра. С помощью высокочувствительного радиометра на частоте 61.2 ГГц определены коэффициенты отражения и радиояркостные контрасты для растворов сульфатов щелочных металлов в широкой области концентраций. Установлено наличие разнознаковых изменений растворов по сравнению с водой. Дано теоретическое обоснование и количественное описание измеряемых эффектов на основе данных комплексной диэлектрической проницаемости растворов. Показано, что излучение отражает вклады как дипольных, так и ионных потерь, которые все еще остаются значимыми на рассматриваемых частотах; они могут даже определять наличие разнознаковых эффектов излучения.
В настоящее время получают повышенное внимание исследования водных систем в миллиметровой (мм) области спектра. В практическом плане это связано с дистанционным экологическим мониторингом и биологическими объектами [1–4]. С теоретических позиций интерес к мм диапазону определяется тем, что в нем лежит частотная граница между коллективными релаксационными процессами и элементарными структурно-кинетическими реакциями в сетке Н-связей воды и растворов, отражающимися в широкополосных диэлектрических спектрах [5]. В то же время трудность исследования этой области состоит в том, что традиционные волноводные методы измерения комплексной диэлектрической проницаемости на частотах миллиметрового диапазона затруднены, в основном, по причине чрезмерного уменьшения размеров образцов и волноводов. С другой стороны, в области мм волн можно использовать квазиоптические методы, позволяющие находить диэлектрические параметры из данных отражения и поглощения растворов. Те же самые характеристики определяют их излучение. Оно может быть экспериментально изучено с помощью высокочувствительных радиометров миллиметрового диапазона, появившихся в последнее время [6–9]. Современная радиотехническая аппаратура позволяет использовать их не только в дистанционном природном мониторинге, но и в лабораторной практике для определения характеристик излучения и отражения растворов разного состава и концентрации. В результате, по аналогии с СВЧ-радиометрией [4], мы приходим к КВЧ-радиометрии (КВЧ – крайне высокие частоты) водных систем. В работах [7–9] характеристики излучения растворов были получены на частоте 61.2 ГГц для ряда модельных растворов широкой области концентраций. Было показано наличие разнознаковых концентрационных изменений в случае растворов хлоридов щелочных металлов. Однако расчет радиояркостных температур не проводился. Задачи анализа связи получаемых параметров излучения с собственным излучением растворов и определяющими его диэлектрическими характеристиками на указанной частоте не ставились в предыдущих исследованиях. В настоящей работе этот вопрос будет рассмотрен как с теоретических, так и с экспериментальных позиций на примере водных растворов сульфатов щелочных металлов.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Интенсивность собственного излучения тела удобно выражать через радиояркостную температуру, которая равна температуре абсолютно черного тела с такой же интенсивностью излучения, как и рассматриваемый образец. В простом случае [4] Тя = Т*χ = Т(1 – R), где Т – термодинамическая температура, χ – коэффициент излучения, R – коэффициент отражения по мощности. Между оптическими и диэлектрическими свойствами веществ существует тесная связь, что позволяет проводить пересчет одних характеристик в другие. Коэффициент отражения по мощности R выражается через комплексную диэлектрическую проницаемость на этой же частоте ε*(ν) с помощью формул Френеля [4] и при нормальном падении волны на поверхность образца, рассчитывается по формуле:
(1)
$R(\nu ) = {{\left| {\frac{{\sqrt {\varepsilon {\text{*}}} - 1}}{{\sqrt {\varepsilon {\text{*}}} + 1}}} \right|}^{2}}.$Величина коэффициента поглощения k(ν) (в dB/мм) связана с диэлектрической проницаемостью раствора соотношением [10, 11]:
(2)
$k(\nu ) = \frac{{40\pi \nu }}{{c\ln (10)}}\operatorname{Im} \sqrt {\varepsilon {\text{*}}(\nu )} .$В общем случае, когда экспериментальные значения ε*(ν) для данной частоты не известны, можно прибегнуть к их расчету, используя известные данные для других частот и релаксационную модель для данного участка спектра. Комплексная диэлектрическая проницаемость ε*(ν) на частоте ν определяется в диэлектрических измерениях и представляется в виде двух составляющих [12]: диэлектрической проницаемости ε'(ν) и диэлектрических потерь ε''(ν) ε*(ν) = ε'(ν) + iε''(ν) где $i = \sqrt { - 1} $. Потери ε''(ν) в случае растворов неэлектролитов определяются дипольной релаксацией молекул. В случае растворов электролитов процесс идет уже по двум механизмам, связанным с переориентациями дипольных молекул воды и смещением заряженных ионов. Для растворов электролитов суммарные потери будут равны:
(3)
$\varepsilon ''(\nu ){\text{ }} = {\text{ }}\varepsilon _{d}^{{''}}(\nu ) + {\text{ }}\varepsilon _{i}^{{''}}(\nu ),$В литературе для расчета ионных потерь от частоты используется формула [12]:
где ε0 – диэлектрическая постоянная вакуума (8.854 × 10–12 Ф/м), σ – электропроводность раствора на низкой частоте.В общем случае частотные зависимости ε'(ν) и $\varepsilon _{d}^{{''}}(\nu )$, связанные с дипольной релаксацией, имеют достаточно сложный вид. Для их воспроизведения используется суперпозиция функций Коула–Коула (СС):
(5)
$\varepsilon {\text{*}}(\nu ) = {{\varepsilon }_{\infty }} + \sum\limits_{k = 1}^K {\frac{{{{{(\Delta \varepsilon )}}_{k}}}}{{1 + {{{(2\pi i\nu {{\tau }_{k}})}}^{{1 - {{\alpha }_{k}}}}}}}} ,$(6)
$S = {{\sum\limits_{j = 1}^N {\left( {\varepsilon _{j}^{*} - {{\varepsilon }_{\infty }} - \sum\limits_{k = 1}^K {\frac{{{{{(\Delta \varepsilon )}}_{k}}}}{{1 + {{{(2\pi i\nu {{\tau }_{k}})}}^{{1 - {{\alpha }_{k}}}}}}}} } \right)} }^{2}} = \min ,$Таблица 1.
Коэффициенты отражения R и поглощения k (в дБ/мм) растворов сульфатов щелочных металлов на частоте 61.2 ГГц при 298 К
| Соль | С, моль/1000 г H2O | Rfull | Rdip | kfull, дБ/мм | kdip, дБ/мм |
|---|---|---|---|---|---|
| H2O | 0 | 0.496 | 0.496 | 27.395 | 27.395 |
| Li2SO4 | 0.49 | 0.482*/0.485 | 0.470/0.473 | 26.977/26.835 | 25.673/25.57 |
| 0.69 | 0.475/0.478 | 0.459/0.462 | 26.149/25.963 | 24.496/24.327 | |
| Na2SO4 | 0.205 | 0.493/0.495 | 0.486/0.488 | 27.742/27.678 | 26.970/26.910 |
| 0.66 | 0.487/0.492 | 0.469/0.475 | 27.300/27.161 | 25.373/25.266 | |
| 1.29 | 0.476/0.480 | 0.446/0.452 | 26.376/26.348 | 23.350/23.365 | |
| K2SO4 | 0.11 | 0.495/0.497 | 0.490/0.492 | 27.725/27.538 | 27.171/26.988 |
| 0.32 | 0.496/0.501 | 0.482/0.489 | 27.763/27.614 | 26.288/26.164 | |
| 0.46 | 0.496/0.502 | 0.478/0.485 | 27.849/27.560 | 25.833/25.58 | |
| Cs2SO4 | 0.24 | 0.500/0.500 | 0.490/0.490 | 28.527/27.898 | 27.381/26.754 |
| 1.27 | 0.509/0.508 | 0.464/0.468 | 29.302/27.868 | 24.258/22.856 |
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование воды и растворов проводили с помощью высокочувствительного модуляционного радиометра с фиксированной рабочей частотой 61.2 ГГц (λ = 4.9 мм). (НПО “Исток”, ИРЭ РАН, г. Фрязино) [6, 7]. Устройство радиометра и методика эксперимента описаны в [6–9]. Радиометр включает в себя антенну (рупор), приемник и регистрирующее устройство, которое показывает уровни напряжения, определяющие коэффициенты излучения наблюдаемого объекта. Низкочастотная составляющая сигнала, полученная на усилителе низкой частоты, оцифровывается и передается на ПК, где с помощью компьютерной программы обеспечивается регистрация и дальнейшая обработка сигнала. Запись и визуализация сигнала осуществляется таким образом, что на результирующем графике по оси абсцисс откладывается время проведения измерений (часы, минуты, секунды), а по оси ординат – радиофизический отклик, где U(ν) – напряжение на выходе усилителя низкой частоты радиометра в вольтах.
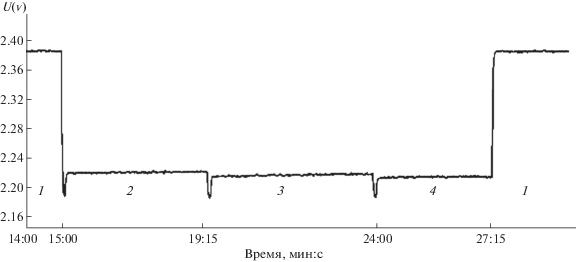
Пример рассматриваемых зависимостей приведен на рис. 1 в случае воды и водных растворов сульфатов лития и цезия. Уточняющая трактовка изменений излучения в растворах с использованием эталонов (полированная медная пластина), была проведена для построения схемы пересчета измеряемых величин в коэффициенты отражения и излучения, отвечающие собственному излучению объектов. Как видно из рис. 1, программа регистрации и визуализации сигнала на выходе радиометра здесь составлена таким образом, что увеличению значения U(ν) принимаемого сигнала соответствует уменьшение амплитуды регистрируемого и представляемого собственного сигнала образца. Уровень сигнала от металлической медной пластины здесь принимается за нулевой, т.е. радиометр имеет обратную шкалу. Соответственно, максимальный отсчет для медной поверхности соответствует минимальному излучению, а минимальные показания прибора для воды и растворов отвечают максимальному эффекту.
Рис. 1.
Регистрируемые радиометром сигналы от разных объектов: на частоте 61.2 ГГц при 290 К: медная пластина (1), раствор Cs2SO4 (2), вода (3), раствор Li2SO4 (4). По оси ординат отложены величины напряжения на выходе усилителя низкой частоты U(ν) радиометра в вольтах (обратная шкала).
Были проведены дополнительные аппаратурно-методические разработки для уточнения методики и точности определения измеряемых характеристик. Анализировались изменения излучения в чашках Петри разного диаметра, направленность антенны рупора, влияние толщины слоя исследуемого раствора и др. Полученные результаты подтвердили ранее принятую экспериментальную методику.
Все исследуемые растворы готовились не позже, чем за сутки до проведения эксперимента для того, чтобы избежать образования пузырьков воздуха при растворении солей. Навески солей марки “х. ч.” растворяли в дистиллированной воде. Раствор, максимальный по концентрации, используемой в эксперименте, готовили растворением навески в воде. Концентрацию полученного раствора проверяли по плотности. Разбавлением исходного раствора получали остальные растворы, концентрации которых также контролировали по плотности.
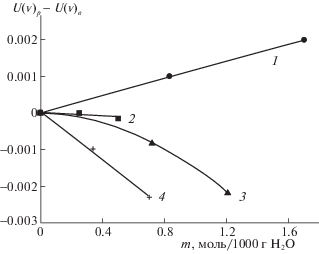
Использовали следующую схему эксперимента: 1) измеряли радиометрический сигнал излучения от медной пластины, 2) регистрировали радиометрические сигналы, соответствующие дистиллированной воде, 3) регистрировали радиометрические сигналы, соответствующие излучению растворов. Целесообразно работать не с абсолютными, а с относительными значениями сигналов. В таком случае лимитируются отклонения, связанные с нестабильностью внешних условий и особенностями методики, а также систематические отклонения величины U(ν), которые не удается полностью контролировать (слабое излучение разных кювет, влажность, добавочные отражения и др.). Соответственно, величинами, отражающими изменения эффектов при переходе от воды к растворам, являются величины ∆U(ν) = U(ν)р – U(ν)в. На рис. 2 представлены изменения величины ∆U(ν) при переходе от воды к растворам (приведены средние значения, полученные в результате 3–5 опытов). Из рис. 2 видно, что различия концентраций и состава проявляются достаточно наглядно. Наблюдаются разнознаковые изменения ∆U(ν) при переходе от воды к раствору. Это происходит в тех же случаях, для которых появляются разные знаки изменений в теоретических расчетах (табл. 1).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Предлагаемые экспериментальная и расчетная схемы позволяют проанализировать связь измеряемых величин ∆U(ν) с коэффициентами собственного излучения и отражения растворов солей. Непосредственно в эксперименте это можно сделать при сравнении значений U(ν) воды и растворов с U(ν) медной пластины, коэффициент отражения которой близок единице. Однако при реализующихся условиях не удается создать идентичные условия опыта, в частности, точно задать одинаковым и постоянным расстояние от поверхности антенны до поверхности образцов и медной пластины. От этого параметра сильно зависят величины ∆U(ν) Поэтому данный метод был использован только для определения знака изменений излучения при переходе от воды к раствору и получения оценочных данных ∆U(ν) растворов. Другой вариант градуировки может быть проведен при использовании данных ∆U(ν) для модельных растворов и рассчитанных из диэлектрических параметров значений коэффициентов отражения и излучения (см. первый раздел). Этот способ практически полностью снимает неэквивалентности условий опыта. Для построения градуировочных зависимостей были использованы растворы хлорида калия. Для них измерены характеристики излучения и есть подробные диэлектрические данные в сантиметровом и миллиметровом диапазонах [8–12]. При этом, реализуются типичные дебаевские зависимости в рассматриваемом интервале частот (что необходимо для пересчета на частоту, на которой проводятся измерения). Соответственно, были определены коэффициенты пересчета. Такой же пересчетный коэффициент сохраняется для растворов сульфатов щелочных металлов. Таким образом, можно определить коэффициенты излучения растворов солей.
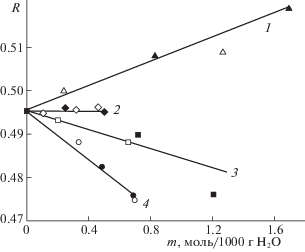
На рис. 3 сопоставлены коэффициенты отражения растворов, полученные в эксперименте и рассчитанные из диэлектрических данных. Наблюдается хорошее согласие величин. Это означает, что измеряемые характеристики относятся непосредственно к параметрам растворов, характеризующим отличия собственного отражения и излучения растворов. В случае растворов сульфата цезия излучение падает, в случае растворов сульфата калия оно практически не отличается от воды, а случае растворов лития и натрия растет при переходе от воды к раствору.
Рис. 3.
Коэффициенты отражения растворов Cs2SO4 (1), K2SO4 (2), Na2SO4 (3), Li2SO4 (4) на частоте 61.2 ГГц при 298 К. Темные точки – данные расчетов из радиометрических измерений, светлые точки – данные расчетов из диэлектрических параметров.
Как следует из табл. 1, рассматриваемые коэффициенты отражения связаны с двумя вкладами, определяемыми дипольными и ионными потерями. Последние все еще остаются значимыми на рассматриваемых частотах. При этом, видно, что их различия в разных растворах могут даже определять разнознаковые эффекты изменений излучения при переходе от воды к раствору. Таким образом, из диэлектрических данных дается теоретическое обоснование экспериментально наблюдаемым характеристикам собственного излучения растворов солей.
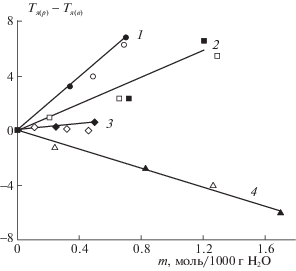
С использованием полученных данных были найдены радиояркостные контрасты растворов солей. На рис. 4 приведены разности радиояркостных температур растворов и воды, рассчитанных по формуле: ∆Тя = Тя(р) – Тя(в), где Тя = Т*χ. Тем самым, полученные изменения сигнала U(ν)р – U(ν)в характеризуют наблюдаемые радиояркостные контрасты. На рис. 4 суммированы концентрационные изменения наблюдаемых радиояркостных контрастов в растворах сульфатов щелочных металлов. Их различия достаточно хорошо фиксируются в эксперименте. Существенные отличия связанных с ними характеристик также наблюдаются и в случае других двух и многокомпонентных водно-электролитных систем [8–10, 17]. Поэтому может быть предложен метод дистанционного экспресс-анализа изменений концентраций и свойств растворов для его использования в лабораторной практике. Наличие таких разнознаковых изменений излучения и поглощения при переходе от воды к растворам разных солей, которое характерно для мм диапазона, может быть значимым для биологических объектов и служить для объяснения медицинских эффектов мм волн [1–3].
Работа выполнена при частичной поддержке РФФИ (код проекта № 19-03-00033).
Список литературы
Бецкий О.В., Кислов В.В., Лебедева Н.Н. Миллиметровые волны и живые системы. М.: Сайнс-Пресс, 2004. 271 с.
Тамбиев А.Х., Киркоров Н.Н., Бецкий О.В. Миллиметровые волны и фотосинтезирующие организмы / Под ред. Ю.В. Гуляева и А.Х. Тамбиева М.: Радиотехника, 2003. 175 с.
Лященко А.К. // Биомедицинская радиоэлектроника. 2007. № 8–9. С. 6.
Шутко А.М. СВЧ-радиометрия водной поверхности. М.: Наука, 1986. 188 с.
Лященко А.К., Новскова Т.А. В “Структурная самоорганизация в растворах и на границе раздела фаз” / Под ред. А.Ю. Цивадзе. М.: ЛКИ, 2008. С. 417.
Криворучко В.И. // Известия вузов. Радиофизика. 2003. Т. XLVI. № 8–9. С. 782.
Козьмин А.С. Низкоинтенсивное электромагнитное излучение миллиметрового диапазона воды и водных растворов. Дисс. … канд. физ.-мат. наук. Волгоград. 2011. 180 с.
Лященко А.К., Каратаева И.М., Козьмин А.С. и др. // Докл. АН. 2015. Т. 462. № 5. С. 561.
Лященко А.К., Каратаева И.М. // Журн. неорган. химии. 2017. Т. 62. № 1. С. 127.
Lyashchenko A.K., Zasetsky A.Yu. // J. Mol. Liquids. 1998. V. 77. P. 61.
Засецкий А.Ю., Лященко А.К. Квазиоптический метод измерения комплексной диэлектрической проницаемости водных растворов электролитов в миллиметровом диапазоне длин волн и релаксационные характеристики растворов. Деп. ВИНИТИ 06.07.99. М., 1999. № 2181-В99. 62 с.
Barthel J., Buchner R., Munsterer M. Electrolyte Data Collection. Part 2: Dielectric Properties of Water and Aqueous Electrolyte Solutions. Chemistry Data Series. V. XII. Part 2. Frankfurt am Main. Dechema. 1995. 365 p.
Лященко А.К., Дуняшев В.С. // Журн. физ. химии. 2014. Т. 88. № 2. С. 288.
Lyashchenko A.K., Lileev A.S. // J. Chem. Eng. Data. 2010. V. 55. P. 2008.
Лященко А.К., Дуняшев В.С. // Журн. неорган. химии. 2018. Т. 63. № 12. С. 1.
Khurgin Y.I., Kudryashova V.A., Zavizion V.A., Betskii O.V. Relaxation Phenomena in Condensed Matter. 2018, тoм 63, № 12, c. 1–8 / W. Coffey Ed. Adv. Chem. Phys. Ser. 1994. V. 87. P. 483.
Лященко А.К., Лилеев А.С., Засецкий А.Ю. Физико-химические аспекты дистанционного радиофизического зондирования водных поверхностей в СВЧ-диапазоне. Тез. Докл. ХV Менделеевский съезд по общей и прикладной химии. Минск. 1993. С. 266.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии