Журнал физической химии, 2019, T. 93, № 4, стр. 615-621
Влияние поверхностно-активных веществ на восстановление ионов кадмия(II) на кадмиевом электроде
М. К. Касымова a, М. К. Наурызбаев b, Айгуль Мамырбекова c, *, Г. Н. Жылысбаева c, Айжан Мамырбекова c, **
a Южно-Казахстанский государственный университет им. М. Ауэзова
Шымкент, Казахстан
b Казахский национальный университет им. аль-Фараби
Алматы, Казахстан
c Университет Ахмеда Ясави
Туркестан, Казахстан
* E-mail: aigul.mamyrbekova@ayu.edu.kz
** E-mail: aizhan.mamyrbekova@ayu.edu.kz
Поступила в редакцию 25.07.2018
Аннотация
Исследовано влияние высокомолекулярных, растворимых в воде поверхностно-активных веществ (ПАВ) с различными функциональными группами (сополимер метакрилоиламинофенола с акриловой кислотой, гидролизат отходов кожевенной промышленности и сополимер ацетата винилового эфира моноэтаноламина) на электровосстановление ионов кадмия(ІІ) на одноименном электроде в различных электролитах: 1 М KCl, KBr, KNO3, HCOONa, NH2SO3H, 0.5 М Na2SO4, 0.35 М Na3C6H5O7 · 2H2O. Показано, что в растворе 1.0 М KCl, KBr ингибирования электровосстановления ионов кадмия(ІІ) адсорбционными слоями ПАВ не наблюдается. Установлено, что ингибирующее действие полимеров на электровосстановление ионов кадмия(ІІ) в электролитах возрастает в следующей последовательности: KCl > KBr > KNO3 > NH2SO3H > Na2SO4 > Na3C6H5O7 · 2H2O > HCOONa.
В последнее время изучению действия поверхностно-активных веществ (ПАВ) на электродные процессы посвящено большое количество работ, большинство из них отражает влияние на электродные процессы низкомолекулярных соединений и только незначительное число – действие высокомолекулярных соединений [1–4]. Введение в электролиты органических ПАВ – один из эффективных способов управления кинетикой электродных процессов, вследствие чего совершенствование технологических процессов электроосаждения металлов и их сплавов невозможно без широкого использования известных и поиска новых органических ПАВ [5, 6]. Присутствие ПАВ, как известно, затрудняет протекание электродных процессов, оказывая на них тормозящее действие, что объясняется блокировкой поверхности электрода [7, 8]. Ингибирующее действие органических добавок зависит также и от ряда других факторов, в том числе и от состава электролита [9–12]. Тормозящее действие добавки зависит от природы анионов электролита, поэтому невозможно предугадать сохранение эффекта ингибирования в различных электролитах. Знание закономерностей влияния органических веществ на анионы фонового электролита и их взаимодействия с ними дает возможность интерпретировать механизм электродных процессов, позволяет в ряде случаев регулировать скорость электрохимических реакций.
Обзор литературы показывает, что природа аниона фона оказывает влияние как на формирование двойного электрического слоя, так и на кинетику и механизм электровосстановления металлов [13]. Однако большинство работ выполнено на ртутном электроде и только незначительное их число проведено на твердых электродах [14–16].
Цель данной работы – изучение влияния ряда органических соединений на скорость процесса электровосстановления кадмия на одноименном электроде в электролитах в присутствии различных анионов фонового электролита.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследовали влияние следующих ПАВ: сополимер метакрилоиламинофенола с акриловой кислотой (СМААФ-АК) (Mr = 15–20 тыс.), гидролизат отходов кожевенной промышленности (ГОКП) и сополимер ацетата винилового эфира моноэтаноламина (ВЭМЭА) (Mr = 50–100 тыс.). Исследовали электролиты следующего состава: 1 М KCl, KBr, KNO3, HCOONa, NH2SO3H, 0.5 М Na2SO4, 0.35 М Na3C6H5O7 · 2H2O.
В качестве фонового электролита выбрали KCl и KBr ввиду сильной адсорбционной активности. Известно ускоряющее действие галогенных ионов на электродные процессы. Na3C6H5O7 · · 2H2O, HCOONa выбрали из числа органических кислот, так как они инертны, ион NO$_{3}^{ - }$ относится к малоадсорбирующимся анионам.
Представляет интерес исследование в качестве фонового электролита 1.0 М NH2SO3H для сравнения с другими электролитами, так как тормозящее действие SO3Н-ионав присутствии ПАВ велико. Определенный интерес представляет изучение Na2SO4 в качестве фонового электролита, так как анион SO$_{4}^{{2 - }}$ адсорбционно малоактивен.
Исследование электрохимического поведения ионов кадмия(II) проводили в интервале концентраций ПАВ 0.067 × 10–2–1.33 × 10–2 мас. % при 298–328 K. Изучение кинетики разряда ионов кадмия(II) на одноименном поликристаллическом электроде проводили методом снятия поляризационных кривых на потенциостате П-5827М.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проведенные исследования по электровосстановлению ионов кадмия(II) на твердом электроде на фоне 1.0 М KCl, 1.0 М KBr и 1.0 М KNO3 показали отсутствие влияния ПАВ на разряд ионов кадмия(II). Это объясняется высокой специфической адсорбцией галогенных ионов на поверхности кадмиевого электрода, способных конкурировать с адсорбцией молекул адсорбата, в результате чего торможения не наблюдается. Деполяризующее действие галогенных ионов на процесс ингибирования может быть вызвано двумя явлениями. Первое заключается в изменении строения адсорбционного слоя в результате адсорбции как галогенных ионов, так и молекул ПАВ. Второе связано с каталитическим действием галогенных ионов, небольшое содержание их в растворе ускоряет электродный процесс.
На рис. 1 приведены поляризационные кривые электровосстановления ионов кадмия(II) на кадмиевом электроде на фоне 0.5 М Na2SO4 в отсутствие и в присутствии ПАВ при Т = 298 K. Введение добавки ПАВ в раствор приводит к существенному торможению разряда ионов кадмия(II), что проявляется в уменьшении токов восстановления и значительном увеличении поляризации. При увеличении содержания ПАВ в растворе степень ингибирования возрастает, увеличивается спад предельного тока в области отрицательных потенциалов. Поляризационные кривые электровосстановления ионов кадмия(II) в присутствии СМААФ-АК и ГОКП имеют N-образную форму, характерную для процессов разряда ионов кадмия(II) в присутствии азотсодержащих ПАВ. В растворе 1.0 М NH2SO3H введение добавки ПАВ приводит к торможению электродных процессов. Это проявляется в уменьшении предельного диффузионного тока и проявляется сильнее для ГОКП, чем для СМААФ-АК и ВЭМЭА.
Рис. 1.
Поляризационные кривые электровосстановления ионов кадмия(II) на кадмиевом электроде, полученные при Т = 298 K на фоне 0.5 М Na2SO4 в отсутствие и в присутствии ПАВ: а – СМААФ-АК, б – ГОКП, в – ВЭМЭА. СПАВ × × 103, мас. %: 1 – 0.00, 2 – 2.00, 3 – 5.30, 4 – 13.30.
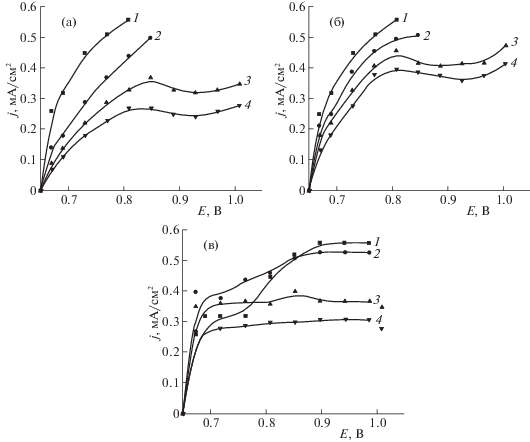
Аналогичная картина наблюдается и в растворах 1.0 М HCOONa и 0.35 МNa3C6H5O7 · 2H2O. В растворе 0.35 М Na3C6H5O7 · 2H2O в присутствии ВЭМЭА наблюдается ускорение электродного процесса, что проявляется в увеличении токов восстановления и уменьшении поляризации. Увеличение токов восстановления может характеризоваться сильным сглаживающим эффектом ПАВ. Вероятно, при малых концентрациях ВЭМЭА, имеющий карбоксильную группу, адсорбируясь на электроде положительным углеродным концом, а кислородным – в раствор, способствует ускорению процесса за счет подтягивающего действия отрицательных частиц на ионы Cd2+ с образованием промежуточных комплексов. Следует отметить, что в случае СМААФ-АК и ГОКП с увеличением концентрации добавок указанный эффект исчезает, и наблюдается торможение процесса, проявляющееся в смещении потенциала полуволны (Е1/2) в область отрицательных значений. Уменьшение токов восстановления связано, по-видимому, с ростом степени заполнения поверхности электрода молекулами адсорбата.
По методу, описанному в работе [17], проведен анализ полученных поляризационных кривых и построены зависимости для процесса электровосстановления ионов кадмия(II)
Процесс электровосстановления ионов кадмия(II) протекает в две стадии:
В случае торможения стадии переноса электрона не нарушается стадия адсорбции иона Cd2+ на электроде. Постоянство коэффициента переноса свидетельствует о неизменности механизма процесса разряда ионов Cd2+. Из зависимостей $\ln i{\text{/}}(1 - {{e}^{{(nF\eta /RT)}}}) - \eta $ рассчитаны величины токов обмена jo для разряда ионов кадмия(II). Величины токов обмена (jo × 103, А/см2) электровосстановления ионов кадмия(II) в различных электролитах в присутствии ПАВ приведены в табл. 1–3.
Таблица 1.
Величины токов обмена (jo × 103, А/см2) электровосстановления ионов кадмия(II) в различных электролитах в присутствии СМААФ-АК при Т = 298–328 K
| Электролит | Т, K | СПАВ × 103, мас. % | |||||
|---|---|---|---|---|---|---|---|
| 0.0 | 2.0 | 4.0 | 5.3 | 7.0 | 13.3 | ||
| 0.5 М Na2SO4 | 298 308 318 328 |
5.0 9.0 13.5 19.4 |
4.4 8.2 10.2 17.8 |
3.8 7.4 9.4 16.2 |
2.5 6.2 8.3 15.4 |
2.2 5.4 6.5 13.3 |
1.0 5.0 7.0 13.0 |
| 1.0 М NH2SO3H | 298 308 318 328 |
6.2 7.3 9.9 11.2 |
6.1 6.8 6.3 8.5 |
6.1 6.5 6.0 7.4 |
5.9 6.0 5.9 7.1 |
5.3 5.7 5.9 6.7 |
5.0 5.5 5.7 6.1 |
| 1.0 М HCOONa | 298 308 318 328 |
3.2 4.9 9.0 14.4 |
2.85 4.0 – – |
2.9 3.5 – – |
2.8 3.4 – – |
2.7 3.2 – – |
2.8 2.6 9.0 14.4 |
| 0.35 М Na3C6H5O7 · 2H2O | 298 308 318 328 |
3.6 4.8 5.1 8.1 |
3.5 4.7 5.0 6.8 |
3.5 4.5 5.0 5.0 |
3.45 4.4 4.4 5.0 |
2.9 4.2 4.0 4.9 |
3.1 4.0 3.8 4.8 |
Таблица 2.
Величины токов обмена (jo × 103, А/см2) электровосстановления ионов кадмия(II) в различных электролитах в присутствии ГОКП при Т = 298–328 K
| Электролит | Т, К | СПАВ×103, мас. % | |||||
|---|---|---|---|---|---|---|---|
| 0.0 | 2.0 | 4.0 | 5.3 | 7.0 | 13.3 | ||
| 0.5 МNa2SO4 | 298 308 318 328 |
5.0 9.0 13.5 19.4 |
4.8 8.1 13.0 19.2 |
4.2 8.4 12.4 19.0 |
3.6 7.8 12.0 19.0 |
3.0 7.6 11.5 18.8 |
2.0 7.0 10.5 18.4 |
| 1.0 М NH2SO3H | 298 308 318 328 |
6.2 7.3 9.9 13.3 |
5.8 7.0 8.0 7.8 |
5.6 6.7 7.5 7.8 |
5.5 6.1 7.0 7.8 |
5.4 5.9 6.7 7.8 |
5.3 5.8 6.2 7.8 |
| 1.0 М HCOONa | 298 308 318 328 |
3.2 4.9 9.0 14.4 |
2.8 4.5 8.6 – |
2.6 4.4 8.5 13.4 |
2.4 4.2 8.2 12.2 |
2.1 4.1 7.0 11.8 |
1.9 3.7 6.1 11.1 |
| 0.35 М Na3C6H5O7 · 2H2O | 298 308 318 328 |
3.6 4.8 5.8 6.3 |
2.9 4.5 5.0 6.0 |
3.0 4.3 4.4 5.5 |
3.0 4.1 3.3 4.2 |
3.1 3.9 3.0 3.1 |
2.7 3.7 2.8 2.9 |
Таблица 3.
Величины токов обмена (jo × 103, А/см2) электровосстановления ионов кадмия(II) в различных электролитах в присутствии ВЭМЭА при Т = 298–328 K
| Электролит | Т, K | СПАВ × 103, мас. % | |||||
|---|---|---|---|---|---|---|---|
| 0.0 | 2.0 | 4.0 | 5.3 | 7.0 | 13.3 | ||
| 0.5 М Na2SO4 | 298 308 318 328 |
5.0 9.0 13.5 19.4 |
2.1 – – – |
2.0 – – – |
1.8 – – – |
1.6 – – – |
1.5 – – – |
| 1.0 М NH2SO3H | 298 308 318 328 |
6.2 7.3 9.9 11.2 |
5.7 6.7 8.0 10.1 |
5.5 6.7 6.9 8.5 |
5.5 6.6 6.8 7.7 |
5.4 6.0 6.7 6.7 |
5.3 5.4 5.6 6.3 |
| 1.0 М HCOONa | 298 308 318 328 |
3.2 4.9 9.0 14.4 |
2.8 – – – |
3.0 – – – |
2.7 – – – |
2.5 – – – |
1.0 4.9 9.0 14.4 |
| 0.35 М Na3C6H5O7 · 2H2O | 298 308 318 328 |
3.6 4.8 5.1 8.1 |
2.6 4.7 5.0 7.8 |
2.6 4.6 4.9 7.5 |
2.8 4.5 4.8 7.3 |
2.8 4.1 4.8 7.1 |
3.0 3.9 4.8 7.0 |
Анализ данных таблиц показывает, что скорость электровосстановления ионов кадмия(II) в зависимости от аниона фона в отсутствие ПАВ уменьшается в ряду:
Введение добавки ПАВ приводит к уменьшению величины jo, что указывает на торможение данного процесса. Следует отметить, что в растворе 0.5 М Na2SO4 в присутствии ПАВ наблюдается сильное торможение процесса электровосстановления ионов кадмия(II). Это объясняется образованием адсорбционной пленки ПАВ на поверхности электрода. Тормозящее действие добавки ПАВ зависит от природы анионов электролита и в присутствии СМААФ-АК усиливается в ряду:
С целью выяснения влияния температуры в исследованных электролитах нами проведено изучение электровосстановления ионов кадмия(II) при Т = 298–328 K.
Поляризационные кривые электровосстановления ионов кадмия(II), полученные при 308–328 K в растворе 1.0 М NH2SO3H, свидетельствуют, что и при Т = 328 K наблюдается торможение разряда ионов кадмия(II). Ингибирование сопровождается уменьшением токов восстановления и увеличением поляризации. Следует отметить, что и при Т = 328 K наблюдается ослабление ингибирующего действия СМААФ-АК. Аналогичная картина наблюдается в растворах 1.0 М HCOONa, 0.5 М Na2SO4, 0.35 М Na3C6H5O7 · 2H2O.
В растворах 1.0 М KCl, KBr, KNO3 ингибирования электровосстановления ионов кадмия адсорбционной пленкой ПАВ с повышением температуры не наблюдается, т.е. температура не влияет на ингибирующее действие ПАВ.
Полученные зависимости $\ln i{\text{/}}(1 - {{e}^{{(nF\eta /RT)}}}) - \eta $ для разряда ионов кадмия(II) в отсутствие и в присутствии ПАВ линейны и параллельны друг другу, т.е. механизм торможения процесса электровосстановления ионов кадмия(II) в присутствии ПАВ при повышенных температурах остается неизменным. Величины коэффициента переноса α для разряда ионов кадмия(II) на кадмиевом электроде остаются постоянными. Постоянство α является свидетельством неизменности механизма процесса разряда ионов кадмия(II) в присутствии ПАВ. Ингибирование осуществляется на стадии проникновения ионов деполяризатора в поверхностный слой.
Рассчитанные в этих условиях токи обмена (jo × 103, А/см2) приведены в табл. 1–3. Данные табл. 1–3 показывают, что при всех исследованных температурах с увеличением содержания ПАВ ингибиторные свойства ПАВ сохраняются, и при всех изученных температурах наблюдается ингибирование процесса. Уменьшение jo служит доказательством торможения электродного процесса. Ингибиторные свойства ГОКП и ВЭМЭА сохраняются и при Т = 328 K. В растворе 0.5 М Na2SO4 с увеличением температуры ингибирующее действие ГОКП ослабляется.
По методу, предложенному в работе [18], проведен температурно-кинетический анализ поляризационных кривых в интервале температур Т = = 298–328 K в отсутствие ПАВ. Температурно-кинетические кривые для разряда ионов кадмия(II) в отсутствие ПАВ (рис. 2) и в присутствии ПАВ (рис. 3) линейны и не зависят от перенапряжения.
Рис. 2.
Температурно-кинетические кривые электровосстановления ионов кадмия(II) в различных фоновых электролитах в отсутствие ПАВ: 1 – 0.5 М Na2SO4, 2 – 1.0 М HCOONa, 3 – 1.0 М NH2SO3H, 4 – 0.35 М Na3C6H5O7 · 2H2O.
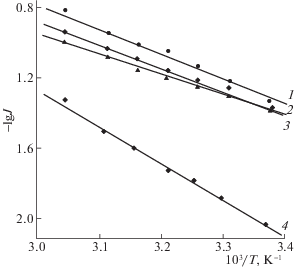
Рис. 3.
Температурно-кинетические кривые электровосстановления ионов кадмия(II) в различных фоновых электролитах в присутствии СМААФ-АК: 1 – 0.5 М Na2SO4, 2 – 1.0 М HCOONa, 3 – 1.0 М NH2SO3H, 4 – 0.35 М Na3C6H5O7 · 2H2O.
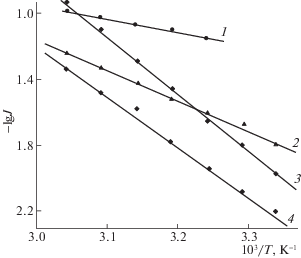
Из полученных данных рассчитаны эффективные энергии активации электровосстановления ионов кадмия(II) в различных электролитах в отсутствие и в присутствии ПАВ, которые приведены в табл. 4. Из табл. 4 видно, что в присутствии СМААФ-АК во всех электролитах значение Аэфф возрастает. Увеличение Аэфф свидетельствует о возникновении дополнительного энергетического барьера при адсорбции ПАВ. В присутствии ГОКП значения Аэфф также возрастает за исключением 0.5 МNa2SO4. А в случае ВЭМЭА значения Аэфф во всех электролитах ниже, чем в электролите без ПАВ, что связано, вероятно, с понижением степени заполнения поверхности электрода при повышении температуры.
Таблица 4.
Значения эффективной энергии активации (Аэфф, кДж/моль) электровосстановления ионов кадмия(II) в различных электролитах
| ПАВ | 0.5 М Na2SO4 | 1.0 М NH2SO3H | 1.0 М HCOONa | 0.35 М Na3C6H5O7 · 2H2O |
|---|---|---|---|---|
| Без ПАВ | 22.9 | 21.1 | 23.2 | 39.0 |
| СМААФ-АК | 34.4 | 50.9 | 32.5 | 63.7 |
| ГОКП | 14.1 | 38.2 | 31.3 | 56.2 |
| ВЭМЭА | 11.3 | 18.0 | 15.4 | 29.0 |
Таким образом, полученные экспериментальные данные позволяют сделать заключение, что адсорбция исследованных ПАВ приводит как к торможению процесса разряда ионов кадмия(II) на кадмиевом электроде, так и к ускорению электродного процесса в зависимости от природы добавки и условий электролиза. Температурные исследования показывают, что разряд ионов кадмия(II) в присутствии СМААФ-АК и ГОКП ингибируются и при Т = 328 K, что свидетельствует о температурной устойчивости адсорбционного слоя исследованных ПАВ. При прочих разных условиях значения Аэфф выше для СМААФ-АК и для цитратного фонового электролита, что свидетельствует о более сильном ингибировании электровосстановления Cd2+ этой добавкой во всех фоновых электролитах и о возрастании энергетического барьера для разряда деполяризатора на фоне цитратных комплексов кадмия(II).
Список литературы
Loshkaryov M.A., Loshkaryov Y.M. // Surface Technology. 1978. V. 6. № 6. P. 397.
Demeev B.B., Dauletbay A., Nauryzbaiev M.K. // Chem. Eng. Trans. 2016. V. 47. P. 211.
Некрасов Л.Н., Выходцева Л.Н. // Электрохимия. 1995. Т. 31. № 11. С. 1235.
Nieszporek J. // S. Afr. J. Chem. 2014. V. 67. P. 1.
Лошкарев М.А., Лошкарев Ю.М., Кудина И.П. // Электрохимия. 1977. Т. 13. № 5. С. 71.
Metikos-Hukovic M., Babic R., Grubac Z., Brinic S. // J. Appl. Electrochem. 1996. № 26. P. 443.
Лошкарев Ю.М. // Журн. аналит. химии. 1993. Т. 48. № 6. С. 999.
Muller E., Emous H., Porfler H.-D., Lipkowsky J.J. // J. Electroanalyt. Chem. 1982. № 142. P. 39.
Grishina E.P., Ramenskaya L.M., Vladimirova T.V., Pimenova A.M. // Russ. J. Appl. Chem. 2007. V. 80. № 2. P. 249.
Kolosnitsin V.S., Yapryntseva O.A. // Ibid. 2004. V. 77. № 1. P. 60.
Dalbanbay A., Nefedov A.N., Nurmanova R.A., Nauryzbayev M.K. // Chem. Bull. Kazakh. Nat. Univ. 2017. № 87(4). P. 12.
Soliman H.M. // App. Surf. Sci. 2002. V. 195. P. 155.
Афанасьев Б.Н., Дамаскин Б.Б. // Электрохимия. 1980. Т. 16. № 3. С. 280.
Kuta J., Cmoler J. // Collect. Czech. Chem. Commun. 1968. V. 33. № 6. P. 1656.
Дяткина С.Л., Дамаскин Б.Б., Выгодская М.З. // Электрохимия. 1980. Т. 16. № 7. С. 996.
Касымова М.К., Мендалиева Д.К., Наурызбаев М.К. // Вестн. КазГУ. Серия хим. 1997. № 8. С. 47.
Делахей П. Двойной слой и кинетика электродных процессов. М.: Мир, 1967. 351 с.
Vlcek A.A. // Collect. Czech. Chem. Commun. 1959. V. 24. № 11. P. 3538.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


