Журнал физической химии, 2019, T. 93, № 6, стр. 924-929
Разделение энантиомеров галогеналканов и спиртов на неподвижной фазе на основе супрамолекулярной структуры меламина с индуцированной хиральностью
Ю. Ю. Гайнуллина a, *, Д. В. Тимофеева a, С. П. Иванов b, В. Ю. Гуськов a
a Башкирский государственный университет
450074 Уфа, Россия
b Российская академия наук, Уфимский федеральный исследовательский центр,
Уфимский институт химии
450054 Уфа, Россия
* E-mail: umashkova@mail.ru
Поступила в редакцию 14.09.2018
После доработки 22.11.2018
Принята к публикации 23.11.2018
Аннотация
Предложена новая хиральная неподвижная фаза на основе супрамолекулярной структуры меламина, самособранной в режиме индуцирования хиральности. Индуцирование осуществлено с помощью механического размешивания в соответствии с эффектом Кондепуди с целью формирования на поверхности сорбента слоя супрамолекулярной структуры с преобладанием одного из видов хиральных супрамолекулярных доменов. Полученный таким образом инертный носитель с 1% меламина применен для газохроматографического разделения энантиомеров 2-бутанола, 1-метокси-2-пропанола, 2-бромбутана, 2-хлорбутана и 2-бромпентана. Рассчитаны коэффициенты селективности и коэффициенты разделения энантиомеров. На колонке, откондиционированной при 100°С, разделения энантиомеров не выявлено. После кондиционирования колонки при 200°С получена серия успешных разделений рацематов в диапазоне температур 60–110°С. Наибольший коэффициент селективности для галогеналканов получен при 70–75°C: 2-бромбутан имеет α = 1.62 при 70°С, для 2-хлорбутана α = 1.23 при 75°С, для 2-бромпентана α = 1.68 при 70°С. Для 2-бутанола и 1-метокси-2-пропанола коэффициент селективности имеет наибольшее значение при 80 и 100°С (α = 1.45 и 2.24) соответственно. Предположено, что способность супраструктуры меламина проявлять энантиоселективность связана с образованием полостей, способных к хиральному распознаванию.
Оптически активные соединения играют важную роль в биохимических процессах, поэтому разработка способов определения энантиомерной чистоты актуальна для решения проблем химической и фармацевтической промышленности. Контроль оптической чистоты производимых лекарственных средств в настоящее время введен практически во всех странах мира [1]. Для этого часто применяется хиральная хроматография [2]. В качестве хиральных неподвижных фаз используются сорбенты с поверхностью, модифицированной группами или веществами с хиральными центрами (хитозаны, циклодекстрины, полисахариды, белки и др.) [3–6]. Однако их энантиоселективность не всегда соответствует требуемой. Поэтому представляет интерес разработка адсорбентов на основе хиральных наноматериалов.
В этой связи представляют интерес двумерные супрамолекулярные структуры ряда гетероциклических соединений. В такие структуры могут самособираться yрацил [7–9] и его производные [10–12], циануровая кислота [13–15] и многие другие соединения [16–18]. Часть таких структур способна давать полости определенного размера и формы, в которых возможна селективная адсорбция органических молекул [19–22].
Среди супрамолекулярных 2D-структур выделяется меламин [9]. Несмотря на сплошную 2D-структуру, было показано, что сформированная на асимметричной подложке Au(111) центральная молекула ячейки супрамолекулярной структуры связана слабее, нежели остальные шесть молекул. При ее отщеплении образуется полость размером 5 Å, в которой возможна селективная адсорбция молекул [15, 23].
Ранее нами было обнаружено, что супрамолекулярные структуры урацила и циануровой кислоты, несмотря на ахиральность исходной молекулы, при определенных условиях способны самособираться в структуры, проявляющие макроскопическую хиральность [24, 25]. В качестве ключевых факторов, определяющих возникновение способности к хиральному распознаванию, были выделены самосборка супрамолекулярной структуры аналогично эффекту спонтанного нарушения симметрии при получении энантиоморфных кристаллов по Кондепуди, а также наличие в супраструктуре полости [26]. При этом для меламина также была обнаружена способность супрамолекулярной структуры к хиральному распознаванию. Однако остается невыясненной роль полости в хиральном распознавании именно супрамолекулярной структуры меламина, а также возможности неподвижных фаз на основе меламина к разделению 2-галогеналканов.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исходным адсорбентом служил Inerton N (Chemapol, Чехия, удельная поверхность 0.4–0.65 м2/г, размер частиц 0.200–0.250 мм). В качестве модификатора поверхности использовали меламин (“Химтрейд”, марка “х.ч.”, CAS 108-78-1). Перед началом модифицирования меламин очищали перекристаллизацией из водного раствора. В качестве растворителя использовали водно-спиртовой раствор в соотношении вода–этанол 3 : 1. Использованную дистиллированную воду подвергали дополнительной очистке на деионизаторе ДВ-10UV (ЦветХром, Россия), этанол марки “х.ч.” дополнительно не очищали. Модифицирование поверхности инертного носителя осуществляли по следующей методике: в 50 мл термостатируемого при 60°С растворителя вносили навеску инертного носителя Inerton N массой 6 г, после чего включали размешивание раствора со скоростью 500 оборотов в минуту. В размешиваемую суспензию медленно вносили нагретый до 60°С раствор меламина объемом 20 мл с массой растворенного вещества 60 мг, с дальнейшим упариванием при температуре 60°С до тех пор, пока размешивание не становилось невозможным. Полученный порошок модифицированного адсорбента сушили при комнатной температуре и далее доводили до постоянной массы в сушильном шкафу при температуре 100–110°С. Данная методика модифицирования способствует формированию на поверхности сорбента слоя супрамолекулярной структуры с преобладанием одного вида хиральных супрамолекулярных доменов [26].
Для установления возможности отщепления центральной молекулы меламина из его супрамолекулярной структуры хроматографическую колонку подвергали прогреву при 100 и 200°С. К концу колонки прикрепляли газовую линию, с помощью которой осуществляли барботирование проходящего через колонку газа через виалу с деионизированной водой.
Далее методом ВЭЖХ на хроматографе Waters Breeze с двухволновым спектрофотометрическим детектором содержимое виал проверяли на содержание меламина. Для анализа применяли колонку Pursuit XRs 5 C18 (250 × 4.6 мм; размер частиц – 5 мкм, Agilent Technologies). В качестве подвижной фазы использовали элюент состава ацетонитрил : вода = 10 : 90, скорость потока 1 мл/мин. Все анализы проводили при 230 нм.
Принципиальную способность адсорбентов на основе супраструктуры меламина к хиральному распознаванию устанавливали методом конкурентной адсорбции энантиомеров 2-бромбутана из их раствора в пентане в мольном соотношении 2-бромбутан:пентан 1 : 300, с поляриметрическим контролем. Последний осуществляли с помощью автоматического поляриметра Atago AP-300 (Atago, Япония). Использовали кювету размером 100 мм с объемом 5 мл. Длина волны составляла 589 нм. Раствор рацемата 2-бромбутана помещали в кювету для измерения угла вращения плоскости поляризованного света α. Затем раствор помещали в стеклянную колбу на 25 мл, в которую добавляли 2 г модифицированного адсорбента. В качестве последнего использовали навески пористого полимера Dowex V503, модифицированного 10% меламина по указанной выше методике, предварительно откондиционированные при 100 и 200°С. Далее раствор перемешивали в течение 1 ч на автоматическом шейкере, фильтровали и проводили повторные измеренияя значений α.
Разделение рацематов галогеналканов и спиртов проводили на газовом хроматографе Цвет-500М (Цвет, Россия) с пламенно-ионизационным детектором при скорости газа-носителя гелия (марки А, Реторта, Россия, CAS № 7440-59-7) ω = 10 мл/мин в диапазоне температур от 55 до 100°С. Использовали стальную колонку длиной 1 м и внутренним диаметром 3 мм. Колонку предварительно кондиционировали в течение 10 ч при 100°С. В качестве аналитов использовали 1-метокси-2-пропанол, 2-бутанол, 2-хлорбутан, 2-бромбутан и 2-хлорпентан (CAS № 78–86–4, 78–76–2, 78–75–3, 78–96–2 и 625–29–6; все – Sigma-Aldrich, США, чистота >98%).
Удельные удерживаемые объемы аналитов рассчитывали из определенных экспериментально приведенных времен удерживания $t_{R}^{'}$, с:
где j – коэффициент Джеймса–Мартина, ω – скорость газа-носителя, мл/с; m – масса сорбента в колонке, г. Коэффициент селективности энантиомеров рассчитывали по формуле: Здесь и далее слабее удерживающийся энантиомер обозначен как S-энантиомер, сильнее удерживающийся – как R-энантиомер. Критерий разделения двух оптических изомеров рассчитывали по формуле:(3)
$R = \frac{{\Delta {{V}_{g}}}}{{{{\mu }_{{0.5\left( S \right)}}} + {{\mu }_{{0.5\left( R \right)}}}}},$В случае неполного разделения пиков использовался критерий разделения К2:
где h1 и h2 – высоты первого и второго пика соответственно, hmin – минимум на кривой элюирования между пиками. В этом случае критерий разделения R рассчитывали по следующей формуле:ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Было обнаружено, что после прогрева при 100°С насадочная колонка, заполненная модифицированным меламином инертным носителем, показала отсутствие способности к разделению энантиомеров: при попытке разделения исследуемых рацематов на хроматограмме наблюдался один пик. При этом ВЭЖХ-анализ показал отсутствие меламина в виале. Однако, после прогрева при 200°С было получено разделение для пар энантиомеров 2-бромбутана, 2-хлорбутана и 2-хлорпентана, 2-бутанола, 1-метокси- 2-пропанола в диапазоне температур 60–100°C (рис. 1–4). Как видно из хроматограмм, наблюдается разделение рацемата на два энантиомера. При этом в некоторых случаях площади пиков отличались друг от друга по не совсем понятным причинам. ВЭЖХ-анализ содержимого виалы после барботирования через нее газа-носителя также показал присутствие меламина в концентрации 0.67 ± 0.08 мкг/мл. Известно [27], что при температуре 180–200°С возможна сублимация меламина. Подобное явление, вероятно, связано с отщеплением центральной молекулы супрамолекулярной структуры меламина, слабее связанной с остальными молекулами [15]. Возможность отщепления центральной молекулы с образованием полости размером 5 Å была показана нами ранее на основе анализа термодинамики адсорбции органических молекул на модифицированных меламином адсорбентах [23]. Образующаяся полость размером 5 Å, по всей видимости, ответственна за способность к хиральному распознаванию. При кондиционировании колонки при 100°С, вероятно, не происходит отщепления центральной молекулы супрамолекулярной структуры, что фиксируется отсутствием следов меламина в газе-носителе при кондиционировании. В результате супраструктура остается сплошной, и разделения энантиомеров не наблюдается.
Рис. 1.
Разделение рацемата 2-бромбутана. Условия: ω = 10 мл/мин, а) Т = 70°С, $t_{R}^{'}$ = 54 c, б) Т = 75°С, $t_{R}^{'}$ = 71 с, в) Т = 85°С, $t_{R}^{'}$ = 85 с.
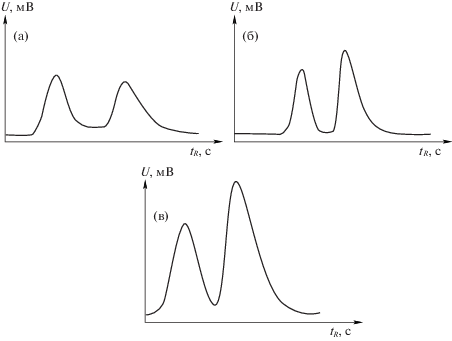
Рис. 2.
Разделение рацемата 2-бромпентана. Условия: ω = 10 мл/мин, а) Т = 70°С, $t_{R}^{'}$ = 227 с, б) Т = 85°С, $t_{R}^{'}$ = 189 с, в) Т = 90°С, $t_{R}^{'}$ = 162 с.
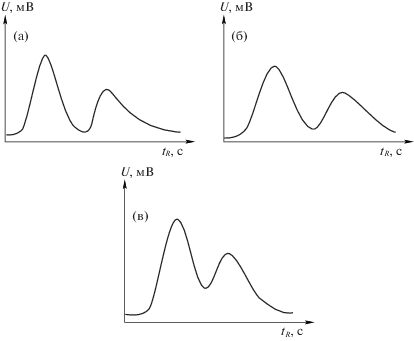
Рис. 3.
Разделение рацемата 2-хлорбутана. Условия: ω = 10 мл/мин, а) Т = 75°С, $t_{R}^{'}$ = 108 с, б) Т = 85°С, $t_{R}^{'}$ = 51 с.

Рис. 4.
Разделение рацемата 1-метокси-2-пропанола. Условия: Т = 100°С, ω = 10 мл/мин, $t_{R}^{'}$ = 23 с.

Угол вращения плоскости поляризованного света раствора 2-бромбутана в пентане составлял 0.00 ± 0.01°, однако после адсорбции модифицированным меламином полимером Dowex V503, прогретым при 200°С, угол вращения составил –0.03 ± 0.01°. Это свидетельствует о том, что D-энантиомер адсорбируется лучше, чем L-энантиомер. Следовательно, супрамолекулярная структура меламина после прогрева при 200°С способна к хиральному распознаванию. В то же время после адсорбции раствора 2-бромбутана таким же образцом, откондиционированным при 100°С, угол вращения составил 0.00 ± 0.01°, что коррелирует с описанными выше результатами.
Значения удерживаемых объемов, коэффициентов селективности, а также критериев разделения К1 для разделяемых пар энантиомеров спиртов и галогеналканов приведены в табл. 1 и 2. Из полученных данных следует, что для 2-бромбутана и 2-хлорбутана время выхода S-энантиомера равно времени выхода несорбирующегося компонента в пределах ошибки измерений, следовательно, $V_{g}^{S}$ = 0. Однако, для 2-бромпентана удерживаемые объемы для S- и R-энантиомеров отличны от нуля, что свидетельствует об удерживании последнего на модифицированном сорбенте. Нулевое удерживания одного из энантиомеров указывает на отсутствие его адсорбции на инертном носителе, модифицированном меламином. Поскольку исходная поверхность инертна, отличное от нуля удерживание другого энантиомера может наблюдаться только в случае его адсорбции в полости структуры меламина. Схожие явления ранее наблюдались на неподвижных фазах, модифицированных циануровой кислотой [24] и урацилом [25]. Причина наблюдаемых явлений заключается в том, что один энантиомер способен частично адсорбироваться в полости супрамолекулярной структуры, а другой – нет.
Таблица 1.
Значения коэффициентов селективности, а также критерии разделения K1 для разделяемых пар энантиомеров спиртов на изучаемом сорбенте
| Т, °С | α | Vg | K1 | |
|---|---|---|---|---|
| Vg1 | Vg2 | |||
| 2-бутанол | ||||
| 60 | 1.38 | 65.60 | 88.64 | 0.76 |
| 70 | 1.42 | 80.93 | 115.86 | 1.08 |
| 80 | 1.45 | 19.40 | 28.82 | 0.95 |
| 90 | 1.14 | 14.32 | 16.54 | 0.52 |
| 100 | 1.28 | 21.07 | 27.46 | 0.79 |
| 1-метокси-2-пропанол | ||||
| 100 | 2.24 | 12.56 | 30.20 | 0.89 |
Таблица 2.
Значения коэффициентов селективности, а также критерии разделения K1 для разделяемых пар энантиомеров галогеналканов на изучаемом сорбенте
| Т, °С | α | Vg | K1 | |
|---|---|---|---|---|
| Vg1 | Vg2 | |||
| 2-бромбутан | ||||
| 70 | 1.62 | 0 | 0.15 | 0.83 |
| 75 | 1.38 | 0 | 0.69 | 1.04 |
| 80 | 1.25 | 0 | 0.43 | 0.84 |
| 85 | 1.26 | 0 | 0.51 | 0.87 |
| 90 | 1.19 | 0 | 0.43 | 0.67 |
| 2-хлорбутан | ||||
| 75 | 1.23 | 0 | 0.81 | 0.48 |
| 80 | 1.19 | 0 | 1.52 | 0.60 |
| 85 | 1.16 | 0 | 0.19 | 0.48 |
| 90 | 1.15 | 0 | 0.16 | 0.39 |
| 2-бромпентан | ||||
| 70 | 1.68 | 1.97 | 4.43 | 1.08 |
| 75 | 1.49 | 1.88 | 3.61 | 0.98 |
| 80 | 1.48 | 1.79 | 3.42 | 0.93 |
| 85 | 1.40 | 1.62 | 2.92 | 0.78 |
| 90 | 1.35 | 1.58 | 2.71 | 0.64 |
Как видно из полученных данных, 2-бутанол имеет высокие коэффициенты селективности (α = 1.42 и 1.45 при 70 и 80°С соответственно). Данная неподвижная фаза показала высокую энантиоселективность по отношению к 1-метокси-2-пропанолу при температуре 100°С. Коэффициент селективности составил 2.24. При более низких температурах сильное размывание пиков мешало достоверному фиксированию максимума пика.
Для галогеналканов высокая энантиоселективность проявлется при более низких температурах: 2-бромбутан имеет высокий коэффициент селективности α = 1.62 при 70°C, для 2- бромпентана α = 1.68 при 70°C, для 2-хлорбутана α = 1.23 при 75°C. В исследуемом диапазоне температур эффективность составляла 150–300 теоретических тарелок. Относительное стандартное отклонение времен удерживания не превышало 5%.
Таким образом, установлена принципиальная энантиоселективность супрамолекулярной структуры меламина, самособранной на поверхности инертного носителя по указанной выше методике. Показано, что энантиоселективность достигается за счет отщепления центральной молекулы супрамолекулярной структуры при кондиционировании при 200°С и образования полостей. Полученные данные коррелируют с ранее установленным влиянием полостей на способность супраструктур гетероциклических соединений к хиральному распознаванию. На предложенной неподвижной фазе проведены успешные разделения рацематов спиртов и 2-галогензамещенных алканов методом газовой хроматографии. Благодаря высокой энантиоселективности исследуемая неподвижная фаза позволила осуществить полное разделение 1-метокси-2-пропанола, 2-бутанола, 2-бромбутана, 2-хлорбутана и 2-хлорпентана на насадочной колонке длиной 1 м с эффективностью всего лишь 150–300 теоретических тарелок, с удовлетворительной воспроизводимостью результатов.
Работа выполнена за счет гранта Российского научного фонда (проект № 17-73-10181).
Список литературы
Xie S.-M., Yuan L.-M. // J. Separation Sci. 2017. V. 40. № 1. C. 124.
Гуськов В.Ю., Майстренко В.Н. // Журн. аналит. химии. 2018. Т. 73. № 10.
Peluso P., Mamane V., Cossu S. // J. Chromatogr. A. 2014. V. 1363. P. 11.
Chang C., Wang X., Bai Y., Liu H. // TrAC. 2012. V. 39. P. 195.
Adly F.G., Antwi N.Y., Ghanem A. // Chirality. 2016. V. 28. № 2. P. 97.
Xiao Y., Ng S.-C., Tan T.T.Y., Wang Y. // J. Chromatogr.A. 2012. V. 1269. P. 52.
Cavallini M., Aloisi G., Bracali M., Guidelli R. // J. Electroanal. Chem. 1998. V. 444. P. 75.
Dretschkow T., Dakkouri A.S., Wandlowski T. // Langmuir. 1997. V. 13. P. 2843.
Gardener J.A., Shvarova O.Y., Briggs G.A.D., Castell M.R. // J. Phys. Chem. C. 2010. V. 114. P. 5859.
Venkatasubramanian K., Mojeste R.J., Trefonas Z.M. // J. Heterocycl. Chem. 1975. V. 12. № 4. P. 699.
Иванов C.П., Лысенко К.А., Колядина О.А. и др. // Журн. физ. химии. 2005. Т. 79 № 2. С. 278.
Feher R., Wurst K., Amabilino D.B., Veciana J. // Inorg. Chimica Acta. 2008. V. 361. P. 4094.
Guo F., Cheung E.Y., Harris K.D.M., Pedireddi V.R. // Cryst. Growth Des. 2006. V. 6 № 4. P. 846.
Kannappan K., Werblowsky T.L., Rim K.T. et al. // J. Phys. Chem. B. 2007. V. 111. P. 6634.
Zhang H.-M., Xie Z.-X., Long L.-S. et al. // J. Phys. Chem. C. 2008. V. 112. P. 4209.
Lin Y.-P., Ourdjini O., Giovanelli L. et al. //Ibid. 2013. V. 117. P. 9895.
Roy B., Bairia P., Nandi A.K. // RSC Adv. 2014. V. 4. P. 1708.
Godlewski S., Tekiel A., Piskorz W. et al. // ACS Nano. 2012.V. 6. № 10. P. 8536.
Gus’kov V.Y., Gainullina Y.Y., Ivanov S.P., Kudasheva F.K. // J. Chromatogr. A. 2014. V. 1356. P. 230.
Гуськов В.Ю., Гайнуллина Ю.Ю., Иванов С.П., Кудашева Ф.Х. // Физикохимия поверхности и защита материалов. 2014. Т. 50. № 1. С. 59.
Гуськов В.Ю., Иванов С.П., Хабибуллина Р.А. и др. // Журн. физ. химии. 2012. Т. 86. № 3. С. 546.
Гуськов В.Ю., Гайнуллина Ю.Ю., Иванов С.П., Кудашева Ф.Х. // Там же. 2014. Т. 88. № 6. С. 1058.
Гайнуллина Ю.Ю., Гуськов В.Ю. // Вестн. Башкирск. ун-та. 2017. Т. 22. № 3. С. 707.
Гуськов В.Ю., Сухарева Д.А., Арсланова И.В., Мусабиров Д.Э. // Журн. аналит. химии. 2017. Т. 72. № 10. С. 65.
Нафикова А.Р., Аллаярова Д.А., Гуськов В.Ю. // Там же. 2019. Т. 74. № 2.
Gus’kov V.Y., Sukhareva D.A., Gainullina Y.Y. et al. // Supramol. Chem. 2018. V. 30. № 11. P. 940.
Правдин А.И. // Успехи в химии и химической технологии. 2008. Т. 22. № 2. С. 28.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



