Журнал физической химии, 2019, T. 93, № 6, стр. 835-839
Константа скорости реакции озона с хлорид-ионом в водном растворе по механизму переноса атома кислорода
А. В. Леванов a, *, О. Я. Исайкина a, В. В. Лунин a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: levanov@kge.msu.ru
Поступила в редакцию 06.09.2018
После доработки 06.09.2018
Принята к публикации 06.09.2018
Аннотация
Выполнены экспериментальные исследования влияния концентраций ионов Cl– и Н+, температуры, ионной силы на величину константы скорости реакции О3 с Cl–(aq), протекающей по механизму переноса атома кислорода и приводящей в кислой среде к образованию молекулярного хлора. Предложена расчетная формула, которая описывает зависимость константы от указанных факторов.
Количественные данные о кинетике взаимодействия озона с хлорид-ионом в водном растворе необходимы в тех областях деятельности человека, где происходит контакт озона с хлоридсодержащими растворами. Это, в частности, процессы озонирования различных вод, в том числе морской воды и рассолов, а также озонотерапия. Кроме того, соответствующая информация требуется при фундаментальных исследованиях комплексного взаимодействия атмосферного озона с хлорид-ионами, содержащимися в воде океана и аэрозоле пограничного слоя атмосферы.
Реакция О3 с Cl–(aq) – сложный процесс и протекает через несколько стадий [1–3]. В кислой среде основным конечным продуктом является молекулярный хлор (в водном растворе хлоридов он присутствует в виде молекулы Cl2 и комплексного иона ${\text{Cl}}_{3}^{ - }$), и стехиометрическое уравнение суммарной реакции имеет вид [4]
(1)
${{{\text{O}}}_{{\text{3}}}} + {\text{2C}}{{{\text{l}}}^{--}} + {\text{2}}{{{\text{H}}}^{ + }} = {\text{C}}{{{\text{l}}}_{{\text{2}}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$Важнейший побочный продукт – хлорат-ион ${\text{ClO}}_{3}^{ - }$ [5], в кислой среде его доля по отношению к молекулярному хлору составляет ~1–2%. Возможно образование и других побочных продуктов, в частности, перхлорат-иона [6].
В настоящей работе рассматривается только основной путь реакции О3 с Cl–(aq), который в кислой среде ведет к образованию молекулярного хлора. Первичной лимитирующей стадией является окисление хлорид-иона озоном по механизму переноса атома кислорода с образованием соединений хлора в степени окисления +1. Это – сложный процесс, который, скорее всего, протекает через образование комплекса молекулы О3 с Cl–; возможно, что в кислой среде комплекс присоединяет ион водорода. В зависимости от кислотности реакционного раствора стехиометрическое уравнение первичной стадии можно представить в виде
(2)
$\begin{gathered} {\text{C}}{{{\text{l}}}^{--}} + {{{\text{O}}}_{{\text{3}}}} \to {\text{Cl}}{{{\text{O}}}^{--}} + {{{\text{O}}}_{{\text{2}}}}\quad {\text{и /и л и }} \\ {\text{C}}{{{\text{l}}}^{--}} + {{{\text{O}}}_{{\text{3}}}} + {{{\text{Н }}}^{ + }} \to {\text{HOCl}} + {{{\text{O}}}_{{\text{2}}}}. \\ \end{gathered} $В кислых растворах соединения Cl(+1) вступают в быстрые реакции протонирования: ClO– + H+ ⇄ ⇄ HOCl, HOCl + H+ + Cl– ⇄ Cl2 + H2O с образованием молекулярного хлора в качестве конечного продукта. Механизм сложной реакции озона с хлорид-ионом в водном растворе, включающей перенос атома кислорода от молекулы О3 к иону Cl–, подробно обсуждается в работе [2].
Важнейшая кинетическая особенность реакции О3 с Cl–(aq) состоит в том, что она ускоряется ионами водорода [1]. Ионы Н+ можно назвать катализаторами [7], хотя в суммарной реакции (1) и первичной стадии (2) они расходуются. Наиболее подробные исследования кинетики реакции О3 с Cl–(aq) выполнены в работе [1], где определена зависимость скорости выделения хлора от концентраций O3, Cl–, H+ и температуры, и показано, что реакция имеет строго первый кинетический порядок по озону и приближенно первый порядок по хлорид-иону. Согласно результатам [1], в растворах NaCl + HCl, в интервале температур 7–60°С и при ионной силе I = 1 М удельная скорость выделения хлора R(Cl2), равная отношению скорости выделения хлора в газовую фазу (моль л–1 с–1) к концентрациям хлорид-иона в растворе (моль/л) и озона в газовой фазе (моль/л), может быть представлена выражением
(3)
$\begin{gathered} R({\text{C}}{{{\text{l}}}_{{\text{2}}}})\;({\text{л м о л }}{{{\text{ь }}}^{{--{\text{1}}}}}{{{\text{с }}}^{{--{\text{1}}}}}){\text{ }} = \\ = \;\frac{{6.43 \times {{{10}}^{5}}\exp ( - 6260{\text{/}}T) + 1.70 \times {{{10}}^{{ - 4}}}\exp (1640{\text{/}}T) \times 3.46 \times {{{10}}^{9}}\exp ( - 7240{\text{/}}T)[{{{\text{H}}}^{ + }}]}}{{1 + 3.46 \times {{{10}}^{9}}\exp ( - 7240{\text{/}}T)[{{{\text{H}}}^{ + }}][{\text{C}}{{{\text{l}}}^{ - }}]}}. \\ \end{gathered} $Необходимо отметить, что в [1], а также во всех экспериментах настоящей работы ионная сила реакционного раствора равна общей концентрации электролитов, поскольку при приготовлении растворов использовали только 1–1-электролиты (HCl, NaCl, NaClO4 и пр.). В [1] приведены также значения константы скорости реакции О3 с Cl–(aq). Однако вследствие систематической ошибки значения растворимости озона в растворах NaCl + HCl завышены в ~1.5 раза, а константы скорости – соответственно занижены.
Правильные величины растворимости озона для аналогичных условий эксперимента в растворах NaCl + HCl различной концентрации найдены в наших недавних исследованиях [8], при этом кажущаяся константа Генри представляется равенством
(4)
${\text{lg}}{{H}_{{\text{O}}}}_{{\text{3}}} = --{\text{4}}.{\text{66}} + {\text{12}}00{\text{/}}T--0.{\text{236}}I,$Выражения скорости выделения хлора (3) и константы Генри озона (4) позволили получить корректную формулу для константы скорости реакции озона с хлорид-ионом в водном растворе:
(5)
$\begin{gathered} k({{{\text{O}}}_{{\text{3}}}} + {\text{C}}{{{\text{l}}}^{--}},I = {\text{1}}),\;{\text{л м о л }}{{{\text{ь }}}^{{--{\text{1}}}}}{{{\text{с }}}^{{--{\text{1}}}}}{\text{ }} = \\ = \;\frac{{5.10 \times {{{10}}^{{10}}}\exp ( - 9020{\text{/}}T) + 13.5\exp ( - 1120{\text{/}}T) \times 3.46 \times {{{10}}^{9}}\exp ( - 7240{\text{/}}T)[{{{\text{H}}}^{ + }}]}}{{1 + 3.46 \times {{{10}}^{9}}\exp ( - 7240{\text{/}}T)[{{{\text{H}}}^{ + }}][{\text{C}}{{{\text{l}}}^{ - }}]}}. \\ \end{gathered} $Ионная сила (наряду с температурой) – один из важнейших факторов, от которых зависят константы скорости реакций в растворе. Цель настоящей работы – получить выражение для константы скорости реакции О3 с Cl–(aq), которое описывает ее зависимость от ионной силы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Взаимодействие озона с водными растворами NaCl + HCl осуществляли в барботажных реакторах. Использовали два реактора – нетермостатируемый и термостатируемый с объемами реакционного раствора 250 и 150 мл соответственно, описанные в работе [8]. Для приготовления растворов использовали однократно дистиллированную воду, хлорид натрия “х.ч.”, концентрированную хлористоводородную кислоту “х.ч.” или “ос.ч.”, концентрированную хлорную кислоту “х.ч.”.
Озон получали при пропускании особо чистого кислорода через барьерный разряд в озонаторе. Концентрацию озона в озоно-кислородной смеси контролировали на входе в реактор с помощью фотометрических озонометров “Медозон 254/5”, она составляла 5–110 г/м3. Скорость потока кислорода во всех экспериментах составляла 21 л/ч (ст.у.). Газовые коммуникации были сделаны из тефлонового или медицинского поливинилхлоридного шлангов. Специальными опытами установлено, что разложения материала шлангов под действием озона и образования за счет этого Cl2 практически не происходит.
В ходе экспериментов методом прямой спектрофотометрии определяли содержание молекулярного хлора в газовом потоке на выходе из реактора. Спектры в УФ- и видимой областях регистрировали в течение 10–15 мин после начала опыта с помощью прибора Agilent-8453. В этой области газообразный Cl2 имеет единственную линию поглощения при λmax = 329.5 нм (ε329.5 = = 66.82 л моль–1 см–1) [9]. При этом на относительно слабую линию хлора накладывается интенсивная полоса Хартли непрореагировавшего озона (λmax = 255 нм, ε255 = 3002.5 л моль–1 см–1) [10]. Поэтому выходящие газы пропускали сначала через трубчатую печь. Ее температуру (~500°С) специально подбирали, так что в печи озон полностью разлагался, а Cl2 не подвергался никаким изменениям [11]. Затем газы поступали в оптическую кювету спектрофотометра Agilent 8453 и далее выводились под тягу.
После такой обработки в спектрах наблюдали единственный пик – сигнал молекулярного хлора с максимумом при 330 нм. Концентрацию Cl2, моль/л, рассчитывали по оптической плотности при 330 нм (A330) на основе закона Бугера–Ламберта–Бера:
где $\ell $ = 10.5 см – длина оптического пути газовой кюветы спектрофотометра.Скорость выделения хлора, ($d{{n}_{{{\text{C}}{{{\text{l}}}_{2}}}}}$/dt)/Vliq, находили из зависимости концентрации хлора в выходящих газах от времени озонирования. Определяли концентрацию хлора на выходе из реактора в установившемся (стационарном) режиме функционирования реактора и вычисляли скорость выделения хлора, моль л–1 с–1, по формуле
Экспериментальные значения константы скорости реакции озона с хлорид-ионом в водном растворе рассчитывали с помощью выражения
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Значения константы k(O3 + Cl–), полученные в экспериментах настоящей работы (точки) при ионной силе раствора 1 М и температуре 20 ± 1°С, и рассчитанные по формуле (5) (линии), показаны на рис. 1, 2. Можно видеть, что формула (5), основанная на результатах [1, 2], очень хорошо согласуется с экспериментальными значениями константы. При этом важно отметить, что концентрацию хлора в выходящих газах определяли разными методами: спектрофотометрическим в настоящей работе, и методом фотометрической иодометрии с предварительным разложением озона [11] в статье [1]. Совпадение данных свидетельствует о корректности этих экспериментальных методов.
Рис. 1.
Зависимость константы скорости реакции О3 с Cl–(aq) от концентрации хлорид-иона в реакционном растворе при постоянной ионной силе 1 М, концентрации ионов H+, равной 0.9 M, и температуре 20 ± 1°С. Содержание озона в исходных газах 94–100 г/м3. Реакционные растворы содержат 0.1 M NaCl, а также HCl и HClO4, сумма концентраций кислот равна 0.9 M. Точки – экспериментальные результаты, линии – расчет по формуле (5).
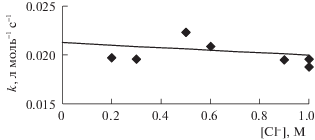
Рис. 2.
Зависимость константы скорости реакции О3 с Cl–(aq) от концентрации ионов водорода в реакционном растворе при постоянной ионной силе 1 М, концентрации хлорид-ионов 1 М, и температуре 20 ± 1°С. Содержание озона в исходных газах 92–106 г/м3. Реакционные растворы содержат NaCl и HCl, сумма их концентраций равна 1 M. Точки – экспериментальные результаты, линии – расчет по формуле (5).

Зависимость константы k(O3 + Cl–) от ионной силы и температуры представлена на рис. 3; ионная сила равна концентрации хлорид-иона в реакционном растворе. При увеличении этого фактора константа возрастает, однако рост имеет тенденцию к насыщению. Выражение (5), соответствующее ионной силе 1 М, не может правильно описать экспериментальные зависимости рис. 3.
Рис. 3.
Зависимости константы скорости реакции О3 с Cl–(aq) от ионной силы реакционного раствора при различных температурах: 1 – 20, 2 – 30, 3– 40°С. Содержание озона в исходных газах 10–102 г/м3. Реакционные растворы содержат 0.5 М HCl и 0.1 – 2 М NaCl; ионная сила равна концентрации Cl–. Точки – экспериментальные результаты, линии – расчет по формуле (7).

Реакция молекулы О3 с ионом Cl– относится к классу реакций между ионом и незаряженной молекулой. Известно, что константы скорости простых (одностадийных) реакций между ионом и молекулой в водном растворе зависят не только от температуры, но и от ионной силы, причем с ростом ионной силы они линейно возрастают [12]. Это явление может быть объяснено на основе уравнения Бренстеда–Бьеррума – одного из выражений термодинамического аспекта теории активированного комплекса [13].
Оказывается, можно получить удовлетворительное описание зависимости константы k(O3 + Cl–) от ионной силы I, если предположить линейную зависимость k(O3 + Cl–) от I и ввести в выражение (5) соответствующий поправочный множитель. Следует отметить, что это – эмпирический подход, поскольку реакция О3 с Cl–(aq) является сложной и идет через несколько стадий. Величина поправочного множителя равна (1 + 0.8 I), а скорректированное выражение константы имеет вид
Коэффициент 0.8 при ионной силе подобран из условия минимизации расхождения экспериментальных значений константы и вычисленных по формуле (6) при всех исследованных температурах. Деление на 1.8 производится потому, что выражение (5) относится к ионной силе 1 М. Выполнив это действие, получаем окончательную формулу для константы скорости реакции О3 с Cl–(aq), описывающую ее зависимость от всех значимых экспериментальных факторов: температуры, концентраций ионов водорода и хлорид-ионов, и ионной силы:
(7)
$\begin{gathered} k({{{\text{O}}}_{{\text{3}}}} + {\text{C}}{{{\text{l}}}^{ - }}),\;{\text{л м о л }}{{{\text{ь }}}^{{ - {\text{1}}}}}{{{\text{с }}}^{{ - {\text{1}}}}} = \left( {1{\text{ }} + {\text{ }}0.8I} \right) \times \\ \times \;\frac{{2.84 \times {{{10}}^{{10}}}\exp ( - 9020{\text{/}}T) + 7.49\exp ( - 1120{\text{/}}T) \times 3.46 \times {{{10}}^{9}}\exp ( - 7240{\text{/}}T)[{{{\text{H}}}^{ + }}]}}{{1 + 3.46 \times {{{10}}^{9}}\exp ( - 7240{\text{/}}T)[{{{\text{H}}}^{ + }}][{\text{C}}{{{\text{l}}}^{ - }}]}}. \\ \end{gathered} $Из рис. 3 следует, что формула (7) хорошо описывает экспериментальные данные настоящей работы. При этом энергии активации и теплоты, входящие в выражения (5)–(7), определены не путем обработки экспериментальных данных рис. 3, а на основе результатов наших предшествующих исследований [1]. Это свидетельствует о хорошем согласии между результатами, полученными разными методами и на разных установках, и подтверждает надежность и достоверность выражения (7) для константы скорости k(O3 + Cl–).
Список литературы
Леванов А.В., Кусков И.В., Зосимов А.В., Антипенко Э.Е., Лунин В.В. // Кинетика и катализ. 2003. Т. 44. № 6. С. 810.
Леванов А.В., Антипенко Э.Е., Лунин В.В. // Журн. физ. химии. 2012. Т .86. № 3. С. 593.
Levanov A.V., Antipenko E.E., Lunin V.V. // Russ. J. Phys. Chem. A. 2012. V. 86. № 13. P. 2086.
Леванов А.В., Кусков И.В., Антипенко Э.Е., Лунин В.В. // Журн. физ. химии. 2012. Т. 86. № 5. С. 849.
Леванов А.В., Кусков И.В., Антипенко Э.Е., Лунин В.В. // Журн. физ. химии. 2008. Т. 82. № 12. С. 2271.
Kang N., Jackson W.A., Dasgupta P.K., Anderson T.A. // Sci. Total Environ. 2008. V. 405. № 1–3. P. 301.
Laidler K.J. // Pure Appl. Chem. 1996. V. 68. № 1. P. 149.
Levanov A.V., Isaikina O.Y., Gasanova R.B., Lunin V.V. // Ind. Eng. Chem. Res. 2018. V. 57. № 43. P. 14355.
Maric D., Burrows J.P., Meller R., Moortgat G.K. // Photochem. Photobiol. A: Chem. 1993. V. 70. P. 205.
Sander S.P., Abbatt J., Barker J.R. et al. // Chemical Kinetics and Photochemical Data for Use in Atmospheric Studies, Evaluation № 17. Pasadena: JPL Publication 10–6, Jet Propulsion Laboratory, 2011.
Леванов А.В., Кусков И.В., Зосимов А.В., Антипенко Э.Е., Лунин В.В. // Журн. аналит. химии. 2003. Т. 58. № 5. С. 496.
Bell R.P. // Salt Effects, in Katalyse in Lösungen (Handbuch der Katalyse, B.2), G.-M. Schwab, Editor. Wien: Verlag von Julius Springer, 1940. P. 191.
Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ, 3-изд. М.: Химия, 1985.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


