Журнал физической химии, 2019, T. 93, № 6, стр. 840-844
Влияние азотсодержащего основания на кинетику образования комплекса цинка с окта(м-трифторметилфенил)порфиразином в бензоле
О. А. Петров a, *, Г. В. Осипова a, П. С. Харламова a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: poa@isuct.ru
Поступила в редакцию 17.09.2018
После доработки 15.10.2018
Принята к публикации 15.10.2018
Аннотация
Изучено влияние добавок н-бутиламина, трет-бутиламина, пиперидина и морфолина на кинетику реакции комплексообразования ацетата цинка с окта(м-трифторметилфенил)порфиразином в бензоле. Предложена возможная схема реакции комплексообразования. Установлено, что с разветвлением углеводородной цепи в амине скорость реакции уменьшается, а с увеличением pKa азотсодержащего основания – возрастает.
Порфиразины, являясь ароматическими макроциклическими соединениями, благодаря необычному электронному и геометрическому строению, находят все более широкое применение в качестве катализаторов, жидкокристаллических материалов и фотосенсибилизаторов. Они проявляют полупроводниковые свойства и рассматриваются в качестве перспективных материалов в сенсорных устройствах [1]. Расширить спектр практического применения этих макроциклов позволяет всестороннее изучение их физико-химических свойств.
К числу наиболее важных свойств порфиразинов относится их способность вступать в реакции молекулярного комплексообразования с солями металлов, среди которых важное место занимает цинк. Его эссенциальные свойства проявляются в регулировании ряда жизненноважных процессов [2, 3].
На реакцию комплексообразования порфиразинов с солями металлов достаточно сильное влияние оказывают свойства среды. В случае порфиразинов влияние протоноакцепторного характера среды подробно изучено на примере образования комплекса магния [4–7]. Напротив, влияние азотсодержащего основания на кинетику и механизм введения иона цинка в порфиразиновый макроцикл еще далеко от полной ясности.
В связи с этим в данной работе показано влияние добавок азотсодержащих оснований (В) – н-бутиламина (BuNH2), трет-бутиламина (ButNH2), пиперидина (Pip) и морфолина (Mor) на реакцию комплексообразования окта(м-трифторметилфенил)порфиразина (H2Pa(C6H4CF3)8
с ацетатом цинка (Zn(OAc)2) в бензоле.ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Окта(м-трифторметилфенил)порфиразин синтезировали по методике [8]. Ацетат цинка, азотсодержащие основания и бензол подвергали очистке согласно [9, 10]. Для проведения кинетических исследований в термостатируемую кювету спектрофотометра SHIMADZU-UV-1800 помещали свежеприготовленный раствор H2Pa(C6H4CF3)8 в бензоле с постоянной концентрацией и добавляли ацетат цинка, растворенный в системе бензол–азотсодержащее основание с переменной концентрацией последнего. Скорость реакции комплексообразования определяли по уменьшению оптической плотности на длине λ = = 660 нм, так как максимум первой полосы поглощения H2Pa(C6H4CF3)8 совпадает с минимумом в электронном спектре поглощения прореагировавшей смеси. Различие в максимумах полос поглощения H2Pa(C6H4CF3)8 и его цинкового комплекса позволило определить текущую и конечную концентрации ZnPa(C6H4CF3)8 по формуле:
Здесь A0, Aτ, A∞ – оптические плотности растворов в начальный момент времени, в момент времени τ и после завершения реакции (τ∞); C° и C – начальная и текущая концентрации H2Pa(C6H4CF3)8. Все измерения проводили в условиях реакции псевдопервого порядка, поэтому эффективную (наблюдаемую) константу скорости реакции образования ZnPa(C6H4CF3)8 рассчитывали по формуле:Погрешность в кинетических параметрах определяли по методу Стьюдента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
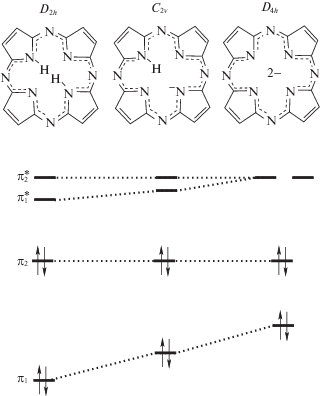
Предварительно установлено, что в среде бензола комплексообразования H2Pa(C6H4CF3)8 с Zn(OAc)2 не наблюдается в виду ограниченной растворимости соли металла. При $C_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ < 0.10 и $C_{{{\text{B}}{{{\text{u}}}^{{\text{t}}}}{\text{N}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ < 0.11 моль/л в бензоле спектрально-фиксируемого взаимодействия H2Pa(C6H4CF3)8 и Zn(OAc)2 также не происходит. Характер исходного электронного спектра поглощения (ЭСП) H2Pa(C6H4CF3)8 (λI = 660, λII = 595 нм) остается без изменений в течение ∼95 ч при 318 K. Однако в интервале концентраций $C_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 0.10–0.58 и $C_{{{\text{B}}{{{\text{u}}}^{{\text{t}}}}{\text{N}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 0.11–6.77 моль/л в бензоле в ЭСП H2Pa(C6H4CF3)8 независимо от природы основания с течением времени регистрируются увеличение интенсивности полосы поглощения с λ = = 630 нм и одновременное уменьшение интенсивности полос поглощения λI, и λII (рис. 1). Спектральные изменения, сопровождающие реакцию комплексообразования (рис. 1), идентичны таковым в процессе кислотно-основного взаимодействия порфиразинов [11], в ходе которых происходит повышение энергии низшей свободной молекулярной орбитали (НСМО) $\pi _{1}^{*}$ и высшей заполненной молекулярной орбитали (ВЗМО) π1, в то время как энергии ВЗМО π2 и НСМО $\pi _{2}^{*}$ не претерпевают существенных изменений. Уменьшение энергетической разности между ВЗМО π1 и π2, а также вырождение двух НСМО $\pi _{{1,2}}^{*}$ (рис. 2) приводит к повышению симметрии π хромофора молекулы от D2h до D4h. Это свидетельствует о депротонировании порфиразинового макроцикла в ходе комплексообразования и указывает на вхождение Zn2+ в координационный центр H2Pa(C6H4CF3)8 с образованием ZnPa(C6H4CF3)8.
Рис. 1.
Изменение электронного спектра поглощения H2Pa(C6H4CF3)8 в присутствии Zn(OAc)2 в системе н‑бутиламин–бензол в течение 17 мин при 298 K и $C_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 0.10 моль/л.
Кинетические исследования показали, что реакция:
(3)
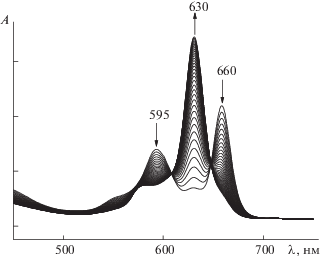
$\begin{gathered} {{{\text{H}}}_{{\text{2}}}}{\text{Pa}}{{({{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}})}_{8}} + {\text{Zn}}{{({\text{OAc}})}_{2}} + {\text{B}}\;\xrightarrow{{{{k}_{{\text{э }}}}}} \\ \to \;{\text{ZnPa}}{{({{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}})}_{8}} + 2{\text{HOAc}} + {\text{B}} \\ \end{gathered} $Рис. 3.
Зависимости ln(C°/C) от времени реакции образования ZnPa(C6H4CF3)8 в системе н-бутиламин (трет-бутиламин) – бензол при 298 K и концентрациях $C_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 0.10 (1) и 1.13 моль/л (2).
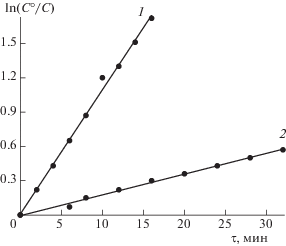
Рис. 4.
Зависимости lg kэ от lg ${{C}_{{{\text{Zn(OAc}}{{{\text{)}}}_{{\text{2}}}}}}}$ для реакции образования ZnPa(C6H4CF3)8 в системе н-бутиламин (трет-бутиламин) – бензол при 298 (1) и 318 K (2) и концентрациях $C_{{{\text{BuN}}{{{\text{H}}}_{{\text{2}}}}}}^{^\circ }$ = 0.20 (1) и 0.11 моль/л (2).
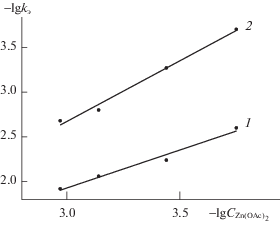
Как видно из данных табл. 1, введению Zn2+ в координационный центр H2Pa(C6H4CF3)8 благоприятствует увеличение в бензоле концентрации н-бутиламина и трет-бутиламина, а также температуры реакции. Каталитическое влияние добавок этих оснований на реакцию (3) иллюстрируют прямолинейные зависимости lg kэ = f(lg CB) (рис. 5) с тангенсом угла наклона, близким к единице. Следовательно,
(5)
$--d{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa}}{{{({{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}})}}_{{\text{8}}}}}}}{\text{/}}d\tau = k{{C}_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa}}{{{({{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}})}}_{{\text{8}}}}}}}{{C}_{{{\text{Zn}}{{{({\text{OAc}})}}_{{\text{2}}}}}}}{{C}_{{\text{B}}}},$Таблица 1.
Кинетические параметры реакции образования ZnPa(C6H4CF3)8 в системе азотсодержащее основание–бензол ($C_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}}}^{^\circ }$ = 1.03 × 10–5 моль/л, $C_{{{\text{Zn(OAc}}{{{\text{)}}}_{{\text{2}}}}}}^{^\circ }$ = 1.08 × 10–4 моль/л)
| $C_{{\text{B}}}^{^\circ }$, моль/л | Т, K | kэ × 103, с–1 | k, л2/(моль2 с) | Ea, кДж/моль | –∆S≠, Дж/(моль K) |
|---|---|---|---|---|---|
| н-Бутиламин | |||||
| 0.10 | 298 308 318 |
1.80 2.15 2.60 |
10.80 12.90 15.50 |
15 | 255 |
| 0.20 | 298 308 318 |
2.50 3.10 3.90 |
7.50 9.30 11.70 |
17 | 246 |
| 0.33 | 298 308 318 |
4.60 5.50 6.85 |
8.35 9.90 12.60 |
15 | 250 |
| 0.58 | 298 308 318 |
8.40 10.50 12.90 |
8.70 10.80 13.20 |
17 | 236 |
| трет-Бутиламин | |||||
| 0.11 | 298 308 318 |
0.03 0.07 0.20 |
2.60 6.40 16.30 |
74 | 91 |
| 0.52 | 298 308 318 |
0.16 0.40 1.00 |
2.90 7.20 18.05 |
72 | 84 |
| 1.13 | 298 308 318 |
0.30 0.75 1.85 |
2.50 6.20 15.20 |
72 | 78 |
| 3.38 | 298 308 318 |
1.00 2.50 6.10 |
2.74 6.85 16.70 |
71 | 72 |
| 6.77 | 298 308 318 |
2.05 4.90 12.15 |
2.80 6.70 16.60 |
70 | 69 |
Рис. 5.
Зависимости lg kэ от lg CB для реакции образования ZnPa(C6H4CF3)8 в системе н-бутиламин (трет-бутиламин) – бензол при 298 K и $C_{{{\text{Zn(OAc}}{{{\text{)}}}_{{\text{2}}}}}}^{^\circ }$ = 1.08 × 10–4 моль/л.

На основании полученных данных возможная схема реакции (3) может иметь следующий вид:
Согласно [12], в порфиразиных макроциклах внутрициклические NH-связи обладают более высокой NH-кислотностью по сравнению с порфириновыми, вследствие чего являются делокализованными, т.е. связанными с двумя атомами азота посредством двухцентровых водородных связей. По этой причине порфиразины достаточно легко вступают в кинетически контролируемые кислотно-основные взаимодействия с азотсодержащими основаниями в среде инертных малополярных растворителей (бензола, хлорбензола) [13]. Этот факт дает основание полагать, что на первой стадии комплексообразования молекула основания вступает во взаимодействие с одним из двух протонов NH-групп H2Pa(C6H4CF3)8, судя по кинетическому уравнению (5), с образованием Н-комплекса, в котором атом водорода, связанный с молекулой основания и двумя внутрициклическими атомами азота через водородные связи, должен располагаться над плоскостью макроцикла. При этом полная передача NH-протона, приводящая к образованию ионной структуры, представляется маловероятной [13].
На завершающей стадии процесса осуществляется вхождение Zn2+ в координационный центр кислотно-основного Н-комплекса, которое требует меньших энергетических затрат на разрыв NH-связей в отличие от молекулярной формы H2Pa(C6H4CF3)8. Предполагается, что k1 ≫ k–1, а k1 < k2, поскольку помежуточный Н-комплекс спектрально не регистрируется. Следует отметить, что аналогичная схема реакции образования ZnPa(C6H4CF3)8, судя по данным [14], реализуется и при введении в бензол циклических азотсодержащих оснований – пиперидина и морфолина.
Результаты эксперимента (табл. 1) показывают, что замена н-бутиламина (pKа = 10.60 [15]) на близкий по основности трет-бутиламин (pKа = = 10.68 [15]) приводит к уменьшению скорости комплексообразования, судя по величинам k298, в ∼5 раз. При этом Еа и ∆S≠ процесса не претерпевают существенных изменений. Этот факт не является неожиданным, если принять во внимание, что разветвление углеводородной цепи в амине препятствует оптимальной пространственной ориентации молекул-партнеров на стадии кислотно-основного взаимодействия (схема), т.е. образованию Н-комплекса между H2Pa(C6H4CF3)8 и ButNH2. Среди циклических оснований максимальная скорость реакции (3) наблюдается в бензоле с добавками пиперидина (табл. 2). Введение в четвертое положение пиридинового цикла дополнительного гетероатома кислорода не влияет на пространственное строение амина [16], однако приводит к понижению pKа на ∼2.5 единицы. В результате этого при переходе от пиперидина (pKа = 11.23 [15]) к менее протоноакцепторному морфолину (pKа = 8.50 [15]) величина k298 уменьшается в ∼23 раза на фоне незначительного роста величин Еа и ∆S≠. Представляется вполне вероятным, что в присутствии пиперидина образование Н-комплекса Н2Pa(C6H4CF3)8 (схема) происходит значительно быстрее, и как следствие, легче происходит вхождение Zn2+ в координационный центр макроцикла.
Таблица 2.
Кинетические параметры реакции образования ZnPa(C6H4CF3)8 в системе азотсодержащее основание–бензол ($C_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}}}^{^\circ }$ = 0.5 × 10–5 моль/л, $C_{{{\text{Zn(OAc}}{{{\text{)}}}_{{\text{2}}}}}}^{^\circ }$ = 1.08 × 10–4 моль/л [14])
| B | $C_{{\text{B}}}^{^\circ }$, моль/л | k298, л2/(моль2 с) | Ea, кДж/моль | –∆S≠, Дж/(моль K) |
|---|---|---|---|---|
| Морфолин | 2.96 | 0.09 | 37 | 215 |
| Пиперидин | 2.63 | 2.05 | 26 | 228 |
Список литературы
The Porphyrins Handbook. Applications: Past, Present and Future / Ed. by K.M. Kadish, M.K. Smith, R. Guilard. V.G. S. Diego, S. Francisco. N.Y., Boston, London, Sydney, Tokio: Acad. Press, 2000. 346 p.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. М.: Медицина, 1998. 704 с.
Кальман Я., Рем К.-Г. Наглядная биохимия. М.: Бином, 2011. 469 с.
Петров О.А., Березин Б.Д. // Журн. физ. химии. 1999. Т. 73. № 12. С. 2148.
Петров О.А. // Коорд. химия. 2000. Т. 26. № 9. С. 652.
Петров О.А., Березин Б.Д., Чижова Н.В., Семейкин А.С. // Там же. 1999. Т. 25. № 9. С. 675.
Петров О.А., Лысова С.А., Березин Б.Д., Чижова Н.В. // Там же. 2003. Т. 29. № 3. С. 187.
Vagin S.I., Hanack M. // Eur. J. Org. Chem. 2002. P. 2859.
Карякин Ю.В., Ангелов И.И. Чистые химические реактивы. М.: Химия, 1974. 407 с.
Титце Л., Айхер Г. Препаративная органическая химия. М.: Мир, 1999. 704 с.
Stuzhin P., Khelevina O., Berezin B. // Phthalocyanines: Properties and Applications. New York: VCH Publ., 1996. V. 4. P. 23.
Stuzhin P., Khelevina O. // Coord. Chem. Rev. 1996. V. 147. P. 41.
Петров О.А. // Журн. общ. химии. 2013. Т. 83. № 4. С. 681.
Петров О.А., Осипова Г.В. // Там же. 2016. Т. 86. № 8. С. 1376.
The Handbook of Chemistry and Physics / Ed. by William and M. Haynes. Taylor and Francis, 2013. 2668 p.
Blackburne I.D., Katritzky A.R., Takeuchi Y. // Accounts. Chem. Res. 1975. V. 8. № 9. P. 300.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии