Журнал физической химии, 2019, T. 93, № 6, стр. 850-855
Межмолекулярные взаимодействия 6-додеканоил-2-диметиламинонафталина в гомогенных и бинарных растворителях по данным спектрофлуорометрии
Т. Ю. Титова a, *, Ю. П. Морозова a
a Национальный исследовательский Томский государственный университет
634050 Томск, Россия
* E-mail: tatyana.yu.titova@gmail.com
Поступила в редакцию 18.09.2018
После доработки 11.11.2018
Принята к публикации 16.11.2018
Аннотация
Проведена оценка роли неспецифических и специфических взаимодействий с учетом диэлектрической проницаемости, параметров основности и кислотности растворителей на флуоресцентные свойства молекулы 6-додеканоил-2-диметиламинонафталина. Предложена количественная оценка вклада водородной связи в смещение полосы флуоресценции. Влияние протонодонорных растворителей рассмотрено с образованием комплексов двух типов. При изучении процессов пересольватации в бинарных смесях (неполярный+апротонный, неполярный-протонодонорный) показана эффективность метода производной спектрофлуорометрии. Полученные данные могут представлять интерес для специалистов в области теории растворов.
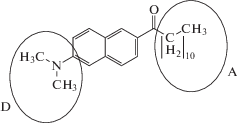
Проблема оценки вклада универсальных и специфических взаимодействий в спектрально-люминесцентные свойства молекул, наблюдаемых в эксперименте, – является одной из актуальных в области фотофизики и спектроскопии межмолекулярных взаимодействий. До сих пор имеется неоднозначность трактовки вкладов (универсальных и специфических взаимодействий) при изучении сольватофлуорохромии. Смена растворителя вызывает неоднозначные изменения флуоресцентных свойств молекулы в растворах, поэтому необходимо использовать подходы, основанные не только на диэлектрических свойствах растворителей и теоретических расчетах, а также на знании эмпирических параметров растворителя. Выбор молекулы лаурдана (6-додеканоил-2-диметиламинонафталин) обусловлен следующими причинами. В молекуле присутствуют электронно-донорная (диметиламино) и электронно-акцепторная (додеканоильная) группы (рис. 1); молекула характеризуется значительным электрическим дипольным моментом. Величина дипольного момента в различных литературных источниках варьируются в интервале 3.76–5 Д для основного и 7.6–19.8 Д – для возбужденного состояний [1–3].
Область флуоресценции выбранной молекулы в зависимости от окружения – 19800–25200 см–1. Молекула лаурдана обладает длинной углеводородной частью (СН2)10, с различной глубиной внедрения, которая способствует избирательности в расположении негомогенных структурах, что играет немаловажную роль при использовании ее в качестве флуоресцентного зонда в биохимических и биофизических исследованиях [4]. Параметры флуоресценции этой молекулы связаны с многоцентровостью к образованию комплексов с растворителями. Анализ динамического поведения молекулы, проведенный авторами данной работы, показал плоскую структуру в основном и первом возбужденном состоянии, а также отсутствие O-TICT (поворот пропионильной группы на 90°) и N-TICT (поворот диметиламиногруппы на 90°) конформаций [5].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование флуоресцентных свойств лаурдана проводилось как для гомогенных растворителей различной химической природы (циклогексан, ацетон, метанол, изопропанол, этанол), так и для бинарных смесей (циклогексан + изопропанол, циклогексан + этилацетат, циклогексан + ацетон).
Спектры флуоресценции регистрировались на установке для снятия спектров люминесценции СДЛ-2 [6]. В люминесцентных измерениях используется метод счета фотонов. Установка СДЛ-2, выполненная по блочному принципу, предназначена для исследования люминесценции в диапазоне от 200 до 800 нм. Источники возбуждения: HAMAMATSU и галогенная Н1 лампы. Все наблюдения производились при комнатной температуре. Длина волны возбуждения выбиралась из длинноволновой полосы поглощения. Для улучшения разрешения спектров флуоресценции использовался метод производной спектрометрии [7].
Используемое вещество и растворители имели следующие степени чистоты: лаурдан (6-додеканоил-2-диметиламинонафталин) (Fluka), гексан (“ч.д.а.”), изопропанол (“х.ч.”), этилацетат (“ч.д.а.”), ацетон (“ос.ч.”), этанол (95%).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Смещение полосы флуоресценции лаурдана при переходе от циклогексана к гидроксилсодержащим растворителям составляет 4100–5100 см–1 (метанол, этанол, изопропанол, глицерин), к апротонным растворителям (ацетон, тетрагидрофуран, ацетонитрил, этилацетат) 1730–2830 см–1 (рис. 2, табл. 1).
Таблица 1.
Эмпирические параметры растворителей и спектральные характеристики спектров флуоресценции лаурдана в различном окружении
| Пара | Растворитель | ε | f(ε) | SA | SB | $\nu _{{\max }}^{{{\text{fl}}}}$, см–1 | Δν1/2, см–1 | Р, фактор асимметрии | Δν, см–1 |
|---|---|---|---|---|---|---|---|---|---|
| 1 | Тетрагидрофуран | 7.32 | 0.404 | 0.000 | 0.591 | 23 150 [15] | 2050 | 1.50 | 50 |
| Этилацетат | 6.02 | 0.384 | 0.000 | 0.542 | 23 200 | 2560 | 1.48 | ||
| 2 | Метанол | 32.66 | 0.477 | 0.605 | 0.545 | 20 080 | 2840 | 1.06 | 280 |
| Глицерин | 42.5 | 0.485 | 0.653 | 0.309 | 19 800 | 2630 | 1.06 | ||
| 3 | Ацетон | 20.56 | 0.464 | 0.000 | 0.475 | 22 370 | 2660 | 1.31 | 1870 |
| Этанол | 24.55 | 0.470 | 0.400 | 0.658 | 20 500 | 2870 | 1.11 | ||
| 4 | Ацетон | 20.56 | 0.464 | 0.000 | 0.475 | 22 370 | 2660 | 1.31 | 1270 |
| Изопропанол | 19.92 | 0.463 | 0.283 | 0.830 | 21 100 | 2680 | 1.11 | ||
| 5 | Ацетонитрил | 38.8 | 0.481 | 0.044 | 0.286 | 22 070 [15] | 3130 | 2270 | |
| Глицерин | 42.5 | 0.485 | 0.653 | 0.309 | 19 800 | 2630 | 1.06 | ||
| 6 | Диоксан | 2.21 | 0.223 | 0.000 | 0.444 | 23 470 | 2380 | 1.34 | 1100 |
| Ацетон | 20.56 | 0.464 | 0.000 | 0.475 | 22 370 | 2660 | 1.31 | ||
| 7 | Ацетонитрил | 38.8 | 0.481 | 0.044 | 0.286 | 22 070 [15] | 3130 | 1990 | |
| Метанол | 32.66 | 0.477 | 0.605 | 0.545 | 20 080 | 2840 | 1.06 | ||
| Циклогексан | 2.03 | 0.202 | 0.000 | 0.073 | 25 200 | 2910 | 1.70 |
Положение полосы флуоресценции определяется как параметрами растворителя, так и изменением дипольного момента при переходе из основного в возбужденное состояние [6]:
Нами были проведены квантово-химические расчеты по определению энергии переходов и дипольные моменты в основном и флуоресцентном состоянии [4, 8, 9]. Теоретические расчеты проведены методом TDDFT (time-dependent density functional theory) [10] с функционалом B3LYP и базиса атомных орбиталей TZV (пакет программ GAMESS US) [11]. Ab initio-расчеты проводились на базе вычислительного кластера СКИФ Cyberia в межрегиональном суперкомпьютерном центре Томского госуниверситета [12]. Расчеты с учетом растворителя проведены в рамках модели поляризационного континуума IEFPCM (Polarized Continuum Model).
Дипольный момент, рассчитанный нами неэмпирическим методом в ряду растворителей (циклогексан, этанол, ацетон, метанол, тетрагидрофуран), при переходе из основного в первое возбужденное состояние возрастает в 2 раза (6.4–9.2 Д и 12.5–18.9 Д соответственно) [6].
Оценка дипольного момента для возбужденного состояния на основе формулы стоксова сдвига проведена, используя формулу Липперта [13]. В качестве растворителя в расчет принимался тетрагидрофуран. Значение величины μ было выбрано из проведенного нами ранее теоретического расчета в пакете программ GAMESS для состояния S0 (8.8 Д). При расчете учитывалось, что углеводородная цепочка является максимально скрученной и радиус полости 4.2 Å. Приближенное значение экспериментально полученного дипольного момента возбужденного состояния составило 22 Д.
Проведено сравнение энергий переходов, полученных экспериментально и теоретически в геометрии возбужденного состояния, в зависимости от величины диэлектрической проницаемости (рис. 3).
Рис. 3.
Положение состояния S1 для лаурдана в среде (и диэлектрическая проницаемость соответствующего растворителя).
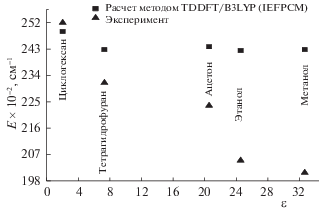
Используемые в расчетах растворители имеют значения диэлектрической проницаемости ε (циклогексан – 2.02, ацетон – 20.56, тетрагидрофуран – 7.32, этанол – 24.55, метанол – 32.66). На рис. 3 приведена зависимость расчетных значений энергии и экспериментальных данных S1-состояния от величины ε. В интервале диэлектрической проницаемости от 2 до 7.32 происходит изменение энергии на 520 см–1 для геометрии возбужденного состояния молекулы. В интервале диэлектрической проницаемости от 8 до 33 энергия перехода изменяется незначительно (150 см–1), что связано с величиной f(ε), которая практически не изменяется и в среднем имеет значение 0.453 (табл. 1). Значительная разница в энергии, полученной экспериментально и теоретически, наблюдается для полярного растворителя (4200 см–1), а наименьшая – для циклогексана (300 см–1) (рис. 3).
Перейдем к рассмотрению полученных экспериментальных данных по спектрам флуоресценции. Форма полосы флуоресценции определяется характеристиками: полуширина Δν1/2, фактор асимметрии. Полосы флуоресценции в протонодонорных растворителях симметричны и ассиметричны в растворителях с основными свойствами (табл. 1).
Для наглядности растворители в табл. 1 распределены по парам, обсуждаемые в работе далее. Параметр ε – диэлектрическая проницаемость, функция f(ε) – низкочастотная поляризуемость, f(n) – высокочастотная поляризуемость, SA – параметр кислотности, SB – параметр основности, Р – фактор асимметрии (P = (λmax – λ2)/(λ1 – λmax), где λ1 и λ2 – значение длин волн между точками полосы флуоресценции, в которых интенсивность равна половине максимальной), $\nu _{{\max }}^{{{\text{fl}}}}$ – максимум флуоресценции. Параметры SA и SB приведены по данным статьи [14].
На рис. 4 представлена зависимость максимума полосы флуоресценции лаурдана в растворителях с различными параметрами (основности, кислотности) от диэлектрической проницаемости (табл. 1). Полученная зависимость условно разбивается на две группы.
Рис. 4.
Зависимость максимума спектра флуоресценции лаурдана в различных средах от диэлектрической проницаемости (ε).
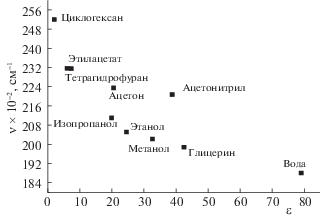
В первой группе оказались растворители, обладающие кислотными и основными свойствами (изопропанол, этанол, метанол, глицерин). Вторая группа содержит растворители с основными свойствами (ацетонитрил, ацетон, тетрагидрофуран, этилацетат).
Перейдем к рассмотрению флуоресцентных данных с учетом параметров кислотности SA и основности SB растворителей. Обратимся к табл. 1, где проведено разделение растворителей по парам. Для первой пары растворителей с близкими значениями ε, SB и SA максимумы полос совпадают (табл. 1). Для второй пары растворителей с отличными параметрами SB разница в максимумах полос – 280 см–1, т.е. выходит за пределы ошибки эксперимента. Но в этом случае отличаются ε и SB. Относительно ε заметим, что в формулу для сдвига полос входит f(ε), значения которой для этих растворителей близки. Для 3, 4, 5, 7-пар растворителей разница в максимумах полосы флуоресценции 1270–2270 см–1. Во всех четырех примерах протонодонорные растворители образуют водородную связь с молекулой лаурдан.
Определение возможных центров взаимодействия с протонодонорными растворителями, было проведено при помощи метода молекулярного электростатического потенциала (МЭСП). Электронное возбуждение в состоянии ππ* типа за счет перераспределения электронной плотности приводит к уменьшению заряда на атоме азота (со значения –0.218 к величине –0.096) и увеличению на атоме кислорода (–0.620) по сравнению с основным состоянием (–0.574) [8]. Рассматриваемое флуоресцентное состояние является зарядопереносным. Группа С=О является наиболее сильным акцептором во флуоресцентном состоянии по сравнению с основным состоянием.
Во всех рассмотренных случаях (пары 3, 4, 5, 7 (табл. 1)) с образованием Н-связи, наименьший сдвиг для пары номер 4. Это связано с самым малым параметром SA и высоким значением SB.
Наиболее близким приближением к оценке вклада Н-связи в смещение полосы флуоресценции является 3-пара. Величина сдвига за счет Н-связи 1870 см–1. Если принять во внимание пару 7 и 5, то можно отметить величину вклада за счет водородной связи 1990–2270 см–1 (различие в SB), при разнице в параметре SB ∼ в 2 раза. Для пары 6 (ацетон–диоксан) разность между максимумами составляет 1100 см–1. Это результат резкого увеличения ε (на порядок) или f(ε) в 2 раза. Сдвиг относительно циклогексана для лаурдана в ацетоне 2830 см–1: возможно сдвиг за счет ε ∼ ∼ 1100 см–1, за счет влияния параметра SB ∼ 1730 см–1.
Таким образом, при исследовании зависимости спектров флуоресценции лаурдана для кислотно-основного растворителя необходимо учитывать кроме общепринятого параметра (диэлектрическая проницаемость), еще два: кислотность и основность. Для растворителей с основными свойствами: диэлектрическую проницаемость и основность.
Для оценки вклада водородной связи в смещение полосы флуоресценции необходимо рассмотрение пар растворителей, для которых величина диэлектрической проницаемости ε по величине близки, но один из них обладает кислотными свойствами, т.е. растворитель должен образовывать с лаурданом водородную связь, а второй растворитель только основными свойствами, т.е. параметр SA = 0. Полученное нами значение 1870 см–1 не является точным, так как не удалось подобрать растворители с одинаковыми параметрами SB.
Перейдем к рассмотрению флуоресцентных свойств лаурдана в бинарных растворителях: циклогексан+этилацетат, циклогексан+ацетон; циклогексан+изопропанол. Разгорание флуоресценции в смеси наблюдается как для полярной компоненты, способной к образованию Н-связи, так и без образования последней. При добавке второй компоненты 10%, для изопропанола интенсивность возрастает в 26 раз, для этилацетата в 7 раз (рис. 5). Разгорание наблюдается и для ацетона.
В бинарных смесях при увеличении концентрации полярной компоненты наблюдается батохромный сдвиг. Как правило, при изучении полярности среды на спектры флуоресценции ππ*-типа речь идет о возрастании константы скорости внутренней конверсии (правило энергетического интервала) [16, 17], т.е. уменьшение интенсивности флуоресценции. Для лаурдана отмечаем разгорание флуоресценции с увеличением полярности среды, т.е. межмолекулярные взаимодействия (ММВ) лаурдана со средой уменьшают константу скорости безызлучательного перехода.
Для лаурдана наблюдается фосфоресценция при температуре 77 K в этаноле (19050–17860 см–1), т.е. нельзя исключить возможность интеркомбинационной конверсии.
Исходя из наблюдаемого разгорания флуоресценции лаурдана в бинарных растворителях предполагаем, что ММВ лаурдана с полярными добавками уменьшает константы скоростей безызлучательных переходов.
Изменение полярности среды при изучении флуоресцентных свойств органических молекул с карбонильной группой может вызвать как увеличение вероятности безызлучательной конверсии, так и ее уменьшение [17]. Молекулы с карбонильной группой, флуоресцентное состояние которых обусловлено внутримолекулярным переносом заряда, при взаимодействии с этанолом в работе [18] разделены на три группы: 1) молекулы испытывают тушение флуоресценции. Безызлучательная дезактивация в протонных растворителях эффективнее, чем та, которая следует из закона энергетического интервала для апротонных растворителей; 2) молекулы, флуоресценция которых испытывает существенный красный сдвиг; 3) молекулы, для которых зависимость энергетического интервала на безызлучательную дезактивацию в протонных растворителях не отличается от апротонных.
Разница в тушении флуоресценции, по мнению авторов [18], при взаимодействии флуорофоров со спиртами связана с изменением заряда на карбонильном кислороде и возможном изменении жесткости молекул при образовании Н‑связи.
Исследуемая молекула лаурдан относится ко второй группе. Водородная связь лаурдана со спиртом приводит к большему разгоранию флуоресценции, чем комплексообразование с апротонными растворителями.
Полоса флуоресценции лаурдана в бинарных смесях с увеличением концентрации полярной компоненты смещается в красную сторону, увеличивается ее полуширина. Так, для смеси циклогексан+изопропанол до определенной концентрации (до 4%) изопропанола увеличивается полуширина (до 3880 см–1) и наблюдается переход от широкого контура к более узкому симметричному (полуширина 2700 см–1) (рис. 6).
Рис. 6.
Спектры флуоресценции лаурдана в смеси циклогексан + изопропанол (%) (1а – 0%, 2а – 2%, 3а – 4%, 1b, 2b, 3b – соответствующие вторые производные).
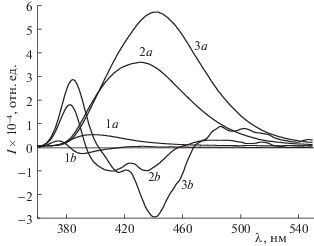
По экспериментальным спектрам флуоресценции проследить за процессом пересольватации молекулы в бинарных растворителях невозможно: можем указать только смещение полосы флуоресценции, изменение ее полуширины и интенсивности в максимуме. Для лучшего выявления характерных особенностей экспериментальных спектров флуоресценции использовался метод производной спектрофотометрии. Два минимума в спектре второй производной на рис. 7 указывают на процесс пересольватации молекулы лаурдана (уменьшая число молекул с сольватной оболочкой из циклогексана и увеличивая число молекул в окружении изопропанола).
Рис. 7.
Смещение полосы флуоресценции лаурдана от объемного процента полярной компоненты бинарной смеси растворителей.

При 2% изопропанола в смеси наблюдается два минимума. При 4% концентрации изопропанола в спектре второй производной наблюдается перегиб в коротковолновой области и минимум в длинноволновой (рис. 6). При добавлении в раствор 40% изопропанола наблюдаем один минимум в спектре второй производной.
Процесс пересольватации наблюдается и при изучении зависимости смещения полосы флуоресценции в бинарных смесях при увеличении добавки полярной компоненты. Наиболее значительное смещение наблюдается до 20% полярной компоненты (рис. 7).
Таким образом, вклад неспецифических взаимодействий в смещение полосы флуоресценции 2830 см–1, специфических (водородная связь) 1870 см–1 (этанол). Сольватофлуорохромию лаурдана необходимо рассматривать с учетом диэлектрической проницаемости, параметров кислотности и основности растворителей. Межмолекулярные взаимодействия молекулы лаурдан средой меняют соотношение мономолекулярных процессов. В случае бинарных растворителей (неполярный+полярный) возрастает роль излучательных переходов. На безызлучательные каналы дезактивации флуоресцентного состояния лаурдана образование Н-связи более существенно, чем комплексообразование лаурдана, обусловленное параметром основности растворителя. Возможно при выяснении причин разгорания флуоресценции лаурдана в дальнейшем следует учесть и влияние фактора жесткости молекулы на безызлучательные процессы дезактивации.
Работа выполнена на кафедре оптики и спектроскопии физического факультета.
В статье использованы результаты, полученные в ходе выполнения проекта (№ НУ 8.1.20.2018 Л), в рамках программы повышения конкурентоспособности ТГУ.
Список литературы
Brozis M., Kozyra K.A., Tomin V.I., Heldt J. // J. Appl. Spectroscopy. 2002. V. 69. № 3. P. 480.
Брозис М., Томин В.И., Хелд Ю. // Журн. прикл. спектроскопии. 2002. Т. 69. № 5. С. 589–591.
Kawski A., Kuklinski B., Bojarski P., Diehl H. // Z. Naturforsch. 2000. V. 55a. P. 817.
Titova T.Yu., Artyukhov V.Ya., Zharkova O.M., Morozova Ju.P. // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2014. V. 124. P. 64.
Жаркова O.M., Титова Т.Ю., Морозова Ю.П. и др. // Изв. высш. учебных заведений. Физика. 2013. Т. 56. № 5. С. 75.
Морозова Ю.П., Жаркова О.М., Королёв Б.В. Спектрально-люминесцентные свойства многоатомных молекул и межмолекулярные взаимодействия. Учебное пособие Томск: ТГУ, 2006. 136 с.
Шмидт В. Оптическая спектроскопия для химиков и биологов / В. Шмидт. М.: Техносфера, 2007. 368 с.
Титова Т.Ю., Морозова Ю.П., Жаркова О.М. Спектрально-люминесцентные свойства флуоресцентных зондов лаурдан и продан. Томск: Издательский Дом Томского государственного университета, 2017. 125 с.
Титова Т.Ю., Морозова Ю.П., Королев Б.В. // Изв. вузов. Физика. 2016. Т. 59. № 5. С. 61.
Rosenthal J., Young E.R., Nocera D.G. // Inorganic Chemistry. 2007. V. 46. № 21. P. 8668.
Schmidt M.W., Baldridge K.K., Boatz J.A. et al. // J. Computational Chem. 1993. V. 14. P. 1347.
URL: http://skif.tsu.ru
Lakowicz J.R. Principles of fluorescence spectroscopy. New York: Kluwer Academic, 1999. 698 p.
Catalan J. // J. Phys. Chem. B. 2009. № 113. P. 5951.
Jozefowicz M., Kozyra K.A., Heldt J.R., Heldt J. // Chem. Phys. 2005. V. 320. P. 45.
Balter A., Nowak W., Pawelkiewicz W., Kowalczyk A. // Chem. Phys. Lett. 1988. V. 143. P. 565.
Павлович В.С. // ЖПС. 2004. Т. 71. № 3. С. 331.
Morimoto A., Yatsuhashi T., Shimada T. et al. //J. Phys. Chem. A. 2001. V. 105. № 45. P. 10488.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии