Журнал физической химии, 2019, T. 93, № 7, стр. 1002-1008
Влияние температуры на кинетику сорбции катионов стронция сорбентом на основе фосфата титана
М. В. Маслова a, *, В. И. Иваненко a, Л. Г. Герасимова a
a Российская академия наук, Кольский научный центр, Институт химии и технологии редких элементов
и минерального сырья им. И.В. Тананаева
Мурманская обл., Апатиты, Россия
* E-mail: maslova@chemy.kolasc.net.ru
Поступила в редакцию 02.08.2018
После доработки 02.08.2018
Принята к публикации 11.11.2018
Аннотация
Исследованы закономерности кинетики сорбции ионов стронция из модельных растворов на неорганическом сорбенте на основе фосфата титана. Получены экспериментальные зависимости для описания кинетики ионного обмена, которые отражают три разновидности механизмов обмена: обмен на их поверхности, диффузия ионов в объем сорбента и гетерогенная ионообменная реакция с образованием новой фазы. Определены значения коэффициентов внутренней диффузии, константы скорости ионного обмена и кажущиеся энергии активации для внешней и внутренней диффузии.
Среди солей поливалентных металлов в качестве неорганических ионитов наиболее широко изучены фосфаты титана, которые представлены широким классом соединений различного состава и строения. Интерес к этим материалам обусловлен их высокой обменной емкостью, химической и радиационной устойчивостью. В зависимости от условий синтеза можно получать аморфные или кристаллические продукты с различным отношением Р : Ti. Аморфные фосфаты титана имеют развитую удельную поверхность и неупорядоченную структуру, большое число сорбционных центров, расположенных на значительном расстоянии. Образующаяся система пор и каналов позволяет без значительных стерических затруднений включать в ионообменные процессы катионы больших размеров.
Кристаллические материалы, полученные обработкой аморфных продуктов концентрированной фосфорной кислотой, имеют слоевую структуру с различным межплоскостным расстоянием, что определяет их селективные свойства. Так, эффективно удаляя катионы калия, натрия и лития из водных сред, они с трудом обменивают катионы цезия и цветных металлов [1].
В Институте химии КНЦ РАН разработан метод синтеза фосфата титана, основанный на гетерогенном замещении сульфатных групп на фосфатные при взаимодействии кристаллического титансодержащего прекурсора, сульфата титанила и аммония – (NH4)2TiO(SO4)2 · H2O, с разбавленной фосфорной кислотой. Использование кристаллического прекурсора позволяет значительно сократить многостадийность синтеза по сравнению с известными способами, использовать разбавленную фосфорную кислоту при стехиометрическом ее расходе. Варьируя условия синтеза можно задавать фазовый состав и уровень кристалличности конечного продукта. На примере сорбции микроколичеств радионуклидов 137Cs и 90Sr показано, что полученные материалы обладают высокими сорбционными свойствами, коэффициенты распределения составляют 103 по цезию и 104 по стронцию в присутствии макроколичеств натрия и кальция.
Простота синтеза фосфата титана, доступность и невысокая стоимость титановой соли, которая является полупродуктом переработки практически любого титансодержащего сырья, высокие сорбционные свойства предопределяют перспективность его использования в качестве коллектора 137Cs и 90Sr при очистке жидких радиоактивных отходов.
При реализации ионообменных процессов на практике необходимо учитывать кинетические свойства сорбента, определяющие возможность селективного поглощения сорбтива за время контакта с сорбентом. Для выбора оптимальных условий эксплуатации сорбентов необходимо знание стадии, лимитирующей массоперенос извлекаемых компонентов.
Целью настоящей работы явилось определение кинетических характеристик процесса сорбции стронция из растворов на фосфате титана, установление механизма кинетики сорбции, расчет коэффициентов диффузии обменивающихся ионов, констант скорости и энергии активации суммарного процесса.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез фосфата титана
Для получения сорбента заданное количество титановой соли (NH4)2TiO(SO4)2 · H2O порционно загружали в нагретую до 60°С 30% фосфорную кислоту при мольном отношении TiO2 : P2O5 = = 1 : 1.5 и выдерживали при перемешивании в течение 4 ч. Полученную суспензию фильтровали, осадок промывали раствором 0.1 н. HCl и водой, сушили при 60°С. Для перевода сорбента в солевую форму, навеску обрабатывали 0.1 М раствором Na2CO3. На основании данных химического, термического и рентгенофазового анализов исходный образец сорбента может быть представлен, как аморфное соединение состава (мас. %): TiO2 – 29.60, P2O5 – 39.40, Na2O – 5.69, H2O – 26.78, в котором протон гидрофосфатной группы замещен на катион натрия.
Методы анализа
Элементный состав фосфата титана определяли с использованием плазменного атомно-эмиссионного спектрометра ICPE-9000 фирмы Shimadzu после разложения осадка смесью кислот HF–HNO3–HCl. Результаты химического анализа хорошо коррелируют с результатами РФА, полученными на дифрактометре Siemens D 5000 с монохромным CuKα-излучением (λ = 1.5418 Å) после термической обработки исходного аморфного образца при 850°С, и с результатами термографических (ДТА и ТГА) исследований на синхронном термическом анализаторе NETZSCH STA 409 PC/PG Luxx. Удельную поверхность образцов определяли методом низкотемпературной адсорбции азота с использованием анализатора поверхности Micrometrics ASAP 2000. Распределение пор по размерам рассчитывали по BJH-методу.
Концентрацию стронция в фильтрате после сорбционных экспериментов определяли методом атомно-адсорбционной спектрометрии на спектрометре AAS 300 Perkin-Elmer.
Для определения среднего размера частиц сорбента проводили ситовой анализ, для работы использовали фракцию сорбента с размером частиц 0.1 мм.
Эксперименты по сорбции
Кинетику сорбции стронция изучали при температуре 25, 45 и 65°С методом ограниченного объема из водных растворов солей хлорида стронция. Концентрация стронция в растворе составляла 10 и 1 ммоль л–1, объем раствора, контактирующего с сорбентом – 200 мл, навеска сорбента – 1 г. Сорбцию проводили при рН 7.5, исходные растворы термостатировали при заданной температуре с точностью ± 1° в течение 1 ч, затем вводили сорбент. Процесс сорбции вели при интенсивном перемешивании со скоростью вращения мешалки 300 об мин-1. Методом отдельных навесок через определенные интервалы времени устанавливали характер изменения концентрации раствора, находящегося в контакте с ионитом до установления равновесия. Концентрацию сорбата во всех точках объема раствора и непосредственно у поверхности сорбента при данных скоростях считали постоянной, т.е. рассматривали диффузию из хорошо перемешиваемого раствора.
Сорбционную емкость сорбента (ммоль г–1) рассчитывали по формуле:
где Сисх и Сравн – исходная и равновесная концентрации металла в растворе, ммоль л–1, V – объем раствора, мл, m – навеска сорбента, г.Степень достижения равновесия в системе (F) рассчитывали как F = Сt/Сe, где Сt – количество сорбированного вещества в момент времени t, ммоль г–1; Сe – количество сорбированного вещества в состоянии равновесия, ммоль г–1.
Для моделирования кинетики сорбции катионов стронция на фосфате титана использовали диффузионные модели Морриса–Вебера и Бойда, модели псевдопервого порядка Лагергрена, псевдовторого порядка Хо и Маккея, модель Еловича.
Диффузионное уравнение Бойда целесообразно использовать для описания случаев внутридиффузионного лимитирования кинетики сорбции и расчета эффективных коэффициентов диффузии [2]:
(2)
$F = 1 - \frac{6}{{{{\pi }^{2}}}}\sum\limits_{n = 1}^\infty {(1{\text{/}}{{n}^{2}})} \exp ( - Dt{{\pi }^{2}}{{n}^{2}}{\text{/}}{{r}^{2}}),$Расчет эффективных коэффициентов диффузии с использованием табличных значений Bt = = f(F) [3], проводили по формуле:
Уравнение модели Морриса–Вебера [4], описывающее внутрипористую диффузию, имеет следующий вид:
где kid – константа скорости диффузии, мг г–1 мин–1/2; С – параметр, связанный с толщиной пограничного слоя, мг г–1.Для выявления вклада химического взаимодействия в общую скорость процесса использовали кинетические модели псевдопервого, псевдо-второго порядка и модель Еловича. Кинетическое уравнение псевдопервого порядка Лагергрена можно представить в виде:
или в линейной форме: где qe и qt – количество металла, сорбированное при равновесии и за определенный промежуток времени t, мг г–1, k1 – константа скорости, мин–1. Линеаризация уравнения в координатах lg(qe – qt) – ‒ t позволяет определить константу скорости адсорбции и количество металла, сорбируемое при равновесии. Это уравнение описывает случаи пленочной диффузии, контролирующей скорость адсорбции в течение нескольких первых минут в экспериментах с перемешиванием [5].Уравнение псевдовторого порядка Хо и Маккея [6] широко используется для описания кинетических закономерностей адсорбции. В интегральной форме оно может быть представлено следующим образом [7]:
где k2 – константа скорости, г мг–1 мин–1. Решение уравнения в координатах $tq_{t}^{{ - 1}}$ – t позволяет найти значения k2 и qe.Экспоненциальная модель Еловича описывает случаи гетерогенной хемосорбции на твердых поверхностях [8]. Уравнение Еловича, упрощенное Ченом и Клейтоном [9], имеет следующий вид:
где α – начальная скорость сорбционного процесса, мг г–1 мин–1, β – константа десорбции, г мг–1. Линеаризация уравнения в координатах qt – ln t позволяет определить α и β. Пригодность использования кинетических моделей определяли методом линеаризации данных в координатах их интегральных уравнений и статистического анализа с определением коэффициентов детерминации.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Количественное определение элементного состава в синтезированном аморфном фосфате титана указывает на высокое содержание функциональных фосфатных групп. Мольное соотношение оксидов в конечном продукте соответствует TiO2 : P2O5 = 1 : 1.5. Удельная поверхность образца 127.9 м2 г–1, общий объем пор 0.256 см3 г–1, средний диаметр пор 7.2 нм. Следует отметить, что на BHJ-кривой как адсорбции, так и десорбции (рис. 1) наблюдаются два максимума в области узких (4 нм) и широких (50 нм) мезопор. Неоднородность поровой системы предполагает диффузионные затруднения при обмене ионов.
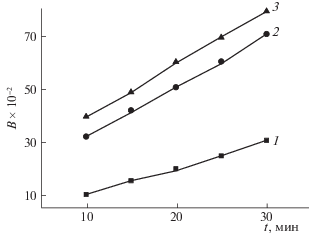
Кинетические кривые процесса сорбции катиона стронция при разной температуре представлены на рис. 2. Для первичного разграничения внутри- и внешнедиффузионного лимитирования адсорбции в рамках диффузионных моделей Бойда и Морриса–Вебера проведен анализ кинетических данных в координатах – ln(1 – F) – t и F – t1/2 соответственно. Линеаризация данных в координатах –ln(1 – F) – t (рис. 3) может указывать на внешнедиффузионный механизм адсорбции. Однако, в целом, для всех исследуемых температур наблюдается нелинейная зависимость изменения адсорбции от времени. Зависимости F – t1/2 в координатах уравнения Морриса–Вебера для сорбции стронция также не являются линейными (R2 = 0.966–0.979), что свидетельствует о смешанно-диффузионном механизме кинетики адсорбции, когда процесс не может однозначно лимитироваться внешней или внутренней диффузией. Ход интегральных кинетических кривых свидетельствует о нескольких периодах сорбции. Наиболее интенсивно сорбция протекает в начальный момент времени, далее скорость сорбции замедляется. Влияние температуры на извлечение стронция свидетельствует о наличии затруднений, которые связаны с лимитированием диффузии катиона Sr2+ в порах сорбента. Кинетические кривые сорбции представляют собой зависимости, которые при малых временах контакта фаз являются прямыми, а затем искривляются. Согласно литературным данным [10], это свидетельствует о том, что и диффузия ионов через пленку раствора, и диффузия в зерне сорбента вносят свой вклад в общую скорость процесса.
Рис. 2.
Кинетика сорбции стронция от температуры. Исходная концентрация стронция –10–2 моль л–1. Температура раствора, °С: 1 – 25, 2 – 45, 3 – 65.
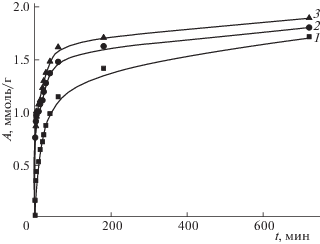
Рис. 3.
Кинетика сорбции стронция в зависимости от температуры. Исходная концентрация стронция 10–2 моль л–1. Температура раствора, °С: 1 – 25, 2 – 45, 3 – 65.
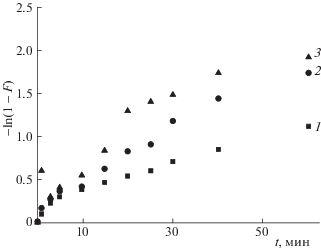
Полученные экспериментальные данные обрабатывали с использованием уравнений, учитывающих влияние внешней (пленочной), внутренней (гелевой) диффузии. Поскольку сорбция на неорганических ионитах является сложным и многостадийным процессом, обычно выявляют лимитирующую стадию, которая определяет общую скорость процесса. Было установлено, что в процессе ионного обмена при концентрации 10 ммоль л–1 стронция в исходном растворе в интервале времени от 0 до 60 мин действуют два механизма: внешне- и внутридиффузионный. При внешнедиффузионном механизме процесс выравнивания концентрации в приповерхностном слое жидкости (диффузионном слое) осуществляется намного быстрее, чем диффузия в твердой фазе, поэтому градиенты концентрации появляются только в зерне. Построение экспериментальных данных в координатах –ln(1–F) от t [11] может быть адекватно описано линейными зависимостями при малых временах контакта фаз, однако наблюдается отклонение от линейности при степени завершенности процесса F > 0.5 для всех выбранных температур. В небольшом временном интервале до 5 минут диффузия в пленке вносит вклад в общую скорость при малых степенях завершенности процесса (рис. 4).
Рис. 4.
Зависимости –ln(1–F) от t для катионов стронция при исходной концентрации стронция в растворе 10 ммоль л–1. Температура раствора, °С: 1 – 25, 2 – 45, 3 – 65.
Для пленочной диффузии:
где D – коэффициент диффузии вещества через пленку толщиной δ, покрывающую зерно сорбента, r – радиус частицы сорбента, t – время контакта, с и m – концентрация сорбтива в растворе и сорбенте соответственно.Тангенс угла наклона прямой к оси абсцисс, определяет кажущуюся константу скорости внешней диффузии γ, мин–1:
Полученные зависимости были обработаны с использованием уравнения первого порядка, что позволило вычислить скорость реакции обмена во внешнедиффузионной области (табл. 1).
Таблица 1.
Кинетические параметры ионного обмена Sr → Na на фосфате титана в зависимости от температуры при концентрации стронция в исходном растворе 10 ммоль л–1
| Внешнедиффузионная область | Внутридиффузионная область | |||||||
|---|---|---|---|---|---|---|---|---|
| Т, °С | γ × 10–2, мин–1 | R2 | Ea, кДж моль–1 | D × 10–11, м2 с–1 | B, мин–1 | R2 | Ea, кДж моль–1 | t1/2, мин |
| 25 | 1.19 | 0.994 | 14.99 | 1.04 | 0.154 | 0.995 | 39.50 | 29 |
| 45 | 2.25 | 0.996 | 4.73 | 1.26 | 0.993 | 10 | ||
| 65 | 2.78 | 0.997 | 5.49 | 1.88 | 0.997 | 5.5 | ||
Анализ кинетических кривых показывает, что по внешнедиффузионному механизму в зависимости от температуры реализуется от 25 до 55% обменной емкости. Также были обработаны кинетические зависимости сорбции при концентрации стронция в растворе 1 ммоль л–1. Отмечено, что скорость внешнедиффузионного механизма возрастает с увеличением концентрации противоиона в растворе. Полученные результаты свидетельствуют о том, что в разбавленных растворах лимитирующей стадией является диффузия в пленке раствора. Значение γ × 10–2 при 25, 45 и 65°C составляет: 1.81, 2.38 и 2.94 мин–1 соответственно, а R2 = 0.994–0.997.
Зависимость константы скорости от температуры описывается уравнением Аррениуса [12]:
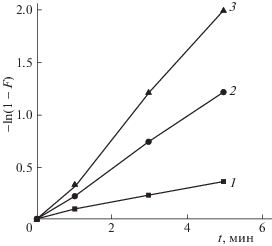
и в логарифмической форме где Eакт – энергия активации, R – универсальная газовая постоянная, Т – абсолютная температура, А – аррениусовский предэкспоненциальный множитель (постоянная). Отсюда, энергия активации Eакт = –2.3tg α, где tg α – тангенс угла наклона прямой lg k – 1/T. Энергия активации ионообменной сорбции на данном этапе из растворов с концентрацией стронция 10 и 1 ммоль л–1 равна 14.99 ± 1.89 и 11.31 ± 1.27 кДж моль–1, а коэффициент детерминации составляет 0.987 и 0.996 соответственно.Скорость сорбционного процесса может быть ограничена как стадией адсорбции, так и диффузией сорбтива. При этом транспортные процессы (продвижение молекул сорбтива из раствора к активным центрам сорбента) играют большую роль в сорбционной системе. При описании кинетики сорбции с учетом внутридиффузионного механизма использовали модели гелиевой диффузии из ограниченного объема в тело, имеющее форму шара. Определив экспериментально степени достижения равновесия F для данного времени t, и, пользуясь справочной величиной Bt [3] были построены зависимости Bt = f(t). Графики (рис. 5) представляют собой прямую линию, что подтверждает гелевую диффузию ионного обмена на фосфате титана. По тангенсу угла наклона В рассчитали скорость реакции ионного обмена (табл. 1). Полученные результаты свидетельствуют, что процесс сорбции стронция на фосфате титана реализуется по двум механизмам: внешнедиффузионному и внутридиффузионному. Рассчитанные эффективные коэффициенты диффузии представляют собой кинетические коэффициенты, учитывающие диффузионные особенности транспорта молекул в сорбционной системе. Очевидно, что с повышением температуры диффузия в зерне увеличивается (табл. 1). Коэффициент диффузии стронция в воде при 25°C рассчитывали по формуле [13]:
где R – универсальная газовая постоянная, Т – температура, К, λ – предельная электропроводность катиона в растворе, F – число Фарадея, z – заряд катиона.Учитывая, что коэффициент самодиффузии стронция равен 7.89 × 10–10 м2 с–1, найденные приближенные значения D не более 5.49 × 10–11 м2 с–1 скорее всего характеризуют диффузию стронция в поровой жидкости внутри частицы сорбента. С использованием эффективных коэффициентов диффузии стронция в ионите рассчитаны кажущиеся энергии активации процесса сорбции по уравнению, подобному уравнению Аррениуса [14]:
где Еакт – кажущаяся энергия активации, кДж моль–1; Do – константа, м2 с–1, R – универсальная газовая постоянная 8.3144 Дж моль–1, Т–температура, К.По тангенсу угла наклона прямой построенной в координатах D от 1/Т рассчитали энергию активации, которая составила 39.5 ± 2.17 кДж моль–1, коэффициент детерминации 0.988.
Значения времени полуобмена, рассчитанные по формуле t1/2 = 0.03r2/D сведены в табл. 1. С повышением температуры время полуобмена значительно уменьшается. На скорость диффузии ионов металлов в фазе сорбента оказывают влияние такие факторы, как радиус гидратированного иона, его заряд и подвижность. По величине удельной поверхности и предельной сорбции катиона стронция оценивали посадочную площадку (S) и радиус (R) сорбированного катиона:
где Sуд – удельная поверхность сорбента, м2 г–1, Г – максимальная сорбционная емкость по катиону стронция, ммоль г–1, Na – число Авогадро, моль–1Для расчета радиуса катиона стронция в фазе сорбента рассчитана посадочная площадка катиона, исходя из данных удельной поверхности сорбента 127.9 м2 г–1 и предельного значения сорбционной способности фосфата титана по данному катиону – 1.89 ммоль г–1. В предположении, что предельно сорбированное количество стронция соответствует мономолекулярному слою, посадочная площадка катиона стронция составляет 1.06 × 10–19 м2 моль–1 и радиус сорбированного катиона составляет 128 × 10–12 м. Полученное значение радиуса больше, чем значение 113 × 10–12 м кристаллохимического радиуса катиона по Бокию и меньше, чем радиус гидратированного катиона по Стоксу (309 × 10–12 м), вычисленного по формуле [15]:
где z – заряд катиона металла, F – постоянная Фарадея, Na – число Авогадро, η –вязкость воды, λ° – предельная эквивалентная электропроводность катиона металла. Степень дегидратации сорбированных катионов можно охарактеризовать количественно следующей формулой:(17)
$\alpha = ({{r}_{{{\text{aq}}}}} - {{r}_{{\text{s}}}}){\text{/}}({{r}_{{{\text{aq}}}}} - {{r}_{{{\text{cr}}}}}),$Уравнение псевдопервого порядка адекватно описывает закономерности адсорбции на начальных этапах адсорбционного процесса, когда значительное влияние на процесс оказывает явление пленочной диффузии. По всей видимости, увеличение концентрации стронция у поверхности сорбента в начальные моменты процесса (F ≤ 0.5) при невысоких степенях заполнения адсорбционного пространства промотирует диффузию молекул адсорбата внутрь пор адсорбента под влиянием градиента концентрации.
Уравнение псевдовторого порядка позволяет учитывать не только взаимодействия сорбат–сорбент, но и межмолекулярные взаимодействия адсорбируемых веществ. Модель Еловича учитывает вклад в кинетику извлечения вещества как процессов сорбции, так и явление десорбции, приобретающей значительное влияние при приближении к равновесному состоянию. Поскольку синтезированный фосфат титана обладает неоднородной пористой структурой, указанная модель может адекватно оценивать процесс адсорбции на гетерогенной поверхности сорбента. Для модели Еловича линейной зависимости удается добиться только на начальных участках кривых (при малых степенях завершенности процесса). Это может быть объяснено высокой скоростью кинетики сорбционного процесса. Значения констант и величин достоверности аппроксимации кинетических моделей адсорбции стронция представлены в табл. 2. Рассчитанные значения коэффициентов детерминации достаточно высоки (R2 > 0.97), что говорит о применимости всех использованных кинетических моделей для прогноза кинетики адсорбции стронция на фосфате титана.
Таблица 2.
Кинетические параметры сорбции Sr2+ на фосфате титана при концентрации внешнего раствора 10–2 моль л–1
| Модель | Параметры | 298 К | 318 К | 338 К |
|---|---|---|---|---|
| Псевдо-первого порядка | k1 × 10–3, мин–1 | 6.81 | 7.57 | 8.29 |
| qe, мг г–1 | 120.6 | 82.5 | 80.0 | |
| R | 0.991 | 0.998 | 0.997 | |
| Псевдо-второго порядка | k2, г мг–1 мин–1 | 0.187 | 0.147 | 0.140 |
| qe, мгг–1 | 81.6 | 136.8 | 148.3 | |
| R | 0.999 | 0.998 | 0.997 | |
| Еловича | α, мг г–1 мин–1 | 0.9 | 4.7 | 5.2 |
| β × 10–2, гмг–1 | 4.96 | 6.4 | 7.1 | |
| R2 | 0.989 | 0.976 | 0.979 |
Уравнение модели псевдопервого порядка идентично уравнению для пленочной диффузии. Однако в случае диффузии в пленке скорость процесса зависит от размера частиц сорбента и толщины пленки. Если же лимитирующей является стадия химической реакции, то скорость сорбции не зависит от выше перечисленных факторов, а зависит только от концентрации ионов и температуры. Таким образом, когда кинетика процесса описывается моделью псевдопервого порядка, сорбции предшествует диффузия. Как и модель псевдопервого порядка, модель псевдо-второго порядка предполагает, что химическая реакция обмена лимитирует процесс сорбции. В этом случае предполагается, что реакция между сорбатом и функциональной группой сорбента является реакцией второго порядка и они взаимодействуют между собой в соотношении 1 : 1. Таким образом, стадия химического взаимодействия ионов стронция также вносит вклад в общую скорость процесса. Разделить же вклад диффузии и химической стадии на основании применения формальных кинетических уравнений достаточно сложно.
Таким образом, механизм сорбции стронция на фосфате титана имеет сложный характер. Синтезированный продукт обладает высокой сорбционной емкостью по отношению к катионам стронция. Благодаря мезопористой структуре обеспечивается высокая скорость массопереноса. Равновесие в системе раствор–сорбент в зависимости от концентрации внешнего раствора устанавливается от нескольких минут до 6 часов, в то время как при использовании классических сорбентов равновесие может устанавливаться от нескольких десятков часов до нескольких дней. Значения эффективных коэффициентов диффузии достаточно высоки (1–5.5 × 10–11 м2 с–1). В скорость сорбционного процесса вносят вклад как диффузионное лимитирование (внутри- и внешнедиффузионное), так и скорость химической стадии адсорбции, что показано применением моделей псевдопервого и псевдовторого порядка.
Исследования выполнены при финансовой поддержке Российского научного фонда (РНФ) в рамках научного проекта № 17-19-01522.
Список литературы
Lavona R., Suarez M., Garsia J.R. // J. Inorg. Chem. 1989. V.28. P. 2863.
Неудачина Л.К., Петрова Ю.С., Засухин А.С. и др. // Аналитика и контроль. 2011. Т. 15. № 1. С. 88.
Полянский Н.Г., Горбунов Г.В., Полянская Н.Л. Методы исследования ионитов. М.: Химия, 1976. 208 с.
Piplai T., Kumar A., Alappat B.J. // Water Enviroment Res. 2018. V. 90. № 5. P. 409.
Ho Y.S., Ng J.C.Y., McKay G. // Separation and purification methods. 2000. № 2 (29). P. 189.
Douven S., Paez C.A., Gommes C.J. // J. Colloid Interface Sci. 2015. V. 448. № 1. P. 437.
Zhou L., Wang Y., Liu Zetal // J. Hazard. Mater. 2009. V. 161. P. 995.
Javadian H. // J. Industr. Eng.Chem. 2014. № 6 (20). P. 4233.
Kołodyńska D., Gęca M., Skwarek E. et al. // Nanoscale Res. Let. 2018. V. 13. P. 1.
Blachnio M., Budnyak T., Derylo-Marczewska A. et al. // Langmuir. 2018. V. 34. № 6. P. 2258.
Тимофеев К.Л., Усольцев А.В., Краюхин С.А. и др. // Сорбционные и хроматографические процессы. 2015. Т. 15. Вып. 5. С. 720.
Кемпбел Дж. Современная общая химия. М.: Мир, 1975. Т. 2. 450 с.
Элькинд К.М., Трунова И.Г. // Труды Нижегородского государственного технического университета им. Р.Е. Алексеева. 2013. № 4(97). С. 272.
Кокотов Ю.А., Пасечник В.А. Равновесие и кинетика ионного обмена. Л.: Химия, 1979. 336 с.
Чиркст Д.Э., Черемисина О.В., Иванов М.В. и др. // ЖПХ. 2006. Т. 79. № 3. С. 374.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии