Журнал физической химии, 2019, T. 93, № 7, стр. 981-985
Термодинамика процессов смешаннолигандного комплексообразования меди(II) с триглицином и L-гистидином
Г. Г. Горболетова a, *, С.А. Бычкова a, К. О. Фролова a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: gorboletova@mail.ru
Поступила в редакцию 06.11.2018
После доработки 25.12.2018
Принята к публикации 25.12.2018
Аннотация
Потенциометрическим и калориметрическим методами изучена система Cu2+–триглицин–L-гистидин в водном растворе при Т = 298.15 K (KNO3). Установлено образование смешаннолигандных комплексов CuLY и CuLHY+, определены стандартные термодинамические характеристики (ΔrH°, ΔrG°, ΔrS°) реакций их образования. Приведены вероятные структуры смешаннолигандных комплексов.
Система Cu2+–триглицин–L-гистидин представляет интерес как с точки зрения большой вероятности ее существования в живых организмах, так и в связи с присущими ее компонентам биохимическими и фармакологическими особенностями [1–3]. Сведения о структуре комплексов триглицина и L-гистидина с ионами меди(II) в растворе получены с помощью различных методов: ЭПР, ЯМР, электронная и колебательная спектроскопия, круговой дихроизм и т.д. [4–6]. Роль калориметрии в понимании процессов, протекающих в растворах биологически важных лигандов также существенна. Однако в литературе, как правило, отсутствуют термохимические данные о реакциях образования смешаннолигандных комплексов аминокислот и пептидов с ионами переходных металлов. Ранее были получены термодинамические характеристики процессов комплексообразования в системе Cu2+–глицин–L-гистидин [7]. В настоящей работе проведено потенциометрическое и калориметрическое изучение процессов комплексообразования Cu2+ с триглицином (L–) и L-гистидином (Y–).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали кристаллический препарат глицил-глицил-глицина фирмы “Sigma” без дополнительной очистки, высушенный перед взятием навесок до постоянной массы при 343 K. Бескарбонатный раствор гидроксида калия готовили из реактива марки “х. ч.”. Для поддержания заданного значения ионной силы (I = 0.2, 0.5, 1.0) применяли перекристаллизованный нитрат калия. Водный раствор Cu(NO3)2 готовили из соли марки “х. ч.”, концентрацию определяли комплексонометрически и иодометрически.
Состав и устойчивость смешаннолигандных комплексов CuLY и CuLHY+ определяли из потенциометрических измерений. Суммарная концентрация лигандов изменялась от 1.6 × 10–2 до 4.0 × 10–2 моль/л. Исследования проводили при соотношениях Cu : (L + Y) = 1 : 2; 1 : 5 (I = 0.2). Концентрации триглицина и L-гистидина находились в соотношении 70 : 30 и 75 : 25.
Потенциометрическое титрование проходило по стандартной методике. Измерения ЭДС цепи:
Градуировку стеклянного электрода проводили по стандартным растворам соляной кислоты при I = 0.2 (KNO3). Полученная при обработке этих данных по методу наименьших квадратов величина tgα cоставляла 0.05803 В/ед рН. Для каждого соотношения Cu : (L + Y) проводили по три–четыре параллельных опыта.
Измерения тепловых эффектов смешения (ΔmixH) и разведения (ΔdilH) проводили в ампульном калориметре с изотермической оболочкой и термисторным датчиком температуры [8]. Надежность работы калориметра проверяли по теплоте растворения KCl в воде при 298.15 K. Необходимое значение рН растворов триглицина и L-гистидина создавали добавлением рассчитанного количества гидроксида калия. Величины рН контролировали с помощью прибора “Мультитест” ИПЛ-311. Опыты проводили при 298.15 K и значениях ионной силы 0.2; 0.5; 1.0. Для расчета доверительного интервала среднего значения ΔН из трех параллельных опытов критерий Стьюдента был взят при доверительной вероятности 0.95.
Энтальпии образования частиц CuLY и CuLHY+ определяли в интервале pH 8.8–6.7 и 6.9–4.3 при соотношении концентраций $c_{{{\text{Cu}}}}^{0}$ : $c_{{\text{L}}}^{0}$ : $c_{{\text{Y}}}^{0}$ = = 1 : 2 : 1 и $c_{{{\text{Cu}}}}^{0}$ : $c_{{\text{L}}}^{0}$ : $c_{{\text{Y}}}^{0}$ = 1 : 7 : 1 соответственно. В качестве калориметрической жидкости объемом 39.86 мл выступали растворы L-гистидина с концентрацией 0.01 моль/л и триглицина 0.02 и 0.07 моль/л. Концентрация раствора Cu(NO3)2 в калориметрической ячейке после разрушения ампулы составляла ∼0.01 моль/л. Были измерены также теплоты разведения растворов Cu(NO3)2 в растворах фонового электролита. Экспериментальные данные приведены в табл. 1, 2.
Таблица 1.
Тепловые эффекты (кДж/моль) взаимодействия раствора Cu(NO3)2 (1.0498 моль/кг раствора) с растворами триглицина (0.02040 моль/л) и L-гистидина (0.01020 моль/л); I – ионная сила, m – навеска
| ${{m}_{{{\text{Cu(N}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}}}}}$, г | –∆mixH1, кДж/моль | –∆rH1 = ∆mixH1 – – ∆dilH, кДж/моль |
|---|---|---|
| $c_{{{\text{Cu}}}}^{0}$ : $c_{{\text{L}}}^{0}$ : $c_{{\text{Y}}}^{0}$ = 1 : 2 : 1; ∆рН 8.8–6.7 ${{I}_{{{\text{KN}}{{{\text{O}}}_{3}}}}}$ = 0.2, ∆dilH = –1.04 ± 0.10 кДж/моль |
||
| 0.39025 | 75.74 | 74.70 |
| 0.39045 | 75.70 | 74.66 |
| 0.39010 | 75.90 | 74.86 |
| (75.78 ± 0.19) | (74.74 ± 0.21) | |
| ${{I}_{{{\text{KN}}{{{\text{O}}}_{3}}}}}$ = 0.5, ∆dilH = –2.60 ± 0.14 кДж/моль | ||
| 0.39035 | 77.88 | 75.28 |
| 0.39000 | 77.90 | 75.30 |
| 0.39005 | 77.63 | 75.03 |
| (77.80 ± 0.28) | (75.20 ± 0.31) | |
| ${{I}_{{{\text{KN}}{{{\text{O}}}_{3}}}}}$ = 1.0, ∆dilH = –4.19 ± 0.10 кДж/моль | ||
| 0.39030 | 79.77 | 75.58 |
| 0.39010 | 79.80 | 75.61 |
| 0.39035 | 80.05 | 75.86 |
| (79.87 ± 0.28) | (75.68 ± 0.30) | |
Таблица 2.
Тепловые эффекты (кДж/моль) взаимодействия раствора Сu(NO3)2 (1.0498 моль/кг раствора) с растворами триглицина (0.07140 моль/л) и L-гистидина (0.01020 моль/л)
| ${{m}_{{{\text{Cu(N}}{{{\text{O}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{2}}}}}}}$, г | –∆mixH2, кДж/моль | –∆rH2 = ∆mixH2 – – ∆dilH, кДж/моль |
|---|---|---|
| $c_{{{\text{Cu}}}}^{0}$ : $c_{{\text{L}}}^{0}$ : $c_{{\text{Y}}}^{0}$ = 1:7:1; ∆рН 6.9–4.3 ${{I}_{{{\text{KN}}{{{\text{O}}}_{3}}}}}$ = 0.2 |
||
| 0.39040 | 28.39 | 27.35 |
| 0.39035 | 28.36 | 27.32 |
| 0.39030 | 28.51 | 27.47 |
| (28.42 ± 0.15) | (27.38 ± 0.18) | |
| ${{I}_{{{\text{KN}}{{{\text{O}}}_{3}}}}}$ = 0.5 | ||
| 0.39000 | 31.08 | 28.48 |
| 0.39015 | 31.10 | 28.50 |
| 0.39020 | 31.22 | 28.62 |
| (31.13 ± 0.14) | (28.53 ± 0.20) | |
| ${{I}_{{{\text{KN}}{{{\text{O}}}_{3}}}}}$ = 1.0 | ||
| 0.39040 | 34.35 | 30.16 |
| 0.39035 | 34.18 | 29.99 |
| 0.39025 | 34.21 | 30.02 |
| (34.25 ± 0.17) | (30.06 ± 0.20) | |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В исследуемой системе Сu(II)–триглицин–L-гистидин возможно протекание следующих реакций:
(2)
${{{\text{L}}}^{--}} + 2{{{\text{H}}}^{ + }} \leftrightarrow {{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ + }},$(3)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}} \leftrightarrow {\text{Cu}}{{{\text{L}}}^{ + }},$(4)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}} \leftrightarrow {\text{Cu}}{{{\text{L}}}_{2}},$(5)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}}--{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--1}}}{\text{L}},$(6)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}}--2{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--2}}}{{{\text{L}}}^{--}},$(7)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}}--3{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--3}}}{{{\text{L}}}^{{2--}}},$(8)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}}--{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--1}}}{\text{L}}_{{2 - }}^{{}},$(9)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}}--2{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--2}}}{\text{L}}_{2}^{{2 - }},$(10)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}} + {{{\text{H}}}^{ + }} \leftrightarrow {\text{CuH}}{{{\text{L}}}^{{2 + }}},$(11)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}} + {{{\text{H}}}^{ + }} \leftrightarrow {\text{CuHL}}_{2}^{ + },$(12)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}} + 2{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{2}}{\text{L}}_{2}^{{2 + }},$(14)
${{{\text{Y}}}^{--}} + 2{{{\text{H}}}^{ + }} \leftrightarrow {{{\text{H}}}_{2}}{{{\text{Y}}}^{ + }},$(15)
${{{\text{Y}}}^{--}} + 3{{{\text{H}}}^{ + }} \leftrightarrow {{{\text{H}}}_{3}}{{{\text{Y}}}^{{2 + }}},$(16)
${\text{С }}{{{\text{u}}}^{{2 + }}} + {{{\text{Y}}}^{--}} \leftrightarrow {\text{С u}}{{{\text{Y}}}^{ + }},$(17)
${\text{С }}{{{\text{u}}}^{{2 + }}} + 2{{{\text{Y}}}^{--}} \leftrightarrow {\text{С u}}{{{\text{Y}}}_{2}},$(18)
${\text{С }}{{{\text{u}}}^{{2 + }}} + {{{\text{H}}}^{ + }} + {{{\text{Y}}}^{--}} \leftrightarrow {\text{С uH}}{{{\text{Y}}}^{{2 + }}},$(19)
${\text{С }}{{{\text{u}}}^{{2 + }}} + {{{\text{H}}}^{ + }} + 2{{{\text{Y}}}^{--}} \leftrightarrow {\text{С uHY}}_{2}^{ + },$(20)
${\text{С }}{{{\text{u}}}^{{2 + }}} + 2{{{\text{H}}}^{ + }} + 2{{{\text{Y}}}^{--}} \leftrightarrow {\text{С u}}{{{\text{H}}}_{2}}{\text{Y}}_{2}^{{2 + }},$(21)
${\text{С }}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}} + {{{\text{Y}}}^{--}} \leftrightarrow {\text{С uLY}},$(22)
${\text{С }}{{{\text{u}}}^{{2 + }}} + {{{\text{H}}}^{ + }} + {{{\text{L}}}^{--}} + {{{\text{Y}}}^{--}} \leftrightarrow {\text{С uLH}}{{{\text{Y}}}^{ + }},$(23)
${{{\text{H}}}^{ + }} + {\text{O}}{{{\text{H}}}^{--}} \leftrightarrow {{{\text{H}}}_{2}}{\text{O}},$(24)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {\text{HOH}} \leftrightarrow {\text{CuO}}{{{\text{H}}}^{ + }} + {{{\text{H}}}^{ + }}.$Результаты потенциометрического титрования использовали для расчета констант устойчивости образующихся смешаннолигандных соединений. Экспериментальные данные обрабатывали по универсальной программе “PHMETR”, предназначенной для расчета констант равновесия с произвольным числом реакций по измеренной равновесной концентрации одной из частиц [9]. Критерием адекватности выбранной модели служили различия между рассчитанными и экспериментальными величинами pH. Они были знакопеременными и не превышали погрешности эксперимента.
Значения констант диссоциации триглицина при I = 0.2 , рK1 = 3.25, рK2 = 7.90 и L-гистидина в этих же условиях рK2 = 6.10, рK3 = 9.16, а также значения констант устойчивости однородных комплексов меди(II) с триглицином, L-гистидином и термодинамические параметры диссоциации воды на фоне KNO3 были определены ранее [10–12]. В расчетах также учитывали возможность гидролиза ионов Cu2+.
Расчеты показали, что в системе Cu2+–триглицин–L–гистидин происходит образование смешанных комплексов состава CuLY и CuLHY+. Полученные при разных соотношениях триглицина и L-гистидина значения lg β(CuLY) = 15.06 ± ± 0.02 и 15.05 ± 0.02 хорошо согласуются между собой. В качестве наиболее вероятных приняты величины lg β(CuLY) = 15.05 ± 0.02 и lg β(CuLНY+) = = 19.50 ± 0.05. Следует отметить, что при моделировании изучаемой системы с помощью универсальной программы “PHMETR” не зафиксировано образование молекулярных комплексных соединений между триглицином и L-гистидином. Погрешность полученных величин рассчитана как средневзвешенное вероятного отклонения среднеарифметического при доверительной вероятности 0.95.
Экспериментальный тепловой эффект взаимодействия растворов меди(II), триглицина и L‑гистидина имеет вид:
(25)
$\begin{gathered} {{\Delta }_{{{\text{mix}}}}}H - {{\Delta }_{{{\text{dil}}}}}H = {{\alpha }_{1}}{{\Delta }_{r}}{{H}_{{({\text{CuLY}})}}} + \\ + \;{{\alpha }_{2}}{{\Delta }_{r}}{{H}_{{({\text{CuLH}}{{{\text{Y}}}^{ + }})}}} + \sum {{{\alpha }_{i}}{{\Delta }_{r}}{{H}_{i}}} , \\ \end{gathered} $Калориметрические измерения проводили в условиях максимального выхода изучаемых комплексов и минимизации вкладов побочных процессов. Равновесный состав растворов в условиях каждого опыта и энтальпии образования частиц CuLY и CuLHY+ рассчитывали с помощью универсальных программ, более подробно описанных в [13]. Необходимые при этом константы и энтальпии ионизации триглицина и L-гистидина взяты из работ [10, 14, 15]. Энтальпии реакций образования однородных комплексов меди(II) с триглицином взяты из [13, 16, 17] с L-гистидином из [18]. Вклад теплового эффекта процесса (24) был пренебрежимо мал.
Расчет показал, что при выбранных концентрационных соотношениях реагирующих частиц доля образования смешаннолигандного комплекса CuLY составляла 66%, максимальный выход комплекса CuLHY+ – 16%.
Рассчитанные энтальпии процессов образования частиц CuLY и CuLHY+ приведены в табл. 3.
Таблица 3.
Стандартные термодинамические характеристики реакций образования комплексов меди(II) с глицином (Gly–), триглицином (L–) и L-гистидином (Y–)
| Процесс | lg βo | –ΔrН°, кДж/моль | –ΔrG°, кДж/моль | ΔrS°, Дж/(мольK) |
|---|---|---|---|---|
| I = 0 | ||||
| Cu2+ + L– + Y– ↔ CuLY | 15.86 ± 0.02 | 76.02 ± 0.30 | 90.53 ± 0.11 | 48.7 ± 0.6 |
| Сu2+ + H++ L– + Y– ↔ СuLHY+ | 20.31 ± 0.05 | 91.20 ± 0.79 | 115.93 ± 0.28 | 82.9 ± 1.6 |
| I = 0.2 | ||||
| Cu2+ + L– + Y– ↔ CuLY | 15.05 ± 0.02 | 77.24 ± 0.21 | 85.90 ± 0.11 | 29.1 ± 0.3 |
| Сu2++H++ L– + Y– ↔ СuLHY+ | 19.50 ± 0.05 | 95.42 ± 0.29 | 111.31 ± 0.28 | 53.3 ± 0.6 |
| I = 0.5 | ||||
| Cu2+ + L– + Y– ↔ CuLY | 14.94 ± 0.02 | 77.07 ± 0.31 | 85.28 ± 0.11 | 27.5 ± 0.6 |
| Сu2+ + H+ + L– + Y– ↔ СuLHY+ | 19.34 ± 0.05 | 101.59 ± 0.38 | 110.39 ± 0.28 | 29.5 ± 0.6 |
| I = 1.0 | ||||
| Cu2+ + L– + Y– ↔ CuLY | 14.81 ± 0.02 | 76.89 ± 0.30 | 84.54 ± 0.11 | 25.6 ± 0.6 |
| Сu2+ + H+ + L– + Y– ↔ СuLHY+ | 19.26 ± 0.05 | 109.04 ± 0.39 | 109.94 ± 0.28 | 3.0 ± 0.6 |
| I = 0 | ||||
| Cu 2+ + H+ + Gly– + Y– ↔ CuGlyHY+ [7] | 22.91 ± 0.20 | 89.22 ± 0.33 | 130.77 ± 1.14 | 139.4 ± 2.7 |
Энтальпия комплексообразования в стандартном растворе была найдена экстраполяцией величин тепловых эффектов при фиксированных значениях ионной силы к нулевой по уравнению [19]:
где ΔН, ΔН° – изменение энтальпии при конечном значении ионной силы и I = 0 соответственно; Ψ(I) – функция ионной силы, вычисленная теоретически; ΔZ2 – разность квадратов зарядов продуктов реакции и исходных компонентов; b – эмпирический коэффициент.Результаты экстраполяции и рассчитанные значения стандартных термодинамических характеристик комплексообразования в системе Cu2+–триглицин–L-гистидин приведены в табл. 3.
Логарифмы констант равновесия реакций сопропорционирования:
(28)
${\text{С u}}{{{\text{L}}}_{2}} + {\text{С u}}{{{\text{H}}}_{2}}{\text{Y}}_{2}^{{2 + }} \leftrightarrow 2{\text{CuLH}}{{{\text{Y}}}^{ + }}$Реакцию (27) можно представить как сумму двух реакций:
(29)
${\text{Cu}}{{{\text{L}}}^{ + }} + {\text{Cu}}{{{\text{Y}}}_{2}} \leftrightarrow {\text{CuLY}} + {\text{Cu}}{{{\text{Y}}}^{ + }},$(30)
${\text{Cu}}{{{\text{Y}}}^{ + }} + {\text{Cu}}{{{\text{L}}}_{2}} \leftrightarrow {\text{CuLY}} + {\text{Cu}}{{{\text{L}}}^{ + }}.$Реакцию (28) можно представить как сумму двух реакций:
(31)
${\text{С u}}{{{\text{L}}}^{ + }} + {\text{С u}}{{{\text{H}}}_{2}}{\text{Y}}_{2}^{{2 + }} \leftrightarrow {\text{CuLH}}{{{\text{Y}}}^{ + }} + {\text{CuH}}{{{\text{Y}}}^{{2 + }}},$(32)
${\text{CuH}}{{{\text{Y}}}^{{2 + }}} + {\text{С u}}{{{\text{L}}}_{2}} \leftrightarrow {\text{CuLH}}{{{\text{Y}}}^{ + }} + {\text{С u}}{{{\text{L}}}^{ + }}.$В табл. 4 приведены термодинамические характеристики процессов (27)–(32), рассчитанные с использованием результатов настоящей работы (табл. 3) и литературных данных [17, 18], а также термодинамические характеристики процессов смешаннолигандного комплексообразования в системе Cu2+–глицин–L-гистидин, полученные ранее [7].
Таблица 4.
Стандартные термодинамические характеристики реакций сопропорционирования смешаннолигандных комплексов меди(II) с глицином, триглицином и L-гистидином при I = 0
| Процесс | lg K | –ΔrН°, кДж/моль | –ΔrG°, кДж/моль | –ΔrS°, Дж/(моль K) |
|---|---|---|---|---|
| CuL2 + CuH2${\text{Y}}_{2}^{{2 + }}$ ↔ 2CuLHY+ | 2.33 | 33.51 | 13.31 | 67.8 |
| Cu(Gly)2 + CuH2${\text{Y}}_{2}^{{2 + }}$ ↔ 2CuGlyHY+ [7] | 2.52 | 16.51 | 14.07 | 8.1 |
| CuL+ + CuH2${\text{Y}}_{2}^{{2 + }}$ ↔ CuLHY+ + CuHY2+ | 1.34 | 27.35 | 7.65 | 66.1 |
| CuHY2+ + CuL2 ↔ CuLHY+ + CuL+ | 0.99 | 6.16 | 5.66 | 1.7 |
| CuGly+ + CuH2${\text{Y}}_{2}^{{2 + }}$ ↔ CuGlyHY+ + CuHY2+ [7] | 1.09 | 15.41 | 6.22 | 30.7 |
| CuHY2+ + Cu(Gly)2 ↔ CuGlyHY+ + CuGly+ [7] | 1.43 | 1.10 | 7.85 | –22.6 |
| CuL2 + CuY2 ↔ 2CuLY | 2.25 | 29.97 | 37.80 | 57.3 |
| CuL+ + CuY2 ↔ CuLY + CuY+ | 1.94 | 25.04 | 36.03 | 46.8 |
| CuY+ + CuL2 ↔ CuLY + CuL+ | 0.31 | 4.93 | 1.77 | 10.5 |
Смешанные комплексы устойчивы к диспропорционированию, так как для реакций (27) и (28) lg K > 0, ΔrH < 0 и ΔrS < 0. Очевидно, при образовании смешаннолигандных комплексов CuLY и CuLHY+ из однородных комплексов CuL2, CuY2 и СuH2Y$_{2}^{{2 + }}$ увеличивается количество координированных молекул воды, а также происходит стабилизация связей металл–лиганд. Положительные значения lg K реакций (29)–(32) и аналогичных реакций для системы Cu2+–глицин–L-гистидин показывают, что присоединение глицина, триглицина и L-гистидина в качестве смешанных лигандов в комплексах CuLY, CuLHY+ и CuGlyHY+ усиливает их устойчивость больше, чем присоединение этих лигандов в качестве однородных усиливает устойчивость образующихся бискомплексов. Сравнение lg K реакций, приведенных в табл. 4, показывает, что комплекс CuLHY+ менее устойчив к распаду на однородные, чем комплекс CuGlyHY.
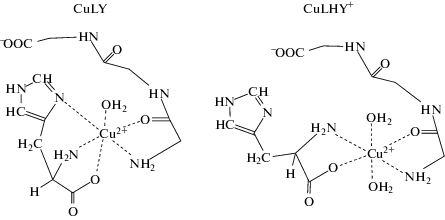
Вероятные структуры комплексов CuLY и CuLHY+ приведены на схеме:
Список литературы
Deschamps P., Kulkarni P., Gautam-Basak M., Sarkar B. // Coordination Chemistry Reviews. 2005. V. 249. P. 895.
Aljazzar S.O. // International Journal of Pharmaceutical Sciences Review and Research. 2016. V. 37. P. 105.
Srisuknimit V., Qiao Y., Schaefer K., Kahne D., Walker S. // Journal of the American Chemical Society. 2017. V. 139. P. 9791.
Bukharov M.S., Shtyrlin V.G., Mamin G.V., Stapf S., Mattea C., Mukhtarov A.S., Serov N.Y., Gilyazetdi-nov E.M. // Inorganic Chemistry. 2015. V. 54. P. 9777.
Li H., Jiang J., Luo Y. // Physical Chemistry Chemical Physics. 2017. V. 19. P. 15030.
Marsh B.M., Zhou J., Garand E. // RSC Advances. 2015. V. 5. P. 1790.
Горболетова Г.Г., Метлин А.А. // Журн. физ. химии. 2016. Т. 90. № 9. С. 1342.
Лыткин А.И., Черников В.В., Крутова О.Н., Смирнова Д.К. // Журн. общ. химии. 2018. Т. 88. № 5. С. 811.
Бородин В.А., Васильев В.П., Козловский Е.В. // Журн. неорган. химии. 1986. Т. 31. № 1. С. 10.
Горболетова Г.Г., Бычкова С.А., Метлин А.А. // Изв. вузов. Химия и хим. технология. 2016. Т. 59. Вып. 2. С. 57.
Метлин А.А., Горболетова Г.Г., Бычкова С.А., Березина Н.М. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1115.
Васильев, В.П., Зайцева Г.А. // Журн. неорган. химии. 1988. Т. 33. № 5. С. 1196.
Горболетова Г.Г., Метлин А.А., Бычкова С.А. // Журнал физ. химии. 2017. Т. 91. № 12. С. 2077.
Васильев В.П., Кочергина Л.А., Гаравин В.Ю. // Журн. общ. химии. 1985. Т. 55. № 1. С. 189.
Лыткин А.И., Черников В.В., Крутова О.Н., Горболетова Г.Г., Скворцов И.А., Корчагина А.С. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 249.
Горболетова Г.Г., Метлин А.А. // Журн. физ. химии. 2018. Т. 92. № 11. С. 1720.
Горболетова Г.Г., Бычкова С.А. // Там же. В печати.
Горболетова Г.Г., Метлин А.А. // Там же. 2015. Т. 89. № 2. С. 218.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высш. школа, 1982. С. 320.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии