Журнал физической химии, 2019, T. 93, № 7, стр. 986-991
Термодинамические и кинетические параметры растворимости озона в воде
А. В. Леванов a, *, О. Я. Исайкина a, В. В. Лунин a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
Москва, Россия
* E-mail: levanov@kge.msu.ru
Поступила в редакцию 06.09.2018
После доработки 06.09.2018
Принята к публикации 15.11.2018
Аннотация
Исследованы растворимость и кинетика разложения озона в чистой воде при различных температурах. Найдены значения константы Генри озона, кинетического порядка и констант скорости его разложения. Показано, что для определения концентрации растворенного озона достаточно использовать закон Генри [O3] = HO3C(O3), где [O3] и C(O3) – концентрации озона в растворе и в газовой фазе, моль/л, причем константа Генри определяется равенством: ln HO3 = –(9.445 ± 1.00) + (2406 ± 300)/T (в интервале 20–40°С). Обсуждена зависимость растворимости от кинетических характеристик процессов разложения и массопереноса озона, чистоты воды и особенностей реактора.
Озон играет значительную роль в хозяйственной деятельности человека, причем наиболее широко используется для обработки воды (водоочистка, водоподготовка, и пр.) [1]. Количественные данные о растворимости озона требуются при разработке, проектировании и контроле соответствующих промышленных процессов. Важная особенность озона – его неустойчивость и высокая реакционная способность. Поэтому для полной характеристики его растворимости при постоянной температуре требуется не один, а несколько параметров (не только константа равновесия процесса растворения – константа Генри, но и коэффициенты скорости разложения и массопереноса). Это отличает его от большинства других распространенных газов, для определения растворимости которых достаточно только константы Генри, и приводит к весьма значительным погрешностям как при оценке числовых характеристик растворимости из экспериментальных данных, так и при расчете концентрации растворенного вещества на основе справочных значений параметров. Такая ситуация находит отражение в значительном расхождении данных о растворимости озона в воде в различных работах, несмотря на более чем 120-летнюю историю этих исследований. Обобщение литературных результатов по этому вопросу можно посмотреть в статьях и обзорах [2–10]. Особенности растворимости озона описываются в литературе с использованием нескольких подходов. В части работ, например, [2, 11, 12] закономерности растворимости интерпретируются в терминах зависимости константы Генри не только от температуры, но и от состава раствора, рН или концентрации гидроксил-ионов в растворе. В других исследованиях (например, [4, 10, 13, 14]), акцент сделан на решении обратной задачи моделирования – математически строгом описании процесса растворения в рамках принятых моделей массопереноса и химических реакций озона, и оценке параметров моделей, в частности константы Генри, из первичных экспериментальных данных. Определение растворимости на основе таких результатов требует решения прямой задачи. До сих пор проблема надежной характеристики растворимости озона не решена (см. обсуждение ниже). Цель настоящей работы – изучение растворимости и кинетики разложения озона в чистой воде при различных температурах и определение полного набора термодинамических и кинетических параметров, позволяющих предсказывать растворимость этого вещества.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Растворение озона осуществляли в барботажных реакторах. Использовали нетермостатируемый реактор с рабочим объемом 250 мл и термостатируемый реактор с объемом 150 мл. Их рабочая секция представляла собой стеклянный цилиндр внутренним диаметром ~2 или 3 см, в нижнюю часть которого впаяна перегородка – фильтр из пористого стекла в форме диска. Снизу реактора, над фильтром, имелся отвод для отбора проб жидкости. Столб воды располагался над фильтром, и через него же в реактор поступал озонированный кислород. Такая конструкция обеспечивала дробление газового потока на большое количество мелких пузырьков и эффективный контакт газа с жидкостью. Схема аналогичной экспериментальной установки приведена в нашей работе [15].
Озон получали при пропускании особо чистого кислорода через озонатор барьерного разряда. Концентрацию О3 в газовом потоке измеряли на входе в реактор с помощью фотометрического озонометра “Медозон-254/5”. Концентрация О3 принимала значения от 5 до 97 г/м3, скорость потока газовой смеси 21 л/ч (ст. у.) во всех экспериментах. Для определения концентрации растворенного озона из реактора отбирали пробы раствора и измеряли их оптическую плотность при 260 нм (на максимуме поглощения озона в воде) с течением времени A260(t). Использовали спектрофотометр “Agilent-8453”. Началом отсчета времени служил момент отбора пробы. При исследовании растворимости озона при повышенных температурах (30.6 и 40°С) оптическую кювету предварительно подогревали до требуемой температуры. В ходе регистрации оптической плотности кювета находилась при комнатной температуре. Хотя при этом происходило ее охлаждение, мы считаем, что на начальном этапе измерений температура жидкости в кювете незначительно отклоняется от температуры в реакторе.
Характерные примеры зависимостей оптической плотности пробы от времени (кинетические кривые) показаны на рис. 1. Во всех наших экспериментах они имеют достаточно протяженный начальный прямолинейный участок. Разность (A260(t) – A260(∞)) представляет собой оптическую плотность озона в пробе, а величина (A260(0) – ‒ A260(∞)) равна оптической плотности озона в растворе в реакторе. Остаточная величина A260(∞) обусловлена в основном фоновым поглощением; ее принимали равной оптической плотности исходной воды, залитой в реактор.
Рис. 1.
Характерные зависимости оптической плотности озона в пробах реакционного раствора от времени при различных температурах в реакторе (1 – 20, 2 – 30.6, 3 – 40°С) и их аппроксимации кинетическими кривыми нулевого порядка. Концентрация озона в газовом потоке 30–35 г/м3.
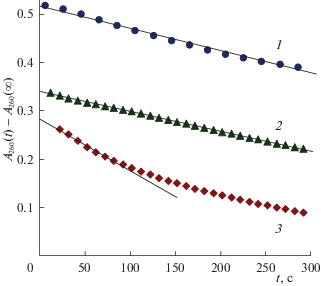
Для нахождения значений (A260(0) – A260(∞)) выбирали начальный линейный участок зависимости (A260(t) – A260(∞)) и аппроксимировали его прямой линией
Искомое значение равно величине свободного члена b:
Примеры аппроксимации показаны на рис. 1. Концентрацию озона в жидкости в реакторе, [O3], рассчитывали с помощью закона Бугера–Ламберта–Бера по формуле
Растворимость озона в настоящей работе характеризуется с помощью кажущейся константы Генри (безразмерной)
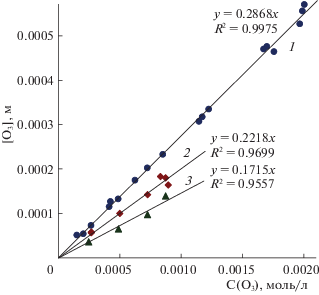
где [O3] и C(O3) – концентрации озона в жидкости и газовом потоке на входе в реактор, моль/л, при стационарном режиме функционирования реактора. Во всех наших экспериментах концентрации озона в растворе и в газовой фазе прямо пропорциональны друг другу (см. рис. 2). Мы аппроксимировали экспериментальные зависимости [O3] от C(O3) прямыми, выходящими из начала координат, и оценивали значения констант Генри, HO3, как угловые коэффициенты этих линий. Следует отметить, что при определении HO3 величины C(O3) пересчитывали к значениям температуры и давления в реакторе.Рис. 2.
Зависимости концентрации озона в растворе от концентрации в газовой фазе при различных температурах: 1 – 20, 2 – 30.6, 3 – 40°С.
Кинетический порядок реакции разложения озона определяли дифференциальным методом Вант-Гоффа, по начальным участкам серии кинетических кривых. Нетрудно показать, что если реакция разложения имеет n-й порядок, то временная зависимость оптической плотности озона в пробе описывается дифференциальным уравнением
(3)
$\begin{gathered} \frac{{d({{A}_{{260}}}(t)\quad--\quad{{A}_{{260}}}(\infty ))}}{{dt}} = \\ = \; - {\kern 1pt} {{k}_{{{\text{eff}}}}}{{({{A}_{{{\text{26}}0}}}(t) - {{A}_{{{\text{26}}0}}}(\infty ))}^{n}}, \\ \end{gathered} $По результатам серии экспериментов, которые отличались только концентрацией озона в газовом потоке на входе в реактор, строили график зависимости lg(–d(A260(0) – A260(∞))/dt) от lg(A260(0) – A260(∞)), аппроксимировали его прямой линией и определяли ее угловой коэффициент. Согласно (3), график описывается уравнением
Вместе с определением порядка, находили константу скорости реакции разложения озона kd. Как показано далее, порядок равен единице, n = 1, и поэтому уравнение (3) принимает вид
Отсюда следует формула для оценки константы скорости:
Доверительные интервалы определяемых величин HO3, n, kd оценивали стандартными статистическими методами в программе Microsoft Excel, с помощью встроенных функций и процедуры “Регрессия” из пакета “Анализ данных”, для доверительной вероятности 95%.
Следует отметить, что недостатком многих работ, в которых растворимость озона находят путем определения его концентрации в пробах, отобранных из реактора, является неучет разложения озона в ходе измерений. В настоящей работе мы принимаем этот фактор во внимание, что позволяет найти неискаженные значения концентрации озона в жидкости в реакторе. Кроме того, одновременно определяются кинетические параметры реакции разложения озона в реакционном растворе, необходимые при характеристике его растворимости.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Зависимости концентрации озона в растворе от концентрации в газовом потоке на входе реактора показаны на рис. 2. Они хорошо соответствуют закону Генри – прямой пропорциональности концентраций вещества в растворе и газовой фазе при постоянной температуре. Значения кажущейся константы Генри озона в воде приведены в табл. 1. Ее температурная зависимость описывается аппроксимационным уравнением:
(4)
$\ln {{H}_{{\text{O}}}}_{{\text{3}}} = - ({\text{9}}.{\text{445}} \pm {\text{1}}.00) + ({\text{24}}0{\text{6}} \pm {\text{3}}00){\text{/}}T.$Таблица 1.
Кажущаяся константа Генри, порядок и константа скорости реакции разложения озона в воде
| Т, °С | 20 ± 1 | 30.6 ± 0.5 | 40 ± 0.5 |
| HO3 | 0.287 ± 0.004 | 0.222 ± 0.014 | 0.172 ± 0.028 |
| n | 1.1 ± 0.1 | 1.0 ± 0.4 | 1.2 ± 0.5 |
| kd × 103, с–1 | 1.4 ± 0.1 | 1.5 ± 0.2 | 3.9 ± 0.8 |
Интервалы неопределенности коэффициентов (4) соответствуют доверительной вероятности 95%.
Также в табл. 1 даны кинетические характеристики реакции разложения озона в воде – порядок и константа скорости. Можно видеть, что порядок реакции разложения является первым. Довольно большие интервалы неопределенности значений порядка обусловлены прежде всего характерной чертой используемого дифференциального метода – возрастанием погрешностей при оценке производной по значениям функции. Необходимо отметить, что применение какого-либо другого метода определения порядка невозможно, поскольку кинетические кривые в большинстве случаев – прямые линии (или аппроксимируются ими), т.е. соответствуют кинетике псевдонулевого порядка. Константа скорости разложения озона с ростом температуры увеличивается, однако ее температурная зависимость не является аррениусовской. Это согласуется с тем, что разложение озона в водных средах – сложный многостадийный процесс.
Как уже упоминалось выше, растворимость озона определяется как термодинамическими, так и кинетическими параметрами. Термодинамическим параметром является истинная константа Генри, ${{\hat {H}}_{{{{{\text{O}}}_{3}}}}}$. Определим ее как отношение концентраций озона в растворе и газовой фазе в условиях термодинамического равновесия, которое установилось бы, если бы разложение озона (и другие реакции) не происходили. Для того, чтобы выяснить связь между кажущейся и истинной константами Генри, ${{H}_{{{{{\text{O}}}_{3}}}}}$ и ${{\hat {H}}_{{{{{\text{O}}}_{3}}}}}$, необходимо принять во внимание кинетику процессов с участием озона, а также учесть макрокинетические особенности реактора.
Примем для нашего барботажного реактора модель реактора идеального перемешивания, в котором находятся две фазы – жидкая и газообразная. Будем рассматривать только стационарный режим, что соответствует условиям экспериментов. Известно, что процессы массопереноса (растворения) и химических реакций озона (в нашем случае имеет место только разложение О3) можно считать независимыми, если число Хатта h ≤ 0.3 (см., например, [17]). Число Хатта определяется выражением
(5)
${{k}_{{\text{L}}}}a({{\hat {H}}_{{{{{\text{O}}}_{{\text{3}}}}}}}\hat {C}({{{\text{O}}}_{{\text{3}}}}) - [{{{\text{O}}}_{{\text{3}}}}]) - {{k}_{{\text{d}}}}[{{{\text{O}}}_{{\text{3}}}}] = 0,$(6)
$\frac{v}{{{{V}_{L}}}}{\kern 1pt} (C({{{\text{O}}}_{{\text{3}}}}) - \hat {C}({{{\text{O}}}_{{\text{3}}}})) - {{k}_{{\text{L}}}}a({{\hat {H}}_{{{\text{O3}}}}}\hat {C}({{{\text{O}}}_{{\text{3}}}}) - \left[ {{{{\text{O}}}_{{\text{3}}}}} \right]) = 0,\quad{\text{ }}$(7)
${{\hat {H}}_{{{{{\text{O}}}_{{\text{3}}}}}}} = {{H}_{{{{{\text{O}}}_{{\text{3}}}}}}}\frac{{1 + {{{{k}_{{\text{d}}}}} \mathord{\left/ {\vphantom {{{{k}_{{\text{d}}}}} {{{k}_{{\text{L}}}}a}}} \right. \kern-0em} {{{k}_{{\text{L}}}}a}}}}{{1 - {{k}_{{\text{d}}}}\frac{{{{V}_{{\text{L}}}}}}{v}{{H}_{{{{{\text{O}}}_{{\text{3}}}}}}}}}.$Значения kd определены в настоящем исследовании (см. табл. 1). Величина kLa ≈ 0.1 с–1 найдена в нашей работе [19] для нетермостатируемого реактора (при 20 ± 1°С) и растворов с ионной силой 0.1–0.9 М. Если принять, что коэффициент массопереноса озона в воде в интервале 20–40°С имеет такое же значение, то с помощью формулы (7) можно оценить различие между истинной и кажущейся константами Генри. При 20 ± 1°С оно составляет менее 3.8%, при 30.6°С примерно 2%, при 40°С – 6%. В случае повышенных температур это различие меньше, чем погрешности величины ${{H}_{{{{{\text{O}}}_{3}}}}}$. При комнатной температуре относительная погрешность ${{H}_{{{{{\text{O}}}_{3}}}}}$ составляет 1.4%, т.е. весьма невелика. Однако речь идет только о случайных ошибках, и не учтены возможные систематические погрешности, например, погрешность, вносимая при описании реального реактора с помощью модели идеального перемешивания. Поэтому мы считаем, что при всех исследованных температурах, различие кажущейся ${{H}_{{{{{\text{O}}}_{3}}}}}$ и истинной ${{\hat {H}}_{{{{{\text{O}}}_{3}}}}}$ констант Генри для озона в воде сопоставимо или меньше погрешностей величины ${{H}_{{{{{\text{O}}}_{3}}}}}$. Следовательно, значения кажущейся константы Генри ${{H}_{{{{{\text{O}}}_{3}}}}}$, представленные в табл. 1 и описываемые аппроксимационным уравнением (4), служат надежными оценками истинной константы Генри озона в воде.
При расчете растворимости озона на основе закона Генри необходимо учитывать кинетику процессов его разложения и растворения. Если применима модель реактора идеального перемешивания, то растворимость в стационарном режиме можно определить путем решения системы уравнений (5)–(6). При этом она может быть значительно меньше равновесного значения, если коэффициент kLa мал (низкая скорость растворения) и/или константа kd велика (высокая скорость разложения, например, в загрязненной воде).
Сравнение температурной зависимости константы Генри, полученной в настоящей работе, со справочными данными и рекомендациями, имеющимися в литературе, представлено на рис. 3. В источниках использованы иные определения константы Генри, поэтому ее значения пересчитаны в соответствии с формулой (2). Заслуживает внимания хорошее соответствие результатов настоящей работы и рекомендаций [4, 21]. В то же время температурные зависимости согласно обзорам [22] и уравнению (6) в [5] (оно представляет стандартные данные международной озоновой ассоциации по растворимости озона в воде), весьма значительно отличаются, в большую и меньшую стороны от результатов [4, 20, 21] и настоящей работы, что может свидетельствовать об их некорректности.
Таким образом, в настоящей работе выполнены исследования растворимости и кинетики разложения озона в чистой воде. Определены значения кажущейся константы Генри, порядка и константы скорости реакции разложения озона при различных температурах. Показано, что различие между истинной ${{\hat {H}}_{{{{{\text{O}}}_{3}}}}}$ и кажущейся ${{H}_{{{{{\text{O}}}_{3}}}}}$ константами Генри находится внутри интервала неопределенности ${{H}_{{{{{\text{O}}}_{3}}}}}$, и поэтому полученные в значения ${{H}_{{{{{\text{O}}}_{3}}}}}$ служат надежной оценкой истинной константы Генри озона в воде.
Список литературы
Лунин В.В., Попович М.П., Ткаченко С.Н. Физическая химия озона. М.: Изд-во МГУ, 1998.
Roth J.A., Sullivan D.E. // Ind. Eng. Chem. Fundamen. 1981. V. 20. № 2. P. 137.
Александров Ю.А., Тарунин Б.И., Переплетчиков М.Л. // Журн. физ. химии. 1983. Т. 57. № 10. С. 2385.
Rischbieter E., Stein H., Schumpe A. // J. Chem. Eng. Data. 2000. V. 45. № 2. P. 338.
Biń A.K. // Ozone Sci. Eng. 2006. V. 28. № 2. P. 67.
Леванов А.В., Кусков И.В., Антипенко Э.Е., Лунин В.В. // Журн. физ. химии. 2008. Т. 82. № 7. С. 1275.
Clever H.L., Battino R., Miyamoto H. et al. // J. Phys. Chem. Ref. Data. 2014. V. 43. № 3. P. 033102.
Ferre-Aracil J., Cardona S.C., Navarro-Laboulais J. // Ozone Sci. Eng. 2015. V. 37. № 2. P. 106.
Sander R. // Atmos. Chem. Phys. 2015. V. 15. № 8. P. 4399.
Ershov B.G., Gordeev A.V., Seliverstov A.F. // Ozone: Science & Engineering. 2017. V. 39. № 2. P. 69.
Sotelo J.L., Beltrán F.J., Benitez F.J., Beltrán-Heredia J. // Water Res. 1989. V. 23. № 10. P. 1239.
Andreozzi R., Caprio V., Ermellino I. et al. // Ind. Eng. Chem. Res. 1996. V. 35. № 4. P. 1467.
Gershenzon M., Davidovits P., Jayne J.T. et al. // J. Phys. Chem. A. 2001. V. 105. № 29. P. 7031.
Mizuno T., Tsuno H. // Ozone: Sci. Eng. 2010. V. 32. № 1. P. 3.
Леванов А.В., Кусков И.В., Зосимов А.В. и др. // Кинетика и катализ. 2003. Т. 44. № 6. С. 810–816.
Леванов А.В., Исайкина О.Я., Тютюнник А.Н. и др. // Журн. аналит. химии. 2016. Т. 71. № 6. С. 577.
Леванов А.В., Исайкина О.Я., Лунин В.В. // Журн. физ. химии. 2017. Т. 91. № 10. С. 1641.
Johnson P.N., Davis R.A. // J. Chem. Eng. Data. 1996. V. 41. № 6. P. 1485.
Леванов А.В., Исайкина О.Я., Гасанова Р.Б., Лунин В.В. // Журн. физ. химии. 2017. Т. 91. № 8. С. 1307.
Kirk-Othmer Encyclopedia of Chemical Technology, 2nd ed. Vol. 14. New York: Wiley, 1967. P. 412.
Sander S.P., Abbatt J., Barker J.R. et al. // Chemical Kinetics and Photochemical Data for Use in Atmospheric Studies, Evaluation No. 17. Pasadena: JPL Publication 10–6, Jet Propulsion Laboratory, 2011. P. 5–66.
Wilhelm E., Battino R., Wilcock R.J. // Chem. Rev. 1977. V. 77. № 2. P. 219.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



