Журнал физической химии, 2019, T. 93, № 7, стр. 1097-1102
Равновесие дефектов и электропроводность катион-дефицитных двойных кобальтитов
М. О. Калинкин a, Б. В. Политов a, А. Ю. Сунцов a, *, И. А. Леонидов a, М. В. Патракеев a, В. Л. Кожевников a
a Российская академия наук, Уральское отделение, Институт химии твердого тела
Екатеринбург, Россия
* E-mail: suntsov@ihim.uran.ru
Поступила в редакцию 04.09.2018
После доработки 04.11.2018
Принята к публикации 20.11.2018
Аннотация
Изучены кристаллическая структура, кислородная нестехиометрия и электропроводность в кобальтитах PrBa1 – xCo2O6 – δ со структурой двойного перовскита. Показано, что дефектные кобальтиты в пределах области гомогенности 0 < х ≤ 0.1 имеют тетрагональную структуру (пр. гр. P4/mmm) с параметрами ap × аp × 2аp, где аp ~ 3.8 Å. Методом кулонометрического титрования измерено содержание кислорода в оксидах в широком интервале температур и давлений кислорода в газовой фазе, рассчитаны концентрации электронных дефектов и определены границы термодинамической стабильности состава х = 0.1. Установлено, что увеличение концентрации катионных вакансий в бариевой подрешетке приводит к уменьшению подвижности дырочных носителей заряда и способствует снижению коэффициента термического расширения.
Кобальтиты LnBaCo2O6 – δ, где Ln = лантаноид, привлекают внимание исследователей благодаря комплексу функциональных свойств, которые могут быть использованы при создании различных высокотемпературных устройств. В частности, интенсивно изучаются возможности их применения в качестве катодных материалов твердооксидных топливных элементов, кислородных аккумуляторов и керамических мембран для выделения кислорода из воздуха [1–5]. Данные соединения имеют структуру, для которой характерно чередующееся расположение перовскитных слоев LnCoO3 – δ и BaCoO3, обусловленное большой разницей поляризуемости и ионных радиусов катионов Ln3+ и Ba2+. Это приводит к удвоению ap × ap × 2ap элементарной ячейки, где ap – параметр кубической перовскитной ячейки, вдоль кристаллографической оси c и возникновению трех структурно неэквивалентных позиций атомов кислорода. Кристаллохимическое строение кобальтитов можно также представить, как чередование слоев BaO–CoO2–LnO1 – δ–CoO2–BaO, где состав указан в расчете на элементарную ячейку, а позиции атомов кислорода в слоях ионов бария, кобальта и лантаноида обозначаются, как О1, О2 и О3, соответственно [6]. Кобальтиты со слоевой структурой отличаются высокими значениями электронной и кислород-ионной компонент проводимости [7–10], а также большой константой кислородного обмена с газовой фазой [11, 12]. Эти особенности связаны с высокой подвижностью ионов кислорода, обусловленной относительно низкой энергией связи Co–O и наличием большого количества кислородных вакансий, δ, в структуре кобальтитов. В целом, общее содержание кислорода, 6 – δ, вероятно, является главным фактором, который не только влияет на величину ионной проводимости, но и определяет зарядовое и спиновое состояние ионов кобальта и, соответственно, характеристики электронного транспорта и магнитного состояния LnBaCo2O6 – δ. Поэтому важным предметом исследований в последние годы является построение модели дефектной структуры, которая позволит достаточно полно и точно охарактеризовать свойства кобальтитов в условиях их применения, т.е., при повышенных температурах и широких вариациях давления кислорода в газовой фазе. Так, в работе [13] на примере PrBaCo2O6 – δ показано, что равновесие дефектов кристаллической структуры в кобальтитах в основном обусловлено реакцией кислородного обмена и термически активированным зарядовым диспропорционированием ионов Co3+:
(1)
$\frac{1}{2}{{{\text{O}}}_{{\text{2}}}} + V_{{{\text{O3}}}}^{{ \bullet \bullet }} + 2Co_{{{\text{Co}}}}^{'} = O_{{{\text{O3}}}}^{ \times }\; + 2Co_{{{\text{Co}}}}^{ \times },$(2)
$2Co_{{{\text{Co}}}}^{ \times }{\text{ }} = {\text{ }}Co_{{{\text{Co}}}}^{'}\; + Co_{{{\text{Co}}}}^{ \bullet }.$В реакциях (1) и (2) используются обозначения Крёгера–Винка [14], где эффективные зарядовые состояния соотносятся со степенями окисления, как $Co_{{{\text{Co}}}}^{ \times } \equiv {\text{ C}}{{{\text{o}}}^{{{\text{3 + }}}}},$ $Co_{{{\text{Co}}}}^{'} \equiv {\text{ C}}{{{\text{o}}}^{{{\text{2 + }}}}}$ и $Co_{{{\text{Co}}}}^{ \bullet } \equiv {\text{ C}}{{{\text{o}}}^{{{\text{4 + }}}}}.$ Константа равновесия реакции диспропорционирования (2) достаточно велика, что обеспечивает высокую концентрацию катионов Co4+ и дырочную проводимость в кобальтитах даже при низком содержании кислорода, когда средний заряд ионов кобальта меньше 3+ [15].
Образование вакансий в позициях О3 при изменении внешних условий является настолько интенсивным, что их концентрация может даже превосходить количество заполненных узлов О3. Вследствие такого изобилия вакантных позиций вполне естественным кажется предположение, что кислородно-ионный транспорт в LnBaCo2O6 – δ должен быть обусловлен исключительно прямыми перескоками ионов кислорода по вакансиям в плоскостях Ln–О3 [16]. Однако это не вполне так, поскольку данная траектория связана с прохождением большого иона кислорода через узкое пространство, ограниченное двумя ионами лантаноида, кроме того, длина элементарного прыжка, равная параметру ap ~ 3.8 Å является необычно большой для движения кислорода в структуре перовскита. Между тем, структура кобальтитов также допускает и образование вакансий в позициях О2, т.е. в СоО2 плоскостях [17–23]. Как установлено в работах [19, 22], именно наличие таких вакансий открывает альтернативный канал для ионного переноса, связанный с более короткими элементарными прыжками между позициями О2 и О3. Соответствующая реакция обмена может быть представлена как
(3)
$O_{{{\text{O2}}}}^{ \times } + V_{{{\text{O3}}}}^{{ \bullet \bullet }} = O_{{{\text{O3}}}}^{ \times }{\text{ + }}V_{{{\text{O2}}}}^{{ \bullet \bullet }}.$Реакции (1)–(3), по существу, являются моделью равновесия атомарных дефектов в структуре кобальтитов LnBaCo2O6 – δ, следствия которой должны подтверждаться экспериментальными данными.
В попытках улучшения функциональных свойств слоевых кобальтитов авторы работ [24–27] исследовали составы LnBa1 – xCo2O6 – δ полагая, что дефицит бария может способствовать появлению дополнительных кислородных вакансий и интенсификации ионного транспорта, а также уменьшению склонности барийсодержащих кобальтитов к карбонизации [28] при взаимодействии с примесями СО2 в газовой фазе. Однако ряд вопросов остался нерешенным. Так, не ясно какая предельная концентрация вакансий бария может существовать в пределах устойчивости кристаллической структуры, как дефекты в бариевой подрешетке влияют на распределение и концентрацию подвижных носителей заряда и т.д. Поэтому целью настоящей работы является определение предельного дефицита по барию, вариаций содержания кислорода, термического расширения, электропроводности и интерпретация полученных данных с помощью модельных представлений на основе реакций (1)–(3).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы с номинальным составом PrBa1 ‒ xCo2O6 – δ, где x = 0, 0.025, 0.05, 0.075 и 0.1, были получены методом глицерин-нитратного синтеза. В качестве исходных веществ использовали оксид празеодима Pr6O11, карбонат бария BaCO3 квалификации “ос.ч.” и металлический кобальт. Необходимые навески сухих веществ, взятых с точностью до 10–4 г, растворяли в азотной кислоте и, далее, в раствор добавляли глицерин в эквимолярном отношении к сумме катионов металлов. Выдерживание полученного геля на воздухе при 300°C приводило к образованию обезвоженного продукта, его воспламенению и горению в спокойном режиме. Полученный материал перетирали в агатовой ступке и подвергали дополнительному отжигу при 900°C для полного удаления остаточных летучих продуктов пиролиза. Полученный порошок прессовали в виде брусков и проводили финальное спекание при температуре 1100°C в течение 12 ч.
Контроль фазового состава синтезированных образцов осуществляли методом порошковой рентгеновской дифракции с использованием дифрактометра Shimadzu XRD-7000 (Cu Kα-излучение). Для расчета параметров элементарной ячейки использовали полнопрофильный анализ спектров порошковой дифракции по методу Ритвелда, реализованный в программном пакете Fullprof [29].
Изменение содержания кислорода в образцах при изобарическом нагревании на воздухе рассчитывали из данных термогравиметрического (ТГ) эксперимента, полученных с помощью термоанализатора Setsys Evolution 18 (Setaram). Для определения изотермических зависимостей изменения состава по кислороду при вариациях парциального давления в интервале 10–6 – 1 атм использовали метод кулонометрического титрования. Кулонометрическая электрохимическая ячейка была изготовлена из стабилизированного диоксида циркония. Две пары платиновых электродов, нанесенных на внутреннюю и наружную поверхности ячейки, использовались независимо в качестве датчика давления кислорода и кислородного насоса. Электрические параметры в процессе титрования измеряли, используя прецизионный вольтметр Solarton 7081. В качестве источника тока использовали электрохимический интерфейс Solarton 1286. Погрешность определения состава по кислороду не превышала Δδ = = ±0.002. Более детально процесс измерений описан в работе [30].
Измерения электропроводности четырехзондовым методом на постоянном токе проводили в изотермических условиях с использованием керамических образцов 2 × 2 × 15 мм в ячейке из стабилизированного диоксида циркония с нанесенными платиновыми электродами, что позволяло изменять и независимо контролировать парциальное давление кислорода над образцом. Погрешность измерения значений проводимости при температурах 700–950°C составляла не более 1%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ спектров рентгеновской дифракции синтезированных образцов показывает образование твердого раствора PrBa1 – xCo2O6 – δ в пределах 0 ≤ х ≤ 0.1. Увеличение дефицита по барию до х = = 0.125 приводит к образованию примеси орторомбического кобальтита PrCoO3, исследованного в работе [31]. На рис. 1 приведена экспериментальная дифрактограмма (Yobs) и расчетный (Ycalc) спектр для тетрагональной структуры (пространственная группа P4/mmm). Вид разностной линии (Yobs–Ycalc) указывает на хорошую сходимость полученного спектра и свидетельствует о корректном описании структуры. Образование при синтезе на воздухе однофазных, тетрагональных кобальтитов PrBa1 – xCo2O6 – δ вплоть до состава x = 0.1 согласуется с результатами [27]. Следует отметить немонотонное изменение объема элементарной ячейки синтезированных образцов с концентрацией бария и содержанием кислорода, рис. 1 (вставка). Можно предполагать, что такое поведение отражает совместный эффект двух разнонаправленных тенденций, а именно, сжатия решетки при удалении крупных ионов бария и увеличения элементарной ячейки за счет увеличения содержания ионов Co3+ при росте дефицита по кислороду. Аналогичная картина наблюдается при сравнении коэффициентов термического расширения и температурных зависимостей линейного удлинения, рис. 2. Видно, что небольшое уменьшение содержания бария в кобальтите приводит к довольно резкому снижению теплового расширения, которое сменяется возрастанием при дальнейшем увеличении дефицита по барию.
Рис. 1.
Дифрактограмма кобальтита PrBa0.9Co2O6 – δ (Yobs) и результаты полнопрофильного анализа (Ycalc). На вставке показаны изменения объема элементарной ячейки и содержания кислорода в зависимости от состава синтезированных на воздухе образцов PrBa1 – xCo2O6 – δ.
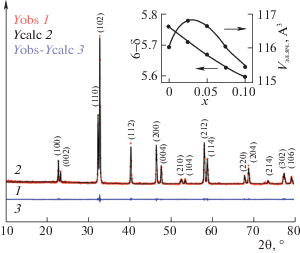
Рис. 2.
Температурные зависимости линейного расширения твердых растворов PrBa1 – xCo2O6 – δ и значения коэффициентов температурного расширения (α × 106, K–1) для различных температур.

Рассмотрим влияние дефицита бария на равновесие дефектов с использованием реакций (1)–(3). При образовании вакансий бария в кристалле возникает некомпенсированный эффективный отрицательный заряд, что может приводить к появлению дополнительного количества кислородных вакансий:
(4)
$\Pr {\text{BaC}}{{{\text{o}}}_{2}}{{{\text{O}}}_{{6 - \delta }}}\,\xrightarrow{{ - x{\text{BaO}}}}\,\Pr {\text{B}}{{{\text{a}}}_{{1 - x}}}{{({\text{V}}_{{{\text{Ba}}}}^{{''}})}_{x}}{\text{C}}{{{\text{o}}}_{2}}{{({\text{V}}_{{\text{O}}}^{{ \bullet \bullet }})}_{x}}{{{\text{O}}}_{{6 - x - \delta }}}.$Соответственно, условие электронейтральности следует представить как
(5)
$[{\text{Co}}_{{{\text{Co}}}}^{ \bullet }] = [{\text{Co}}_{{{\text{Co}}}}^{'}] - 2\delta + {\text{1}} + {\text{2}}x{\text{,}}$(6)
$[{\text{Co}}_{{{\text{Co}}}}^{'}] + [{\text{Co}}_{{{\text{Co}}}}^{ \times }] + [{\text{Co}}_{{{\text{Co}}}}^{ \bullet }] = 2$(7)
${{K}_{{{\text{cd}}}}} = \frac{{[{\text{Co}}_{{{\text{Co}}}}^{'}][{\text{Co}}_{{{\text{Co}}}}^{ \bullet }]}}{{{{{[{\text{Co}}_{{{\text{Co}}}}^{ \times }]}}^{2}}}}$(8)
$\begin{gathered} [{\text{Co}}_{{{\text{Co}}}}^{ \times }] = 3 + 2x - 2\delta - 2[{\text{Co}}_{{{\text{Co}}}}^{ \bullet }]; \hfill \\ {\text{ }}[{\text{Co}}_{{{\text{Co}}}}^{'}] = [{\text{Co}}_{{{\text{Co}}}}^{ \bullet }] - 1 - 2x + 2\delta ; \hfill \\ \end{gathered} $(9)
$\begin{gathered} [{\text{Co}}_{{{\text{Co}}}}^{ \bullet }] = \frac{3}{2} - \delta + x + \\ + \;\frac{{2\, - \,\sqrt {(4{{K}_{{{\text{cd}}}}}\, - \,1)\{ (2\delta \, - \,1)(1\, - \,2\delta \, + \,4x)\, - \,4{{x}^{2}}\, - \,4\} \, - \,4} }}{{2(4{{K}_{{cd}}}\, - \,1)}}. \\ \end{gathered} $Для ионной подсистемы имеем константу равновесия реакции (3):
(10)
${{K}_{{od}}} = \frac{{[V_{{{\text{O2}}}}^{{ \bullet \bullet }}][O_{{{\text{O3}}}}^{ \times }]}}{{[O_{{{\text{O2}}}}^{ \times }][V_{{{\text{O3}}}}^{{ \bullet \bullet }}]}},$(11)
$\begin{gathered} [V_{{{\text{O2}}}}^{{ \bullet \bullet }}] + [O_{{{\text{O}}2}}^{ \times }] = 4,\quad [V_{{{\text{O3}}}}^{{ \bullet \bullet }}] + [O_{{{\text{O3}}}}^{ \times }] = 1, \\ [O_{{{\text{O3}}}}^{ \times }] + [O_{{{\text{O2}}}}^{ \times }] = 5 - \delta . \\ \end{gathered} $Решение системы уравнений (10), (11) позволяет получить выражения для расчета концентраций ионных дефектов и квазинейтральных атомов кислорода $[V_{{{\text{O2}}}}^{{ \bullet \bullet }}]$, $[V_{{{\text{O3}}}}^{{ \bullet \bullet }}]$, $[O_{{{\text{O2}}}}^{ \times }]$ и $[O_{{{\text{O3}}}}^{ \times }]$. Подстановка формул (8)–(11) в выражение для константы равновесия реакции (1) дает возможность установить взаимосвязь величины равновесного давления кислорода над оксидом с концентрациями дефектов
(12)
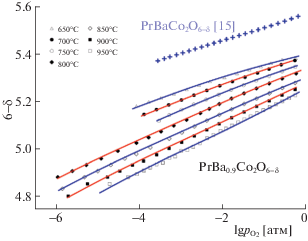
$p_{{{{{\text{O}}}_{{\text{2}}}}}}^{{1/2}} = \frac{1}{{{{K}_{{ox}}}}}\frac{{[O_{{{\text{O3}}}}^{ \times }]{{{[{\text{Co}}_{{{\text{Co}}}}^{ \times }]}}^{2}}}}{{[V_{{{\text{O3}}}}^{{ \bullet \bullet }}]{{{[{\text{Co}}_{{{\text{Co}}}}^{'}]}}^{2}}}}.$Выражение (12) может быть использовано для численного расчета зависимостей $\delta (x,T,{{p}_{{{{O}_{2}}}}})$ при различных температурах. Для этого необходимо определить оптимальные значения констант равновесия для реакций (1), (2) и (3), позволяющие добиться наилучшего совпадения теоретических зависимостей (12) с экспериментальными данными. На рис. 3 в качестве примера приведены результаты соответствующего подбора констант равновесия реакций образования дефектов для крайнего в пределах области гомогенности состава PrBa0.9Co2O6 – δ. Видно, что теоретические кривые с высокой точностью описывают экспериментальные точки. Анализ значений полученных параметров показывает, что величина константы Kcd практически не изменяется при удалении катионов бария из решетки. Более того, представленные на рис. 3 зависимости подтверждают уравнение зарядовой компенсации (4). В результате, кислородная нестехиометрия в PrBa0.9Co2O6 – δ оказывается существенно выше, чем в исходном кобальтите PrBaCo2O6 – δ. Данное обстоятельство должно оказывать существенное влияние на электротранспортные свойства катион-дефицитного кобальтита.
Рис. 3.
Изотермические зависимости содержания кислорода в PrBa1 – xCo2O6 – δ от равновесного давления кислорода в газовой фазе. Линии показывают результаты фитинга согласно (12). Данные для состава x = 0 приведены для температуры 650°С.
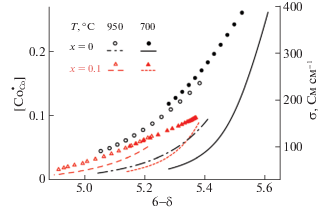
На рис. 4 приведены изотермические зависимости проводимости кобальтитов PrBa1 – xCoxO6 – δ от равновесного давления кислорода в газовой фазе. Уменьшение электропроводности при увеличении температуры и понижении парциального давления кислорода над оксидами обусловлено уменьшением концентрации дырочных носителей заряда, т.е. ионов Co4+. Сопоставление экспериментальных данных на рис. 3 и 4 позволяет получить функциональные зависимости ${\sigma } = f{\text{(}}\delta ,T{\text{)}}$, рис. 5. Следует отметить, что дефицит бария приводит к снижению общей электропроводности, что следует связать, прежде всего, с отмеченными выше большими значениями кислородной нестехиометрии в PrBa0.9Co2O6 – δ. Общий ход зависимостей проводимости коррелирует с изменениями концентрации носителей заряда, рассчитанными по уравнению (9). Интересно заметить, что в широком диапазоне содержаний кислорода концентрация электронных дырок в PrBa0.9Co2O6 – δ оказывается заметно выше, чем в PrBaCo2O6 – δ, а уровень электропроводности при этом существенно снижается. По-видимому, наличие вакансий бария приводит к сильным локальным искажениям кристаллической решетки двойного перовскита и, соответственно, изменению подвижностей носителей заряда. В частности, эффективный отрицательный заряд катионных вакансий должен увеличивать энергию барьера электронного перескока. Действительно, рассчитанная энергия активации кобальтита PrBa0.9Co2O5.25 составила 0.2 эВ, что в 5 раз выше по сравнению с таковой для PrBaCo2O5.25.
Рис. 4.
Изотермические зависимости электропроводности в PrBa1 – xCo2O6 – δ от равновесного давления кислорода в газовой фазе.

Рис. 5.
Экспериментальные зависимости общей электропроводности от содержания кислорода в PrBa1 – xCo2O6 – δ (символы) и рассчитанные концентрации носителей заряда $[{\text{Co}}_{{{\text{Co}}}}^{ \bullet }]$ при различных температурах (линии).
Таким образом, полученные данные показывают, что наличие дефицита бария в PrBa1 ‒ хCo2O6 – δ как позитивно, так и негативно влияет на свойства этих кобальтитов. Именно, существенное уменьшение коэффициента термического расширения при небольшой концентрации бариевых вакансий является благоприятным фактором для долговременной термомеханической устойчивости соответствующих электрохимических устройств. В то же время, дефицит бария приводит к некоторому снижению электропроводности, обусловленному уменьшением подвижности дырочных носителей. Тем не менее, величина электропроводности сохраняется на достаточно высоком уровне. Поэтому можно полагать, что введение дефектов в небольшой концентрации в подрешетку бария является эффективным приемом для оптимизации функциональных свойств слоевых кобальтитов.
Список литературы
Kim J.H., Manthiram A. // J. Electrochem. Soc. 2008. V. 155. № 4. P. B385.
Tarancon A., Burriel M., Santiso J. et al. // J. Mater. Chem. 2010. V. 20. P. 3799.
Kim J.H., Mogni L., Prado F. et al. // J. Electrochem. Soc. 2009. V. 156. № 12. P. B1376.
Luo L., Cheng H., Li G. et al. // J. Energy Chem. 2015. V. 24. № 1. P. 15.
Chen T., Zhao H., Xie Z. et al. // Ionics. 2015. V. 21. № 6. P. 1683.
Maignan A., Martin C., Pelloquin D. et al. // J. Solid State Chem. 1999. V. 142. P. 247.
Kim J.H., Manthiram A. // J. Mater. Chem. A. 2015. V. 3. P. 24195.
Pelosato R., Cordaro G., Stucchi D. et al. // J. Power Sources. 2015. V. 298. P. 46.
Aksenova T.V., Gavrilova L.Y., Yaremchenko A.A. et al. // Mater. Res. Bull. 2010. V. 45. № 9. P. 1288.
Volkova N.E., Gavrilova L.Y., Cherepanov V.A. et al. // J. Solid State Chem. 2013. V. 204. P. 219.
Yoo C.Y., Boukamp B.A., Bouwmeester H.J.M. // Solid State Ionics. 2014. V. 262. P. 668.
Ananyev M.V., Eremin V.A., Tsvetkov D.S. et al. // Solid State Ionics. 2017. V. 304. P. 96.
Suntsov A.Yu., Leonidov I.A., Patrakeev M.V. et al. // Solid State Chem. 2014. V. 213. P. 93.
Kröger F.A., Vink H.J. // Physics. 1956. V. 3. P. 307.
Suntsov A.Yu., Leonidov I.A., Patrakeev M.V. et al. // J. Solid State Chem. 2011. V. 184. P. 1951.
Zhang K, Ge L., Ran R., Shao Z. et al. // Acta Mater. 2008. V. 56. P. 4876.
Anderson P.S., Kirk C.A., Knudsen J. et al. // Solid State Sci. 2005. V. 7. № 10. P. 1149–1156.
Burley J.C., Mitchell J.F., Short S. et al. // J. Solid State Chem. 2003. V. 170. № 2. P. 339.
Suntsov A.Yu., Leonidov I.A., Patrakeev M.V. et al. // Solid State Ionics. 2015. V. 274. P. 17.
Hu Y., Hernandez O., Broux T. et al. // J. Mater. Chem. 2012. V. 22. P. 18744.
Seymour I.D., Tarancon A., Chroneos A. et al. // Solid State Ionics. 2012. V. 216. P. 41.
Chen Y.C., Yashima M., Peña-Martinez J. et al. // Chem. Mater. 2013. V. 25. № 13. P. 2638.
Cox-Galhotra R.A., Huq A., Hodges J.P. et al. // Solid State Ionics. 2013. V. 249–250. P. 34.
Pang Sh., Jiang X., Li X. et al. // J. Power Sourc. 2012. V. 204. P. 53.
Sun J., Liu X., Han F. et al. // Solid State Ionics. 2016. V. 288. P. 54.
Donazzi A., Pelosato R., Cordaro G. et al. // Electrochimica Acta. 2015. V. 182. P. 573.
Dong F., Ni M., Chen Y. et al. // J. Mater. Chem. A. 2014. V. 2. P. 20520.
Arnold M., Wang H., Feldhoff A. // J. Membr. Sci. 2007. V. 293 № 1. P. 44.
Rodriguez-Carvajal J. // Phys. B. Condens. Matter. 1993. V. 192. № 1. P. 55.
Patrakeev M.V., Leonidov I.A., Kozhevnikov V.L. // J. Solid State Electrochem. 2001. V. 15. № 5. P. 931.
Knizek K., Hejtmanek J., Jirak Z. et al. // Phys. Rev. B. 2009. V. 79. № 134103.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


