Журнал физической химии, 2019, T. 93, № 7, стр. 1103-1110
Физико-химические свойства оксида алюминия, синтезированного с использованием электрогенерированных реагентов
Е. В. Петрова a, *, А. Ф. Дресвянников a, А. И. Хайруллина a, Ж. В. Межевич a
a Казанский национальный исследовательский технологический университет
420015 Республика Татарстан, Казань, Россия
* E-mail: katrin-vv@mail.ru
Поступила в редакцию 26.09.2018
После доработки 26.10.2018
Принята к публикации 24.12.2018
Аннотация
Исследовано влияние условий синтеза (плотности анодного тока и состава электролита) на формирование в бездиафрагменном коаксиальном электролизере-реакторе высокодисперсных частиц прекурсоров оксида алюминия. Методами лазерной дифракции, рентгенофазового и термического анализов, а также электронной микроскопии изучены структура, состав, морфология и размеры высокодисперсных частиц, полученных электрохимическим методом. На основании экспериментальных данных предложены схемы фазовых превращений гидроксида и оксида алюминия в зависимости от способа получения.
Одни из наиболее активно используемых в технике и технологии неорганических материалов – оксиды p-, d-металлов, например, оксиды алюминия, железа, а также твердые растворы на основе оксидов алюминия и циркония, алюминия и железа и др. Они представляют большой практический интерес вследствие востребованных промышленностью и техникой физико-химических и эксплуатационных свойств [1, 2].
В настоящее время перспективны подходы, основанные на применении методов “мягкой химии”, реализуемых преимущественно в водных растворах при относительно низкой температуре. К таковым можно отнести традиционные методы химического осаждения, частично – гидро- или сольвотермальный синтез, а также методы, основанные на электрогенерировании реагентов с последующим их превращением в растворах в гидроксиды, оксигидроксиды или оксиды [3–8]. В случае последних количество исследований, посвященных установлению физико-химических закономерностей направленного электрохимического синтеза высокодисперсных прекурсоров оксидов с определенными размерами, морфологией, структурой и свойствами, невелико.
Цель работы – создание способов получения наноразмерного оксида алюминия на основе прекурсоров, сформированных в водных растворах с помощью электрогенерированных реагентов и исследование их физико-химических свойств.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Получение гидроксидов алюминия проводили путем химического осаждения из растворов солей различной концентрации, в качестве осадителя использовали концентрированные растворы гидроксидов натрия и аммония (табл. 1). Для синтеза прекурсоров оксида алюминия с помощью электрогенерированных реагентов использовали бездиафрагменный коаксиальный реактор-электролизер и объемом 0.5 дм3, где катодом служит сталь Х18Н10Т, а растворимым анодом – алюминий марки А5, причем площадь внешнего электрода (анода) на два и более порядков превосходит площадь внутреннего (катода) Sвнеш. эл $ \gg $ Sвнутр. эл. Электролиз проводили при плотностях анодного тока 20–240 А/м2; в качестве электролита использовали водные растворы хлорида натрия (NaCl “х.ч.”) с концентрацией 0.1–3.0 М.
Таблица 1.
Условия получения гидроксидов алюминия
| Способ получения | № | Условия получения | |
|---|---|---|---|
| Исходные реагенты | j, А/м2 | ||
| Химический | 1 | 1.0 М AlCl3 + 3.0 М NaOH | – |
| 2 | 0.2 М Al2(SO4)3 + 3.0 М NaOH | ||
| 3 | 0.5 М Al(NO3)3 + 3.0 М NaOH | ||
| 4 | 0.5 М Al(NO3)3 + 10.0 М NН4OH | ||
| С растворимым анодом | 5 | 0.1 М NaCl | 20 |
| 6 | 84 | ||
| 7 | 167 | ||
| 8 | 240 | ||
| 9 | 0.2 М NaCl | 84 | |
| 10 | 167 | ||
| 11 | 0.5 М NaCl | 84 | |
| 12 | 1.0 М NaCl | ||
| 13 | 2.0 М NaCl | ||
| 14 | 3.0 М NaCl | ||
| С нерастворимым анодом | 15 | 0.2 М Al2(SO4)3 + 3.0 М NaOH | 480 |
| 16 | 0.5 М Al(NO3)3 + 3.0 М NaOH | ||
При получении прекурсоров комбинированным способом использовали электролизер аналогичной геометрической конфигурации, с нерастворимым анодом ОРТА, катодом также служила сталь Х18Н10Т [9].
Для более полной кристаллизации осадок выдерживали в маточном растворе в течение 48 ч, после чего отфильтровывали, промывали дистиллированной водой и высушивали при температуре 363–383 К. Для формирования кристаллических оксидов, соответствующие гидроксиды прокаливали при разных температурных режимах. Элементный анализ синтезированных образцов проводили с помощью рентгенофлуоресцентного спектрометра “S1 TITAN”, Bruker.
Для установления закономерностей анодного поведения алюминия в исследуемых растворах использовали потенциодинамический (скорость развертки потенциала 16 мВ/с) и хронопотенциометрический методы. Поляризационные измерения проводили в трехэлектродной электролитической ячейке с разделенным катодным и анодным пространством при температуре 20 ± 1°С и естественной аэрации. В качестве вспомогательного электрода использовали платиновый электрод, в качестве электрода сравнения – насыщенный хлоридсеребряный электрод марки ЭЛВ-1 (Е = 0.222 В). Поляризацию рабочего электрода-алюминия и соответствующие измерения обеспечивали с помощью потенциостата P-301M, Ellins.
Исследование морфологии образцов гидроксида и оксида алюминия осуществляли методом сканирующей электронной микроскопии на высокоразрешающем автоэмиссионном электронном микроскопе Auriga™ CrossBeam® Zeiss. На исследуемые образцы с помощью установки Quorum Q150T ES предварительно наносили слой золото–палладий (60 : 40) толщиной 15 нм.
Для измерения ξ-потенциала проводимости и электрофоретической подвижности синтезированных дисперсных систем использовали прибор Zeta Sizer Nano ZS, Malvern. Для определения размеров частиц прекурсоров оксидов использовали лазерный анализатор Mastersizer 2000, Malvern.
Определение фазового состава синтезированных образцов проводили на рентгеновском дифрактометре D2 PHASER, Bruker с использованием CoKα-излучения. Дополнительный рентгенографический анализ проводили методом порошка на дифрактометре D8 ADVANCE, Bruker с использованием монохроматизированного CuKα-излучения в режиме шагового сканирования. Идентификацию кристаллических фаз осуществляли путем сопоставления полученных экспериментальных значений межплоскостных расстояний и относительных интенсивностей с эталонными, приведенными в международной картотеке PDF-2.
Исследование состояния поверхности анода после электролиза проводили с помощью электронного сканирующего микроскопа EVEX Mini SEM SX-3000. Исследуемые образцы представляли собой участки анода размером 15 × 15 мм, предварительно отмытые от остатков солей дистиллированной водой. На образце выбирали 2–3 участка с характерным рельефом, исследование которых проводили при условиях: вакуум 10–5 мм рт. ст., ускоряющее напряжение 20 кВ, электронное увеличение 500–1500 крат.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В работах [10–13] показано, что активация алюминия при анодной поляризации обусловлена образованием на поверхности металла промежуточных комплексов с частичным переносом заряда $[{\text{AlC}}{{{\text{l}}}_{\beta }}]_{{\text{s}}}^{{ - \beta + \sigma }}$, где σ – заряд иона металла (σ < < 3). Такой промежуточный комплекс рассматривается как низковалентная частица, которая при взаимодействии с компонентами раствора (водой или ионами гидроксония) окисляется, что объясняет явление отрицательного дифференц-эффекта (ОДЭ). Увеличение ОДЭ (скорости выделения водорода) при анодно-анионной активации обусловлено процессами на границе раздела металл/раствор в порах, а изменение потенциала электрода отражает совокупность электрохимических процессов на электроде, включая миграцию анионов хлора в капиллярно-пористом пространстве оксидно-гидроксидной пленки [10, 14–16].
Известно, что рост кривизны электрода приводит к уменьшению среднего размера (dср) и дисперсии распределения пузырьков газа. Кривизна поверхности электрода обусловливает неравномерность электрического поля и его высокую напряженность. Чем выше напряженность поля и величина заряда, тем больше пондеромоторные силы, отрывающие пузырек газа от поверхности электрода и меньше его размер [17]. Пузырьки водорода в водных растворах несут отрицательный заряд [18]. Отмечено, что при вертикальном расположении электрода максимальная конвекция наблюдается в условиях, когда архимедова сила и сила Лоренца направлены в одну сторону [19].
Таким образом, в используемом коаксиальном электролизере-реакторе дисперсия пузырьков газа и электролита движется вверх, и в силу непрерывности потока в закрытом пространстве образует вихрь. Это позволяет уменьшить толщину диффузионного слоя у поверхности твердых частиц в результате роста скорости жидкости и суспендировать сформировавшиеся частицы твердого вещества в объем более равномерно, а также равномерно распределить компоненты реакционной смеси в объеме жидкости за счет возникшей турбулентности. Поэтому интенсивное выделение водорода на центральном электроде катоде и его разогрев приводят к конвективному переносу продуктов реакций на этом электроде по торообразной траектории по направлению от центра к периферии. Это позволяет в течение короткого времени доставлять продукты катодной реакции, например, ионы ОН–, радикалы и т.п. вплоть до поверхности анода [20, 21].
За счет высокой скорости движения пузырьков газа, а, следовательно, и жидкости (до нескольких десятых метра в секунду) происходит быстрое смешивание реагентов. В то же время этот процесс препятствует взаимной адгезии частиц.
В ходе исследований установлено, что начальный период поляризации (диапазон значений потенциалов от –0.75 до –0.55 В) кинетика анодного процесса незначительно зависит от концентрации раствора. Так, скорость анодного растворения алюминия возрастает при увеличении концентрации раствора NaCl от 0.1 до 3.0 М, при этом значения плотности тока изменяются от 0.10 до 1.18 мкА/см2.
Следует отметить, что в образцах гидроксида алюминия, при получении которых использовали традиционное химическое осаждение, наблюдаются разнообразные по форме и размерам частицы субмикронного и микронного диапазонов (штриховые, удлиненно-пластинчатые, брусковидные и зернистые в незначительном количестве). Гидроксид алюминия, полученный химическим осаждением, проявляет наибольшую склонность к агрегированию частиц, которая снижается в условиях наложения электрического поля в реакторе-электролизере с нерастворимым анодом.
На морфологию поверхности частиц, полученных с помощью электрогенерированных реагентов, значительное влияние оказывают условия получения, например, плотность анодного тока (рис. 1) и состав электролита. В случае использования реактора с растворимым анодом быстрое взаимодействие генерируемых ионов металла с молекулами воды и ОН–-ионами при турбулентном режиме способствует формированию полиядерных гидроксокомплексов, которые образуют первичные частицы (зародыши), растущие до определенного предела. Образцы гидроксида алюминия, полученные с помощью электрогенерированных реагентов в реакторе с растворимым анодом при плотностях анодного тока 84 А/м2 и выше, представлены высокодисперсными частицами сферической или близкой к ней форм размером ~50 нм и агрегатами размером до 200 нм и более крупных (рис. 1). Снижение плотности анодного тока до 24 А/м2 приводит к образованию частиц чешуйчатой и брусковидной форм с поперечным размером ~150–200 нм и длиной более 1 мкм.
Рис. 1.
Микрофотографии образцов гидроксида алюминия, полученных с растворимым анодом при плотности тока 84 А/м2.

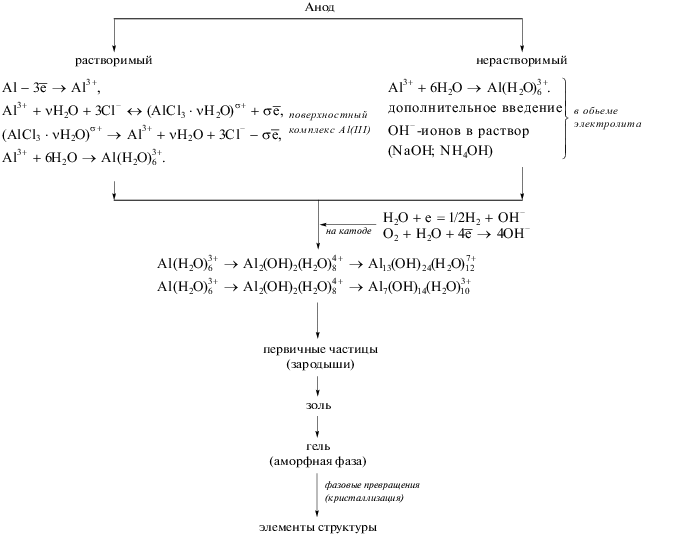
Избыток ОН–-ионов, поступающих от катода, постепенно приводит к гидроксилированию поверхности частиц, сообщая им отрицательный заряд, что отражается на величине ξ-потенциала (рис. 2). Это, а также отрицательный заряд пузырьков водорода приводит к отталкиванию частиц и препятствует их агрегированию.
Рис. 2.
Изменение ξ-потенциала системы Al(III)–OH—HOH при электрогенерировании реагентов в зависимости от времени и концентрации гидроксида алюминия (С(NaCl): 1 – 0.1, 2 – 0.5 моль/л).
Экспериментально установлено, что при росте концентрации электролита в 30 раз средний размер частиц (гидродинамический диаметр) увеличивается примерно в 2 раза. В случае зависимости среднего размера от плотности тока можно констатировать почти двукратный рост агрегатов частиц от 350 до 750 нм при более чем пятикратном повышении плотности анодного тока от 20 до 240 А/м2. Увеличение размеров частиц связано, в первую очередь, с интенсивностью роста агрегатов и повышением концентрации в единицу времени гидратированных полиионов Al (III). Другим фактором роста размеров частиц являются особенности механизма ионизации алюминия. В процессе анодного растворения при относительно высоких плотностях тока (>100 А/м2) имеет место межкристаллитное разрушение, сопровождающееся “выпадением” зерен металла из тела матрицы, с последующим их окислением в объеме раствора [22, 23]. Этим явлением можно объяснить высокий (>100%) выход по току процесса анодного растворения алюминия, который упомянут авторами ряда работ [22, 23].
Согласно данным [6, 24] существует более 15 полиморфных модификаций гидроксида и оксида алюминия. Термодинамически равновесной модификацией оксида является α-Al2O3. Остальные формы – либо кинетически заторможенные лабильные структурные состояния, либо метастабильные формы, трансформирующиеся по цепочке последовательных превращений в равновесную форму – α-Al2O3. Практически для всех метастабильных модификаций оксида алюминия химический состав не отвечает стехиометрии, поэтому граница понятий “полиморфная модификация” и “фаза переменного состава” по отношению к формам оксида алюминия размыты [6, 24].
Изменения координации окружения атомов алюминия можно рассматривать как химические реакции дегидроксилирования, при которых изменяется состав и координационное число. В ходе дегидратации при атмосферном давлении гидроксидов и оксидов алюминия разного строения наблюдается варьирование температуры превращения, что многие исследователи [6–8] связывают с аморфной скрытокристаллической или неопределенной структурой исходных и промежуточных в цепочке превращений соединений.
Результаты исследования фазового состава гидроксида алюминия, полученного различными способами, представлены на рис. 3 и в табл. 2.
Рис. 3.
Рентгеновские дифрактограммы, характерные для образцов гидроксидов алюминия, полученных различными способами: а – химическим, б – с нерастворимым анодом, в – с растворимым анодом.

Таблица 2.
Фазовый состав гидроксида алюминия, полученного с использованием электрогенерированных реагентов
| № | Условия получения | Al(OH)3 аморф с d |
γ-AlOOH с d |
α-Al(OH)3 с d |
α, % | |
|---|---|---|---|---|---|---|
| CNaCl, моль/л | j, А/м2 | |||||
| 1 | 0.1 | 20 | 11.5/4.0 | 10.0/3.6 | 79.0/130.0 | 88.5 |
| 2 | 84 | 9.0/4.0 | 22.0/4.0 | 69.0/56.0 | 81.0 | |
| 3 | 167 | 17.0/3.2 | 25.3/5.5 | 58.0/42.0 | 83.0 | |
| 4 | 240 | 26.5/3.6 | 73.5/5.6 | – | 73.5 | |
| 5 | 1.0 | 84 | 13.0/2.8 | 38.0/2.8 | 49.0/103.0 | 87.0 |
| 6 | 2.0 | 17.0/3.0 | 61.0/2.8 | 22.0/84.0 | 83.0 | |
| 7 | 3.0 | 18.0/3.2 | 82.0/3.0 | – | 82.0 | |
В процессах с нерастворимым анодом при термическом воздействии имеет место образование байерита, в то время как из продуктов, полученных с растворимым анодом, формируется бинарная смесь байерита и бемита. Метастабильный характер осадков подтверждается значительной долей аморфной фазы.
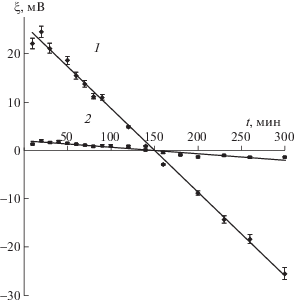
Установлено, что варьирование плотности тока и концентрации электролита в реакторе с растворимым анодом позволяет регулировать фазовый состав продукта. Так, образец, синтезированный при более высокой плотности тока (240 А/м2) и малой концентрации электролита (0.1 М), в большем количестве содержит байеритовую фазу. С увеличением концентрации электролита и плотности анодного тока наблюдается образование значительного количества бемита (рис. 4). Это обусловлено удалением химически связанной воды из структуры гидроксидной формы, что подтверждается результатами термического анализа.
Рис. 4.
Зависимости количественного содержания фаз бемита и байерита в образцах гидроксида алюминия, от плотности анодного тока j (а) и концентрации электролита СNaCl (б).
Фазовые превращения образцов кристаллического гидроксида при их нагреве определяются особенностями двух стадий: удалением гидроксильных групп и переходом структуры гидроксида в кристаллическую структуру оксида. При скоростях нагрева ~10 К/мин эти стадии совмещены, поэтому на кривых нагревания ДТА синтезированных образцов гидроксида наблюдаются от одного до трех-четырех эндотермических эффектов, сопровождающихся потерей массы. Первый эндотермический эффект в области температур 298–466 К обусловлен удалением физически связанной воды и дегидратацией байерита. Второй эндотермический максимум при 550 К связан с дегидратацией байерита и формированием двух фаз: бемита и низкотемпературного оксида алюминия (η-Al2O3). Высокотемпературный эндоэффект в области 584–973 К характеризует удаление воды из структуры бемита и образование γ-Al2O3.
Установлено, что при плотности тока 167 А/м2 с ростом концентрации NaCl содержание воды в образце уменьшается в 2 раза. Однако при примерно двукратном понижении плотности тока содержание воды изменяется незначительно. Кроме того, при старении осадка в маточном растворе обнаружен эффект незначительного снижения размеров частиц, что обусловлено особенностями процессов кристаллизации, протекающих в этом растворе. При этом изменения отражаются на морфологии частиц, но не влияют на фазовый состав продукта.
Согласно проведенным исследованиям, фазовые превращения гидроксидов и оксидов алюминия в зависимости от способа получения можно представить в виде условных схем:
– химическое осаждение с NaOH
– с нерастворимым анодом
– с растворимым анодом
На основании результатов экспериментальных исследований (на примере соединений алюминия (III)) и имеющихся литературных данных предложена схема превращений ионных форм и перехода их в гетерогенные фазы для случаев электрогенерирования реагентов с применением растворимого и нерастворимого анодов:
Общим здесь является образование полиядерных аквагидроксокомплексов – предшественников первичных частиц прекурсоров оксидов алюминия.
С течением катодных и анодных процессов и в условиях специфической гидродинамики потока электролита в реакторе-электролизере имеют место процессы генерирования ОН– и некоторых других ионов, а также ионизация металла растворимого электрода с последующим образованием поверхностного комплекса и переходом в раствор в виде гидратированных ионов. В результате взаимодействия ОН–-ионов и гидратированных ионов металлов формируются аквагидроксокомплексы, а с течением процесса и полиядерные комплексы, которые далее участвуют случайным образом в процессах поликонденсации.
Рост полимерного комплекса в конечном итоге приводит к образованию первичных частиц, формирующих аморфные структуры, претерпевающие кристаллизацию. При этом присутствие в осадке связанной и адсорбированной воды, как правило, уменьшается, захваченные в процессе формирования ПЧ анионы переходят в раствор, формируются и более крупные частицы за счет электростатического и других взаимодействий.
Наличие поверхностного заряда обусловливает транспорт первичных частиц и раствора в электрическом поле. Электролиз обеспечивает высокую скорость движениях ионов, возникновение нескомпенсированных зарядов на границе раздела фаз и т.д. Интенсификация процесса возможна также за счет разбивания агрегатов частиц гидроксидов посредством кавитации и микроструй жидкости, а также за счет формирования зародышей критического размера в пузырьках. При старении свежеполученного осадка в воде или маточном растворе, наряду с изменениями его химического состава в результате гидролиза, дегидратации и поликонденсации, имеет место кристаллизация.
Тип применяемого метода и состав раствора электролита влияют на фазовый состав продуктов и морфологию, а также на размеры частиц. Так, например, в процессах с нерастворимым анодом образуется гидроксид алюминия в виде монофазного продукта, чего не наблюдается в случае традиционного осаждения.
Установлены физико-химические закономерности синтеза прекурсоров оксида алюминия в водной среде путем осаждения в коаксиальном бездиафрагменном реакторе-электролизере с существенно различающимися площадями электродов и применением нерастворимых анодов типа ОРТА и растворимого алюминиевого анода.
Показано, что в случае получения оксида алюминия при воздействии внешнего электрического поля с использованием растворимого и нерастворимого анодов преимущественно формируются сфероподобные частицы с тонкозернистой структурой и размером 20–60 нм.
Таким образом, исследуемые образцы гидроксидов алюминия, полученные в реакторе – электролизере с растворимым анодом – представляют собой бифазную систему; изменение параметров процесса (плотность тока, концентрацию раствора электролита) позволяет менять соотношение фаз бемита и байерита. Методами термического и рентгеновского структурно-фазового анализов установлены закономерности фазовых превращений предшественников оксидов алюминия, синтезированных предложенными способами, как в процессе старения осадков, так и в условиях высокотемпературного воздействия. На основании экспериментальных данных предложена примерная схема формирования оксида алюминия через цепочку превращений интермедиатов.
Работа выполнена на оборудовании ЦКП “Наноматериалы и нанотехнологии” КНИТУ в рамках государственного задания № 4.5784.2017/8.9 на 2017–2019 гг.
Список литературы
lvarez-Clemares I., Borrell A., Agouram S. et al. // Scripta Materialia. 2013. V. 68. № 8. P. 603.
Бардаханов С.П., Ким А.В., Лысенко В.И., Номоев А.В. // Неорган. материалы. 2009. Т. 45. № 3. С. 379.
Сычев М.М. // Журн. прикл. химии. 1990. Т. 63. № 3. С. 489.
Альмяшева О.В., Корыткова А.В., Маслов Э.Н., Гусаров В.В. // Неорганические материалы. 2005. Т. 41. № 5. С. 1–8.
Коробочкин В.В., Косинцев В.И., Быстрицкий Л.Д., Ковалевский Е.П. // Там же. 2002. Т. 38. № 9. С. 1087.
Ming G.M., Ying J.Z., Zi L.X. // Materials Letters. 2007. V. 61. № 8–9. P. 1812.
Dresvyannikov A.F., Grigoryeva I.O., Khayrullina L.R., Petrova E.V. // J. Adv. Ceramics. 2016. T. 5. № 1. C. 70.
Петрова Е.В., Дресвянников А.Ф., Ахмади Дарякенари М., Хайруллина А.И. // Журн. физ. химии. 2016. Т. 90. № 5. С. 756.
Петрова Е.В., Дресвянников А.Ф. // Журн. прикл. химии. 2013. Т. 86. № 9. С. 1354.
Попов Ю.А. // Успехи химии. 2005. Т. 74. № 5. С. 435.
Curioni M., Scenini F. // Electrochimica Acta. 2015. V. 180. P. 712.
Alwitt R.S. // Oxides and Oxide Films. 1976. V. 4. P. 169.
Thiruchitrambalam M., Palkar V.R., Gopinathan V. // Materials Letters. 2004. V. 58. P. 3063.
Колотыркин Я.М. // Успехи химии. 1962. Т. 3. С. 322.
Изотова С.Г. // Журн. прикл. химии. 1985. № 9. С. 2115.
Зарцын И.Д., Самарцев В.М., Маршаков И.К. // Физикохимия поверхности и защита материалов. 1994. Т. 30. № 1. С. 45.
Кабанов Б.Н., Фрумкин А.Н. // Журн. физ. химии. 1933. Т. 4. № 5. С. 538.
Матов Б.М. // Электрохимия. 1973. Т. 9. № 10. С. 1495–1498.
Koza J.A., Uhlemann M., Gebert A., Schultz L. // Electrochem. Comm. 2008. V. 10. № 9. P. 1330.
Дресвянников А.Ф., Дресвянников Ф.Н., Ситников С.Ю. Электрохимическая очистка воды. Казань: Изд-во КНИТУ, 2004. 207 с.
Ritchie W. // Phil Trans Roy Soc Lond. 1832. V. 122. P. 279.
Лысенко А.П., Середкин Ю.Г. // Технология металлов. 2009. № 12. С. 7.
Tomcsányi L., Varga K., Bartik I. et al. // Electrochimica Acta. 1989. V. 34. № 6. P. 855.
Иванова А.С., Литвак Г.С., Крюкова Г.Н. и др. // Кинетика и катализ. 2000. Т. 41. № 1. С. 137.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии