Журнал физической химии, 2019, T. 93, № 7, стр. 1082-1088
Особенности гидратации уплотненного метилкремнезема и созданного на его основе композита с янтарной кислотой
Т. В. Крупская a, *, Н. В. Елагина a, Н. В. Борисенко a, В. В. Туров a
a Национальная академия наук Украины, Институт химии поверхности им. А.А. Чуйко
Киев, Украина
* E-mail: krupska@ukr.net
Поступила в редакцию 25.09.2018
После доработки 05.11.2018
Принята к публикации 15.11.2018
Аннотация
Разработан способ перевода гидрофобного нанокремнезема, исходного и с иммобилизованной на его поверхности янтарной кислотой во влажное состояние, при котором с материалом связывается количество воды, сопоставимое с массой самого кремнезема, а насыпная плотность составляет 0.7–1 г/см3. Полученный композит изучен методами низкотемпературной 1Н ЯМР-спектроскопии, рентгенофазового анализа и термогравиметрии. Показано, что связывание воды гидрофобным кремнеземом более эффективно, чем его композитом с гидрофильной янтарной кислотой. Сделан вывод, что это обусловлено формированием под влиянием механических нагрузок в межчастичных зазорах кремнезема небольших (менее 10 нм) кластеров воды, взаимодействующих с гидрофобной поверхностью путем ван-дер-ваальсових взаимодействий.
Янтарная кислота (СООН(СН2)2СООН) – одна из простейших дикарбоновых кислот. Впервые она была выделена из природного янтаря, хотя в настоящее время синтезируется преимущественно биотехнологическими методами [1–3] и обладает многими полезными свойствами, что обусловливает ее использование в ряде медицинских и косметических препаратов. Янтарная кислота (ЯК) хорошо растворима в воде и некоторых полярных органических растворителях, но практически не растворима в хлороформе, гексане и других неполярных или слабополярных жидкостях. В настоящее время на рынке присутствует несколько типов препаратов, созданных на основе янтарной кислоты и гидрофильных адсорбентов, таких как кремнеземы или глинистые минералы, применяемые для лечения алкоголизма, остеопороза и других заболеваний [4, 5]. Между тем, в ряде случаев, особенно в косметологии, востребованными могут стать композитные системы, созданные с использованием янтарной кислоты, иммобилизованной на поверхности гидрофобного высокодисперсного метилкремнезема (МК), в межчастичные зазоры которого кроме янтарной кислоты включено сопоставимое с массой адсорбента количество воды. Такие композиты могут обладать уникальными свойствами, поскольку в равной степени будут смачиваться как водой, так и слабополярной органикой, входящей в состав значительной части косметологических средств. Можно надеяться, что таким путем будут созданы бифильные композитные системы без использования поверхностно-активных веществ (ПАВ).
Вода относится к сильно структурированным жидкостям, ее уникальные свойства активно изучаются уже на протяжении более 100 лет [6–9]. Вода в межчастичных зазорах МК может взаимодействовать с его поверхностью лишь по механизмам гидрофобной гидратации [10–15] в основе которой лежат ван-дер-ваальсовы взаимодействия, поскольку на поверхности практически отсутствуют группы, с которыми молекулы воды могут образовывать водородносвязанные комплексы. Механизмы ван-дер-ваальсовых взаимодействий подробно описаны в монографиях [13, 14], в соответствии с которыми, в разных системах могут реализовываться дисперсионные, индукционные или ориентационные взаимодействия. Благодаря склонности молекул воды к формированию пространственно упорядоченной сетки водородных связей, даже в гидрофобном окружении она может находиться в кластеризованном состоянии [15–17], которое зависит от морфологии межчастичных зазоров метилкремнезема. Однако, если на поверхности МК иммобилизовать некоторое количество ЯК, содержащей гидрофильные центры в виде карбонильных групп, последняя может служить интермедиатом для взаимодействия поверхности метилкремнезема с водой.
Состояние воды в композите МК/ЯК может быть изучено с использованием метода низкотемпературной 1Н ЯМР-спектроскопии [18–21]. При этом параметром, ответственным за строение сетки водородных связей воды является химический сдвиг (δН). Для неассоциированной воды характерна величина химического сдвига δН = 0–2 м.д., в то время как для тетракоординированной воды в гексагональном льду δН = 7 м.д. [22]. Если же молекулы воды на поверхности формируют прочные водородносвязанные комплексы с кислотными (карбоксильными) группами, можно ожидать увеличение химического сдвига вплоть до δН = 20 м.д. в комплексах с симметричными водородными связями [23].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве высокодисперной гидрофобной компоненты использовали метилкремнезем АМ1-300 (г. Калуш), который производят путем замещения поверхностных гидроксильных групп гидрофильного кремнезема А-300 на метильные в результате химического модифицирования [24]. Полученный продукт гидрофобный и способен адсорбировать из воздуха лишь небольшие (до 5%) количества воды. Композитную систему МК/ЯК создавали путем длительного совместного перетирания кристаллической ЯК с МК. При этом ЯК равномерно размещается по поверхности частиц метилкремнезема, в значительной степени аморфизуется и создает на поверхности гидрофобного материала центры адсорбции воды. Композит МК/ЯК, как и чистый МК, продолжает сохранять гидрофобные свойства. Он не смешивается с водой. Добавление к нему воды в равных весовых количествах создает гетерогенную систему, в которой вода находится в виде отдельной фазы в порошкообразной среде МК/ЯК. Однако, если такой композит (или чистый МК (рис. 1а)) подвергнуть высоким механическим нагрузкам в фарфоровой ступке (рис. 1б), то через 20–30 мин интенсивного перетирания система становится более гомогенной. Она равномерно распределяется по стенкам ступки (рис. 1в). Ее плотность возрастает до 1000 мг/см3 и после удаления композита со стенок ступки приобретает вид влажного порошка, что свидетельствует об удалении из межчастичных зазоров воздуха и замене его на воду. Такие уплотненные материалы смачиваются как водой, так и неполярными жидкостями.
Рис. 1.
Фотографии изменения внешнего вида метилкремнезема (или композита МК/ЯК) при высоких механических нагрузках.

Спектры 1Н ЯМР снимали на ЯМР-спектрометре высокого разрешения (Varian “Mercury”) с рабочей частотой 400 МГц. Использовали восемь 60° зондирующих импульсов, длительностью 1 мкс при ширине полосы 20 кГц. Температуру в датчике регулировали термоприставкой Bruker VT-1000 с точностью ±1 К. Измерения проводили в 5 мм ампулах. В качестве гидрофобной дисперсионной среды использовали дейтерохлороформ, где содержание дейтерия составляло 99.9%. Для определения связывания воды в композитах измеряли температурные зависимости интенсивности сигнала незамерзающей воды в процессе нагревания образцов от 200–210 до 280–285 К. При этом интенсивность сигналов определяли путем интегрирования спектров с использованием процедуры корректировки нулевой линии. Точность интегрирования была не ниже ±10%. Поскольку количество воды в образцах было постоянным и равным 1000 мг/г, то по интенсивностям сигналов рассчитывали зависимости концентрации незамерзающей воды (Сuw) от температуры, а на их основе с использованием эмпирического соотношения, полученного на основе температурного изменения свободной энергии Гиббса для льда (ΔG = 0.036(T – 273)) [25] рассчитывали зависимость ΔG(Сuw), интегрирование которой во всем диапазоне изменения Сuw позволяло рассчитать межфазную энергию воды, определяющую суммарное понижение свободной энергии воды, обусловленное присутствием границ раздела фаз [18–21]:
(1)
${{\gamma }_{S}} = - K\int\limits_0^{C_{{{\text{uw}}}}^{{\max }}} {\Delta G({{C}_{{{\text{uw}}}}})d{{C}_{{{\text{uw}}}}}} ,$Распределения по радиусам кластеров адсорбированной воды рассчитывали в соответствии с уравнением Гиббса–Томсона:
(2)
$\Delta {{T}_{{\text{m}}}} = {{T}_{{\text{m}}}}(R) - {{T}_{{{\text{m}},\infty }}} = \frac{{2{{\sigma }_{{{\text{sl}}}}}{{T}_{{{\text{m}},\infty }}}}}{{\Delta {{H}_{{\text{f}}}}\rho R}},$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
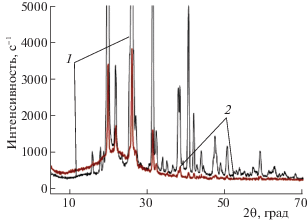
Результаты рентгенофазового анализа кристаллической янтарной кислоты и ЯК, входящей в состав композитной системы с МК и водой приведены на рис. 2. Как видно из рисунка, в результате механохимической обработки рефлексы, относящиеся к кристаллам кислоты, существенно уменьшаются, и в спектрах регистрируется широкий сигнал, относящийся к аморфным метилкремнезему и ЯК, иммобилизованной на его поверхности.
Рис. 2.
Рентгенограмы исходного порошка янтарной кислоты (1) и кислоты, иммобилизованной на поверхности метилкремнезема (2).
Снятые при разных температурах спектры 1Н ЯМР воды в композитных системах МК/Н2О (1/1) и МК/ЯК/Н2О (1/0.3/1.3), приведены на рис. 3а, б и рис. 3в–е соответственно. Измерения связывания воды с поверхностью МК (рис. 3а, б) проводили в среде метана, который использовали в качестве стандарта химического сдвига (δН(СН4) = 0 м.д.). Для композита МК/ЯК/Н2О использовали воздушную среду (рис. 3в, г) и слабополярный органический растворитель – дейтерохлороформ (рис. 3д, е). Дейтерированный аналог хлороформа использовали для предотвращения появления в спектрах интенсивного сигнала жидкого CHCl3.
Рис. 3.
Снятые при разных температурах спектры 1Н ЯМР воды, адсорбированной в межчастичных зазорах метилкремнезема (а, б) и композита МК/ЯК/Н2О (1/0.3/1.3) (в–е) в воздушной среде (в, г) и среде дейтерохлороформа (д, е).
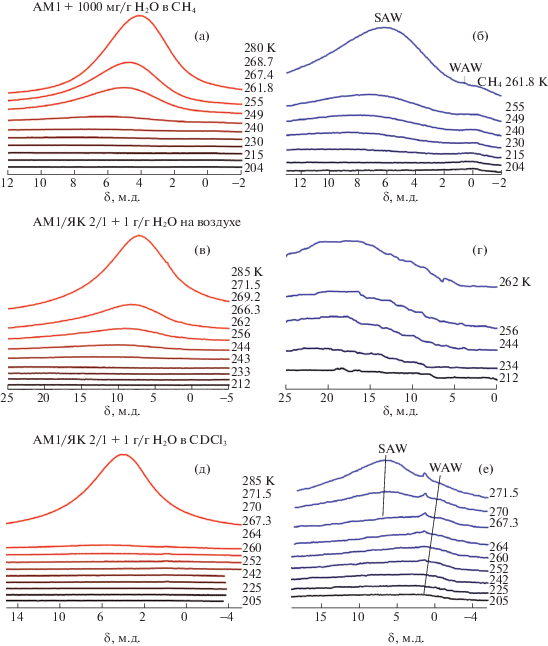
Вода, локализованная в межчастичных зазорах метилкремнезема, наблюдается в широком диапазоне температур при T < 273 K, что свидетельствует о сильном влиянии гидрофобной поверхности на изменение свободной энергии воды в процессе ее внедрения в межчастичные зазоры. Это влияние может осуществляться двумя основными путями – переход воды в наноразмерное, кластеризованное состояние, в котором, по сравнению с объемной водой, резко возрастает поверхность границы раздела фаз МК/Н2О и изменение строения (частичное разрушение) сетки водородных связей воды при ее диспергировании в кремнеземной матрице.
Химический сдвиг воды, адсорбированной в гидрофобном окружении частиц МК увеличивается от δН = 4 м.д. при Т = 280 К до δН = 7 м.д. при Т = 215 К. Отсюда следует, что практически вся адсорбированная вода находится в сильноассоциированном состоянии (SAW), причем ассоциированность воды лишь немного меньше, чем для жидкой воды [18, 19]. Вблизи δН = 0 м.д. в спектрах фиксируется слабый сигнал адсорбированного метана, а при δН = 1.5 м.д. – сигнал слабоассоциированной воды (WAW). Следует отметить, что ввиду близости химических сдвигов WAW и метана последний может маскировать присутствие WAW при низких температурах, когда можно ожидать максимальную величину адсорбции метана.
Для композитной системы МК/ЯК/Н2О в воздушной среде (рис. 3в, г) химический сдвиг адсорбированной воды смещается в область больших величин химического сдвига. При Т = 280 К химический сдвиг воды δН = 7 м.д., а при уменьшении температуры он возрастает почти до δН = = 20 м.д. (рис. 4г). Вероятно, это обусловлено преимущественной адсорбцией воды на поверхности метилкремнезема, покрытой слоем иммобилизованной на нем янтарной кислоты. Благодаря наличию в молекулах ЯК карбоксильных групп они могут выступать центрами связывания с кластерами адсорбированной на поверхности воды. Столь большая величина химического сдвига в замороженных системах свидетельствует о возможности образования с молекулами кислоты очень прочных (близких к симметричным) водородных связей [23]. Следует отметить, что отсутствие в спектрах сигналов метиленовых групп ЯК можно интерпретировать как существование ее исключительно в твердом состоянии и слабую растворимость в кластеризованной воде.
Рис. 4.
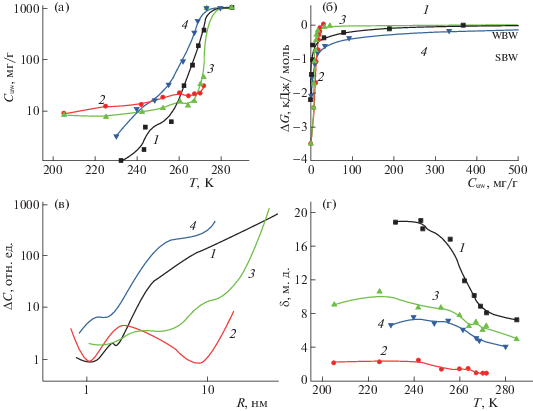
Температурные зависимости концентрации незамерзающей воды (а), изменения свободной энергии Гиббса от концентрации незамерзающей воды (б), распределения по радиусам кластеров адсорбированной воды (в) и температурные зависимости химического сдвига разных форм адсорбированной воды (г); а, б, в, г: 1 – АМ1/ЯК на воздухе, 2 – АМ1/ЯК в CDCl3, WAW, 3 – АМ1/ЯК в CDCl3, SAW; 4 – AM1 в CH4.
В среде CDCl3 вид спектров композитной системы МК/ЯК/Н2О меняется (рис. 3д, е). Уменьшается величина химического сдвига адсорбированной воды, основная ее часть замерзает при относительно более высоких температурах, а при низких температурах в спектрах фиксируются, по крайней мере, два сигнала слабоассоциированной воды с δН = 1–2 м.д. При T < 267 K сигнал WAW становится доминирующим, поскольку практически вся SAW замерзает.
На рис. 4 приведены температурные зависимости концентрации незамерзающей воды (Cuw(T)), построенные на основе изменения интенсивности сигнала воды в процессе нагревания образца, предварительно охлажденного до Т = 200–210 К (рис. 4а), изменения свободной энергии Гиббса (ΔG) от концентрации незамерзающей воды (рис. 4б), распределения по радиусам кластеров адсорбированной воды, рассчитанные в соответствии с формулой (3) (рис. 4в) и температурные зависимости химического сдвига разных форм адсорбированной воды (рис. 4г). Термодинамические параметры слоев связанной воды – концентрации сильно- и слабосвязанной воды ($C_{{{\text{uw}}}}^{S}$ и $C_{{{\text{uw}}}}^{W}$ соответственно), максимальное понижение свободной энергии в слое сильносвязанной воды (ΔGS) и величина межфазной энергии (γS) для гидратированных МК и композитной системы МК/ЯК/Н2О приведены в табл. 1. При этом слабосвязанной считали ту часть незамерзающей воды, которая замерзает при T > 265 K (ΔG < –0.5 кДж/моль).
Таблица 1.
Характеристики слоев незамерзающей воды в уплотненных образцах МК и композите МК/ЯК, в различных средах
| Образец | Среда | $C_{{{\text{uw}}}}^{S}$, мг/г | $C_{{{\text{uw}}}}^{W}$, мг/г | ΔGS, кДж/моль | ΔγS, Дж/г |
|---|---|---|---|---|---|
| МК 0.7 г/см3 + 1.0 г/г H2O |
СН4 | 80 | 920 | –2.2 | 11.7 |
| МК/ЯК 0.6 г/см3 + 1.0 г/г H2O |
Воздух | 20 | 980 | –2.2 | 4.8 |
| CDCl3 WAW | 18 | 5 | –3.5 | 2.5 | |
| CDCl3 SAW | 12 | 965 | –3.5 | 3.2 |
В соответствии с данными табл. 1, межфазная энергия контролируется преимущественно концентрацией сильносвязанной воды. Максимальная величина межфазной энергии (γS = 11.7 Дж/г) регистрируется для гидратированного МК, несмотря на то, что его поверхность практически не содержит центров гидрофильного связывания воды. Вода, адсорбированная в межчастичных зазорах этого образца, (рис. 4в) находится в виде относительно малых кластеров, максимальный радиус которых составляет 10 нм. Для композитной системы МК/ЯК/Н2О в воздушной среде межфазная энергия в водной среде составляет γS = = 4.8 Дж/г, что в 2.5 раза меньше, чем для полностью гидрофобного материала. Соответственно вода преимущественно входит в состав кластеров относительно большего радиуса (рис. 4в). Замена воздушной среды хлороформом приводит к существенному снижению межфазной энергии сильноассоциированной воды (до γS = 3.2 Дж/г). Однако при этом возрастает вклад в межфазную энергию от слабоассоциированной воды, количество которой не превышает 2% от общего количества незамерзающей воды (рис. 4а).
Химические сдвиги адсорбированной воды в среде CDCl3, (рис. 3г) становятся существенно меньше, чем в воздушной среде. Это может быть связано с уменьшением возможности для адсорбированной на поверхности воды формировать прочные водородные связи с карбоксильными группами кислоты, которая находится на поверхности МК в твердом состоянии. Вероятно, хлороформ, проникая в зазоры между кластерами адсорбированной воды и твердой, частично аморфизованной кислоты, (рис. 2) уменьшает связывание воды с поверхностью (величина γS падает), а это, в свою очередь, приводит к уменьшению вероятности образования водородных связей вода–кислота.
На рис. 5 приведены термограммы композитной системы МК/ЯК/Н2О и кристаллической янтарной кислоты. На ней хорошо различимы два эндотермических пика, связанных с десорбцией воды (левый пик на кривой ДТГ) и ЯК, которая удаляется с поверхности путем испарения, происходящего при температурах ниже температуры воспламенения (отсутствуют экзотермические пики горения ЯК). Максимум потери массы из-за десорбции воды отвечает температуре Т = 150°С. Десорбция кислоты происходит при 180–250°С. Раздельные области испарения воды и ЯК свидетельствуют о том, что они находятся на поверхности МК в виде индивидуальных соединений, а не образуют водный раствор. Это также подтверждается отсутствием в спектрах ЯМР метильных групп ЯК (рис. 3).
Рис. 5.
Термограммы кристаллической янтарной кислоты (а) и кислоты, иммобилизованной на поверхности метилкремнезема (б).
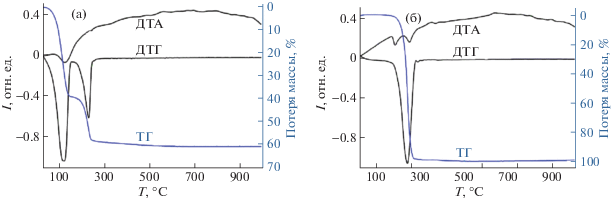
Максимум температуры испарения адсорбированной воды существенно выше, чем можно было ожидать для объемной (некластеризованной) воды. Это также подтверждает переход воды при уплотнении МК в наноразмерное состояние, которое характеризуется повышением температуры кипения воды.
Таким образом, разработан способ перевода гидрофобного нанокремнезема, исходного и с иммобилизованной на его поверхности янтарной кислотой во влажное состояние, при котором с материалом связывается количество воды, сопоставимое с массой самого кремнезема, а насыпная плотность составляет 0.7–1 г/см3. Адсорбированная гидрофобным кремнеземом вода имеет максимальную межфазную энергию и находится в кластеризованном состоянии, причем радиус кластеров не превышает 10 нм. Вероятно, рост величины γS в процессе создания композита МК/Н2О под воздействием высоких механических нагрузок обусловлен переводом воды из объемного в кластеризованное состояние. При одинаковом содержании воды, межфазная энергия МК оказалась в 2.5 раза выше, чем для созданного на его основе композита МК/ЯК/Н2О, что обусловлено формированием на поверхности МК с иммобилизированной ЯК кластеров воды относительно большего размера, т.е. энергия гидрофобной гидратация МК оказывается выше, чем при иммобилизации на его поверхности ЯК.
Данная работа проведена при грантовой поддержке Государственного фонда фундаментальных исследований по конкурсному проекту Ф76/21.
Список литературы
Fumagalli C. // Kirk-Othmer Encyclopedia of Chemical Technology, 4th ed. Ed.by J.I. Kroschwitz, M. Howe-Grant. New York, NY, USA: Wiley, 1997. V. 22. P. 1074.
Bertuzzi A., Gandolfi A., Salinari S.et al. //Eng. Med. Biol. 1994. V. 13. P. 472.
Chen S.W., Kong W.X., Min L., Li J.F. // Life Sciences. 2003. V. 73. P. 3257.
Narayan S., Devi R.S., Jainu M. et al. // Indian J. Pharmacol. 2004. V. 36. P. 34.
Vicent D., Villanueva-Penacarrillo M., Malaisse-Lagae F. et al. // Arch. Int. Pharmacodyn. Ther. 1994. V. 327. № 2. P. 246.
Эйзенберг Д., Кауцман В. Структура и свойства воды. Л.: Гидрометеоиздат, 1975. 280 с.
Зацепина Г.Н. Свойства и структура воды. М.: Изд-во МГУ, 1974. 168 с.
Понятковский Е.Г., Синицын В.В., Поздняков Т.А. Вторая критическая точка и низкотемпературные аномалии физических свойств воды // Письма в ЖЭТФ. 1994. Т. 60. № 5. С. 352.
Yaminsky V.V., Vogler E.A. // Curr. Opin. Colloid Interface Science. 2001. V. 6. P. 342.
Chandler D. // Nature. 2005. V. 437. P. 640.
Mitra R.K., Verma P.K., Pal S.K. // J. Phys. Chem. B.2009. V. 113. P. 4744.
Imai T., Hirata F. // J. Chem. Phys. 2005. V. 122. P. 094509. https://doi.org/https://doi.org/10.1063/1.1854626
Дерягин Б.В., Чураев Н.Н., Муллер В.В. Поверхностные силы. М.: Наука. 1985. 398 с.
Тиноко И., Зауер К., Венг Дж. // Физическая химия. Принципы и применение в биологических науках. Техносфера. М.: 2005. 774 с.
Wiggins P.M., MacClement B.A.E. // Internat. Rev. Cytol. 1987. V. 108. P. 249.
Dore J. // Chem. Phys. 2000. V. 258. P. 327.
Chaplin M.F. // Biophys. Chem. 1999. V. 83. P. 211.
Гунько В.М., Туров В.В., Горбик П.П. Вода на межфазной границе. К.: Наукова думка, 2009. 694 с.
Gun'ko V.M., Turov V.V. Nuclear Magnetic Resonance Studies of Interfacial Phenomena. New York: Taylor & Francis, 2013. 1006 p.
Gun’ko V.M., Turov V.V., Bogatyrev V.M. et al. // Adv. Colloid. Interf. Sci. 2005. V. 118. № 1–3. P. 125.
Туров В.В., Гунько В.М. Кластеризованная вода и пути ее использования. К.: Наукова думка, 2011. 316 с.
Kinney D.R., Chaung I.-S., Maciel G.E. // J. Am. Chem.Soc. 1993. V. 115. P. 6786.
Грагеров И.П., Погорелый В.К., Франчук И.Ф. Водородная связь и быстрый протонный обмен. К.: Наукова думка, 1978. 216 с.
Тертых В.А., Белякова Л.А. Химические реакции с участием поверхности кремнезема. К.: Наукова думка, 1991. 236 с.
Термодинамические свойства индивидуальных веществ / Под ред. В.П. Глушкова. М.: Наука, 1978. 495 с.
Petrov O.V., Furo I. // Progr. NMR. 2009. V. 54. P. 97.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


