Журнал физической химии, 2019, T. 93, № 8, стр. 1243-1248
Адсорбционные и мембранотропные свойства коллоидных систем на основе катионных амфифилов: влияние структуры головной группы
Д. А. Кузнецова a, *, Д. Р. Габдрахманов a, С. С. Лукашенко a, Л. Я. Захарова a
a Российская академия наук, Казанский научный центр, Институт органической и физической химии
им. А.Е. Арбузова
Казань, Россия
* E-mail: Dashyna111@mail.ru
Поступила в редакцию 02.10.2018
После доработки 02.10.2018
Принята к публикации 11.11.2018
Аннотация
Оценены агрегационные характеристики и рассчитаны адсорбционные параметры катионных амфифилов с гексадецильным радикалом и варьируемой головной группой в водных растворах. Показано, что переход от аммонийной головной группы к имидазолиевой делает процессы мицеллообразования и адсорбции более термодинамически выгодными. Выявлена ключевая роль структуры головной группы в способности к встраиванию молекул поверхностно-активных веществ в липидный бислой. Продемонстрирована способность некоторых амфифилов к увеличению мембранотропной способности лекарственных препаратов – метронидазола и левомицетина.
Важнейшей характеристикой поверхностно-активных веществ (ПАВ), определяющей их практически полезные свойства, является агрегирующая способность, которую количественно характеризует величина критической концентрации мицеллообразования (ККМ). В настоящее время усилия современных исследователей в этой области сосредоточены на поиске путей снижения порогов агрегации систем (снижения величин ККМ), что позволит значительно снизить их действующие концентрации и минимизировать затраты на производство. Существует множество подходов решения данной проблемы. Так, один из способов снижения ККМ – увеличение гидрофобности молекулы за счет увеличения длины углеводородного радикала [1]. К снижению порогов агрегации также приводит введение в структуру эфирного фрагмента [2, 3], замена галогенных противоионов на ароматические [4] и переход от аммонийных головных групп на циклические [5]. Однако подобный эффект наблюдается не для всех ПАВ с циклической головной группой [6], в некоторых случаях может происходить небольшое увеличение порогов агрегации [7]. Кроме того, фундаментальную и практическую значимость представляют термодинамические адсорбционные параметры, количественно характеризующие поведение ПАВ на границе раздела фаз вода–воздух и позволяющие оценить потенциал их использования. Как правило, процессы адсорбции из водных растворов термодинамически выгодны для большинства ПАВ [8, 9], и выгодность данных процессов возрастает с увеличением гидрофобности молекулы [10].
Имея амфифильную природу, ПАВ находят широкое применение в медицине, генной инженерии и биохимии. На основе катионных ПАВ создаются эффективные наноконтейнеры [11] и микроэмульсии [12] для доставки лекарственных препаратов, полиэлектролитные капсулы [13–15] комплексы с белком [16–18]. Большое направление исследований связано с мицеллярным катализом [19–22], а также с созданием на основе ПАВ невирусных векторов [23–29]. Одна из важных особенностей некоторых ПАВ – их способность к прохождению через клеточные мембраны, представляющие собой липидный бислой [30]. Оценку этой способности удобно проводить на модельных липосомах построенных из синтетических и коммерчески доступных липидов типа дипальмитоилфосфатидилхолина (ДПФХ) [29]. Показано, что на способность ПАВ встраиваться в липидный бислой влияет длина углеводородного радикала: более короткие хвосты вызывают разупорядочивание липидного бислоя, а более длинные, наоборот, стабилизируют его [29].
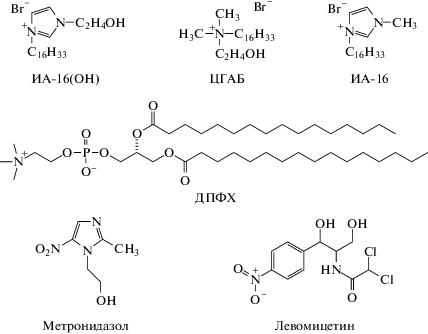
Тем не менее, результаты указанных исследований носят разрозненный характер. Поэтому для понимания процессов, происходящих в липосомальном слое при добавлении ПАВ, необходимо расширять теоретическую базу. В данной работе оценены адсорбционные характеристики ПАВ с гексадецильным радикалом и различными головными группами (ИА-16(ОН), ЦГАБ, ИА-16), исследовано влияние головной группы амфифилов на способность ПАВ встраиваться в липидный бислой ДПФХ (модель клеточной мембраны) и увеличивать мембранотропность лекарственных препаратов – метронидазола и левомицетина, которые в индивидуальном состоянии не могут проникать через барьер клеточного бислоя. Формулы используемых соединений приведены ниже:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Имидазолсодержащий амфифил с гидроксиэтильным фрагментом ИА-16(ОН) синтезировали согласно стандартной экспериментальной процедуре [31] кватернизацией третичного гидроксиэтилимидазола гексадецилбромидом. Для турбидиметрических исследований использовали коммерчески доступный дипальмитоилфосфадитилхолин (ДПФХ) (Sigma, 99%). Навеску липида (5.4 мг) растворяли в 60 мкл хлороформа. Раствор липида оставляли в открытой колбе в течение 20 ч при 25°С для удаления растворителя, в результате чего получали тонкую липидную пленку. Пленку диспергировали в воде при перемешивании при 55–60°С. Смесь несколько раз попеременно замораживали с помощью жидкого азота и растапливали на водяной бане (60°С). Для приготовления липосом приготовленную таким образом грубую дисперсию экструдировали (не менее 20 раз) через пористую поликарбонатную мембрану Whatman®Nuclepore с размером пор 100 нм с использованием экструдера LiposoFast Basic (Avestin).
Измерение поверхностного натяжения проводили по методу Дю Нуи (отрыв кольца) на тензиометре Krűss K06 [32]. Для проведения тензиометрических измерений использовали объемы растворов ~10 мл. Кольцо между измерениями обрабатывали этиловым спиртом и обжигали в пламени горелки. Используя полученные изотермы поверхностного натяжения, вычисляли адсорбционные характеристики систем.
Максимальную адсорбцию Гmax рассчитывали по уравнению:
(1)
${{\Gamma }_{{\max }}} = \frac{1}{{2.3nRT}}\mathop {\lim (d\pi {\text{/}}d\lg C)}\limits_{C \to {\text{К К М }}} ,$Минимальную поверхность, приходящуюся на одну молекулу ПАВ Аmin, свободную энергию мицеллобразования ΔGm, стандартную свободную энергию адсорбции ΔGad рассчитывали по формулам:
(2)
${{А }_{{{\text{min}}}}} = {\text{1}}{{0}^{{{\text{18}}}}}{\text{/}}{{N}_{{\text{A}}}}{{\Gamma }_{{{\text{max}}}}},$(3)
$\Delta {{G}_{{\text{m}}}} = \left( {{\text{1}} + \beta } \right)RT{\text{ln}}\left( {{\text{К К М }}} \right),$(4)
$\Delta {{G}_{{{\text{ad}}}}} = \Delta {{G}_{{\text{m}}}} - ({{\pi }_{{{\text{К К М }}}}}{\text{/}}{{\Gamma }_{{{\text{max}}}}}).$Фазовые переходы в смесях ПАВ/ДПФХ изучали методом турбидиметрии с помощью спектрофотометра Specord 250 PLUS фирмы “Analytik Jena”. При исследовании фиксировали зависимость оптической плотности раствора при длине волны 350 нм от температуры, которую варьировали от 35 до 45°С. Вначале регистрировали аналитический сигнал для индивидуальной дисперсии ДПФХ при концентрации 7 × 10–4 М. Далее к липосомам добавляли ПАВ и вновь фиксировали изменение оптической плотности раствора. Полученные кривые обрабатывали с использованием уравнения Вант-Гоффа для двух состояний, согласно которому, температура фазового перехода ДПФХ соответствует точке перегиба на турбидиметрической кривой.
Эксперименты по встраиванию лекарственного препарата в липидный бислой проводили аналогично описанному выше, добавляя раствор лекарственного препарата или его смесь с ПАВ к липосомам с ДПФХ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Методом тензиометрии для амфифила с имидазолиевой головной группой и гидроксиэтильным фрагментом ИА-16(ОН) оценивали агрегационные характеристики и сравнивали с ранее полученными данными для ПАВ с аммонийной головной группой и гидроксиэтильным фрагментом ЦГАБ [32] и ПАВ с имидазолиевой головной группой ИА-16 [29]. Показано, что замена аммонийной головной группы на имидазолиевую и введение в структуру имидазолиевого ПАВ гидроксиэтильного фрагмента не влияют на пороги агрегации. Для всех трех ПАВ ККМ системы находится на уровне 0.8–1.0 мМ (рис. 1). На основании тензиометрических данных для всех систем рассчитывали адсорбционные характеристики на границе раздела фаз вода–воздух (табл. 1). Анализ полученных данных показывает, что введение в структуру имидазолиевой головной группы гидроксиэтильного фрагмента позволяет снизить минимальную поверхность, занимаемую молекулой ПАВ (Аmin), практически в 2 раза, что согласуется с увеличением максимальной адсорбции. Это, вероятно, связано с тем, что наличие дополнительного гидрофильного фрагмента разворачивает молекулу ПАВ на поверхности таким образом, что плоскость имидазолиевой головной группы ориентирована не параллельно поверхности раздела фаз, а перпендикулярно. Для аналога амфифила ИА-16(ОН) с аммонийной головной группой (ЦГАБ) значения Аmin несколько выше, что объясняется наличием у амфифила ЦГАБ метильной группы, которая, вероятно, по стерическим причинам затрудняет сближение молекул ПАВ в адсорбционном слое. Процессы адсорбции и мицеллообразования для всех исследуемых амфифилов самопроизвольны и термодинамически выгодны, о чем свидетельствуют отрицательные значения свободной энергии мицеллообразования (ΔGm) и стандартной свободной энергии адсорбции (ΔGad). Во всех случаях величины ΔGm сопоставимы друг с другом, это указывает на то, что основной вклад в процесс мицеллообразования для всех трех ПАВ вносит гидрофобный эффект. Однако, процесс адсорбции для ИА-16 более энергетически выгоден (соответствующие величины ΔGad принимают более отрицательные значения). Это, по всей видимости, связано с отсутствием у данного ПАВ гидроксильного фрагмента, что делает его структуру более гидрофобной по сравнению с другими аналогами.
Рис. 1.
Изотермы поверхностного натяжения для водных растворов ПАВ: 1 – ИА-16(ОН), 2 – ЦГАБ, 3 – ИА-16; 25°С.

Таблица 1.
Значения критической концентрации мицеллообразования ККМ, максимальной адсорбции Гmax, минимальной поверхности в расчете на молекулу ПАВ Аmin, свободной энергии мицеллообразования ΔGm, стандартной свободной энергии адсорбции ΔGad, поверхностного давления в точке ККМ ПАВ πККМ
| ПАВ | ККМ,мМ | 106 Гmax, моль м–2 | Аmin, нм2 | πККМ, мН м–1 | –ΔGm, кДж моль–1 | –ΔGad, кДж моль–1 |
|---|---|---|---|---|---|---|
| ИА-16(ОН) | 0.8 | 1.91 | 0.95 | 33.5 | 34.2 | 54.2 |
| ЦГАБ | 0.9 | 1.69 | 0.98 | 30.8 | 31.9 | 43.5 |
| ИА-16 | 1 | 1.43 | 1.16 | 33.5 | 34 | 57.5 |
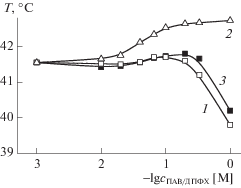
Оценку способности ПАВ к встраиванию в модельные липосомы ДПФХ проводили на основании результатов турбидиметрического титрования дисперсии липосом раствором ПАВ с целью определения изменения температуры главного фазового перехода липида в присутствии ПАВ. Как правило, для ДПФХ главный фазовый переход жидкие кристаллы – гель происходит при температуре TФП = 41 ± 0.2°С (рис. 2), которой соответствует точка перегиба на турбидиметрической зависимости. Модифицирующие добавки, в том числе и ПАВ, способны влиять на значение ТФП, которое может изменяться в обоих направлениях. Например, при добавлении ЦГАБ, температура ТФП значительно увеличивается, вплоть до 42.5°С, уже при соотношении ПАВ/липид = 1 : 3 (рис. 2), при добавлении ИА-16(ОН) наблюдается обратная картина: ТФП уменьшается. На рис. 3 приведены зависимости температуры фазового перехода липосом от мольного соотношения компонентов ПАВ/ДПФХ для всех изучаемых амфифилов. Анализ представленных данных позволяет утверждать, что варьирование природы головной группы может значительно влиять на способность ПАВ встраиваться в липидный бислой. Так, амфифилы ИА-16(ОН) и ИА-16 [29] по своей способности к встраиванию отличаются незначительно, но у амфифила ИА-16(ОН) эта способность выражена в большей степени. Наблюдаемое в их случае понижение ТФП с увеличением мольного соотношения ПАВ/ДПФХ обусловлено тем, что, вероятно, молекулы данных ПАВ, встраиваясь в липидный бислой, разрыхляют его за счет разупорядочивания гидрофобных радикалов липида, приводя к снижению температуры фазового перехода, что эквивалентно увеличению проницаемости клеточной мембраны. Однако, для амфифила с аммонийной головной группой наблюдается обратный эффект. Температура главного фазового перехода начинает увеличиваться, что является необычным результатом и свидетельствует о стабилизации липидного бислоя ДПФХ. Подобный эффект может быть связан с тем, что аммонийная головная группа менее объемна, и в силу этого при взаимодействии с липосомами гидрофобный хвост ПАВ проникает глубже в гидрофобное ядро липосом, чем ее аналоги. Вероятно, глубина его погружения близка к длине алкильного фрагмента фосфолипида. Это кардинально меняет упаковку внутри фосфолипидной матрицы и сопровождается стабилизацией бислоя.
Рис. 2.
Турбидиметрические зависимости для индивидуальных липосом ДПФХ (1) и для системы ЦГАБ/ДПФХ (2) при мольном соотношении ПАВ/липид 1 : 3.

Рис. 3.
Зависимости температуры главного фазового перехода липосом ДПФХ от мольного соотношения ПАВ/ДПФХ для амфифилов ИА-16(ОН) (1), ЦГАБ (2), ИА-16 (3) [29].
Стратегия увеличения проницаемости клеточного бислоя путем добавок ПАВ может быть использована для того, чтобы усилить транспортные свойства систем на основе амфифильных соединений по отношению к лекарственным препаратам. В рамках данной работы эти исследования проведены на примере лекарственных препаратов – левомицетина и метронидазола с использованием ПАВ ИА-16(ОН), продемонстрировавшего наиболее выраженные мембранотропные свойства. В индивидуальном состоянии метронидазол и левометицин не обладают мембранотропными свойствами (рис. 4). Это следует из того, что увеличение их содержания в системе не приводит к изменению температуры фазового перехода липида. Совместное введение лекарственных препаратов левомицетина и метронидазола с амфифильным соединением в липосомы на основе ДПФХ приводит к снижению температуры главного фазового перехода (рис. 4). Зафиксированный эффект служит доказательством интегрирования молекул левомицетина и метронидазола в липидный бислой в присутствии ПАВ. Полученные результаты позволяют заключить, что использование амфифилов определенной структуры, способных разрыхлять липидный бислой, позволяет повысить способность лекарственного препарата проникать в клетку через барьер клеточной стенки.
Рис. 4.
Зависимости температуры главного фазового перехода ДПФХ от мольных соотношений компонентов систем: метронидазол/ДПФХ (1), левомицетин/ДПФХ (2), метронидазол/ИА-16(ОН)/ДПФХ (3) и левомицетин/ИА-16(ОН)/ДПФХ (4).

Таким образом, для амфифилов с гексадецильным радикалом и варьируемой структурой головной группы оценены агрегационные характеристики, адсорбционные параметры и мембранотропные свойства. Показано, что переход от аммонийной головной группы к имидазолиевой делает процесс адсорбции более термодинамически выгодным. В то же время введение в структуру имидазолиевой головной группы гидроксиэтильного фрагмента в 2 раза снижает минимальную площадь ПАВ и увеличивает максимальную адсорбцию. Турбидиметрические эксперименты по оценке мембранотропной способности амфифилов выявили, что структура головной группы является ключевым фактором в регулировании данного процесса. ПАВ с имидазолиевой головной группой встраиваются в липидный бислой, разрыхляя его, в то время как ПАВ с аммонийной головной группой и гидроксиэтильным фрагментом стабилизирует липидный бислой. Показано, что амфифил, разрыхляющий липидный бислой, может быть использован для увеличения мембранотропной способности лекарственных препаратов метронидазола и левомицетина, которые в индивидуальном состоянии такой способностью не обладают.
Список литературы
Qian Z., Huang D., Yi S. et al. // Tenside, Surfactants Deterg. 2016. V. 53. № 6. P. 540.
Chauhan V., Kamboj R., Singh Rana S.P. et al. // J. Colloid Interface Sci. 2015. V. 446. P. 263.
Bhadani A., Singh S., Kamboj R. et al. // Colloid Polym Sci. 2013. V. 291. P. 2289.
Bijma K., Engberts J.B.F.N. // Langmuir. 1997. V. 13. P. 4843.
Bhadani A., Tani M., Endo T. et al. // Phys. Chem. Chem. Phys. 2015. V. 17. P. 19474.
Cornellas A., Perez L., Comelles F. et al. // J. Colloid Interface Sci. 2011. V. 355. P. 164.
Яцкевич Е.И., Миргородская А.Б., Лукашенко С.С. и др. // Изв. АН. Сер. хим. 2014. № 8. С. 1801.
Миргородская А.Б., Валеева Ф.Г., Захаров С.В. и др. // Там же. 2018. № 2. С. 291.
Ju H., Jiang Y., Geng T. et al. // J. Mol. Liq. 2018. V. 264. P. 306.
Brycki B., Koziróg A., Kowalczyk I. et al. // Molecules. 2017. V. 22. P. 1810.
Mandal S., Kuchlyan J. // J. Phys. Chem. B. 2014. V. 118. P. 5913.
Kaur M., Singh G., Kumar S. et al. // J. Colloid Interface Sci. 2018. V. 511. P. 344.
Васильева Э.А., Ибрагимова А.Р., Миргородская А.Б. и др. // Изв. АН. Сер. хим. 2014. № 1. С. 232.
Vasilieva E.A., Ibragimova A.R., Lukashenko S.S. et al. // Fluid Phase Equilib. 2014. V. 376. P. 172.
Ibragimova A.R., Mirgorodskaya A.B., Vasilieva E.A. et al. // Colloids Surf. A. 2017. V. 526. P. 20.
Li F., Liu Y., Lin W. // J. Mol. Liq. 2018. V. 256. P. 372.
Hoque Md.A., Ahmed Md.F. // Ibid. 2018. V. 260. № 15. P. 121.
Самаркина Д.А., Габдрахманов Д.Р., Лукашенко С.С. и др. // Журн. общ. химии. 2017. Т. 87. № 12. С. 2009.
Габдрахманов Д.Р., Валеева Ф.Г., Семенов В.Э. и др. // Макрогетероциклы. 2016. Т. 9. № 1. С. 29.
Gabdrakhamanov D.R., Samarkina D.A., Semenov V.E. et al. // Phosphorus Sulfur Silicon Relat. Elem. 2016. V. 191. P. 1673.
Самаркина Д.А., Габдрахманов Д.Р., Семенов В.Э. и др. // Журн. общ. химии. 2016. Т. 86. № 3. С. 518.
Самаркина Д.А., Габдрахманов Д.Р., Семенов В.Э. и др. // Там же. 2016. Т. 87. № 9. С. 1977.
Zakharova L., Voronin M., Semenov V. et al. // ChemPhysChem. 2012. V. 13. P. 788.
López-López M., López-Cornejo P., Martín V.I. et al. // J. Colloid Interface Sci. 2018. V. 521. P. 197.
Martínez-Negro M., Barrán-Berdón A.L., Aicart-Ramos Cl. et al. // Colloids Surf. B. 2018. V. 161. P. 519.
Gabdrakhmanov D., Samarkina D., Semenov V. et al. // Colloids Surf. A. 2015. V. 480. P. 113.
Gabdrakhmanov D.R., Samarkina D.A., Semenov V.E. et al. // J. Mol. Liq. 2016. V. 218. P. 255.
Габдрахманов Д.Р., Самаркина Д.А., Семенов В.Э. и др. // Макрогетероциклы. 2017. Т. 10. № 4. С. 567.
Samarkina D.A., Gabdrakhmanov D.R., Lukashenko S.S. et al. // Colloids Surf., A. 2017. V. 529. P. 990.
Clamme J.P., Bernacchi S., Vuilleumier C. et al. // Biochim. Biophys. Acta. 2000. V. 1467. P. 347.
Yina T., Qina M., Shena W. // Colloids Surf. A. 2014. V. 461. P. 22.
Pal A., Yadav S. // Fluid Phase Equilib. 2016. V. 412. P. 71.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии