Журнал физической химии, 2019, T. 93, № 8, стр. 1237-1242
Синтез и электрофоретическое концентрирование Ag–Cu-наночастиц типа ядро–оболочка в микроэмульсии аот в н-декане
П. С. Поповецкий a, *, А. И. Булавченко a, А. Т. Арымбаева a, О. А. Булавченко b, Н. И. Петрова a
a Российская академия наук, Сибирское отделение, Институт неорганической химии им. А.В. Николаева
630090 Новосибирск, Россия
b Российская академия наук, Сибирское отделение, Институт катализа им. Г.К. Борескова
630090 Новосибирск, Россия
* E-mail: popovetskiy@niic.nsc.ru
Поступила в редакцию 26.12.2018
После доработки 26.12.2018
Принята к публикации 15.01.2019
Аннотация
В обратных мицеллах бис-(2-этилгексил)сульфосукцината натрия (АОТ) в эмульсионном и микроэмульсионном вариантах получены и охарактеризованы набором физико-химических методов стабильные органозоли биметаллических наночастиц из серебра и меди. Установлено, что адсорбционный слой наночастиц в растворах АОТ в н-декане имеет сложное полислойное строение; увеличение мольной доли меди приводит к увеличению гидродинамического диаметра наночастиц с 14 до 23 нм и уменьшению электрокинетического потенциала с 18 до 7 мВ. Показано, что при разбавлении золей хлороформом можно увеличить поверхностный заряд наночастиц и провести электрофоретическое концентрирование с коэффициентами концентрирования 30–50 в зависимости от состава. На основании данных рентгеновской дифракции твердофазных композитов в АОТ сделан вывод о наиболее вероятном формировании структуры наночастиц типа “ядро–оболочка” с металлическим серебряным ядром и поверхностным слоем из рентгеноаморфной меди.
Концентрированные органозоли наночастиц металлов представляют интерес для различных областей микроэлектроники и высокотехнологичного производства, в особенности в качестве чернил на металлической основе для печати проводящих элементов электронных устройств [1, 2]. Наиболее широко используемые металлы для таких чернил – серебро и золото (металлы с высокими электрической проводимостью и коррозионной стойкостью [3–5]). Однако серебро и золото весьма дорогостоящие, поэтому многие исследователи пытаются решить вопрос полной или частичной замены этих металлов на более дешевые, прежде всего медь, превосходящую золото и практически не уступающую серебру по электрической проводимости [6, 7]. Но медь очень быстро окисляется даже на воздухе, особенно в низкоразмерном состоянии [8], характерный размер частиц для металлсодержащих чернил, как правило, не превышает 50 нм [9]. Один из вариантов решения этой проблемы – использование биметаллических наночастиц, особенно имеющих строение типа “ядро–оболочка” (core–shell) [10, 11].
Цель данной работы – исследование возможности синтеза и концентрирования наночастиц, полученных из смеси серебра и меди в различных соотношениях. Акцент сделан на влиянии добавок меди на основные характеристики получаемых наночастиц, определяющие возможность их практического использования: гидродинамический диаметр, электрокинетический потенциал, положение максимума локализованного плазмонного резонанса и коэффициент экстинкции.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Материалы
Использовали поверхностно-активное вещество (ПАВ) – бис-(2-этилгексил)сульфосукцинат натрия (АОТ) производства фирмы Sigma-Aldrich с содержанием основного вещества не менее 97%, моногидрат гидразина (“х.ч.”), нитрат серебра (“х.ч.”), нитрат меди (“х.ч.”). В качестве растворителя использовали н-декан (99%), который дополнительно очищали выдерживанием над слоем оксида алюминия не менее недели и двукратным фильтрованием через бумажный фильтр “синяя лента”. Хлороформ (“х.ч.”), азотную и серную кислоты (обе квалификации “ос.ч.”) использовали без дополнительной очистки.
Синтез и электрофоретическое концентрирование наночастиц
Синтез наночастиц проводили при помощи двух методик: эмульсионной [12] и микроэмульсионной [13]. Микроэмульсионный синтез проводили следующим образом: в две части 0.25 М раствора АОТ в н-декане равного объема инъектировали водные растворы исходных реагентов: в первую часть последовательно вводили водные растворы AgNO3 (0.25 М) и Cu(NO3)2 (0.25 М) в суммарном количестве 1 об. %, во вторую – моногидрат гидразина (без разбавления, 1 об. %). После этого мицеллярные растворы реагентов смешивали. Эмульсионный синтез проводили для получения больших объемов концентратов металла, необходимых для дифракционных измерений. Водные растворы AgNO3 (0.25 М) и Cu(NO3)2 (0.25 М) также последовательно вводили в 0.25 М раствора АОТ в н-декане, но при перемешивании на магнитной мешалке и в суммарном количестве 20 об. %. Моногидрат гидразина добавляли сразу после введения растворов солей по каплям. Через 3 ч водную фазу отделяли, органозоль дегидратировали перемешиванием на магнитной мешалке в течение 3 ч. Для случая серебра данная методика позволяет получить частицы с близкими характеристиками, как и классическая микроэмульсионная методика, но с большей производительностью [12].
Электрофоретическое концентрирование проводили через 16–18 ч после синтеза. К полученному органозолю добавляли хлороформ (до 40 об. %), полученную смесь помещали в стеклянную кювету (5 × 5 × 5 см) с горизонтально ориентированными плоскопараллельными медными электродами (межэлектродный зазор 10–15 мм). На электроды подавали напряжение 600 В. Через некоторое время (в среднем ~30 мин) частицы скапливались на дне кюветы на поверхности катода. Ячейку наклоняли на один из углов, куда стекал полученный концентрат. Концентрирование осуществляли для систем с содержанием меди 50 мол. % и больше.
Характеризация наночастиц
Спектрофотометрия. Электронные спектры поглощения (спектры локализованного плазмонного резонанса) наночастиц записывали при помощи спектрофотометра UV-1700 (Shimadzu, Япония) в диапазоне 250–1000 нм в кюветах из кварца с длиной оптического пути 0.2–1 см.
Атомно-абсорбционная спектрометрия. Определение концентрации металлов в полученных образцах осуществляли при помощи атомной абсорбции на спектрометре Z-8000 (Hitachi, Япония). Для удаления органических компонентов 50 мкл концентрата высушивали на воздухе до постоянной массы и проводили обработку полученного композита смесью серной и азотной кислоты (по 1 мл) при нагревании до начала выделения паров серной кислоты. Далее пробы охлаждали до комнатной температуры и повторно добавляли 1 мл азотной кислоты и повторяли стадии нагревания и охлаждения. Образец переносили в колбу на 50 мл и разбавляли деионизованной водой.
Динамическое рассеяние света. Для определения гидродинамического диаметра аликвоту концентрата объемом 50–100 мкл высушивали на воздухе до постоянной массы и редиспергировали либо чистым растворителем, либо раствором АОТ заданной концентрации (до 1 М). Перед измерением полученный органозоль подвергали 5-кратному циклическому фильтрованию через тефлоновый мембранный фильтр с диаметром пор 0.2 мкм (Sartorius, Германия) для очистки от пыли. Гидродинамический диаметр наночастиц определяли при помощи метода динамического рассеяния света на спектрометре NanoBrook Omni (Brookhaven, США) с использованием мультимодального анализа, обработку автокорреляционной функции осуществляли по алгоритму NNLS (Non-Negatively Constrained Least Squares). Мощность твердотельного лазера с длиной волны 640 нм составляла 35 мВт, рассеянные частицами фотоны детектировали под углом 90° к источнику излучения. Время накопления фотонов для одного измерения составляло 10 с. Гидродинамический диаметр определяли как среднее из 30 измерений.
Фазовый анализ рассеянного света. Электрокинетический потенциал (ζ-потенциал) наночастиц определяли также на спектрометре NanoBrook Omni методом лазерного электрофореза с использованием фазового анализа рассеянного света (phase analysis light scattering, PALS). Рассеянные частицами фотоны детектировали под углом 15°. Измерения проводили в специальной ячейке SRR2 (Brookhaven, США), устойчивой к действию органических растворителей, с плоскопараллельными палладиевыми электродами площадью ~45 мм2 с межэлектродным зазором 3.45 мм. Органозоли очищали от пыли десятикратным циклическим фильтрованием через тефлоновый мембранный фильтр с диаметром пор 0.2 мкм (Sartorius, Германия). Электроды также предварительно очищали от пыли непрерывным пропусканием через них растворителя в течение 20 мин с помощью фильтрующей системы BI-SFS (Brookhaven, США), скорость потока растворителя составляла 7.8 мл/мин. Измерения скорости движения наночастиц проводили в ручном режиме, напряжение внешнего поля варьировали в диапазоне от 100 до 200 В, расчет ζ-потенциала производили по формуле Хюккеля–Онзагера как среднее из 30 измерений (по 10 измерений для каждого напряжения). Для всех исследованных систем ζ-потенциал не зависел от напряженности поля в данном диапазоне, что указывает на соответствие критериям истинного электрофореза [14].
Рентгеновская дифракция. Для исследования дифракции полученных наночастиц аликвоту концентрата наночастиц, полученных эмульсионным синтезом, объемом около 1 мл высушивали на воздухе до постоянной массы. Полученный композит помещали в дифракционную кювету. Дифракционные измерения проводили на дифрактометре Bruker D8 Advance (Германия), в интервале углов 15–85°, с шагом по 2Ө = 0.05° и временем накопления 3 с в каждой точке, с применением линейного детектора LynxEye (1D). Использовали монохроматизорованное CuKα-излучение (λ = 1.5418Å).
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Исходные системы до электрофоретического концентрирования
Спектры плазмонного резонанса. Спектры плазмонного резонансного поглощения полученных наночастиц представлены на рис. 1. Для наночастиц серебра максимум наблюдается при ~400 нм. Частицы, полученные восстановлением нитрата меди, в видимой области свет не поглощают, наблюдается только плечо в области 300 нм. Величина молярного коэффициента экстинкции серебра без добавления меди составляет ~1.1 × 104, что удовлетворительно согласуется с литературными данными. При замене серебра медью на 25 и 50 мол. % молярный коэффициент экстинкции серебра уменьшается на ~20%, при замене на 75% – более чем в 2 раза.
Рис. 1.
Спектры локализованного плазмонного резонанса наночастиц серебра (1), биметаллических наночастиц серебро/медь (2 – 75, 3 – 50, 4 – 25 мол. % серебра) и меди (5).

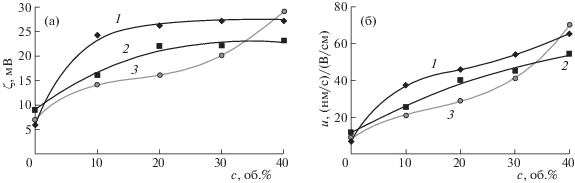
Гидродинамический диаметр и электрокинетический потенциал. Такие основные характеристики наночастиц серебра, полученных микроэмульсионным синтезом (исходная система до концентрирования, через 15–20 ч после синтеза), как гидродинамический диаметр и электрокинетический потенциал, составляют 20 нм и 18 мВ соответственно. При замене части серебра медью наблюдается увеличение гидродинамического диаметра (до 25–27 нм) и резкое снижение ζ-потенциала (до 6–9 мВ при замене на 50% и более). Это соответствует достаточно низкому значению электрофоретической подвижности – ~10 (нм/с)/(В/см). Для увеличения подвижности использовали добавки более полярного и менее вязкого растворителя – хлороформа [15, 16]. На рис. 2 представлены типичные результаты измерения фазы рассеянного частицами света, полученные методом PALS, для систем без добавок хлороформа и с добавкой 20 об. %. Для систем с хлороформом наблюдаются более высокие ζ-потенциалы и лучшая аппроксимация экспериментальных значений. Зависимость электрофоретической подвижности и ζ-потенциала наночастиц от объемной доли хлороформа представлена на рис. 3. Добавки 20% хлороформа и более позволяют увеличить подвижность более чем в 3 раза, провести концентрирование и выделить жидкий концентрат наночастиц.
Рис. 2.
Экспериментальные и расчетные значения фазового сдвига рассеянного наночастицами света в процессе электрофореза для исходных систем (а) и для систем с добавками 20 об. % хлороформа (б); системы Cu–Ag: 1 – 0, 2 – 25, 3 – 50 мол. % Ag. Напряжение 150 В.
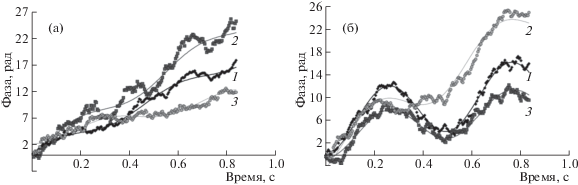
Рис. 3.
Зависимости (а) ζ-потенциала и электрофоретической подвижности (б) наночастиц от добавок хлороформа; 1–3 см. рис. 2.
Электрофоретические концентраты
Коэффициенты концентрирования и соотношение металлов в концентратах. Содержание металлов находили методом атомной абсорбции. В табл. 1 приведены концентрации металлов в концентратах, рафинатах и исходных системах для смешанных систем, в которых серебро заменено на медь на 75 и 50 мол. %, а также рассчитанные исходя из этих данных коэффициенты концентрирования и степени извлечения по каждому из металлов. Для случая серебра в аналогичных условиях коэффициент концентрирования выше в ~5 раз, а без добавления хлороформа – более чем на порядок [17, 18]. По-видимому, низкие значения коэффициентов концентрирования обусловлены как дополнительным разбавлением хлороформом, так и изначально низкими значениями ζ-потенциала наночастиц в смешанных системах. Также следует отметить, что для смешанной системы, в которых серебро заменено на медь на 50%, медь частично остается в рафинате. Концентрат при этом обедняется медью, что приводит к изменению соотношения металлов с 1 : 1 на 1 : 0.69. Так как методом атомной абсорбции определяется общее содержание меди, независимо от ее состояния, наиболее вероятными причинами этого может быть неполное восстановление меди (невосстановленная медь не концентрируется электрофорезом и остается в рафинате) или гальванические процессы между медью и серебром [11, 19], приводящие к окислению металлической меди в наночастицах.
Таблица 1.
Результаты определения состава концентратов и рафинатов наночастиц
| $C_{{\text{М }}}^{{{\text{и с х }}}}$, мМ | $C_{{\text{М }}}^{{{\text{р а ф }}}}$, мМ | $C_{{\text{М }}}^{{{\text{к о н ц }}}}$,мМ | Kконц | R, % | СCu/CAg (I) | СCu/CAg (II) | |||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Cu | Ag | Cu | Ag | Cu | Ag | Cu | Ag | Cu | Ag | ||
| 1.25 | – | – | – | 131 | – | 105 | – | 100 | – | – | – |
| 0.937 | 0.313 | – | – | 48 | 17 | 51 | 53 | 100 | 100 | 3 | 2.87 |
| 0.625 | 0.625 | 0.02 | – | 18 | 26 | 29 | 42 | 97 | 100 | 1 | 0.69 |
Гидродинамический диаметр наночастиц в растворах АОТ. Для исследования зависимости гидродинамического диаметра наночастиц от концентрации АОТ аликвоту концентрата диспергировали в растворе АОТ известной концентрации. Для всех образцов наночастиц наблюдалось увеличение гидродинамического диаметра с ростом концентрации АОТ. Зависимости гидродинамического диаметра наночастиц от концентрации АОТ представлены на рис. 3. Это явление было детально исследовано нами для случая наночастиц серебра и золота и подробно описано в работах [15, 20]. Для случая биметаллических наночастиц разного состава наблюдается аналогичный характер зависимости: при увеличении концентрации АОТ наблюдается увеличение гидродинамического диаметра. Мы связываем это с формированием полислойного адсорбционного слоя из мицелл АОТ под действием электростатического притяжения разноименно заряженных мицелл АОТ и наночастиц.
Следует отметить, что при концентрации АОТ ниже ККМ значение гидродинамического диаметра наночастиц серебра составляет 14 нм, а наночастиц меди и биметаллических наноночастиц – 19–23 нм в зависимости от содержания меди. По-видимому, это обусловливает более высокие значения гидродинамического диаметра биметаллических наночастиц и наночастиц меди при всех исследованных концентрациях АОТ. Далее электрофоретические концентраты высушивали и с ними проводили дифракционные исследования.
Рентгеновская дифракция. На рис. 4 приведены дифракционные картины образцов наночастиц серебра, эквимолярной смеси серебра и меди, а также штрих-диаграмма, построенная по литературным данным для серебра [PDF № 4-783]. Для наночастиц, в которых половина серебра заменена медью, присутствуют дифракционные рефлексы серебра, пики меди не наблюдаются. Кроме того, не происходит смещения рефлексов серебра, что исключает вхождение меди в решетку металлического серебра и образование твердого раствора. Учитывая, что методом атомной абсорбции медь определяется в больших количествах, чем в исходном органозоле, можно предположить, что в этих образцах медь находится в рентгеноаморфном состоянии.
Рис. 4.
Зависимости гидродинамического диаметра (D) наночастиц от концентрации АОТ (с); 1–5 – см. рис. 1.

Также видно, что рентгенограммы исследуемых образцов серебра и смеси серебра с медью очень похожи, наблюдаются широкие рефлексы серебра. Средние размеры ОКР для обоих образцов были оценены по рефлексу 111 по формуле Шеррера и составили ~25Å. На основании схожести рентгенограмм и одинакового размера ОКР в образцах, можно предположить, что добавки меди не влияют на кристаллическую структуру наночастиц серебра, что, по-видимому, обусловлено преимущественным расположением рентгеноаморфной меди на поверхности металлического серебра и образования структуры типа “ядро–оболочка”. Снижение молярного коэффициента экстинкции, ζ-потенциала и увеличение диаметра также косвенно указывают, что образование такой структуры наиболее вероятно.
Рис. 5.
Дифракционные картины образцов электрофоретических концентратов наночастиц серебра (1), эквимолярной смеси серебра и меди (2) и штрих-диаграмма для серебра.

Таким образом, добавки меди снижают ζ-потенциал получаемых частиц, увеличивая при этом диаметр. Использование добавок более полярного хлороформа позволяет осуществить концентрирование наночастиц и исследовать структуру их адсорбционного слоя, аналогичную монометаллическим частицам. Отсутствие дифракционных рефлексов меди и снижение коэффициента экстинкции серебра указывает на преимущественное расположение меди на поверхности наночастиц серебра в ренгеноаморфном состоянии.
Список литературы
Hong S., Yeo J., Kim G. et al. // ACS Nano. 2013. V. 7. №. 6. P. 5024.
Kamyshny A., Magdassi S. // Small. 2014. V. 10. № 17. P. 3515.
Wu W. // Nanoscale. 2017. V. 9. № 22. P. 7342.
Vassem M., Lee K.M., Hong A.-R., Hahn Y.-B. // ACS Appl. Mater. Interfaces. 2012. V. 4. № 6. P. 3300.
Reiser B., Gonzalez-Garcıa, L., Kanelidis I. et al. // Chem. Sci. 2016. V. 7. № 7. P. 4190.
Shin D.-H., Woo S., Yem H. et al. // ACS Appl. Mater. Interfaces. 2014. V. 6. № 5. P. 3312.
Jason N.J., Shen W., Cheng W. // Ibid. 2015. V. 7. № 30. P. 16760.
Kim H.-S., Dhage S.R., Shim D.-E., Hahn H.T. // Appl. Phys. A. 2009. V. 97. № 4. P. 791.
Calvert P. // Chem. Mater. 2001. V. 13. № 10. P. 3299.
Grouchko M., Kamyshny A., Magdassi S. // J. Mater. Chem. 2009. V. 19. № 19. P. 3057.
Lee C., Kim N.R., Koo J. et al. // Nanotechnology. 2015. V. 26. № 455601. P. 9.
Bulavchenko A.I., Arymbaeva A.T., Demidova M.G. et al. // Langmuir. 2018. V. 34. № 8. P. 2815.
Arymbaeva A.T., Shaparenko N.O., Popovetskiy P.S., Bulavchenko A.I. // Russ. J. Inorg. Chem. 2017. V. 62. № 7. P. 1007.
van der Minne J.L., Hermanie P.H.J. // J. Colloid. Sci. 1952. V. 7. № 6. P. 600.
Popovetskiy P.S., Bulavchenko A.I., Demidova M.G., Podlipskaya T.Yu. // J. Struct. Chem. 2015. V. 56. № 2. P. 357.
Popovetskiy P.S., Bulavchenko A.I., Demidova M.G., Podlipskaya T.Yu. // Colloid J. 2015. V. 77. № 1. P. 58.
Bulavchenko A.I., Popovetsky P.S. // Langmuir. 2010. V. 26. № 2. P. 736.
Popovetskii P.S., Bulavchenko A.I., Manakov A.Yu. // J. Opt. Technology. 2011. V. 78. № 7. P. 467.
Westsson E., Koper G.J.M. // Catalysts. 2014. V. 4. № 4. P. 375.
Bulavchenko A.I., Popovetskiy P.S. // Langmuir. 2014. V. 30. № 42. P. 12729.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


