Журнал физической химии, 2019, T. 93, № 8, стр. 1232-1236
Тройные комплексы наночастиц висмута с β-циклодекстрином и поливинилпирролидоном
И. В. Полякова a, *, Л. Н. Боровикова a, Е. М. Коротких b, А. И. Киппер a, О. А. Писарев a, b
a Российская академия наук, Институт высокомолекулярных соединений
Санкт-Петербург, Россия
b Санкт-Петербургский политехнический университет Петра Великого
Санкт-Петербург, Россия
* E-mail: pol_irina_val@list.ru
Поступила в редакцию 06.11.2018
После доработки 06.11.2018
Принята к публикации 20.11.2018
Аннотация
Методами УФ- и видимой спектроскопии и динамического светорассеяния исследованы тройные комплексы наночастиц висмута с β-циклодекстрином и поливинилпирролидоном. Показано, что в зависимости от концентрационного соотношения β-циклодекстрина к поливинилпирролидону в синтетической среде стерическая стабилизация наночастиц висмута осуществлялась либо посредством распределения молекул поливинилпирролидона на поверхности комплекса наночастиц с β‑циклодекстрином, либо посредством образования комплексов включения наночастиц в гидрофобные полости молекул β-циклодекстрина в результате “расталкивания” молекулами поливинипирролидона ассоциированных молекул β-циклодекстрина. Определены условия формирования тройных комплексов, которые агрегативно стабильны в течение 20 суток и характеризуются унимодальным распределением частиц по размеру.
Актуальная задача современной биотехнологии – создание сорбирующих материалов для лечения ран, которые обладают собственной антибактериальной активностью [1–3]. Цель создания таких материалов состоит в преодолении антибиотикорезистентности микроорганизмов путем использования специфических свойств наночастиц, в том числе и наночастиц металлов [4, 5].
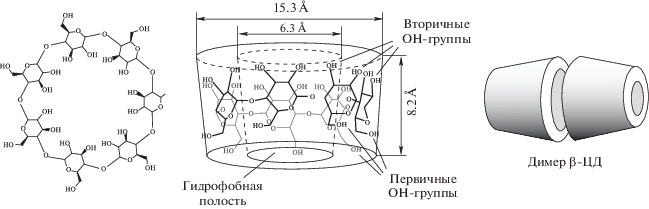
Показано [6], что висмут (Bi) и его соединения проявляют высокую антибактериальную активность. Кроме того, Bi относят к “зеленым” элементам, так как он значительно менее цитотоксичен в сравнении с другими металлами [7]. Отсутствие цитотоксичности наночастиц Bi (НЧ-Bi) также показано на эпителиальных клетках и клетках крови человека [8]. С целью сохранения функциональных свойств НЧ-Bi необходимо разрабатывать методы их стабилизации [9, 10]. Циклодекстрины широко используют в качестве стабилизаторов для наночастиц металлов, прежде всего, благодаря способности этих циклических олигосахаридов формировать комплексы включения по типу “гость–хозяин” [11]. Одновременно с этим наличие реакционноспособных гидроксильных групп на их поверхности позволяет прививать комплексы циклодекстринов с антибактериальными агентами к различным сорбционным поверхностям [12, 13].
Однако, в работе [14] было показано, что стабилизация НЧ-Bi молекулами β-циклодекстрина (β-ЦД) в водном растворе не осуществлялась. Формировались частицы микронных размеров, которые по стерическим причинам не были способны проникать в гидрофобные полости β-ЦД и соответственно образовывать комплексы включения. Основной причиной, препятствующей формированию комплексов включения НЧ-Bi с молекулами β-ЦД, была склонность молекул β‑ЦД к образованию в воде димеров с “закрытыми” полостями [15] (рис. 1).
Улучшение стабилизирующей способности циклодекстринов может быть осуществлено модификацией их поверхности путем нековалентных взаимодействий гидрофильных молекул с ОН-группами олигосахаридов, в частности, при образовании водородных связей с молекулами поливинипирролидона (ПВП) [16].
В связи с этим цель данной работы – изучение влияния содержания ПВП в синтетической среде на образование и агрегативную стабильность тройных комплексов НЧ-Bi с β-ЦД и ПВП.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали пентагидрат нитрата висмута (Bi(NO3)3 · 5H2O, “Реахим” Россия), боргидрид натрия (NaBH4, “Вектон”, Россия), ПВП (Мw = = 55000, “Ferak”, Berlin, Germany), β-ЦД – циклический олигомер из семи молекул D-глюкопиранозы, соединенных посредством альфа-1-4-гликозидной связи (Мw = 1135, “Жуньян Пиньчжоу”, Китай). Синтез НЧ-Bi осуществляли при комнатной температуре путем окислительно-восстановительной реакции:
(1)
$\begin{gathered} {\text{2Bi}}{{\left( {{\text{N}}{{{\text{O}}}_{{\text{3}}}}} \right)}_{{\text{3}}}} + {\text{6NaB}}{{{\text{H}}}_{{\text{4}}}} + {\text{18}}{{{\text{H}}}_{{\text{2}}}}{\text{O}} = \\ = \;{\text{2Bi}} + {\text{6NaN}}{{{\text{O}}}_{{\text{3}}}} + {\text{6B}}{{\left( {{\text{OH}}} \right)}_{{\text{3}}}} + {\text{21}}{{{\text{H}}}_{{\text{2}}}}{\kern 1pt} \uparrow \\ \end{gathered} $Выбор NaBH4 был обусловлен большим различием в редокс-потенциалах NaBH4 (–1.24 В) и Вi (0.8 В) в щелочной среде [17]. Реакцию (1) проводили непосредственно в среде стабилизирующей смеси β-ЦД и ПВП. Концентрация стабилизатора (Сβ-ЦД–ПВП) в реакционной смеси составляла 1%, а концентрационное соотношение β‑ЦД/ПВП (мас. %/мас. %) изменялось в пределах от 10/90 до 90/10.
Методика синтеза была следующей: 0.0003 г Bi(NO3)3 · 5H2O растворяли в 10 мл водного раствора смеси β-ЦД–ПВП с фиксированным содержанием компонентов при интенсивном перемешивании на магнитной мешалке в течение 30 мин до полного растворения соли. Далее в раствор добавляли восстановитель – 0.1 мл раствора NaBH4 (0.8 мас. %). Для предотвращения окисления формирующихся НЧ-Bi реакцию проводили в токе аргона. Конечная концентрация НЧ-Bi (CBi) в растворе составляла 0.008 мас. %. Эта концентрация оптимальна для синтеза стабильных комплексов Bi-ПВП [14].
Оптические спектры поглощения систем исследовали на спектрофотометре СФ-256 УВИ (ЛОМО, Фотоника, Россия) в диапазоне длин волн 220–900 нм в кварцевых кюветах объемом 1 см3. Средние гидродинамические радиусы наноструктур, Rh, определяли методом динамического светорассеяния (ДСР). Корреляционную функцию интенсивности рассеянного света получали с помощью коррелятора PhotoCor-FC с числом каналов 288 (ЗАО “Антекс”, Россия). Анализ корреляционной функции осуществляли с помощью программы Dynals (“Гелиос”, Россия). Из экспериментально полученных коэффициентов диффузии, D, рассчитывали гидродинамический радиус эквивалентной сферы по уравнению Эйнштейна–Стокса:
где Rh – гидродинамический радиус эквивалентной сферы, нм; k – константа Больцмана, ηs – вязкость растворителя, T – температура.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
На первом этапе исследовали влияние концентрационного соотношения β-ЦД/ПВП на свойства β-ЦД, модифицированного молекулами ПВП. С этой целью спектральные и размерные характеристики систем β-ЦД–ПВП сравнивали с характеристиками однокомпонентных растворов β-ЦД и ПВП.
Методом ДСР было установлено, что в водном растворе β-ЦД образует водорастворимые молекулярные ассоциаты, которые характеризуются эффективным размером с Rh ~ 1030 нм. В растворе ПВП формировались коллоидные частицы с Rh ~ 6 нм. В отличие от однокомпонентных растворов, комплексы β-ЦД–ПВП в зависимости от концентрационного соотношения β-ЦД/ПВП характеризовались двумя пиками с различным распределением частиц по размерам (в наноразмерном и микроразмерном диапазонах) (табл. 1).
Таблица 1.
Влияние концентрационного соотношения β-ЦД/ПВП (мас. %/мас. %) на гидродинамические радиусы двойных комплексов β-ЦД–ПВП
| β-ЦД/ПВП | 1-й пик | 2-й пик | ||
|---|---|---|---|---|
| Rh, нм | S, % | Rh, нм | S, % | |
| 0/100 | 6.3 ± 0.6 | 100 | – | – |
| 10/90 | 6.2 ± 0.5 | 85 | 886.7 ± 70.9 | 15 |
| 20/80 | 7.4 ± 0.7 | 88 | 2970.9 ± 29.7 | 12 |
| 30/70 | 6.0 ± 0.4 | 55 | 1394.7 ± 13.9 | 45 |
| 40/60 | 7.1 ± 0.7 | 81 | 761.7 ± 76.1 | 19 |
| 50/50 | 6.2 ± 0.5 | 82 | 416.6 ± 33.3 | 18 |
| 60/40 | 5.7 ± 0.4 | 15 | 167.5 ± 16.7 | 85 |
| 70/30 | 9.2 ± 0.8 | 14 | 416.5 ± 37.4 | 86 |
| 80/20 | 9.2 ± 0.8 | 8 | 168.9 ± 16.8 | 92 |
| 90/10 | 13.4 ± 0.9 | 3 | 307.3 ± 27.6 | 87 |
| 100/0 | – | – | 1030.2 ± 82.4 | 100 |
Данные оптического поглощения показали, что раствор ПВП характеризуется максимумом поглощения в диапазоне длин волн 220–230 нм, тогда как у β-ЦД характеристический максимум поглощения отсутствовал (рис. 2). Комплексы β-ЦД–ПВП, как и раствор β-ЦД, характеризовались оптическими спектрами без максимумов, кроме смеси при соотношении β-ЦД/ПВП = = 10/90. Абсолютные значения оптических плотностей растворов монотонно возрастали по мере увеличения концентрации ПВП в смесях.
Рис. 2.
Оптические спектры поглощения комплексов β-ЦД–ПВП при различных концентрационных соотношениях β-ЦД/ПВП: 1 – 100/0, 2 – 90/10, 3 – 80/20, 4 – 70/30, 5 – 60/40, 6 – 50/50, 7 – 40/60, 8 – 30/70, 9 – 20/80, 10 – 10/90, 11 – 0/100.

Стабилизацию НЧ-Bi комплексом β-ЦД–ПВП исследовали при варьировании соотношения β-ЦД/ПВП. Тройные системы Bi–β-ЦД–ПВП характеризовались унимодальным распределением по размеру (табл. 2). При этом максимальным временем сохранения агрегативной стабильности (в течение 20 суток) обладали системы, полученные при соотношениях β-ЦД/ПВП = = 10/90 и 90/10.
Таблица 2.
Влияние концентрационного соотношения β-ЦД/ПВП (мас. %/мас. %) на гидродинамические радиусы тройных комплексов Bi–β-ЦД–ПВП (СBi = 0.008 мас. %, Сβ-ЦД-ПВП = 1.0 мас. %)
| β-ЦД/ПВП | Rh, нм |
|---|---|
| 10/90 | 174.2 ± 17.4 |
| 20/80 | 184.4 ± 14.7 |
| 30/70 | 257.5 ± 23.1 |
| 40/60 | 247.6 ± 19.7 |
| 50/50 | 90.5 ± 8.1 |
| 60/40 | 107.6 ± 9.6 |
| 70/30 | 134.5 ± 13.4 |
| 80/20 | 110.4 ± 8.8 |
| 90/10 | 90.2 ± 7.2 |
Для интерпретации механизмов стабилизации тройные системы Bi–β-ЦД–ПВП сравнивали с двойными системами Bi–β-ЦД и Bi–ПВП. Как было показано ранее, НЧ-Bi в присутствии β-ЦД образовывали частицы микронных размеров с Rh в диапазоне от 4 до 9 мкм. Эти частицы были не способны проникать в конусообразную структуру β-ЦД [14]. Полученная система была агрегативно неустойчива, и наночастицы выпадали в осадок уже через ~24 ч. Максимум оптического поглощения этой системы при λ = 253 нм соответствовал максимуму поглощения свободных НЧ-Bi [18]. Это также свидетельствовало о том, что комплексы Bi–β-ЦД не образуются. В среде ПВП образовывались коллоидные частицы с бимодальным распределением в нано- (Rh = 122 нм) и микроразмерном (Rh = 1–3 мкм) диапазонах, стабильные в течение двух недель. Характеристический максимум ПВП в оптическом спектре поглощения системы Bi–ПВП сдвигался в диапазон длин волн 270–290 нм (батохромный сдвиг), что свидетельствовало об образовании комплексов Bi–ПВП.
В отличие от двойных систем Bi–β-ЦД и Bi–ПВП, в оптических спектрах поглощения тройных систем Bi–β-ЦД–ПВП вместо характеристических максимумов формировались плато. Спектральные кривые тройных комплексов пересекались в изобестических точках (рис. 3). Это подтверждало образование тройных комплексов с НЧ-Bi [19]. В зависимости от соотношения β-ЦД/ПВП изобестические точки смещались в диапазоне волн ~ 280–330 нм. Особенно четко указанный эффект проявлялся для наиболее стабильных тройных комплексов, синтезированных при β-ЦД/ПВП = 90/10 и 10/90.
Рис. 3.
Оптические спектры поглощения тройных комплексов Bi–β-ЦД–ПВП при различных концентрационных соотношениях β-ЦД/ПВП: 1 – 90/10, 2 – 80/20, 3 – 70/30, 4 – 60/40, 5 – 50/50, 6 – 40/60, 7 – 30/70, 8 – 20/80, 9 – 10/90; СBi = 0.008 мас. %, Сβ-ЦД–ПВП = = 1 мас. %.

Исследование влияния концентрации НЧ-Bi на агрегативную стабильность комплексов Bi–β-ЦД–ПВП при этих соотношениях β-ЦД/ПВП показало, что с ростом СBi эффективный размер комплексов увеличивался, а их агрегативная стабильность ухудшалась и зависела от механизма стабилизации (табл. 3).
Таблица 3.
Агрегативная стабильность тройных комплексов Bi–β-ЦД–ПВП (t – время агрегативной стабильности, сутки)
| СBi, мас.% | β-ЦД/ПВП = 10/90 | β-ЦД/ПВП = 90/10 | ||
|---|---|---|---|---|
| Rh, нм | t | Rh, нм | t | |
| 0.008 | 174.0 | 20 | 90.0 | 2 |
| 0.04 | 240.5 | 14 | 264.1 | 1 |
| 0.1 | 522.6 | 2 | 483.7 | |
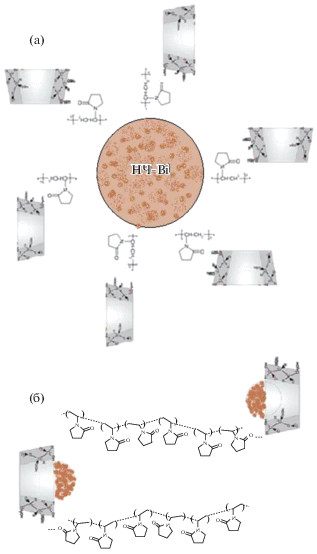
Обнаруженные различия в размерных и спектральных характеристиках тройных комплексов НЧ-Bi–β-ЦД–ПВП свидетельствовали о различных механизмах стабилизации липофильных НЧ-Bi в зависимости от концентрационного соотношения β-ЦД/ПВП. При избытке молекул ПВП в комплексе (β-ЦД/ПВП = 10/90) стерическая стабилизация НЧ-Bi, по всей видимости, осуществлялась преимущественно посредством связывания молекул ПВП с поверхностью наночастиц (рис. 4а). При избытке молекул β-ЦД в комплексе (β-ЦД/ПВП = 90/10) молекул ПВП становилось недостаточно для поверхностной стерической стабилизации НЧ-Bi. Поэтому осуществлялась модификация поверхности β-ЦД молекулами ПВП и “расталкивание” молекул β‑ЦД (рис. 4б). Это способствовало формированию комплексов включения.
Рис. 4.
Механизмы формирования тройных комплексов Bi–β-ЦД–ПВП при стерической стабилизации НЧ-Bi посредством связывания молекул ПВП с поверхностью НЧ-Bi (а) и посредством формирования комплексов включения НЧ-Bi в гидрофобные полости β-ЦД (б).
Таким образом, определены оптимальные условия формирования агрегативно устойчивых комплексов Bi–β-ЦД–ПВП. В дальнейшем с целью создания сорбционных материалов для лечения раневых инфекций эти комплексы будут использованы в качестве лиганда с групповой специфичностью, содержащего антибактериальный агент.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (код проекта № 18-03-00835).
Список литературы
Tsiouris C.G., Tsiouri M.G. // Wound Med. 2017. V. 19. № 1. P. 33.
Chen H., Cheng J., Ran L. et al. // Carbohydr. Polym. 2018. V. 201. № 2. P. 522.
Anbazhagan S., Thangavelu K.P. // J. Adv. Res. 2018. V. 14. № 1. P. 67.
Hsu C.-L., Li Yu-J., Jian H.-J. et al. // Nanoscale. 2018. V. 10. № 11. P. 11808.
Jin F., Xiang Q., Chen X. et al. // J. Biomater. Sci., Polym. Ed. 2016. V. 27. №. 14. P. 1447.
Wang R., Zhang B., Liang Z. et al. // Appl. Catal. B: Environmental. 2019. V. 241. № 1. P. 167.
Badireddy A.R., Hernandez-Delgadillo R., Sánchez-Nájera R.I. et al. // J. Nanopart. Res. 2014. V. 16. № 10. P. 2456.
Hernandez-Delgadillo R., Badireddy A.R., Martínez-Sanmiguel J.J. et al. // J. Nanosci. Nanotechnol. 2016. V. 16. № 1. P. 203.
Velasco-Arias D., Zumeta-Dubé I., Díaz D. et al. // J. Phys. Chem. C. 2012. V. 116. № 10. P. 14717.
Brown A.L., Goforth A.M. // Chem. Mater. 2012. V. 24. № 9. P. 1599.
Sancey B., Trunfio G., Charles J. et al. // J. Incl. Phenom. Macrocyc. Chem. 2011. V. 70. № 1. P. 316.
Besson J.C.F., Hernandes L., Campos J.M. et al. // Int. J. Care Injured. 2017. V. 48. № 8. P. 2417.
Mendes C., Meirelles G.C., Barp C.G. et al. // Carbohydr. Polym. 2018 V. 195. № 3. P. 586.
Боровикова Л.Н., Полякова И.В., Коротких Е.М. et al. // ЖФХ. 2018. Т. 92. № 11. С. 1760.
Zhang H., Tan T., Feng W., Spoel D. // J. Phys. Chem. B. 2012. V. 116. № 8. 12684.
Sikdera T., Rahmand M., Jakariya et al. // Chem. Eng. J. 2019. V. 355. № 3. P. 920.
Помогайло А.Д., Джардималиева Г.И. Металлополимерные гибридные нанокомпозиты. М.: Наука, 2015. 489 с.
Dadashi S., Poursalehi R., Delavari H.H. // Mater. Res. Bul. 2018. V. 97. № 2. P. 421.
Chaudhari U.E. // Orien. J. of Chem. 2011. V. 27. № 1. P. 297.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии