Журнал физической химии, 2019, T. 93, № 8, стр. 1169-1174
Энтальпийные характеристики растворения n-метилглицина в некоторых водно-органических смесях при 298.15 К
В. И. Смирнов a, *, В. Г. Баделин a
a Российская академия наук, Институт химии растворов им. Г.А. Крестова
153045 Иваново, Россия
* E-mail: vis@isc-ras.ru
Поступила в редакцию 21.10.2018
После доработки 20.11.2018
Принята к публикации 17.12.2018
Аннотация
Методом калориметрии определены энтальпии растворения N-метилглицина в водных растворах ацетонитрила (AN), 1,4-диоксана (DO), ацетона (AC) и диметилсульфоксида (DMSO) при концентрации органического растворителя x2 = 0 – 0.25 мол. доли и Т = 298.15 К. Результаты эксперимента использованы для расчета стандартных значений энтальпий растворения (${{\Delta }_{{{\text{sol}}}}}H^\circ $) и переноса (${{\Delta }_{{{\text{tr}}}}}H^\circ $) N-метилглицина из воды в смешанный растворитель, а также энтальпийных коэффициентов парных взаимодействий, (hxy ) N-метилглицина с молекулами органических растворителей. Рассмотрено влияние состава водно-органической смеси и структуры органических растворителей на энтальпийные характеристики растворения и переноса N-метилглицина. Оценено влияние энергетики межмолекулярных взаимодействий между компонентами смешанного растворителя на межмолекулярные взаимодействия N-метилглицина с молекулами сорастворителя. Выявлены основные свойства сорастворителя, существенно влияющие на энергетику взаимодействия с молекулами N-метилглицина в водном растворе – полярность/поляризуемость и электронодонорная способность сорастворителя.
В продолжение предыдущих термохимических исследований процессов растворения и сольватации N-метилглицина в смешанных растворителях (Н2О + спирты) и (Н2О + формамиды) [1, 2] в настоящей работе изучено влияние N-метилзамещения в молекуле глицина на его энтальпийные характеристики растворения в водных растворах ацетонитрила (AN), 1,4-диоксана (DO), ацетона (AC) и диметилсульфоксида (DMSO) при T = 298.15 K. Цель проведенных исследований состояла в следующем: а) получение новых экспериментальных данных для оценки влияния N-метилзамещения в NH2-группе молекулы глицина на его термохимические характеристики растворения в смешанных растворителях различной природы; б) оценка энергии межмолекулярных взаимодействий молекул N-метилглицина с молекулами AN, AC, DO и DMSO в водных растворах в зависимости от их концентрации (х2 = 0–0.25 мол. доли); в) оценка влияния энергии взаимодействия между компонентами водно-органической смеси и различных физико-химических свойств органических растворителей на энтальпийные характеристики растворения N-метилглицина в смешанных растворителях при Т = = 298.15 К. Представленные экспериментальные данные получены впервые. Результаты данной работы использованы для сравнения и совместного обсуждения с ранее полученными данными для глицина [3–5] и DL-α-аланина [6, 7] в аналогичных смесях.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В табл. 1 представлены характеристики веществ, использованных в экспериментах (их молекулярная масса, формула, марка, чистота и содержание Н2О). Моляльная концентрация (m) N-метилглицина в смешанном растворителе изменялась в области 5 × 10–3–1.5 × 10–2 моль кг–1. Органические растворители использовали без дальнейшей очистки. Концентрацию органических растворителей изменяли в диапазоне от 0 до 0.25 мол. доли. Воду очищали путем двойной дистилляции с последующей дегазацией (удельная электропроводность ~1 × 10–5 Ом см–1). Все растворы готовили непосредственно перед экспериментом. Навески N-метилглицина и водно-органические смеси взвешивали на весах ВЛР-200 (“Госметр”, Санкт-Петербург, Россия) с точностью 5 × 10–4 г. Экспериментальная калориметрическая установка, описана в работе [8]. Эксперименты проводили при Т = 298.15 ± 0.01 K. Калибровочные данные калориметра, расчет погрешностей измерений представлены в [9]. Относительная ошибка измерений не превышала 0.5%. Надежность полученных результатов подтверждена сравнением с аналогичными результатами других авторов. Полученные нами значения ${{\Delta }_{{{\text{sol}}}}}H^\circ $ (глицина) = 14.25 ± 0.06 кДж моль–1 [11], ${{\Delta }_{{{\text{sol}}}}}H^\circ $ (глицилглицина) = 17.62 ± 0.05 кДж моль–1 [11] и ${{\Delta }_{{{\text{sol}}}}}H^\circ $ (L-метионина) = 11.21 ± 0.08 кДж моль–1 [12] хорошо согласуются со значениями других авторов: 14.23 ± 0.02 [10], 17.69 ± 0.02 [11] и 11.30 ± 0.06 кДж моль–1 [12] соответственно.
Таблица 1.
Список реактивов, их марка и чистота
| Вещество | Формула | M, г моль–1 | CAS No. | Марка | Чистота | C*, мас. % |
|---|---|---|---|---|---|---|
| N-метилглицин | C3H7NO2 | 89.09 | 107-97-1 | Fluka | ≥0.990 | – |
| Ацетонитрил | C2H3N | 41.05 | 75-05-8 | Sigma-Aldrich | ≥0.998, (anhydrous) | <0.001 |
| 1,4-Диоксан | C4H8O2 | 88.11 | 123-91-1 | Fluka | ≥0.998 (anhydrous) | <0.003 |
| Ацетон | C3H6O | 58.08 | 67-64-1 | Fluka | ≥0.998 (GC) | <0.10 |
| Диметилсульфоксид | C2H6SO | 78.13 | 67-68-5 | Sigma | ≥0.995 (GC) | <0.10 |
| Вода | H2O | 18.02 | 7732-18-5 | – | H2O* | – |
Поскольку зависимости энтальпии растворения N-метилглицина от его концентрации в изученных водно-органических смесях не наблюдалось, за стандартные значения энтальпий растворения, ${{\Delta }_{{{\text{sol}}}}}H^\circ $, принято среднее значение ${{\Delta }_{{{\text{sol}}}}}{{H}^{m}}$ из пяти измерений для каждого состава смешанного растворителя. Стандартные значения энтальпий растворения $({{\Delta }_{{{\text{sol}}}}}H^\circ )$ N-метилглицина и стандартные отклонения этих значений в исследованных смесях представлены в табл. 2. Энтальпии переноса N-метилглицина $({{\Delta }_{{{\text{tr}}}}}H^\circ )$из воды в водно-органические смеси, графически представленные на рис. 1, вычислены из стандартных значений энтальпий растворения в воде (${{\Delta }_{{{\text{sol}}}}}H^\circ $(w)) и в водном растворе органического растворителя (${{\Delta }_{{{\text{sol}}}}}H^\circ $(w + y)) по уравнению:
(1)
${{\Delta }_{{{\text{tr}}}}}H^\circ = {{\Delta }_{{{\text{sol}}}}}H^\circ (w + y) - {{\Delta }_{{{\text{sol}}}}}H^\circ (w).$Таблица 2.
Стандартные значения энтальпий растворения N-метилглицина (${{\Delta }_{{{\text{sol}}}}}H^\circ $, кДж моль–1) и стандартные отклонения (u(${{\Delta }_{{{\text{sol}}}}}H^\circ $, кДж моль–1)) в водных растворах ацетонитрила (AN), 1,4-диоксана (DO), ацетона (AC) и диметилсульфоксида (DMSO) при их различной моляльной концентрации (m2) и T = 298.15 K
| AN | 1,4-DO | AC | DMSO | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| m2 | ${{\Delta }_{{{\text{sol}}}}}H^\circ $ | u(${{\Delta }_{{{\text{sol}}}}}H^\circ $) | m2 | ${{\Delta }_{{{\text{sol}}}}}H^\circ $ | u(${{\Delta }_{{{\text{sol}}}}}H^\circ $) | m2 | ${{\Delta }_{{{\text{sol}}}}}H^\circ $ | u(${{\Delta }_{{{\text{sol}}}}}H^\circ $) | m2 | ${{\Delta }_{{{\text{sol}}}}}H^\circ $ | u(${{\Delta }_{{{\text{sol}}}}}H^\circ $) |
| 0.787 | 3.95 | 0.01 | 0.518 | 4.24 | 0.01 | 0.569 | 4.31 | 0.01 | 0.591 | 4.41 | 0.01 |
| 1.810 | 3.89 | 0.01 | 1.111 | 4.43 | 0.01 | 1.219 | 4.92 | 0.01 | 1.255 | 4.64 | 0.01 |
| 2.661 | 3.86 | 0.02 | 1.698 | 4.76 | 0.02 | 1.828 | 5.39 | 0.02 | 2.034 | 5.12 | 0.02 |
| 3.634 | 3.83 | 0.01 | 2.352 | 5.04 | 0.02 | 2.572 | 5.75 | 0.02 | 2.854 | 5.55 | 0.02 |
| 4.737 | 3.78 | 0.02 | 3.074 | 5.38 | 0.02 | 3.324 | 6.18 | 0.02 | 3.812 | 6.03 | 0.02 |
| 5.856 | 3.74 | 0.01 | 3.970 | 5.81 | 0.02 | 4.113 | 6.59 | 0.02 | 4.831 | 6.54 | 0.02 |
| 7.112 | 3.68 | 0.02 | 4.817 | 6.09 | 0.02 | 4.927 | 6.98 | 0.02 | 6.023 | 7.01 | 0.02 |
| 8.499 | 3.62 | 0.02 | 5.938 | 6.56 | 0.02 | 6.028 | 7.49 | 0.03 | 7.367 | 7.42 | 0.02 |
| 9.941 | 3.56 | 0.02 | 7.109 | 6.97 | 0.02 | 7.072 | 7.99 | 0.03 | 8.888 | 7.91 | 0.03 |
| 11.210 | 3.48 | 0.02 | 8.579 | 7.41 | 0.02 | 8.283 | 8.51 | 0.03 | 10.764 | 8.39 | 0.03 |
| 15.519 | 3.37 | 0.01 | 11.995 | 8.03 | 0.02 | 11.023 | 9.44 | 0.03 | 15.496 | 9.21 | 0.03 |
Рис. 1.
Зависимости энтальпий переноса (${{\Delta }_{{{\text{tr}}}}}H^\circ $) N-метилглицина из Н2О в еe смеси с AN (1), DO (2), DMSO (3) и AC (4) от концентрации органических растворителей (x2) при Т = 298.15 К.

Энтальпия растворения N-метилглицина в воде составляет: ${{\Delta }_{{{\text{sol}}}}}H^\circ $(w) = 3.96 ± 0.04 кДж моль–1 [1].
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Анализ зависимостей энтальпий переноса ${{\Delta }_{{{\text{tr}}}}}H^\circ $ N-метилглицина из воды в водные растворы AN, DO, AC и DMSO (рис. 1) показывает, что энергетика взаимодействия молекул N-метилглицина с молекулами сорастворителей зависит как от их концентрации, так и от структуры. Если перенос в смесях (Н2О + DO), (Н2О + AC) и (Н2О + + DMSO) эндотермичен в исследованном диапазоне концентраций сорастворителей, то в смеси (Н2О + AN) – экзотермичен. Увеличение концентрации DO, AC и DMSO в воде вызывает увеличение эндотермичности растворения N-метилглицина в указанных смесях. Это связано с ростом энергетических затрат на дегидратацию молекул сорастворителя в общем энтальпийном эффекте растворения N-метилглицина и с увеличением вклада от гидрофобно-гидрофобных типов взаимодействия между –N(CH3)H–, (‒СН2)– $ \leftrightarrow $ –СН3–, (–СН2)-группами N-метилглицина и сорастворителя. Следует отметить, что эндотермичность переноса N-метилглицина увеличивается в ряду: (Н2О + AN) < (Н2О + DO) < < (Н2О + AC), в той же последовательности, что и электронодонорная способность (DN) указанных растворителей AN (14.1) < DO (14.5) < AC (17.0) [13], т.е. усиление электронодонорных свойств сорастворителя приводит к ослаблению его взаимодействия с молекулами N-метилглицина. Увеличение концентрации AN в водном растворе, напротив, приводит к усилению экзотермичности переноса N-метилглицина, что обусловлено низкими значениями энергии взаимодействия между компонентами смеси (Н2О + AN). Значения энтальпийных коэффициентов парных взаимодействий между ними следующие: h(C + W) = = ‒29 ± 3 (AN), –225 ± 30 (AC), –455 ± 14 (DO) и –995 ± 125 (DMSO) [14]. Поэтому эндотермический вклад от дегидратации молекул AN небольшой, и энергия прямых взаимодействий между молекулами N-метилглицина и AN перекрывает энергетические затраты на их дегидратацию.
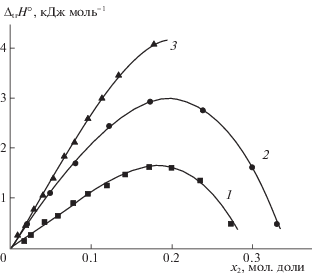
Сравнение зависимостей ${{\Delta }_{{{\text{tr}}}}}H^\circ $= f(x2) для N-метилглицина, глицина [3, 5] и DL-α-аланина [6, 7] в смесях (Н2О + AN) и (Н2О + DO) (рис. 2, 3) показывает, что замена протона в NH2-группе на гидрофобную СН3-группу в молекуле глицина (N-метилглицин) ослабляет его взаимодействие с молекулами AN и DO сильнее, чем аналогичная замена протона в СН2-группе глицина (DL-α-аланин). Это связано со снижением протонодонорной способности N-метилглицина по сравнению с DL-α-аланином. Аналогичная картина наблюдается и в смешанных растворителях (Н2О + + AС) и (Н2О + DMSO), т.е. ослабление межмолекулярных взаимодействий между молекулами сорастворителей и аминокислот происходит в следующем ряду: глицин < DL-α-аланин < N-метилглицин.
Рис. 2.
Зависимости энтальпий переноса (${{\Delta }_{{{\text{tr}}}}}H^\circ $) глицина (1), DL-α-аланина (2) и N-метилглицина (3) из Н2О в ее смеси с AN от его концентрации (x2) при Т = 298.15 К.
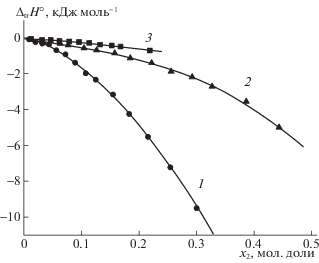
Рис. 3.
Зависимости энтальпий переноса (${{\Delta }_{{{\text{tr}}}}}H^\circ $) глицина (1), DL-α-аланина (2) и N-метилглицина (3) из Н2О в ее смеси с DO от его концентрации (x2) при Т = 298.15 К.
Для оценки энергетики межчастичных взаимодействий между молекулами аминокислоты и молекулами сорастворителя в водном растворе, согласно методу Каузмана [15], основанному на теории Макмиллана–Майера [16], использовано уравнение:
(2)
${{\Delta }_{{{\text{sol}}}}}H^\circ = {{a}_{0}} + {{a}_{1}}{{m}_{{\text{2}}}} + {{a}_{2}}m_{{\text{2}}}^{{\text{2}}} + {{a}_{3}}m_{{\text{2}}}^{{\text{3}}},$Таблица 3.
Расчетные параметры уравнения (2) для N-метилглицина в водных растворах ацетонитрила (AN), 1,4-диоксана (DO), ацетона (AC) и диметилсульфоксида (DMSO) при Т = 298.15 K
| Раство-ритель | a0 | a1 | R | SD |
|---|---|---|---|---|
| AN | 3.961 ± 0.014 | –0.028 ± 0.008 | 0.997 | 0.011 |
| DO | 3.962 ± 0.035 | 0.467 ± 0.026 | 0.999 | 0.031 |
| AC | 3.960 ± 0.081 | 0.795 ± 0.064 | 0.998 | 0.066 |
| DMSO | 3.960 ± 0.055 | 0.625 ± 0.034 | 0.999 | 0.052 |
Обозначения: a0, a1 – коэффициенты аппроксимации уравнения (2), R – коэффициент корреляции, SD – значения критерия Стьюдента, N = 11 – число экспериментальных точек.
Таблица 4.
Энтальпийные коэффициенты парных взаимодействий (hxy, Дж кг моль–2) N-метилглицина, глицина and DL-α-аланина с молекулами ацетонитрила (AN), 1,4-диоксана (DO), ацетона (AC) и диметилсульфоксида (DMSO) в водных растворах и их стандартные отклонения u(hxy, Дж кг моль-2)
Отметим, что такой же порядок изменения энергии межчастичных взаимодействий в указанных смесях наблюдается и для глицина, и для DL-α-аланина (табл. 4). Ранее нами были установлены линейные зависимости величины энтальпийных коэффициентов парных взаимодействий различных аминокислот с молекулами спиртов [18–20], амидов [21–23] и апротонных органических растворителей [14] от энтальпийных коэффициентов парных взаимодействий h(C + W) (Н2О + спирты (амиды)), которые свидетельствуют о том, что сильные межчастичные взаимодействия между компонентами в самой водно-органической смеси ослабляют энтальпийный эффект от межчастичных взаимодействий между молекулами аминокислоты и сорастворителя. Используя рассчитанные значения h(C + W) для указанных выше смесей [14], мы установили линейную взаимосвязь hxy = f(h(C + W)) для N-метилглицина, а также для глицина и DL-α-аланина в серии водно-органических смесей: (H2O + AN), (H2O + AC) и (H2O + DO) соответственно:
(3)
$\begin{gathered} {{h}_{{xy}}}\, = \,( - {\text{2}}0.{\text{845}}\, \pm \,{\text{46}}.{\text{4}}00)\, - \,(0.{\text{959}}\, \pm \,0.{\text{158}}){{h}_{{(C + W)}}}, \\ R = 0.{\text{986}}, \\ \end{gathered} $(4)
$\begin{gathered} {{h}_{{xy}}}\, = \,( - {\text{1}}0{\text{5}}.{\text{5}}0{\text{2}}\, \pm \,{\text{57}}.{\text{426}})\, - \,({\text{1}}.{\text{224}}\, \pm \,0.{\text{195}}){{h}_{{(C + W)}}}, \\ R = 0.{\text{987}}, \\ \end{gathered} $(5)
$\begin{gathered} {{h}_{{xy}}}\, = \,( - {\text{76}}.{\text{454}}\, \pm \,0.{\text{372}})\, - \,({\text{1}}.{\text{263}}\, \pm \,0.00{\text{1}}){{h}_{{(C + W)}}}, \\ R = 0.{\text{999}}. \\ \end{gathered} $Увеличение эндотермичного значения hxy N-метилглицина в ряду: (H2O + AN) < (H2O + DO) < < (H2O + DMSO), может быть связано с усилением электронодонорных свойств сорастворителей в той же последовательности (DN = 14.1 < 14.3 < < 29.9) [13]. Это приводит к усилению взаимодействия молекул сорастворителя с молекулами воды, часть которых будет удалена из гидратной оболочки сорастворителя при взаимодействии с молекулами N-метилглицина, т.е. затраты энергии на частичную дегидратацию молекул сорастворителя возрастут, а значение hxy N-метилглицина увеличится. Если сравнить значения hxy N‑метилглицина, глицина и DL-α-аланина (табл. 4), то можно увидеть, что ослабление межчастичных взаимодействий с молекулами AN и DO происходит в следующем порядке: глицин > > DL-α-аланин > N-метилглицин. Это может быть связано с уменьшением дипольного момента аминокислот в том же порядке: µ = 2.151, 2.020, 1.697. При взаимодействии указанных аминокислот с молекулами AC и DMSO такой зависимости не наблюдается, поскольку существенно возрастает роль как донорно-акцепторных взаимодействий (DN(AC) = 17.0; DN(DMSO) = 29.9), так и гидрофобно-гидрофобных взаимодействий (молекулы AC и DMSO содержат по две СН3-группы). Величина же hxy определяется соотношением энтальпийных вкладов от перечисленных типов межмолекулярных взаимодействий.
Поскольку в настоящей работе мы расширили круг органических растворителей, использованных в качестве сорастворителя, то представилась возможность выяснить, какие свойства органических растворителей оказывают существенное влияние на их межчастичные взаимодействия с молекулами N-метилглицина. Для этого было использовано модифицированное уравнение Камлета–Тафта [24]:
(6)
${{h}_{{xy}}} = {{A}_{0}} + {{A}_{1}}(\pi _{1}^{*}\pi _{2}^{*}) + {{A}_{2}}({{\alpha }_{{\text{1}}}}{{\beta }_{{\text{2}}}}) + {{A}_{3}}({{\beta }_{{\text{1}}}}{{\alpha }_{{\text{2}}}})$(7)
$\begin{gathered} {{h}_{{xy}}} = ({\text{629}}.{\text{33}} \pm {\text{168}}.{\text{76}}) - ({\text{1331}}.{\text{27}} \pm {\text{157}}.{\text{76}}) \times \\ \times \;(\pi _{1}^{*}\pi _{2}^{*}) - {\text{1335}}.0{\text{7}} \pm {\text{582}}.{\text{55}})({{\alpha }_{{\text{1}}}}{{\beta }_{{\text{2}}}}) + \\ + \;({\text{12}}0{\text{2}}.{\text{13}} \pm {\text{156}}.{\text{84}})({{\beta }_{{\text{1}}}}{{\alpha }_{{\text{2}}}}), \\ R = 0.{\text{953}},\quad N = {\text{11}},\quad SD = {\text{98}}.{\text{25}}. \\ \end{gathered} $Анализ уравнения (7) показывает, что увеличение полярности/поляризуемости и кислотности органического растворителя усиливает энергию парных взаимодействий N-метилглицин – органический растворитель. Напротив, увеличение основности органического растворителя уменьшает энергию парных взаимодействий N-метилглицин – органический растворитель. Аналогичное влияние указанных свойств органических растворителей на их межчастичные взаимодействия с другими аминокислотами наблюдалось в работах [23, 27, 28].
В заключение отметим, что термохимические характеристики растворения и сольватации N-метилглицина в бинарных смесях воды с апротонными электронодонорными органическими растворителями, будут определяться электронодонорной способностью сорастворителя (увеличение DN уменьшает энтальпийный эффект растворения N-метилглицина), гидрофобными свойствами сорастворителя (увеличение числа гидрофобных групп в молекуле сорастворителя также уменьшает энтальпийный эффект растворения N-метилглицина) и концентрацией со-растворителя в водном растворе. Замена протона в NH2-группе молекулы глицина на СН3-группу (N-метилглицин) ослабляет межмолекулярные взаимодействия аминокислоты с молекулами электронодонорных растворителей в водных растворах. Это связано с усилением гидрофобных свойств N-метилглицина и ослаблением донорно-акцепторных взаимодействий с молекулами сорастворителя. Усиление полярности, поляризуемости и кислотности сорастворителя увеличивает энергию его взаимодействия с молекулами N-метилглицина, а усиление основности сорастворителя – уменьшает. Ослабление межмолекулярных взаимодействий между молекулами изученных сорастворителей и производными глицина происходит в следующем порядке: глицин < DL-α-аланин < N-метилглицин.
Список литературы
Баделин В Г., Смирнов В.И. // Журн. физ. химии. 2018. Т. 92. № 7. С. 1062.
Smirnov V.I., Badelin V.G. // J. Mol. Liquid. 2018. V. 255. P. 471.
Смирнов В.И., Баделин В.Г., Межевой И.Н. // Изв. вузов. Химия и хим. технол. 2003. Т. 46 . № 1. С. 91.
Smirnov V.I., Badelin V.G. // Biophysics. 2004. V. 49. № 3. P. 375.
Smirnov V.I., Badelin V.G. // Russ. J. Phys. Chem. A. 2005. V. 79. № 4. P. 583.
Смирнов В.И., Межевой И.Н., Баделин В.Г. // Изв. вузов. Химия и хим. технол. 2004. Т. 47. С. 38.
Smirnov V.I., Badelin V.G., Meжeвoй И.H. // Russ. J. Phys. Chem. A. 2006. V. 80. № 5. P. 672.
Badelin V.G., Tyunina E.Yu., Mezhevoi I.N. // Russ. J. Appl. Chem. 2007. V. 80. P. 711.
Smirnov V.I., Badelin V.G. // Thermochim. Acta. 2015. V. 606. P. 41.
Palecz B. // J. Therm. Anal. Calorim. 1998. V. 54. P. 257.
Piekarski H., Nowicka B. // J. Therm. Anal. Calorim. 2010. V. 102. P. 31.
Palecz B., Piekarski H., Romanowski W. // J. Mol. Liquid. 2000. V. 84. № 3. P. 279.
Gutman V. The Donor–Acceptor Approach to Molecular Interactions. New York: Plenum Press, 1978.
Smirnov V.I., Badelin V.G. // Russ. J. Phys. Chem. A. 2018. V. 92. № 1. P. 93.
Kozak J.J., Knight W.S., Kauzmann W. // J. Chem. Phys. 1968. V. 48. P. 675.
McMillan W.G., Mayer J.E. // J. Chem. Phys. 1945. V. 13. P. 276.
Piekarski H., Tkaczyk M. // J. Chem. Soc. Faraday Trans. 1991. V. 87. P. 3661.
Badelin V.G., Smirnov V.I. // Russ. J. Phys. Chem. A. 2010. V. 84. P. 1163.
Smirnov V.I., Badelin V.G. // Thermochim. Acta. 2009. V. 495. P. 90.
Smirnov V.I., Badelin V.G. // Ibid. 2011. V. 526. P. 46.
Smirnov V.I., Badelin V.G. // Ibid. 2010. 503–504. P. 97.
Smirnov V.I., Badelin V.G. // Ibid. 2013. V. 551. P. 145.
Smirnov V.I., Badelin V.G. // J. Chem. Ing. Data. 2014. V. 56. P. 1774.
Kamlet M.J., Abraham M.H., Doherty R.M., Taft R.W. // J. Am. Chem. Soc.1984. V. 106. P. 464.
Kamlet M.J., Taft R.W. // Ibid. 1976. V. 98. P. 377.
Kamlet M.J., Abboud J.L.M., Taft R.W. // Ibid. 1977. V. 99. P. 6027.
Smirnov V.I. Badelin V.G. // J. Mol. Liquids. 2017. V. 229. P. 198.
Smirnov V.I. Badelin V.G. // Thermochim. Acta. 2015. V. 616. P. 20.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


