Журнал физической химии, 2019, T. 93, № 9, стр. 1342-1348
Термодинамика образования бис-комплексов меди(II) с триглицином в водных растворах
Г. Г. Горболетова a, *, С. А. Бычкова a
a Ивановский государственный химико-технологический университет
Москва, Россия
* E-mail: gorboletova@mail.ru
Поступила в редакцию 12.10.2018
После доработки 20.11.2018
Принята к публикации 15.12.2018
Аннотация
Прямым калориметрическим методом измерены тепловые эффекты взаимодействия растворов триглицина с растворами Cu(NO3)2 при температуре 298.15 K в интервале значений ионной силы от 0.2 до 1.0 (KNO3). По результатам калориметрических измерений рассчитаны энтальпии реакций образования комплексов CuL2, CuH–1L$_{2}^{ - }$ и CuH–2L$_{2}^{{2 - }}$. Получены термодинамические характеристики (ΔrH°; ΔrG°; ΔrS°) процессов комплексообразования. С помощью анализа полученных термодинамических параметров и результатов спектрофотометрических измерений сделаны заключения о структуре изучаемых комплексов.
В данной работе, как и в [1, 2] прямым калориметрическим методом, определены тепловые эффекты образования комплексов меди(II) с триглицином при температуре 298.15 K в интервале значений ионной силы от 0.2 до 1.0 (KNO3).
Аминокислоты и пептиды – одни из наиболее биологически важных лигандов. Термодинамические данные для процессов, протекающих в растворах олигопептидов, могут представлять интерес при изучении полимеризации аминокислот [3], необходимы для понимания механизмов регуляции клеточного метаболизма и стабилизации биомолекулярных конформаций [4]. Процессы образования комплексов низкомолекулярных пептидов с такими металлами, как медь(II), никель(II), палладий(II) являются определяющими для связывания этих металлов в физиологических условиях [5]. Комплексные соединения, содержащие аминогруппы, карбоксильные и амидные группы, используются в качестве лекарственных средств [6, 7].
Изучение структуры и устойчивости комплексов меди(II) с триглицином проводилось в последние годы различными методами [8, 9]. Ранее нами было изучено взаимодействие ионов Cu(II) с триглицином потенциометрическим методом [10]. Были определены состав и устойчивость комплексов триглицина c ионами Cu(II) в широком интервале концентрационных соотношений при Т = 298.15 K и I = 0.2 (KNO3). Установлено существование частиц CuHL2+, CuHL$_{2}^{ + }$, CuH2L$_{2}^{{2 + }}$, CuL+, CuH–1L, CuH–2L–, CuH–3L2–, CuL2, CuH–1L$_{2}^{ - }$ и CuH–2L$_{2}^{{2 - }}$. Для бис-комплексов Cu(II) с триглицином величины констант устойчивости составили: lg β (CuL2) = 9.72 ± 0.05; lg β (CuH–1L$_{2}^{ - }$) = = 3.82 ± 0.05; lg β (CuH–2L$_{2}^{{2 - }}$) = –3.91 ± 0.05.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Тепловые эффекты смешения и разведения измеряли в калориметре с изотермической оболочкой и автоматической записью кривой калориметрического опыта [11]. Калибровку калориметра проводили электрическим током. В работе использовали глицил-глицил-глицин фирмы “Sigma” без дополнительной очистки. Перед взятием навески пептид высушивали до постоянной массы при 343 K. Растворы триглицина готовили растворением навесок препарата в свежеприготовленном дистилляте непосредственно перед проведением калориметрического опыта. Для приготовления растворов Cu(NO3)2 использовали соль марки “х. ч.”. Исходный раствор анализировали комплексонометрически и иодометрически. В калориметрический стаканчик помещали растворы триглицина с заданным значением рН, для поддержания которого использовали реактивы HNO3 и KOH квалификации “х. ч”. В качестве фонового электролита использовали KNO3, перекристаллизованный из дистиллята. Опыты проводили при 298.15 K и значениях ионной силы 0.2, 0.5, 1.0. Величины рН контролировали с помощью прибора “Мультитест” ИПЛ-311. Для расчета доверительного интервала среднего значения ΔН из трех параллельных опытов критерий Стьюдента брали при доверительной вероятности 0.95.
В исследуемой системе Сu(II)–триглицин возможно протекание следующих реакций:
(2)
${{{\text{L}}}^{--}} + 2{{{\text{H}}}^{ + }} \leftrightarrow {{{\text{H}}}_{2}}{{{\text{L}}}^{ + }},$(3)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}} \leftrightarrow {\text{Cu}}{{{\text{L}}}^{ + }},$(4)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}} \leftrightarrow {\text{Cu}}{{{\text{L}}}_{2}},$(5)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}}{\kern 1pt} --{\kern 1pt} {{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--1}}}{\text{L}},$(6)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}}{\kern 1pt} --{\kern 1pt} 2{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--2}}}{{{\text{L}}}^{--}},$(7)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}}{\kern 1pt} --{\kern 1pt} 3{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--3}}}{{{\text{L}}}^{{2--}}},$(8)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}}{\kern 1pt} --{\kern 1pt} {{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--1}}}{\text{L}}_{2}^{ - },$(9)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}}{\kern 1pt} --{\kern 1pt} 2{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{{--2}}}{\text{L}}_{2}^{{2 - }},$(10)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {{{\text{L}}}^{--}} + {{{\text{H}}}^{ + }} \leftrightarrow {\text{CuH}}{{{\text{L}}}^{{2 + }}},$(11)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}} + {{{\text{H}}}^{ + }} \leftrightarrow {\text{CuHL}}_{2}^{ + },$(12)
${\text{C}}{{{\text{u}}}^{{2 + }}} + 2{{{\text{L}}}^{--}} + 2{{{\text{H}}}^{ + }} \leftrightarrow {\text{Cu}}{{{\text{H}}}_{2}}{\text{L}}_{2}^{{2 + }},$(13)
${{{\text{H}}}^{ + }} + {\text{O}}{{{\text{H}}}^{--}} \leftrightarrow {{{\text{H}}}_{2}}{\text{O}},$(14)
${\text{C}}{{{\text{u}}}^{{2 + }}} + {\text{HOH}} \leftrightarrow {\text{CuO}}{{{\text{H}}}^{ + }} + {{{\text{H}}}^{ + }}.$При определении изменения энтальпии в процессе комплексообразования частицы CuH–2L$_{2}^{{2 - }}$ в калориметрическую ячейку помещали триглицин, нейтрализованный КОН до рН 12.4. В стеклянную ампулу вводили точную навеску раствора нитрата меди(II) (1.0498 моль/кг раствора). Соотношение $c_{{{\text{Cu}}}}^{^\circ }:c_{{\text{L}}}^{^\circ }$ в конце калориметрического опыта составляло 1 : 2, рН 10.7. Также измеряли теплоты разведения растворов Cu(NO3)2 в растворах фонового электролита КNO3. Экспериментальные данные приведены в табл. 1.
Таблица 1.
Тепловые эффекты (кДж/моль) взаимодействия раствора Сu(NO3)2 (1.0498 моль/кг раствора) с раствором триглицина (0.02040 моль/л)
| I(KNO3) | m, г | –∆mixH1 | m, г | –∆dilH | –∆rH1 |
|---|---|---|---|---|---|
| $c_{{{\text{Cu}}}}^{^\circ }:c_{{\text{L}}}^{^\circ }$ = 1 : 2; ∆рН = 12.4–10.7) | |||||
| 0.2 | 0.39030 | 95.80 | 0.39005 | 1.02 | 94.76 |
| 0.39025 | 95.78 | 0.39015 | 1.01 | 94.74 | |
| 0.39015 | 95.60 | 0.39010 | 1.08 | 94.56 | |
| 0.5 | 0.39020 | 98.75 | 0.39010 | 2.52 | 96.15 |
| 0.38990 | 98.49 | 0.39015 | 2.67 | 95.89 | |
| 0.39020 | 98.62 | 0.39030 | 2.61 | 96.02 | |
| 1.0 | 0.39010 | 100.56 | 0.39025 | 4.22 | 96.37 |
| 0.39020 | 100.60 | 0.39030 | 4.16 | 96.41 | |
| 0.39025 | 100.36 | 0.39005 | 4.18 | 96.17 | |
Как видно из диаграмм равновесия в системе Cu2+ – триглицин (рис. 1, 2), невозможно провести независимые друг от друга определения энтальпий образования комплексов CuL2 и CuH–1L$_{2}^{ - }$. Энтальпии образования частиц CuL2 и CuH–1L$_{2}^{ - }$ определяли в интервале pH 11.9–7.4 и 8.6–5.9 при соотношении концентраций $c_{{{\text{Cu}}}}^{^\circ }:c_{{\text{L}}}^{^\circ }$ = 1 : 2 и 1 : 3 соответственно. В качестве калориметрической жидкости выступал раствор триглицина с концентрацией 0.02 и 0.03 моль/л объемом 39.86 мл. Концентрация раствора Cu(NO3)2 в калориметрической ячейке после разрушения ампулы составляла ∼0.01 моль/л. Экспериментальные данные приведены в табл. 2, 3.
Рис. 1.
Диаграмма распределения частиц в системе Cu2+ – триглицин (с°(Cu2+) = 1 × 10–2 моль/л, с°(L–) = 1 × 10–2 моль/л); 1 – Cu2+, 2 – CuHL2+, 3 – CuH2L$_{2}^{{2 + }}$, 4 – CuHL$_{2}^{ + }$, 5 – CuL+, 6 – CuL2, 7 – CuH–1L$_{2}^{ - }$, 8 – CuH–1L, 9 – CuH–2L–, 10 – CuH–3L2–.

Рис. 2.
Диаграмма распределения частиц в системе Cu2+ – триглицин (с°(Cu2+) = 1 × 10–2 моль/л, с°(L–) = 5 × 10–2 моль/л); 1 –10 – см. рис. 1, 11 – CuH–2L$_{2}^{{2 - }}$.
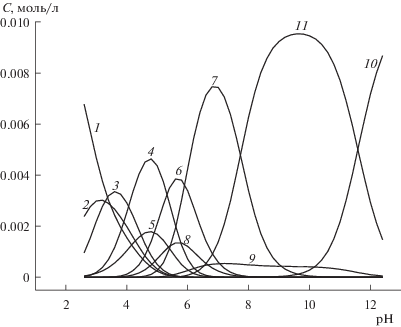
Таблица 2.
Тепловые эффекты (кДж/моль) взаимодействия раствора Сu(NO3)2 (1.0498 моль/кг раствора) с раствором триглицина (0.2040 моль/л)
| I(KNO3) | m, г | –∆mixH2 | –∆rH2 |
|---|---|---|---|
| ($c_{{{\text{Cu}}}}^{^\circ }:c_{{\text{L}}}^{^\circ }$ = 1 : 2; ∆рН = 11.9–7.4) | |||
| 0.2 | 0.39020 | 71.04 | 70.00 |
| 0.39015 | 70.96 | 69.92 | |
| 0.39000 | 71.11 | 70.07 | |
| 0.5 | 0.39030 | 74.08 | 71.48 |
| 0.39025 | 73.93 | 71.33 | |
| 0.39010 | 73.88 | 71.28 | |
| 1.0 | 0.39010 | 76.72 | 72.53 |
| 0.39015 | 76.58 | 72.39 | |
| 0.39025 | 76.56 | 72.37 | |
Таблица 3.
Тепловые эффекты (кДж/моль) взаимодействия раствора Сu(NO3)2 (1.0498 моль/кг раствора) с раствором триглицина (0.03000 моль/л)
| I(KNO3) | m, г | –∆mixH3 | –∆rH3 |
|---|---|---|---|
| ($c_{{{\text{Cu}}}}^{^\circ }:c_{{\text{L}}}^{^\circ }$ = 1 : 3; ∆рН = 8.6–5.9) | |||
| 0.2 | 0.39015 | 45.55 | 44.51 |
| 0.39025 | 45.59 | 44.55 | |
| 0.39005 | 45.53 | 44.49 | |
| 0.5 | 0.39020 | 47.51 | 44.91 |
| 0.39035 | 47.35 | 44.75 | |
| 0.39000 | 47.31 | 44.71 | |
| 1.0 | 0.39005 | 49.51 | 45.32 |
| 0.39015 | 49.39 | 45.20 | |
| 0.39010 | 49.45 | 45.26 | |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Энтальпии процессов образования комплексов Сu2+ с триглицином можно рассчитать по уравнению:
(15)
$\begin{gathered} {{\Delta }_{{{\text{mix}}}}}H - {{\Delta }_{{{\text{dil}}}}}H = {{\alpha }_{1}}\Delta {{H}_{{{\text{Cu}}{{{\text{L}}}_{2}}}}} + {{\alpha }_{2}}\Delta {{H}_{{{\text{Cu}}{{{\text{H}}}_{{ - 1}}}{\text{L}}_{2}^{ - }}}} + \\ + \;{{\alpha }_{3}}\Delta {{H}_{{{\text{Cu}}{{{\text{H}}}_{{ - 2}}}{\text{L}}_{2}^{{2 - }}}}} + \sum {{{\alpha }_{i}}{{\Delta }_{{\text{r}}}}{{H}_{i}}} , \\ \end{gathered} $Условия проведения калориметрических опытов выбирали таким образом, чтобы вклад побочных процессов был минимальным. Необходимые для расчета энтальпии и константы реакций кислотно-основного взаимодействия в растворах триглицина взяты из работ [12, 13], энтальпии реакций образования депротонированных монолигандных комплексов CuH–1L, CuH–2L–, CuH–3L2– – из [1], комплексов CuL+, CuHL2+, CuHL$_{2}^{ + }$, CuH2L$_{2}^{{2 + }}$ – из [2]. Вклад теплового эффекта процесса (14) стремился к нулю.
Равновесный состав растворов в условиях каждого опыта и энтальпии образования частиц CuL2, CuH–1L$_{2}^{ - }$ и CuH–2L$_{2}^{{2 - }}$ рассчитывали с помощью универсальных программ, более подробно описанных в [1]. Максимальный выход комплекса CuH-2L$_{2}^{{2 - }}$ в условиях проведения эксперимента составил около 66%. Полнота протекания реакции (6) составляла 22%, реакции (7) – 12%. Результаты расчета ΔrН(CuH–2L$_{2}^{{2 - }}$) приведены в табл. 4. В экспериментальных условиях определения энтальпий образования частиц CuL2 и CuH–1L$_{2}^{ - }$ при одновременном протекании равновесий (4) и (8) доля образования комплекса CuL2 в зависимости от концентрации триглицина и рН раствора колебалась от 4 до 27%, а комплекса CuH–1L$_{2}^{ - }$ – от 17 до 48%. Величины энтальпий образования изучаемых комплексов приведены в табл. 4.
Таблица 4.
Стандартные термодинамические характеристики процессов образования комплексов Cu2+ с триглицином
| Процесс | lg βo | ΔrН°, кДж/моль | ΔrG°, кДж/моль | ΔrS°, Дж/(моль K) |
|---|---|---|---|---|
| I = 0 | ||||
| Cu2+ + 2L– ↔ CuL2 | 10.53 ± 0.05 | –40.83 ± 0.32 | –60.10 ± 0.29 | 64.6 ± 0.3 |
| Cu2+ + 2L––H+ ↔ CuH–1L$_{2}^{ - }$ | 4.36 ± 0.05 | –15.46 ± 0.36 | –24.89 ± 0.29 | 31.6 ± 0.3 |
| Cu2+ + 2L––2H+ ↔ CuH–2L$_{2}^{{2 - }}$ | –3.91 ± 0.05 | 8.83 ± 0.30 | 22.32 ± 0.29 | –45.2 ± 2.0 |
| Cu2+ + L– ↔ CuL+ | 5.78 ± 0.02 | –17.08 ± 0.30 | –32.99 ± 0.11 | 53.4 ± 0.6 |
| Cu2+ + L––H+ ↔ CuH–1L | 0.43 ± 0.02 | –0.25 ± 0.26 | –2.45 ± 0.11 | 7.4 ± 0.5 |
| Cu2+ + L––2H+ ↔ CuH–2L– | –6.52 ± 0.02 | 42.54 ± 0.30 | 37.22 ± 0.11 | 17.9 ± 0.6 |
| Cu2+ + L––3H+ ↔ CuH–3L2– | –17.22 ± 0.02 | 86.58 ± 0.30 | 98.29 ± 0.11 | –39.3 ± 0.6 |
| Cu2+ + L– + H+ ↔ CuHL2+ | 9.79 ± 0.03 | –47.83 ± 0.30 | –55.88 ± 0.17 | 27.0 ± 0.4 |
| Cu2+ + 2L– + H+ ↔ CuHL$_{2}^{ + }$ | 15.85 ± 0.10 | –69.88 ± 0.30 | –90.47 ± 0.57 | 69.1 ± 0.9 |
| Cu2+ + 2L– + 2H+ ↔ CuH2L$_{2}^{{2 + }}$ | 19.64 ± 0.10 | –91.77 ± 0.30 | –112.11 ± 0.57 | 68.2 ± 0.9 |
| I = 0.2 | ||||
| Cu 2+ + 2L– ↔ CuL2 | 9.72 ± 0.05 | –41.72 ± 0.20 | –55.48 ± 0.29 | 46.2 ± 0.3 |
| Cu2+ + 2L––H+ ↔ CuH–1L$_{2}^{ - }$ | 3.82 ± 0.05 | –17.07 ± 0.22 | –21.80 ± 0.29 | 15.9 ± 0.3 |
| Cu2+ + 2L––2H+ ↔ CuH–2L$_{2}^{{2 - }}$ | –3.91 ± 0.05 | 8.44 ± 0.22 | 22.32 ± 0.29 | –46.5 ± 1.7 |
| I = 0.5 | ||||
| Cu 2+ + 2L– ↔ CuL2 | 9.58 ± 0.05 | –40.91 ± 0.28 | –54.68 ± 0.29 | 46.2 ± 0.3 |
| Cu2+ + 2L––H+ ↔ CuH–1L$_{2}^{ - }$ | 3.72 ± 0.05 | –19.08 ± 0.28 | –21.23 ± 0.29 | 7.2 ± 0.3 |
| Cu2+ + 2L––2H+ ↔ CuH–2L$_{2}^{{2 - }}$ | –3.93 ± 0.05 | 7.70 ± 0.28 | 22.43 ± 0.29 | –49.4 ± 1.9 |
| I = 1.0 | ||||
| Cu 2+ + 2L– ↔ CuL2 | 9.48 ± 0.05 | –39.90 ± 0.20 | –54.11 ± 0.29 | 47.7 ± 0.3 |
| Cu2+ + 2L––H+ ↔ CuH–1L$_{2}^{ - }$ | 3.64 ± 0.05 | –21.01 ± 0.24 | –20.78 ± 0.29 | –0.8 ± 0.3 |
| Cu2+ + 2L––2H+ ↔ CuH–2L$_{2}^{{2 - }}$ | –3.96 ± 0.05 | 6.71 ± 0.26 | 22.60 ± 0.29 | –53.3 ± 1.8 |
Тепловые эффекты при фиксированных значениях ионной силы экстраполировали на нулевую ионную силу по уравнению:
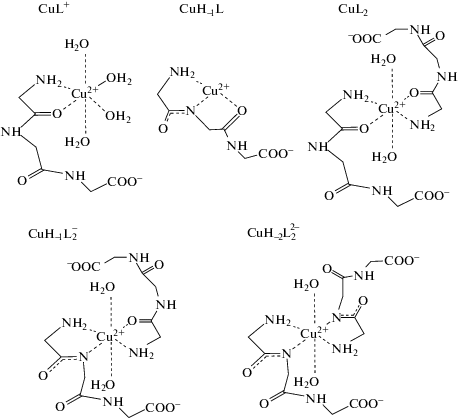
где ΔН и ΔН0 – изменение энтальпии при конечном значении ионной силы и I = 0, соответственно; Ψ(I) – функция ионной силы, вычисленная теоретически; ΔZ2 – разность квадратов зарядов продуктов реакции и исходных компонентов; b – эмпирический коэффициент. Результаты расчета термодинамических характеристик при I = 0 и фиксированных значениях ионной силы приведены в табл. 4. Анализ полученных термодинамических параметров (табл. 4) позволяет предположить, что наиболее вероятны структуры изучаемых комплексов, представленные на рис. 3.В табл. 4 приведены также термодинамические характеристики образования триглицинатных комплексов меди(II), полученные ранее [1, 2]. Величины изменения энтальпии в процессах образования частиц CuL+ и CuL2 свидетельствуют о бидентатной координации лиганда в моно- и бис-комплексах, когда координация триглицина осуществляется через азот аминогруппы и кислород ближайшей к ней пептидной группы с образованием пятичленных хелатных колец. При этом в моно- и бис-комплексах лиганд координируется в экваториальном положении (рис. 3). Близкие для обоих комплексов величины ΔrS° (табл. 4) показывают, что наиболее вероятно образование цис-изомера частицы CuL2. В случае транс-конфигурации двух карбонильных групп бис-комплекса, как это предложено в [9], величина ΔrS°(CuL2) была бы гораздо больше ΔrS°(CuL+) вследствие затруднений во внутрисферной координации молекул воды между двумя гидрофобными группами.
Так как кислород пептидной группы – более слабый донор электронной плотности по сравнению с кислородом карбоксильной группы, энтальпии образования частиц CuL+ и CuL2 по абсолютной величине меньше, чем ΔrН° комплексов Cu(Gly)+ и Cu(Gly)2 (соответственно –27.04 и –53.87 кДж/моль) [14].
Предположение об экваториальной координации азота амидных групп в депротонированных бис-комплексных частицах CuH-1L$_{2}^{ - }$ и CuH–2L$_{2}^{{2 - }}$, структурные формулы которых представлены на рис. 3, подтверждается полученными термодинамическими параметрами (табл. 4). Экзотермичность процесса образования комплекса CuH–1L$_{2}^{ - }$ на ∼2 кДж/моль меньше, чем можно было бы ожидать от объединения частиц CuL+ и CuH–1L. Расхождение в величинах ΔrН реакций образования комплекса CuH–2L$_{2}^{{2 - }}$ и суммы двух ΔrН реакций образования комплексов CuH–1L составляет ∼9 кДж/моль. При этом обратная тенденция наблюдается для величин ΔrS, характеризующих рассматриваемые процессы, что свидетельствует о более значительной гидратации бис-комплексных частиц по сравнению с монокомплексными частицами. Подобные закономерности были отмечены для процессов образования депротонированных комплексов никеля(II) с триглицином (ΔrН°(NiH–1L+) = 34.03 кДж/моль; ΔrН°(NiH–2L2) = = 88.47 кДж/моль) [15], а также комплексов меди(II) с L-гистидином, в экваториальной координации которого участвуют амино- и имидазольная группы (ΔrН°(Cu(His)+) = –47.34 кДж/моль, ΔrН°(Cu(His)2) = –81.24 кДж/моль) [16]. Вероятно, увеличение эндотермичности при одновременной координации двух лигандов в случае образования депротонированных бис-комплексов связано с ослаблением σ-связей между атомами азота и ионом меди(II) в этих комплексах по сравнению с депротонированными монолигандными комплексами.
Структурные предположения наряду с термодинамическими параметрами подтверждаются также спектральными данными. На рис. 4 и 5 представлены спектры поглощения растворов Cu2+ в присутствии триглицина при соотношениях Cu : L = 1 : 1; 1 : 5 и различных значениях рН. Видно, что увеличение рН раствора приводит к росту оптической плотности и смещению максимума поглощения в коротковолновую часть спектра. Это связано с процессами ступенчатого комплексообразования и соответствует, согласно диаграммам равновесий (рис. 1, 2), увеличению количества координированных атомов. Картина несколько усложняется при образовании депротонированных частиц. Согласно диаграмме равновесий (рис. 1), в области рН 6.2 образуется ∼60% комплекса CuH–1L и 20% CuH–2L–. В спектрах поглощения (рис. 4, кривая 4) при данном значении рН наблюдается полоса поглощения с максимумом при 650 нм и максимальным значением оптической плотности 0.5. Согласно диаграмме равновесий (рис. 2), в области рН 8 образуется ∼30% комплекса CuH–1L$_{2}^{ - }$ и 60% CuH–2L$_{2}^{{2 - }}$, что приводит к смещению максимума в коротковолновую часть спектра (рис. 5, кривая 9) и, очевидно, связано с увеличением количества хелатных колец. Однако, для последней кривой максимальное значение оптической плотности практически не отличается от аналогичной величины на кривой 4 рис. 4 и составляет 0.55. Это можно объяснить стабилизацией электронной плотности и, как следствие, затруднением ее сдвига в координационной сфере депротонированных бис-комплексов меди(II) благодаря отсутствию там атомов кислорода, а также за счет гидрофильной гидратации находящихся в координационной сфере азотсодержащих групп.
Рис. 4.
Спектры поглощения: 1 – иона Cu2+ (с°(Cu2+) = 8 × 10–3 моль/л), 2 – 7 – иона Cu2+ в присутствии триглицина (с°(L–) = 8 × 10–3 моль/л) при различных значениях рН: 2 – 4.2, 3 – 5.2, 4 – 6.1, 5 – 7.0, 6 – 7.8, 7 – 8.9.
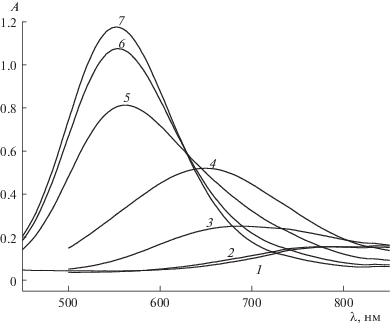
Рис. 5.
Спектры поглощения: 1 – иона Cu2+ (с°(Cu2+) = 8 × 10–3 моль/л), 2 – 10 – иона Cu2+ в присутствии триглицина (с°(L–) = 4 × 10–2 моль/л) при различных значениях рН: 2 – 3.2, 3 – 3.6, 4 – 4.1, 5 – 4.6, 6 – 5.1, 7 – 5.7, 8 – 6.5, 9 – 7.9, 10 – 11.9.

Работа выполнена в рамках НИИ Т и К ИГХТУ и Государственного задания (базовая часть), проект № 4.7104.2017/8.9.
Список литературы
Горболетова Г.Г., Метлин А.А., Бычкова С.А. // Журн. физ. химии. 2017. Т. 91. № 12. С. 2077.
Горболетова Г.Г., Метлин А.А. // Там же. 2018. Т. 92. № 11. С. 1720.
Kitadai N. // J. Mol. Evol. 2014. V. 78. P. 171.
Wang P., Wesdemiotis C., Kapota C., Ohanessian G. // J. Am. Soc. Mass Spectrom. 2007. V. 18. P. 541.
Sanna D., Agoston C., Micera G. et al. // Polyhedron. 2001. V. 20. P. 3079.
Xia-Bing Fu, Zi-Hua Lin, Hai-Feng Liu et al. // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2014. V. 122. P. 22.
Dharmaraja J., Esakkidurai T., Subbaraj P. et al. // Spectrochimica Acta Part A: Molecular and Biomolecular Spectroscopy. 2013. V. 114. P. 607.
Илакин В.С., Штырлин В.Г., Захаров А.В., Конькин А.Л. // Журн. общ. химии. 2002. Т. 72. Вып. 3. С. 377.
Nagy N.V., Szabo-planka T., Rockenbauer A. et al. // J. Am. Chem. Soc. 2003. V. 125. P. 5227.
Метлин А.А., Горболетова Г.Г., Бычкова С.А., Березина Н.М. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1115.
Лыткин А.И., Черников В.В., Крутова О.Н., Скворцов И.А., Корчагина А.С. // Журн. физ. химии. 2017. Т. 91. № 1. С. 5.
Горболетова Г.Г., Бычкова С.А., Метлин А.А. // Изв. вузов. Химия и хим. технология. 2016. Т. 59. Вып. 2. С. 57.
Лыткин А.И., Черников В.В., Крутова О.Н., Горболетова Г.Г., Скворцов И.А., Корчагина А.С. // Журн. неорган. химии. 2017. Т. 62. № 2. С. 249.
Горболетова Г.Г., Метлин А.А. // Журн. физ. химии. 2013. Т. 87. № 5. С. 785.
Горболетова Г.Г., Метлин А.А., Бычкова С.А. // Там же. 2018. Т. 92. № 5. С. 684.
Горболетова Г.Г., Метлин А.А. // Там же. 2015. Т. 89. № 2. С. 237.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии