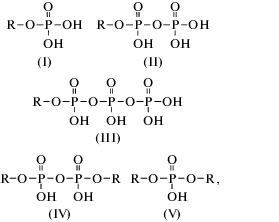Журнал физической химии, 2019, T. 93, № 9, стр. 1401-1409
Влияние состава этерифицирующей смеси на кислотные свойства гелеобразующих фосфорилированных полисахаридов
Т. Л. Юркштович a, Н. В. Голуб a, С. О. Соломевич a, *, Н. К. Юркштович a, П. М. Бычковский a, Р. И. Костерова a, В. А. Алиновская a
a Белорусский государственный университет, Научно-исследовательский институт физико-химических проблем
Минск, Республика Беларусь
* E-mail: sergeysolomevich@gmail.com
Поступила в редакцию 13.11.2018
После доработки 18.02.2019
Принята к публикации 12.03.2019
Аннотация
Изучены физико-химические и биологические свойства гидрогелей на основе фосфатов крахмала, декстрана и целлюлозы, синтезированных в системах ортофосфорная кислота–трибутилфосфат–оксид фосфора(V) и ортофосфорная кислота–мочевина. Установлено, что показатели кажущихся констант ионизации фосфатных групп по первой ступени находятся в интервале 2.5–2.9 и практически не зависят от природы исходного полисахарида, способа этерификации, концентрации функциональных групп. Сделан вывод, что отличия потенциометрических кривых в области титрования слабокислотных групп обусловлены наличием в составе фосфатов полисахаридов карбаматных групп, которые способствуют формированию более сшитой структуры гидрогелей, затрудняющей ионизацию фосфатных групп по второй ступени. Выявлена противоопухолевая активность гелеобразующих фосфорилированных полисахаридов.
Синтез и исследование физико-химических свойств гидрогелей на основе полисахаридов, представляющих собой трехмерную сетку из сшитых макромолекул, – одно из перспективных и интенсивно развивающихся направлений в химии высокомолекулярных соединений. Высокая сорбционная емкость гидрогелей по отношению к гидрофильным низко- и высокомолекулярным биологическим веществам, способность сохранять нативную структуру биополимеров в процессе сорбции и десорбции, а также низкая токсичность, биосовместимость, биодеградируемость позволяет использовать их в медицине и биотехнологии в качестве носителей для иммобилизации клеток, белков, пептидов, витаминов, противоопухолевых препаратов и др. биологически активных веществ [1–3].
Среди модифицированных полисахаридов в отдельную группу можно выделить фосфорилированные полисахариды, которые наряду с названными свойствами обладают способностью к комплексообразованию, проявляют высокую селективность по отношению к белкам, иммуностимулирующую и противоопухолевую активность [4–8].
К перспективным методам этерификации полисахаридов, применяемых для получения фосфорсодержащих гидрогелей, можно отнести системы ортофосфорная кислота–мочевина и ортофосфорная кислота–трибутилфосфат–оксид фосфора(V) благодаря возможности достижения высокой степени замещения по фосфорсодержащим группам [4, 9], варьирования параметров структуры полимерной сетки гидрогелей, что удобно при создании полимеров-носителей низко- и высокомолекулярных биологически активных соединений.
В [5, 6, 10] нами изучена эффективность применения гелеобразующих фосфорилированных полисахаридов разной степени сшивки при создании пролонгированных форм некоторых противоопухолевых веществ (проспидина, темозоломида, цисплатина, оксалиплатина). Было отмечено, что электролитические свойства гидрогелевых матриц определяют скорость релиза биологически активных веществ.
Цель настоящей работы – сравнительное изучение кислотно-основных свойств гидрогелей на основе фосфатов целлюлозы, декстрана, крахмала, полученных в системах ортофосфорная кислота–трибутилфосфат–оксид фосфора(V) и ортофосфорная кислота–мочевина, оценка их противоопухолевой активности.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез фосфатов полисахаридов (ФП) в системе, содержащей ортофосфорную кислоту (“ч”, ГОСТ 6552-80, $\rho _{4}^{{20}} = 1.698$ г/мл; с = 85.4%), трибутилфосфат (“х. ч.”, Alfa Aesar, $\rho _{4}^{{20}} = 0.98$ г/мл), оксид фосфора(V) (“ч”, ТУ 6-09-417385) проводили в течение 6–50 ч при температуре 313 K согласно методу [4]. Смешанные эфиры полисахаридов (ФКП), содержащие одновременно фосфатные и карбаматные группы, получали путем обработки полисахаридов смесями ортофосфорной кислоты и мочевины (“ч”, ГОСТ 6691-77) при разном мольном соотношении в течение 4 ч при температуре 408 K, давлении 0.005–0.010 МПа [9]. После охлаждения реакционной смеси до комнатной температуры добавляли дистиллированную воду, продукт реакции этерификации переводили в Na-форму, для чего приливали 30%-ный раствор NaCl в водно-этанольной смеси (содержание спирта 70%, модуль ванны 1 : 20 г/мл), подщелоченный гидроксидом натрия до рН 11–12.
Продукты реакции (ФП, ФКП) промывали пятикратно 50%-ным раствором этилового спирта (массовый модуль 1:10), высушивали.
Состав продуктов реакции, степень набухания (Q) определяли методами элементного анализа, ИК-спектроскопии, гравиметрии [5, 9–14]. Характеристики фосфатов полисахаридов и условия реакции приведены в табл. 1.
Таблица 1.
Физико-химические свойства полисахаридов, фосфорилированных в системах ортофосфорная кислота–оксид фосфора–трибутилфосфат и ортофосфорная кислота–мочевина
| № | Поли-сахарид | Система этерифи-кации | Мольное соотношение | t, ч | СР, ммоль/г | СN, ммоль/г | Q, г/г | ОЕ1 | ПОЕ | рK1 | рK2 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Na-форма | Н-форма | |||||||||||
| 1 | Крахмал | Н3РО4 : (NH2)2CО | 1 : 0.4 : 4.0 | 4 | 2.4 | 1.1 | 26.5 | 16.6 | 1.9 | 4.4 | 2.9 | – |
| 2 | 1 : 0.6 : 4.0 | 3.4 | 1.2 | 23.8 | 9.3 | 3.2 | – | 2.7 | – | |||
| 3 | 1 : 0.8 : 4.0 | 3.8 | 1.4 | 14.7 | 5.1 | 3.6 | – | 2.7 | – | |||
| 4 | Декстран | 1 : 0.4 : 4.0 | 1.9 | 1.3 | 152.1 | 34.7 | 1.9 | – | 2.8 | – | ||
| 5 | 1 : 0.7 : 4.0 | 2.6 | 1.4 | 71.2 | 18.6 | 2.6 | – | 2.8 | – | |||
| 6 | 1 : 1.0 : 4.0 | 3.2 | 1.7 | 47.8 | 9.2 | 3.3 | – | 2.7 | ||||
| 7 | Декстран | Н3РО4 : Р2О5 : Bu3PO4 | 1 : 6.1 : 10.0 : 4.6 | 6 | 2.1 | – | в/р | в/р | 2.2 | 4.4 | 2.8 | 6.8 |
| 8 | 18 | 3.1 | – | 48.3 | 3.0 | 6.3 | 2.6 | 6.8 | ||||
| 9 | 50 | 4.9 | – | 21.0 | 4.6 | 9.2 | 2.6 | 6.9 | ||||
| 10 | Целлюлоза | 1 : 20.0 : 10.0 : 5.0 | 4 | 2.1 | – | 36.3 | 43.2 | 2.0 | 4.1 | 2.7 | 6.7 | |
| 11 | 6 | 2.8 | – | 37.6 | 42.6 | 2.6 | 5.4 | 2.6 | 6.5 | |||
| 12 | 24 | 4.6 | – | 36.8 | 46.1 | 4.5 | 8.9 | 2.5 | 6.5 | |||
Фосфаты крахмала и декстрана получали в виде микрогелей с размерами в диапазоне от 0.05 до 1050 мкм (максимальное объемное содержание (25–60%) колеблется в интервале 150–450 мкм), а также фосфат целлюлозы, представляющий собой гелеобразующую пористую салфетку. Ширина и толщина волокон салфетки фосфата целлюлозы составляли 10–50 мкм и 1–5 мкм соответственно. Фосфат декстрана (ФД) и целлюлозы (ФЦ) после обработки в системе ортофосфорная кислота–оксид фосфора(V)–трибутилфосфат находились в Н-форме.
Для проведения потенциометрического титрования образцы Na-соли смешанных эфиров ФКК и ФКД, содержащие фосфатные и карбаматные группы, переводили в Н-форму обработкой 0.2 н. раствором соляной кислоты в смеси вода:этанол (содержание спирта – 70%) в течение 30 мин. Н-форму фосфорилированных полисахаридов (ФКП) отфильтровывали на фильтре Шотта с размером 100 мкм, промывали путем контактирования с 50%-ным раствором этанола при перемешивании в течение 1.5–2 ч (массовый модуль 1:10) и последующим фильтрованием на фильтре Шотта.
Потенциометрическое титрование образцов ФП и ФКП в Н-форме проводили методом одной навески на фоне ионной силы 0.05 [15]. Титрование образцов осуществляли 0.05 н. раствором гидроксида натрия, содержащим фиксированное количество NaCl в качестве фонового электролита. Отношение массы катионита к объему раствора составляло 1:250 г/мл.
Для описания кислотных свойств катионитов в работе использовано уравнение Гельденсона–Гассельбаха:
где n – коэффициент кооперативности процесса ионизации; αi – степень ионизации фосфорнокислых групп по первой и второй ступени:Оценку противоопухолевого эффекта гидрогелей на основе ФКП и ФП в условиях in vitro проводили на монослойной культуре опухолевых клеток Hela (эпителиоидная карциома шейки матки человека, клон М) путем сравнения количества выживших клеток с их исходным числом до воздействия гидрогелей:
где Nо и Nк – среднее число клеток в опытной и контрольной группах в конце эксперимента, Nисх – исходное число клеток, перед добавлением ФП и ФКП, а также на основании показателя эффективности противоопухолевого действия (ИК50), численно равного концентрации гидрогелей, вызывающей ингибирование пролиферации на 50%.Сравнительное изучение противоопухолевой активности фосфорилированных полисахаридов на примере ФКД в опытах in vivo проводили на моделях саркомы М-1 (Банк опухолевых штаммов РОНЦ им. Н.Н. Блохина РАМН, Москва) и саркомы Йенсена (Институт цитологии РАН, Санкт-Петербург). Исследование проводили в соответствии с техническим кодексом “Надлежащая лабораторная практики” (введен Постановлением МЗ РБ от 28.03.2008 г. № 56) и международными этическими и научными стандартами качества планирования и проведения исследований на животных (Хельсинская декларация Всемирной медицинской ассоциации, 2000 г.).
Для экспериментов крысам перевивали опухоли подкожно в область левого бедра, вводя 0.5 мл 20%-й взвеси опухолевой ткани. Эксперименты проводили на 7–10 сутки после перевивки опухоли крысам (80 крыс с саркомой М-1 и 40 крыс с саркомой Йенсена). Гидрогели ФП и ФКП вводили однократно внутрибрюшинно (в объеме 1 мл на 100 г массы животного). В качестве критериев оценки противоопухолевой эффективности гидрогелей ФКД использовали динамику роста опухолей, измерение объема которых проводили 3 раза в неделю, а также процент торможения опухоли.
Объем опухолей (V, см3) измеряли по формуле:
где a, b, c – линейные размеры опухоли, см. Процент торможения опухоли (Т, %) рассчитывали по уравнению: где: Vк и Vо – средние размеры опухоли у крыс контрольной и опытной групп.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Обработка полисахаридов в системах ортофосфорная кислота–мочевина и ортофосфорная кислота–оксид фосфора(V)–трибутилфосфат является известным методом введения в их состав фосфорсодержащих групп. Согласно данным [10, 11], в указанных смесях в условиях реакции протекают процессы образования полифосфорных кислот, которые влияют на ход этерификации и могут приводить к получению гелеобразующих катионитов.
Возможные фосфорсодержащие группы в составе катионитов приведены ниже:
где R – остаток полисахарида.Видно, что каждый атом фосфора в фосфатах полисахаридов имеет одну сильнокислотную гидроксильную группу, а концевые фосфаты – дополнительно слабокислотную группу. Для полученных катионитов, в состав которых могут входить двухосновные, одноосновные фосфаты и полифосфаты, экспериментально можно определить только две усредненные константы ионизации: для сильнокислотных и слабокислотных групп.
Наличие в составе продуктов реакции фосфатов подтверждено методом ИК-спектроскопии [4, 5]. В ИК-спектре Na-формы фосфорнокислых катионитов появляются полосы поглощения в области 955–1055 см–1 (симметричные и асимметричные валентные колебания групп C–Р–О), полосы поглощения при 1220 см–1 (валентные колебания группы Р=О) и 760 см–1 (валентные колебания связи –Р–О–Р–), которые свидетельствуют о присутствии в составе катионитов фосфатов и полифосфатов. Интенсивная полоса поглощения при 1715 см–1 в ИК-спектрах ФКД, полученных в системе ортофосфорная кислота–мочевина, обусловлена асимметричными валентными колебаниями связей С=О карбаматных групп [5, 11].
На рис. 2–4 приведены кривые потенциометрического титрования фосфорилированных полисахаридов: крахмала, декстрана, целлюлозы. Результаты сравнения кривых титрования, полученных разными способами, показывают, что в области рН < 5.0, соответствующей полной нейтрализации сильнокислотных групп, они практически идентичны. Совпадение кривых свидетельствует о том, что показатели кислотности по первой ступени фосфорнокислых катионитов не чувствительны к методу синтеза, а также природе полисахарида, входящего в их состав (табл. 1). Следовательно, при ионизации сильнокислотных групп первой ступени избирательность сорбции катионов натрия разными фосфорнокислыми катионитами одинакова, что свидетельствует о наличии достаточно сильных электростатических взаимодействий функциональная группа – противоион, нивелирующих индивидуальные особенности различных катионитов.
Рис. 1.
Интегральные (а) и дифференциальные (б) кривые потенциометрического титрования целлюлозы (1), декстрана (2–5), фосфорилированных в различных этерифицирующих смесях: 1, 2, 4 – ортофосфорная кислота–оксид фосфора–трибутилфосфат; 3, 5 – ортофосфорная кислота–мочевина. Содержание фосфорнокислых групп: 2.0–2.2 (1–3); 3.0–3.2 ммоль/г (4, 5). Ионная сила 0.05.

Рис. 2.
Интегральные (а) и дифференциальные (б) кривые потенциометрического титрования крахмала (1, 2) и декстрана (3, 4), фосфорилированных в системе ортофосфорная кислота–мочевина. Содержание фосфорнокислых групп: 2.0–2.2 (1, 2) и 3.2 ммоль/г (3, 4).

Рис. 3.
Кривые потенциометрического титрования фосфатов крахмала (1); декстрана (2–4); целлюлозы (5) в координатах уравнения Гендерсона–Гассельбаха в области титрования сильнокислотных групп. Содержание фосфорнокислых групп: 2.0–2.2 (1–3); 3.2–3.4 (3, 4); 4.5 ммоль/г (5). Этерифицирующие системы: 1–3 – ортофосфорная кислота–мочевина; 4, 5 – ортофосфорная кислота–оксид фосфора(V)–трибутилфосфат.
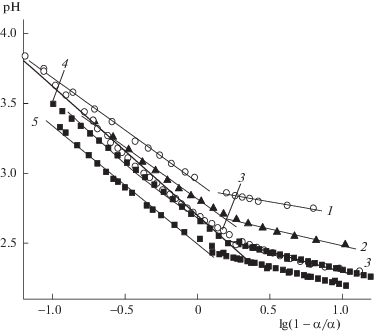
Рис. 4.
Кривые потенциометрического титрования фосфатов целлюлозы (1, 2), декстрана (3, 4) в координатах уравнения Гендерсона–Гассельбаха в области слабокислотных групп. Содержание фосфорнокислых групп: 2.0–2.2 (1, 3), 3.2 (4) и 4.5 ммоль/г (2). Этерифицирующая система – ортофосфорная кислота–оксид фосфора(V)–трибутилфосфат.
По мере увеличения степени диссоциации функциональных групп (рН > 5.0) различия между кривыми рН = f(mNaOH) фосфатов полисахаридов, полученных разными способами, возрастают: наиболее четко выражены точки перегиба для ФД и ФЦ, полученных в системе ортофосфорная кислота–оксид фосфора(V)–трибутилфосфат. Одновременно на дифференциальных кривых титрования данных катионитов наблюдаются два максимума, положение которых соответствует обменной емкости по первой ступени (ОЕ1) и полной обменной емкости (ПОЕ). Видно, что интервалы до первой точки и от первой до второй точек эквивалентности, соответствующей обменной емкости слабокислотных групп (ОЕ2), практически равны между собой. Это свидетельствует о том, что в состав катионитов, полученных в системе ортофосфорная кислота–оксид фосфора(V)–трибутилфосфат, входят преимущественно однозамещенные фосфорнокислые группы.
Из рис. 2 видно, что для смешанных эфиров ФКК и ФКД, полученных в системе ортофосфорная кислота–мочевина, зависимость рН = = f(mNaOH) имеет смазанный вид: для участка титрования слабокислотных групп характерно наличие не только одной, но несколько неявно выраженных ступеней, аналогичных кривым титрования полифункциональных кислот. При этом эффект выравнивания кривых титрования слабокислотных групп возрастает с ростом содержания в образцах фосфора, а также при переходе от ФКД к ФКК, имеющего более низкую степень набухания (табл. 1). Соответственно (рис. 2б) на дифференциальных кривых имеется только один ярко выраженный пик: в более щелочной области рН он либо размыт, либо отсутствует. Как следует из дифференциальной кривой смешанных эфиров ФКК и ФКД, количество щелочи, пошедшее на титрование слабокислотных групп больше, чем слабокислотных, что не согласуется с представленными выше структурными формулами. Вероятная причина этого – частичное перекрывание процессов титрования сильно- и слабокислотных групп.
Очевидно, существенным фактором, влияющим на электролитические свойства слабокислотных групп гидрогелей смешанных эфиров, является наличие в их составе дополнительных полярных карбаматных групп (табл. 1), образующих интенсивные внутри- и межмолекулярные водородные связи с фосфатными, гидроксильными группами катионита и играющих важную роль в формировании его сшитой структуры, доступности функциональных групп для титранта. Следует отметить, что локальная прочность системы водородных связей будет зависеть как от локальной концентрации функциональных групп, так и от числа химических сшивок между макромолекулами полисахарида, образованных при участии двухзамещенных фосфатов (структура V, IV). Неоднородность системы водородных связей в гидрогелях может быть причиной неоднородности кислотности слабокислотных групп [16].
Таким образом, сопоставление кривых потенциометрического титрования фосфорилированных полисахаридов позволяет сделать вывод, что ФП, синтезированные в системе ортофосфорная кислота–оксид фосфора(V)–трибутилфосфат, представляют собой двухосновные катиониты. В то же время кривые титрования смешанных эфиров крахмала и декстрана, полученные в системе ортофосфорная кислота–мочевина, имеют вид, характерный для полифункциональных катионитов.
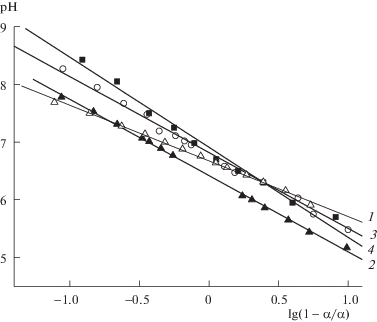
Для определения показателя кислотности сильно- и слабокислотных групп катионитов использовали графический способ решения уравнения Гендерсона–Гассельбаха. Из рис. 3 видно, что зависимость между рН раствора и величиной lg(1 – α1/α1) в области титрования сильнокислотных групп характеризуется двумя прямыми: одна – при значениях степени нейтрализации (α1) до 0.4–0.5 и вторая – α > 0.5. Аналогичная зависимость рН = f[lg(1 – α/α)] наблюдалась и для других полиэлектролитов, например, полиметакриловой кислоты [15]. Известное объяснение этого факта состоит в том, что существенный вклад в энергию Гиббса при ионизации функциональных групп полиэлектролитов вносит процесс конформационных переходов сегментов макромолекул.
Согласно литературным данным, можно предположить, что при α1 < 0.4 происходит нейтрализация, во-первых, сильнокислотных групп, расположенных на поверхности гидрогелей, в области пор и дефектов и связанных между собой более слабыми водородными связями; во-вторых, сильнокислотных групп, ставших доступными в результате конформационных превращений. Эффект конформационных превращений макромолекул связан с тем, что по мере роста α1 электролитическое отталкивание ионизированных фосфатных групп становится способным разрывать межмолекулярные водородные связи, которые в гидрогелях могут образовываться как между недиссоциированными фосфорсодержащими группами одной или соседних цепей, так и между фосфатными и гидроксильными, фосфатными и карбаматными группами. Разрушение межмолекулярных водородных связей на участках макромолекул между сшивками сопровождается раскручиванием и выправлением сегментов макромолекул в полимерной сетке гидрогелей, что приводит к росту доступности функциональных групп и способствует усилению кислотности гидрогелей. Следует отметить, что изменение конформации полимерной сетки сопровождается значительным увеличением степени набухания гидрогелей (в ∼2–3 раза).
При α1 > 0.5 наклон линейной зависимости рН = = f[lg(1 – α1/α1)] резко увеличивается, т.е. характер зависимости кислотных свойств ФП и ФКП от α1 становится типичным для катионитов и объясняется влиянием кулоновского эффекта на энергию взаимодействия протонов с фосфатными группами гидрогелей [15]. Следует отметить, что характер зависимости рН = f[lg(1 – α1/α1)] и значение α1, при котором наблюдается перелом кривых, практически не зависит от природы полисахарида, способа получения, что может указывать на определяющую зависимость конформационных изменений от наличия фосфатных групп.
Полученная зависимость рН от степени ионизации сильнокислотных групп обусловливает некорректность расчета константы ионизации сильнокислотных групп рK1 согласно уравнению Гендерсона–Гассельбаха. В данном исследовании значение рK1 (табл. 1) принимали равным рН при степени нейтрализации 0.5.
В области рН > 5.0, где титруются слабокислотные группы, для ФП, синтезированных в системе ортофосфорная кислота–оксид фосфора(V)–трибутилфосфат, имеет место линейная зависимость рН = f[lg(1 – α2/α2)]. Это свидетельствует о том, что на данном участке кривой титрования существенные изменения структуры гидрогелей отсутствуют. Необходимо отметить, что оценка рK2 фосфатов полисахаридов, синтезированных в системе ортофосфорная кислота–мочевина, в работе не проведена, так как определить полную обменную емкость смешанных эфиров по экспериментальным данным, представленным на рис. 1 и 2, невозможно. Рассчитанные по уравнению Гендерсона–Гассельбаха значения pK2 ряда катионитов представлены в табл. 1.
Данные табл. 1 показывают, что величины pK1 фосфорилированных полисахаридов сравнительно мало зависят от концентрации фосфатных групп в фазе гидрогеля, природы полисахарида, способа этерификации. Как свидетельствуют полученные результаты, величины pK1 = 2.5–2.9 для ФП и ФКП выше по сравнению с pK сильнокислотных групп низкомолекулярных ортофосфорной (pK1 = 2.0), а также пирофосфорной (pK1 = = 1.09, pK2 = 2.0) кислот. В то же время показатель кислотности второй ступени ионизации (pK2 = = 6.5–6.9) фосфорнокислых групп ФП по величине соответствует показателю кислотности слабокислотных групп фосфорной (pK2 = 6.8) и пирофосфорной (pK3 = 6.6) кислот.
Из табл. 1 видно, что гелеобразующие фосфорилированные полисахариды являются катионитами с полной обменной емкостью в интервале 4.4–8.9 мг-экв г–1 и могут найти применение в медицине в качестве полимеров-носителей биологически активных веществ, в частности, противоопухолевых веществ.
Результаты сравнительного исследования собственной противоопухолевой активности фосфатов полисахаридов в условиях in vitro представлены в табл. 2. Из данных табл. 2 видно, что цитостатическая активность фосфорилированных полисахаридов является дозозависимой и при фиксированной концентрации образцов увеличивается по мере роста содержания в катионитах фосфорнокислых групп. В то же время существенных различий в противоопухолевой активности фосфатов полисахаридов в зависимости от природы исходного полисахарида (крахмал, декстран), способа получения не выявлено.
Таблица 2.
Влияние исходных и модифицированных полисахаридов на рост культуры опухолевых клеток HeLa в течение 72 ч
| № | Полисахарид | СР, ммоль/г | СN, ммоль/г | Концен-трация, мг/мл | Число клеток (×103) | Прирост (в % к конт-ролю) | ИК50, мг/мл | ||
|---|---|---|---|---|---|---|---|---|---|
| Nисх | N | N – Nисх | |||||||
| контроль | 180 ± 60 | 805 ± 45 | 625 | 100 | |||||
| 1 | исходный декстран | – | – | 1 | 720 ± 35 | 540 | 86 | >2.0 | |
| 2 | 550 ± 55 | 370 | 59 | ||||||
| 2 | фосфат карбамат декстрана | 1.9 | 1 | 505 ± 45 | 325 | 52 | 1.5 | ||
| 2 | 480 ± 30 | 300 | 48 | ||||||
| 4 | 3.2 | – | 1 | 505 ± 20 | 325 | 52 | 1.1 | ||
| 2 | 410 ± 20 | 230 | 37 | ||||||
| 5 | фосфат декстрана | 2.1 | – | 1 | 795 ± 40 | 615 | 98 | 2.0 | |
| 2 | 490 ± 33 | 340 | 50 | ||||||
| 6 | 3.1 | – | 1 | 520 ± 20 | 340 | 54 | 1.2 | ||
| 2 | 408 ± 20 | 228 | 36 | ||||||
| 7 | фосфат карбамат крахмала | 2.4 | 1.1 | 1 | 460 ± 35 | 280 | 45 | 0.9 | |
| 2 | 420 ± 25 | 240 | 38 | ||||||
| 8 | 3.4 | 1.2 | 1 | 465 ± 30 | 285 | 46 | 0.9 | ||
| 2 | 365 ± 30 | 185 | 30 | ||||||
| 9 | 3.8 | 1.4 | 1 | 460 ± 30 | 280 | 45 | 0.9 | ||
| 2 | 215 ± 20 | 35 | 6 | ||||||
Противоопухолевый эффект фосфата декстрана был подтвержден в опытах in vivo (рис. 5). Как видно из рис. 5, после введения ФКД объем опухолей (V, см3) крыс по сравнению с контролем уменьшается, что свидетельствует о том, что гидрогели вызывают торможение роста опухолей. Процент торможения опухоли для суспензии гидрогелей ФКД на 28 сутки наблюдения животных составлял 57% для саркомы Йенсена – 92%.
Рис. 5.
Динамика роста объема (V) Са М-1 (1, 2) и саркомы Йенсена (3, 4) крыс в контроле (1, 3) и после внутрибрюшинного введения фосфата декстрана (содержание фосфатов 2.2 ммоль/г) в дозе 2000 (2) и 1000 мг (4).

Таким образом, сравнительный анализ данных потенциометрического титрования показал, что фосфаты полисахаридов, полученные в системе ортофосфорная кислота–трибутилфосфат–оксид фосфора(V), являются двухосновными катионитами. Кривые титрования смешанных эфиров полисахаридов, полученные путем этерификации в системе ортофосфорная кислота–мочевина, имеют вид, характерный для полифункциональных катионитов. Значения pK1 полученных полиэлектролитов находятся в пределах 2.5–2.9 и практически не зависят от способа получения, природы полисахарида, концентрации функциональных групп. Отличия на участке потенциометрической кривой в области титрования слабокислотных групп связаны с наличием в смешанных эфирах крахмала и декстрана карбаматных групп, которые способствуют формированию более сшитой структуры гидрогелей, затрудняющей ионизацию фосфатных групп по второй ступени. В опытах in vitro и in vivo показано, что включение фосфатных групп в состав полисахаридов приводит к повышению их противоопухолевой активности.
Список литературы
Tomme S.R.V., Hennink W.E. // Expert Rev. Med. Devices. 2007. V. 4. P. 147.
Peppas N.A., Kim B. // J. Drug Del. Sci. Tech. 2006. V. 16. P. 11.
Oh J.K., Lee D.I., Park J.M. // Progress in Polymer Sci. 2009. V. 34. P. 1261.
Granja P.L., Pouységu L., Pétraud M. et al. // J. Appl. Polymer Sci. 2001.V. 82. Iss. 13. P. 3341.
Yurkshtovich T.L., Golub N.V., Yurkshtovich N.K. et al. // Appl. Biochem. Microbiology. 2017. V. 53. P. 5378.
Ревтович М.Ю., Истомин Ю.П., Красько О.В. и др. // Рос. биотерапевт. журн. 2016. Т. 15. № 4. С. 97.
Kokol V., Božič M., Vogrinčič R. et al. // Carbohydr. Polym. 2015. P. 125.
Petreus T., Stoica B.A., Petreus O. et al. // J. Mater. Sci.: Mater. Med. 2014. V. 25. Iss. 4. P. 1115.
Heinze U., Klemm D., Under E. et al. // Starch/Stärke. 2003. V. 55. P. 55.
Соломевич С.О., Бычковский П.М., Юркштович Т.Л. и др. // Журн. прикл. химии. 2016. Т. 89. Вып. 8. С. 17.
Юркштович Н.К., Голуб Н.В., Юркштович Т.Л. и др. // Журн. Белорусского гос. ун-та. Химия. 2017. № 1. С. 16.
Murphy J., Riley J.H. // Anal. Chim. Acta. 1962. V. 27. P. 31.
Jones J.B. Kjeldahl method for nitrogen determination / Ed. by J.B. Jones. Athens: Micro-Macro Publishing, 1991. 79 p.
Колориметрические (фотометрические) методы определения неметаллов / Под ред. А.И. Бусева. М.: Изд-во иностр. лит., 1963. 467 с.
Либинсон Г.С. Физико-химические свойства карбоксильных катионитов. М.: Наука, 1969. 176 с.
Демин А.А., Чернова И.А., Шатаева Л.К. Ионообменная сорбция биологически активных веществ. Изд-во С.-Пб. ун-та. 2008. 154 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии