Журнал физической химии, 2019, T. 93, № 9, стр. 1392-1400
Термодинамика адсорбции изомерных дипиридилов и их производных из водно-органических растворов на пористом графитированном углероде Hypercarb™
Б. Р. Сайфутдинов a, b, *, А. К. Буряк a
a Российская академия наук, Институт физической химии и электрохимии им. А.Н. Фрумкина
119071 Москва, Россия
b Самарский государственный технический университет
443100 Самара, Россия
* E-mail: sayf_br@mail.ru
Поступила в редакцию 28.12.2018
После доработки 08.02.2019
Принята к публикации 14.02.2019
Аннотация
Методом высокоэффективной жидкостной хроматографии в условиях, приближенных к равновесным, изучена адсорбция изомерных дипиридилов и их производных из водно-ацетонитрильных, водно-метанольных и водно-изопропанольных растворов на графитоподобном углеродном материале Hypercarb™ в области закона Генри. Исследованный графитоподобный углеродный материал Hypercarb™ проявляет высокую адсорбционную селективность при разделении изученных изомерных дипиридилов и их производных. Показано, что возможность образования прочной внутримолекулярной C–H–N'-водородной связи в молекуле 2,2'-дипиридила и его производных усиливает адсорбционное связывание молекул-адсорбатов с поверхностью графитоподобного материала за счет стабилизации их планарной конформации. Дестабилизация этой внутримолекулярной водородной связи за счет введения заместителей в различные положения пиридиновых циклов способствует специфическому межмолекулярному взаимодействию молекул-адсорбатов с компонентами растворителя и искажению планарной конформации дипиридилов, тем самым, ослабляя их удерживание на материале Hypercarb™. Установлено, что для всех исследованных дипиридилов, за исключением 2,2'-дипиридил-N,N'-диоксида, характерна положительная адсорбция из водно-органических сред на углеродном адсорбенте, в то время как 2,2'-дипиридил-N,N'-диоксид адсорбируется слабее компонентов растворителя. Обнаружены аномальные зависимости среда – свойство для термодинамических характеристик адсорбции исследованных дипиридилов на пористом графитированном углероде, которые объясняются превалированием π–π-взаимодействий адсорбат – адсорбент над гидрофобными взаимодействиями и пересольватацией молекул адсорбатов ацетонитрилом по мере уменьшения обводненности объемного раствора.
Микро- и мезопористые углеродные материалы до настоящего времени вызывают интерес исследователей в качестве перспективных компонентов систем аккумулирования газов, полупроводниковых, фотоактивных и электродных материалов, носителей для гетерогенного катализа, адсорбентов в процессах концентрирования и разделения [1–7]. Особое место среди углеродных материалов занимают графитоподобные структуры, обладающие уникальной селективностью при адсорбционном разделении веществ с близким молекулярным строением [8–10].
В хроматографии получил распространение углеродный материал Hypercarb™, созданный путем пиролитического разложения и последующей графитизации фенолформальдегидного олигомера в порах мезопористого кремнезема [11–13]. Пористый графитированный углерод (ПГУ) марки Hypercarb™ обладает высокой адсорбционной селективностью при разделении соединений, различающихся пространственным строением молекул, в том числе изомеров, методом высокоэффективной жидкостной хроматографии (ВЭЖХ) [14–18]. Помимо этого, с использованием ПГУ в качестве неподвижной фазы для ВЭЖХ можно легко разделить трудноразделяемые смеси веществ, молекулы которых имеют близкое пространственное строение, но различаются числом π-электронов [15–18].
В то же время механизм адсорбции на ПГУ при жидкофазных разделениях до сих пор не понят. Практически нет данных о влиянии качественного и количественного состава жидкой фазы на термодинамические характеристики адсорбции (ТХА) различных классов соединений на ПГУ. Отсутствуют также надежные сведения о вкладе специфических и дисперсионных взаимодействий молекул-адсорбатов с поверхностью ПГУ при разных составах объемного раствора. В связи с этим трудно оптимизировать условия разделения сложных многофункциональных органических соединений, в том числе изомеров, на ПГУ методом ВЭЖХ.
Цель работы – определение ТХА изомерных дипиридилов и некоторых их производных на графитоподобном углеродном материале Hypercarb™ в области закона Генри из водно-органических растворов методом ВЭЖХ, а также установление зависимости ТХА от молекулярного строения адсорбатов и состава и природы жидкой фазы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве адсорбатов использовали изомерные дипиридилы и их производные от Sigma Aldrich (табл. 1). Чистота исследованных веществ доказана хроматографически.
Таблица 1.
Структурные формулы адсорбатов
| Адсор-бат | Название | Структурная формула |
|---|---|---|
| 1 | 2,2'-Дипиридил |  |
| 2 | 4,4'-Дипиридил |  |
| 3 | 6-Метил-2,2'-дипиридил |  |
| 4 | 6,6'-Диметил-2,2'-дипиридил |  |
| 5 | 5,5'-Диметил-2,2'-дипиридил |  |
| 6 | 4,4'-Диметил-2,2'-дипиридил |  |
| 7 | Ди(2-пиридил)кетон |  |
| 8 | 2,2'-Дипирил-N-оксид |  |
| 9 | 2,2'-Дипирил-N,N '-диоксид | 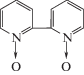 |
В роли адсорбента выступал коммерческий ПГУ марки Hypercarb™ (Thermo Scientific, США) с удельной площадью поверхности sуд = 120 м2/г. Размер частиц адсорбента составлял 5 мкм. Размеры стальной хроматографической колонки: длина 50 мм, внутренний диаметр 2.1 мм. Масса адсорбента в колонке g = 0.2 г.
В качестве подвижных фаз использовали бинарные водно-органические смеси. Органические компоненты – ацетонитрил (MeCN), метанол (MeOH) и изопропанол (i-PrOH) для ВЭЖХ. Деионизованную воду получали на мембранном деионизаторе “ДМЭ-1/Б” (БМТ, Россия). Концентрацию MeCN варьировали в интервале от ФMeCN = 0.40 до ФMeCN = 0.90 об. доли с шагом 0.10 об. доли, а концентрацию MeOH и i-PrOH оставляли постоянной и равной ФMeOH = Фi-PrOH = = 0.70 об. доли.
Измерения ТХА изомерных дипиридилов из растворов выполнены в условиях динамического адсорбционного эксперимента с использованием хроматографического оборудования. Первичные хроматографические данные получали на жидкостном хроматографе “Agilent 1100 Series”, укомплектованном детектором на диодной матрице, дегазатором подвижной фазы и краном-дозатором “Rheodyne” с петлей на 20 мкл. Элюирование 10–4 M растворов индивидуальных образцов адсорбатов осуществляли в изократическом режиме. Объемный расход подвижной фазы составлял 1 мл/мин. Косвенным подтверждением близости условий эксперимента к области закона Генри являлась наблюдаемая правильная гауссова форма хроматографических пиков. Температуру колонки T варьировали в интервале от 313 до 333 K с шагом 10 K. Перед проведением динамической адсорбции дипиридилов колонку термостатировали в течение 30 мин.
Из полученных первичных экспериментальных хроматографических данных определяли величины константы Генри адсорбции (K1,c, мкл/м2) и изменений стандартной дифференциальной молярной энергии Гиббса (∆aG°, кДж/моль), энтальпии (∆aH°, кДж/моль) и энтропии (∆aS°, Дж/(моль K)) при адсорбции так, как это описано в статье [18]. Рассчитанные значения ТХА относятся к среднегармонической температуре исследованного температурного интервала равной Tav = 323 K. При расчете величин ТХА использовали значения “мертвого” объема VM = 270 мкл, объема адсорбционной фазы va = = 61 мкл и толщины адсорбционного слоя t = = 2.54 нм. Результаты определения ТХА изомерных дипиридилов и их производных представлены в табл. 2–4.
Таблица 2.
Константы Генри адсорбции (K1,c, мкл/м2) и стандартные дифференциальные молярные изменения энергии Гиббса (ΔaG°, кДж/моль) при адсорбции дипиридилов и их производных на ПГУ из растворов MeCN–H2O с разной объемной долей ФMeCN при Tav = 323 K
| Адсор-бат | ФMeCN = 0.40 | ФMeCN = 0.50 | ФMeCN = 0.60 | ФMeCN = 0.70 | ФMeCN = 0.80 | ФMeCN = 0.90 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| K1,c | –ΔaG° | K1,c | –ΔaG° | K1,c | –ΔaG° | K1,c | –ΔaG° | K1,c | –ΔaG° | K1,c | –ΔaG° | |
| 1 | 156.1 | 11.1 | 96.9 | 9.8 | 69.0 | 9.0 | 52.4 | 8.3 | 43.1 | 7.8 | 36.8 | 7.4 |
| 2 | 31.8 | 7.0 | 20.7 | 5.9 | 15.8 | 5.3 | 14.8 | 5.1 | 14.6 | 5.1 | 16.5 | 5.4 |
| 3 | 352.6 | 13.3 | 206.9 | 11.8 | 136.3 | 10.7 | 98.7 | 9.9 | 76.1 | 9.2 | 59.3 | 8.6 |
| 4 | 1067.7 | 16.2 | 590.8 | 14.6 | 362.7 | 13.3 | 245.2 | 12.3 | 174.8 | 11.4 | 126.7 | 10.6 |
| 5 | 1948.2 | 17.8 | 1024.7 | 16.1 | 614.0 | 14.7 | 423.9 | 13.8 | 316.1 | 13.0 | 241.4 | 12.3 |
| 6 | 938.8 | 15.9 | 504.3 | 14.2 | 310.8 | 12.9 | 218.5 | 12.0 | 167.0 | 11.3 | 131.3 | 10.6 |
| 7 | 21.6 | 6.0 | 14.1 | 5.0 | 10.1 | 4.3 | 8.0 | 3.8 | 6.7 | 3.5 | 6.2 | 3.3 |
| 8 | 12.3 | 4.7 | 9.7 | 4.2 | 9.1 | 4.1 | 10.2 | 4.3 | 11.6 | 4.6 | 16.3 | 5.4 |
| 9 | –0.9 | –1.2 | –0.7 | –0.8 | –0.9 | –1.2 | –0.5 | –0.5 | –0.6 | –0.7 | 0.5 | 0.5 |
Таблица 3.
Стандартные дифференциальные молярные изменения энтальпии (ΔaH°, кДж/моль) и энтропии (ΔaS°, Дж/моль·K) при адсорбции дипиридилов и их производных на ПГУ из растворов MeCN–H2O с разной объемной долей ФMeCN при Tav = 323 K
| Адсор-бат | ФMeCN = 0.40 | ФMeCN = 0.50 | ФMeCN = 0.60 | ФMeCN = 0.70 | ФMeCN = 0.80 | ФMeCN = 0.90 | ||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| –ΔaH° | –ΔaS° | –ΔaH° | –ΔaS° | –ΔaH° | –ΔaS° | –ΔaH° | –ΔaS° | –ΔaH° | –ΔaS° | –ΔaH° | –ΔaS° | |
| 1 | 10.9 | –0.5 | 11.0 | 3.8 | 14.2 | 16.4 | 13.3 | 15.5 | 13.1 | 16.5 | 14.7 | 22.7 |
| 2 | 6.1 | –2.8 | 5.1 | –2.8 | 7.8 | 7.7 | 6.3 | 3.6 | 7.1 | 6.2 | 8.0 | 8.1 |
| 3 | 13.5 | 0.7 | 13.9 | 6.2 | 14.9 | 12.7 | 15.5 | 17.5 | 16.1 | 21.2 | 17.4 | 27.3 |
| 4 | 15.6 | –2.0 | 15.2 | 1.7 | 16.8 | 10.6 | 18.0 | 17.7 | 18.8 | 22.9 | 20.1 | 29.4 |
| 5 | 16.6 | –4.1 | 15.7 | –1.4 | 16.8 | 6.2 | 17.5 | 11.5 | 17.8 | 14.9 | 20.0 | 24.1 |
| 6 | 15.5 | –1.0 | 15.3 | 3.2 | 15.98 | 9.2 | 16.6 | 14.2 | 17.4 | 19.1 | 20.2 | 29.4 |
| 7 | 5.48 | –2.1 | 5.9 | 2.7 | 5.9 | 4.8 | 8.9 | 15.6 | 9.1 | 17.3 | 10.1 | 21.1 |
| 8 | 0.4 | –13.5 | 1.2 | –9.5 | 2.9 | –3.6 | 4.7 | 1.3 | 8.0 | 10.5 | 8.4 | 9.4 |
| 9 | 4.5 | 17.5 | – | – | – | – | – | – | – | – | – | – |
Таблица 4.
Термодинамические характеристики адсорбции дипиридилов и их производных на ПГУ из водно-спиртовых растворов с объемной долей органического компонента Фi-PrOH = ФMeOH = 0.70 при Tav = 323 K
| Адсорбат | i-PrOH–H2O | MeOH–H2O | ||||||
|---|---|---|---|---|---|---|---|---|
| K1,c, мкл/м2 | –ΔaG°, кДж/моль | –ΔaH°, кДж/моль | –ΔaS°, Дж/(моль K) | K1,c, мкл/м2 | –ΔaG°, кДж/моль | –ΔaH°, кДж/моль | –ΔaS°, Дж/(моль K) | |
| 1 | 14.7 | 5.1 | – | – | 104.4 | 10.0 | 20.2 | 31.4 |
| 2 | 3.7 | 2.4 | – | – | 59.5 | 8.6 | 21.3 | 39.3 |
| 3 | 32.8 | 7.1 | 9.6 | 7.9 | 223.0 | 12.0 | 21.4 | 28.7 |
| 4 | 88.4 | 9.6 | 11.0 | 4.2 | 589.2 | 14.6 | 24.1 | 29.2 |
| 5 | 128.6 | 10.6 | 10.1 | –1.4 | 1298.1 | 16.8 | 27.7 | 34.0 |
| 6 | 68.7 | 8.9 | 8.1 | –2.8 | 580.3 | 14.6 | 25.2 | 32.7 |
| 7 | 1.8 | 1.4 | – | – | 25.3 | 6.4 | 17.2 | 33.2 |
| 8 | 2.1 | 1.6 | – | – | 18.4 | 5.7 | 12.9 | 22.5 |
| 9 | –2.5 | –11.0 | – | – | 0.2 | 0.2 | – | – |
Оптимизацию геометрии молекул исследованных соединений и расчет величин их дипольного момента проводили с помощью программы Gaussian 09 [19] методом теории функционала плотности (DFT) с использованием гибридного функционала B3LYP и базисного набора 6‑31+G(d,p). Расчет выполняли для молекул в вакууме.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Данные табл. 2 и 4 демонстрируют существенное влияние молекулярного строения дипиридилов на их значения константы Генри адсорбции K1,c и стандартного дифференциального молярного изменения энергии Гиббса ∆aG° при адсорбции из растворов на поверхности ПГУ. При переходе от 2,2'-дипиридила (вещество 1) к 4,4'-дипиридилу (вещество 2) величина K1,c уменьшается ориентировочно в 5 раз при адсорбции из растворов с малым содержанием MeCN (ФMeCN = 0.40–0.60 об. доли), примерно в 4 раза при адсорбции из раствора MeCN–H2O с ФMeCN = 0.70 об. доли и приблизительно в 3 раза при адсорбции из сред MeCN–H2O с большим содержанием органического компонента (ФMeCN = 0.80–0.90 об. доли).
Следует отметить, что молекулы обоих изомеров неполярны, согласно данным квантово-химического расчета, у обоих адсорбатов µ = 0.000 D. Гораздо более сильная адсорбция 2,2'-дипиридила (вещество 1) по сравнению с 4,4'-дипиридилом (вещество 2), на наш взгляд, обусловлена тем, что молекула первого имеет плоскую геометрию (табл. 2, 4). Так, планарная конформация молекулы 2,2'-дипиридила сильно стабилизирована двумя внутримолекулярными C–H–N' водородными связями между атомом водорода, находящимся в положении 3 одного пиридильного радикала, и атомом азота соседнего цикла, а также π–π-сопряжением между пиридиновыми циклами, в результате чего атомы азота в молекуле 2,2'-дипиридила находятся в анти-положении друг к другу [20, 21]. Анти-конформер 2,2'-дипиридила оказывается на 27 кДж/моль стабильнее цис-конформера [21]. По данным [20] комплексообразование в растворе с участием атомов азота 2,2'-дипиридила способно разрушать существующие внутримолекулярные C–H–N' водородные связи, вследствие чего транс-ориентация атомов азота в 2,2'-дипиридиле может изменяться, и его молекула приобретает неплоскую геометрию. Однако более сильная адсорбция 2,2'-дипиридила (вещество 1) из водно-органических сред по сравнению с 4,4'-дипиридилом (вещество 2) на поверхности ПГУ (табл. 2, 4) свидетельствует об отстутствии такого комплексообразования, следовательно, 2,2'-дипиридил в указанных растворах, по-видимому, сольватируется за счет ван-дер-ваальсовых взаимодействий с растворителем.
Увеличение содержания MeCN в растворе, из среды которого происходит адсорбция, уменьшает разницу в константах Генри адсорбции 2,2'-дипиридила (вещество 1) и 4,4'-дипиридила (вещество 2), что отражает ослабление адсорбционной селективности системы по отношению к этим двум изомерам. В то же время даже при ФMeCN = 0.90 об. доли различия в величинах K1,c этих двух изомерных дипиридилов достаточно для их полного разделения методом ВЭЖХ с использованием ПГУ в качестве неподвижной фазы (табл. 2, 4). Более слабое адсорбционное связывание 4,4'-дипиридила (вещество 2), для которого угол между циклами составляет 37.2° [22], с поверхностью ПГУ по сравнению с 2,2'-дипиридилом (вещество 1), вероятно, связано с отсутствием у его молекулы плоской геометрии, для достижения которой недостатачно π–π-сопряжения между ароматическими циклами.
Введение одного метильного радикала в положение 6 молекулы 2,2'-дипиридила еще больше усиливает адсорбционное связывание молекул-адсорбатов с поверхностью ПГУ (табл. 2, 4). Так, величина K1,c 6-метил-2,2'-дипиридила (вещество 3), молекула которого обладает слабой полярностью (µ = 0.536 D), практически вдвое превосходит соответствующее значение для незамещенного неполярного аналога. Такой эффект объясняется увеличением числа контактов молекулы-адсорбата с графитоподобной поверхностью углеродного материала при введении метила и, кроме того, повышенной электронной плотностью на атоме азота замещенного цикла за счет электронодонорных свойств метила, которая способствует образованию внутримолекулярной C–H–N' водородной связи и, как следствие, стабилизирует планарную конформацию данного адсорбата. Введение второго метила в положение 6' соседнего пиридинового цикла при переходе к 6,6'-диметил-2,2'-дипиридилу, для которого µ = = 0.000 D, (вещество 4) увеличивает величину K1,c практически втрое (табл. 2, 4), что также объясняется увеличением числа контактов молекулы-адсорбата с углеродным адсорбентом и стабилизацией плоской геометрии молекулы, благоприятствующей его планарной ориентации при адсорбции на графитоподобной поверхности.
К практически двукратному возрастанию удерживания на ПГУ приводит переход от 6,6'-диметил-2,2'-дипиридила (вещество 4) к его структурному изомеру – 5,5'-диметил-2,2'-дипиридилу, у которого так же µ = 0.000 D, (вещество 5). Как и в случае изомерных 2,2' и 4,4'-дипиридилов, увеличение концентрации MeCN в подвижной фазе несколько уменьшает различие в величинах K1,c изомерных диметил-2,2'-дипиридилов, но не препятствует их полному разделению на колонках с ПГУ в условиях ВЭЖХ (табл. 2, 4). В 2 раза более сильное адсорбционное связывание 5,5'-диметил-2,2'-дипиридила с ПГУ по сравнению с 6,6'-диметил-2,2'-дипиридилом, по-видимому, связано с тем, что присутствие двух метилов в мета-положениях по отношению к атомам углерода в положениях 3 и 3' пиридиновых циклов усиливает электронодонорные свойства атомов водорода, находящихся при этих атомах углерода, тем самым, способствуя упрочнению внутримолекулярной C–H–N' водородной связи, стабилизирующей планарную конформацию молекулы 5,5'-диметил-2,2'-дипиридила.
Другой изомер – 4,4'-диметил-2,2'-дипиридил, у которого µ = 0.094 D, (вещество 6), напротив, адсорбируется на ПГУ, согласно данным табл. 2 и 4, несколько слабее 6,6'-диметил-2,2'-дипиридила (вещество 4). Это, по нашему мнению, обусловлено тем, что присутствие двух метилов в положениях 4 и 4' несколько ослабляет электроноакцепторные свойства атомов водорода, находящихся в положении 3 и 3' соответственно. Такое ослабление может происходить за счет положительного индуктивного эффекта метильного радикала и эффекта гиперконъюгации. В результате оно препятствует образованию прочной внутримолекулярной C–H–N' водородной связи, стабилизирующей планарную конформацию молекулы 4,4'-диметил-2,2'-дипиридила. Поэтому, вероятно, данный адсорбат с неплоской геометрией удерживается на ПГУ меньше 6,6'-диметил-2,2'-дипиридила (табл. 2, 4).
Таким образом, основными факторами, определяющими характер адсорбции изомерных дипиридилов и их замещенных аналогов из водно-органических растворов на углеродном материале Hypercarb™, являются геометрия молекулы адсорбата и число ее возможных контактов с графитоподобной поверхностью ПГУ. При этом присутствие в адсорбирующейся молекуле заместителей, стабилизирующих планарную конформацию, в значительной степени усиливает адсорбционное связывание дипиридилов с ПГУ. При этом, по-видимому, основным фактором, обусловливающим возможность адсорбционного связывания молекулы дипиридилов с ПГУ является именно возможность наиболее полного контакта всех ее атомов с графитоподобной поверхностью и, как следствие, реализации π-π-взаимодействия адсорбат – адсорбент и дополнительных электростатических сил, возникающих между молекулами с плоской геометрией и подвижной π-электронной системой графитоподобной поверхности ПГУ, а не взаимодействие полярных центров молекул адсорбатов с остаточными полярными функциональными группами графитового листа, как это происходит в случае графитированной термической сажи [23, 24].
В пользу последнего положения свидетельствует слабая адсорбция молекул с неплоской геометрией. Так, ди(2-пиридил)кетон (вещество 7), согласно данным таблиц 2 и 4, адсорбируется на ПГУ из водно-органических сред гораздо слабее своего ближайшего аналога – 2,2'-дипиридила (вещество 1). Так же слабо адсорбируются на ПГУ и содержащие семиполярные связи 2,2'-дипиридил-N-оксид и 2,2'-дипиридил-N,N '-диоксид (вещества 8 и 9 соответственно). Молекулы ди(2-пиридил)кетона и 2,2'-дипиридил-N-оксида обладают дипольным моментом (μ = 4.299 D и μ = 2.048 D соответственно), поэтому они, вероятно, вступают в сильные ориентационные взаимодействия с молекулами полярного растворителя. В то же время у молекулы 2,2'-дипиридил-N,N '-диоксида нет дипольного момента, и этот адсорбат не может взаимодействовать с растворителем посредством ориентационных сил. Эти адсорбаты, вероятно, сольватируются не только по механизму ван-дер-ваальсовых взаимодействий с полярным растворителем, но и за счет образования межмолекулярной водородной связи между осно́вными пиридиновыми атомами азота молекул адсорбатов и кислотными центрами компонентов растворителей. Такая сольватация вкупе с неплоской геометрией этих адсорбатов приводит к их быстрому элюированию из колонки в условиях динамического адсорбционного эксперимента.
Адсорбционное равновесие, согласно приведенным значениям ∆aG°, смещено в сторону образования адсорбционных комплексов молекул-адсорбатов с поверхностью ПГУ (табл. 2, 4). Исключение составляет только 2,2'-дипиридил-N,N '-диоксид (вещество 9), молекула которого непланарна и содержит две семиполярные связи. В результате за счет сочетания слабого адсорбционного связывания с графитоподобной поверхностью и сильной сольватации водно-органическим растворителем данное вещество адсорбируется слабее самого растворителя, то есть характеризуется отрицательной адсорбцией на ПГУ из водно-органических растворов. Это проявляется в его отрицательных значениях K1,c и положительных величинах ΔaG° (см. данные табл. 2, 4), свидетельствующих о сдвиге адсорбционного равновесия в случае 2,2'-дипиридил-N,N '-диоксида (вещество 9) в сторону разрушения адсорбционных комплексов адсорбат – адсорбент.
На рис. 1 представлены зависимости логарифма константы распределения исследованных дипиридилов от обратной температуры при их адсорбции на ПГУ из раствора MeOH–H2O c ФMeOH = 0.70 об. доли. Как и при адсорбции дипиридилов из сред MeCN–H2O и i-PrOH–H2O, эти зависимости имеют линейный возрастающий характер, что отражает экзотермический характер жидкофазной адсорбции исследованных веществ на ПГУ. Так, в табл. 3 и 4 представлены величины изменений стандартных дифференциальных молярных энтальпии ∆aH° и энтропии ∆aS° при адсорбции. Из приведенных данных видно, что жидкофазная адсорбция всех исследованных соединений характеризуется отрицательными значениями ∆aH°, независимо от природы и состава объемного раствора, из среды которого происходит адсорбция. Это обусловлено превалированием энергетического выигрыша за счет взаимодействия молекул-адсорбатов с поверхностью ПГУ над энергетическими затратами на преодоление сольватационного взаимодействия молекул-адсорбатов с растворителем и десорбцию предадсорбированных на поверхности ПГУ молекул растворителя. Адсорбции большинства исследованных веществ свойственны, помимо этого, отрицательные величины ∆aS°, отражающие превалирование потери числа степеней свободы адсорбционной системы за счет адсорбционного связывания молекул-адсорбатов с поверхностью ПГУ над высвобождением дополнительного числа степеней свободы, вызванным поступлением молекул растворителя в объемный раствор вследствие разрушения сольватных оболочек молекул-адсорбатов и десорбцией предадсорбированного растворителя. Исключение составляет адсорбция из максимально обводненных растворов MeCN–H2O и из раствора i-PrOH–H2O, когда для различных адсорбатов наблюдаются положительные изменения энтропии при переходе молекулы из объемного раствора в поверхностный слой (табл. 3, 4).
Рис. 1.
Зависимости логарифма константы распределения исследованных дипиридилов от обратной температуры при их адсорбции на ПГУ из раствора MeOH–H2O с ФMeOH = 0.70; здесь и далее номера на кривых соответствуют номераму соединений в табл. 1.
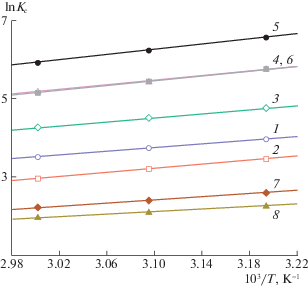
Максимальные по модулю величины ∆aH° и ∆aS° свойственны адсорбции исследованных дипиридилов на ПГУ из растворов MeOH–H2O, промежуточные значения ∆aH° и ∆aS° характерны для адсорбции из растворов MeCN–H2O, а минимальными по модулю изменениями рассматриваемых ТХА сопровождается адсорбция из растворов i-PrOH–H2O (табл. 4). Таким же образом уменьшаются при переходе от растворов MeOH–H2O к средам MeCN–H2O и далее к бинарным растворителям i-PrOH–H2O и величины K1,c, а также абсолютные значения ΔaG° исследованных дипиридилов (табл. 2, 4). Как известно [18], это обусловлено сильной ассоциацией смесей MeOH–H2O по сравнению со смесями MeCN–H2O, что приводит к более эффективному вытеснению молекул адсорбатов из сред MeOH–H2O на неполярную поверхность. Помимо этого, в таком порядке уменьшения абсолютных величин ТХА при изменении природы водно-органического растворителя важную роль играет более высокая по сравнению с метанолом концентрация предадсорбированного ацетонитрила на неполярной поверхности [18].
Помимо природы органического компонента объемного раствора, из среды которого происходит адсорбция, сильное влияние на значения ТХА исследованных дипиридилов оказывает состав бинарного растворителя (табл. 2, 3). В то же время из представленных на рис. 2 зависимостей различных величин ТХА исследованных дипиридилов от объемной доли ацетонитрила в подвижной фазе видно, что абсолютные значения ΔaG° закономерно монотонно уменьшаются по мере роста содержания ацетонитрила в растворе ФMeCN. Такое ослабление адсорбционного связывания большинства исследованных дипиридилов связано с усилением сольватации их молекул ацетонитрилом и уменьшением гидрофобных взаимодействий вследствие разрушения сетки водородных связей в объемном растворе. Отмеченное уменьшение абсолютных величин ΔaG° с увеличением ФMeCN характерно практически всем дипиридилам (рис. 2а, б, в), за исключением 2,2'-дипиридил-N-оксида, абсолютные значения ΔaG° которого слабо убывают с ростом ФMeCN, а затем, наоборот, несколько увеличиваются до величин, превосходящих по модулю значения ΔaG°, характерных для адсорбции из обводненных растворов (табл. 2). Это, по-видимому, обусловлено тем, что вначале повышение содержания ацетонитрила в растворе способствует сольватации пиридиновых циклов данного адсорбата, тем самым, ослабляя его удерживание, а дальнейшее увеличение объемной доли ацетонитрила, напротив, вероятно, препятствует специфической сольватации молекулы 2,2'-дипиридил-N-оксида водой по центрам, содержащим семиполярную связь, в результате чего удерживание несколько увеличивается (табл. 2).
Рис. 2.
Зависимости термодинамических характеристик адсорбции 2,2'-дипиридила (а), 6-метил-2,2'-дипиридила (б), ди(2-пиридил)кетона (в) на ПГУ из растворов MeCN–H2O от объемной доли ФMeCN.

В то время как большинству исследованных дипиридилов свойственны закономерные монотонно убывающие зависимости –ΔaG° от ФMeCN, зависимости среда–свойство для абсолютных значений изменений стандартных дифференциальных молярных энтальпии ΔaH° и энтропии TΔaS° для всех исследованных соединений имеют нетривиальный возрастающий характер, причем в зависимости от природы адсорбатов эти зависимости характеризуются наличием экстремумов, областей перегиба, либо носят монотонный характер (табл. 3, рис. 2). Так, в случае 2,2'-дипиридила и 4,4'-дипиридила зависимости энтальпийной и энтропийной составляющей энергии Гиббса адсорбции от состава среды MeCN–H2O характеризуются наличием экстремума в области ФMeCN = 0.60 объемной доли (рис. 2а). В случае 6-метил-2,2'-дипиридила зависимости модулей ΔaH° и TΔaS° от состава имеют монотонный, но все так же нетривиальный возрастающий характер (рис. 2б). В случае ди(2-пиридил)кетона на зависимостях среда–свойство для энтальпийной и энтропийной составляющих энергии Гиббса адсорбции присутствуют области перегиба в диапазоне ФMeCN = 0.6–0.7 объемной доли (рис. 2в). В целом возрастающий характер зависимостей среда–свойство для энтальпии и энтропии, вероятнее всего, обусловлен изменением состава адсорбированного раствора по мере уменьшения обводненности объемного раствора, в результате чего π–π-взаимодействия начинают превалировать при адсорбции из растворов с большими объемными долями ацетонитрила и закономерно снижается роль гидрофобных взаимодействий. При этом присутствие на зависимостях среда–свойство для энтальпии и энтропии экстремумов или областей перегиба, скорее всего, связано с пересольватацией молекул адсорбатов ацетонитрилом по мере уменьшения обводненности объемного раствора.
Для каждого из исследованных адсорбатов наблюдается компенсация между значениями ΔaH° и ΔaS°, измеренными при адсорбции одного вещества из сред MeCN–H2O разного состава. Одна из таких компенсационных диаграмм, характерная для 6-метил-2,2'-дипиридила, представлена на рис. 3. В то же время на зависимостях среда–свойство для ТХА исследованных дипиридилов области составов подвижной фазы, в которых наблюдаются экстремумы или области перегиба, одинаковы для энтальпийной и энтропийной составляющих энергии Гиббса адсорбции (рис. 2). Поскольку величины ΔaH° и ΔaS° являются членами уравнения Гиббса–Гельмгольца, одновременное изменение этих величин приводит к исчезновению экстремумов и перегибов на кривых зависимости ΔaG° от ФMeCN (рис. 2) [25].
Рис. 3.
Корреляция между значениями стандартных дифференциальных молярных изменений энтальпии и энтропии, измеренными при адсорбции 6-метил-2,2'-дипиридила на ПГУ из растворов MeCN–H2O с разной объемной долей ФMeCN.

Изменение состава среды MeCN–H2O, а также изменение природы подвижной фазы при переходе к средам MeOH–H2O и i-PrOH–H2O не изменяет адсорбционной селективности изученных систем и, как следствие, порядка элюирования адсорбатов из колонки с ПГУ, что проявляется в существовании линейных корреляций между величинами ΔaG° в ряду исследованных дипиридилов. Такие корреляции между величинами ΔaG°, измеренными при адсорбции дипиридилов из жидких сред разной природы, представлены на рис. 4.
Рис. 4.
Зависимости значений стандартных дифференциальных молярных изменений энергии Гиббса при адсорбции исследованных дипиридилов из водно-спиртовых растворов от соответствующих значений, измеренных при адсорбции из раствора MeCN–H2O (Фi-PrOH = ФMeOH = ФMeCN = 0.70).

Полученные в настоящей работе данные позволяют прогнозировать адсорбционное поведение исследованных дипиридилов и их производных, в том числе изомеров, а также их аналогов при жидкофазных разделениях на ПГУ.
Список литературы
Duffy E., He X., Nesterenko E.P. et al. // RSC Adv. 2015. V. 5. P. 22906.
Gomis-Berenguer A., Velasco L.F., Velo-Gala I., Ania C.O. // J. Colloid Interface Sci. 2017. V. 490. P. 879.
Mukdasai S., Crowley U., Pravda M. et al. // Sens. Actuators B. 2018. V. 218. P. 280.
Mansouri H., Carmona R.J., Gomis-Berenguer A. et al. // J. Colloid Interface Sci. 2015. V. 449. P. 252.
Lanin S.N., Rychkova S.A., Vinogradov A.E. et al. // Diam. Relat. Mater. 2016. V. 64. P. 49.
Peristyy A., Paull B., Nesterenko P.N. // J. Chromatogr. A. 2015. V. 1391. P. 49.
Apel N., Ulianchenko E., Moyses S. et al. // Ibid. 2017. V. 1488. P. 77.
Weber T.P., Jackson P.T., Carr P.W. // Anal. Chem. 1995. V. 67. P. 3042.
West C., Elfakir C., Lafosse M. // J. Chromatogr. A. 2010. V. 1217. P. 3201.
Stevenson P.G., Guiochon G. // Ibid. 2012. V. 1247. P. 57.
Melmer M., Stangler T., Premstaller A., Lindner W. // Ibid. 2010. V. 1217. P. 6092.
Iverson C.D., Lucy C.A. // Ibid. 2014. V. 1373. P. 17.
Lunn D.B., Yun Y.J., Jorgenson J.W. // Ibid 2017. V. 1530. P. 112.
Wan Q.H., Nicholas Shaw P., Davies M.C., Barrett D.A. // Ibid. 1995. V. 697. P. 219.
Сайфутдинов Б.Р., Пимерзин А.А., Емельянова Н.С., Курбатова С.В. // Журн. физ. химии. 2012. Т. 86. № 2. С. 350.
Сайфутдинов Б.Р., Емельянова Н.С., Курбатова С.В., Пимерзин А.А. // Там же. 2012. Т. 86. № 7. С. 1270.
Сайфутдинов Б.Р., Емельянова Н.С., Курбатова С.В., Пимерзин А.А. // Изв. АН. Сер. хим. 2012. № 8. С. 1626.
Сайфутдинов Б.Р., Емельянова Н.С., Пимерзин А.А. // Физикохимия поверхности и защита материалов. 2014. Т. 50. № 3. С. 268.
Frisch M.J., Trucks G.W., Schlegel H.B. et al. Gaussian 09, Rev. A.02. Wallingford CT: Gaussian, Inc., 2009.
Merritt L.L., Schroeder E.D. // Acta Crystallogr. 1956. V. 9. P. 801.
Göller A., Grummt U.-W. // Chem. Phys. Lett. 2000. V. 321. P. 399.
Bastiansen O., Seip H.M., Boggs J.E. // Perspectives in structural chemistry / Ed. by J.D. Dunitz, J.A. Ibers. New York: John Wiley, 1971. V. 4. P. 60–165.
Zeng Y., Prasetyo L., Nguyen V.T. et al. // Carbon. 2015. V. 81. P. 447.
Klomkliang N., Kaewmanee R., Saimoey S. et al. // Carbon. 2016. V. 99. P. 361.
Сайфутдинов Б.Р. // Изв. АН. Сер. хим. 2014. № 12. С. 2609.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


