Журнал физической химии, 2020, T. 94, № 1, стр. 50-59
Низкотемпературная конверсия орто-водорода в пара-водород на нанесенных катализаторах Ni/Al2O3
А. В. Жужгов a, *, О. П. Криворучко a, Л. А. Исупова a
a Российская академия наук, Сибирское отделение, Институт катализа им. Г.К. Борескова
Новосибирск, Россия
* E-mail: faleks2010@gmail.com
Поступила в редакцию 04.12.2018
После доработки 14.05.2019
Принята к публикации 11.06.2019
Аннотация
Выполнены сравнительные исследования Ni/Al2O3 катализаторов в процессе низкотемпературной конверсии орто-водорода в пара-водород. В качестве носителей использовали промышленный оксид алюминия марки А-64, получаемый методом осаждения (ОАПП-1), и оксид алюминия (ОАПП-2), полученный нами по технологии термоактивации (без соосаждения). Объемные константы скорости реакции приготовленных катализаторов 8 ± 1%Ni/ОАПП-1 и 8 ± 1%Ni/ОАПП-2 на основе этих носителей в низкотемпературной конверсии орто-пара-превращения (ОПП) составили 2.2 × 10–3 и 2.4 × 10–3$\left[ {\frac{{{\text{моль}}}}{{{\text{с}}{{{\text{м}}}^{{\text{3}}}}\;{\text{с}}}}} \right]$ соответственно, что позволяет использовать для приготовления катализатора более экологически привлекательный носитель.
ВВЕДЕНИЕ
Известно, что водород нормального состава (n-H2) представляет собой смесь двух модификаций орто-водорода (o-H2) и пара-водорода (p‑H2), отличающихся ядерными спинами: в o-H2 спины ядер параллельны друг другу, а p-H2 характеризуется антипараллельным спином [1]. Газообразный водород при обычных условиях содержит 75% o-H2 и 25% пара-водорода. После ожижения водорода нормального состава (при 21–22 K) в жидкой фазе самопроизвольно протекает медленная реакция ОПП. При этом выделяется теплота конверсии (около 1057 Дж/моль), превышающая собственную теплоту испарения жидкого водорода, составляющую 953 Дж/моль. В результате большого внутреннего тепловыделения происходят неконтролируемые потери ЖВ при хранении и/или транспортировке [2–4]. По некоторым оценкам потери водорода после его ожижения при нормальном давлении за первые сутки составляют около 20%, за четыре дня остается примерно 50% от исходного объема [5–7].
Следует подчеркнуть, что протекание реакции конверсии o-H2 в p-H2, как в газовой фазе, так и в жидком состоянии обеспечивает катализатор. Без катализатора в газообразном водороде эта реакция вообще не происходит, а в ожиженном – медленно. Поэтому для получения жидкого p-H2 необходимо совмещать процесс его ожижения с реакцией орто-пара-превращения в присутствии катализатора. Эта задача решается в реакторе, включенном в единую систему водородного ожижителя, при температурах 20–21 K [5, 6].
Ранее нами в обзоре [8] достаточно подробно рассмотрены проблемы получения жидкого p-H2 путем каталитической реакции ОПП газообразного водорода нормального состава при криогенных температурах, катализаторы для этого процесса, а также ряд вопросов по эксплуатации этих катализаторов в условиях водородных ожижителей. В работе [9] отражены научные основы технологии криогенного гетерогенно-каталитического производства жидкого пара-водорода, организованного во времена СССР.
В 1972 г. Институтом катализа СО АН СССР была разработана серия катализаторов ИК-5 (ИК-5-1, ИК-5-2, ИК-5-3 и ИК-5-4) для процесса ОПП, укрупненное производство которых было организовано на Государственном Чирчикском электрохимическом комбинате имени И.В. Сталина (ГЧЭХК) в г. Чирчике Узбекской ССР [9]. На этом же комбинате было налажено производство жидкого криогенного p-H2, синтезированного с использованием указанных катализаторов. Среди разработанных катализаторов одним из наиболее эффективных оказался ИК-5-4 представляющий собой, нанесенный оксид NiO на наиболее распространенный в то время промышленный алюмооксидный носитель марки A‑1 [8, 9]. Под определением эффективности катализатора ИК-5-4 следует понимать такие достоинства как достаточная активность, простота приготовления, устойчивость к дезактивации, отеплению и “захолаживанию” реакторов ОПП, загруженных им.
Данная работа направлена на установление роли физико-химических свойств носителей Al2O3, приготовленных по разным технологиям, на активность нанесенных катализаторов Ni/Al2O3 в процессе конверсии орто-водорода в пара-водород при криогенных температурах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе были использованы два типа алюмооксидных носителей для приготовления нанесенных Ni-катализаторов: оксид алюминия марки A‑64 (ТУ 2163-025-04610600-2003) производства ОАО “Ангарский завод катализаторов и органического синтеза” (г. Ангарск) и оксид алюминия, приготовленный c использованием продукта центробежной термоактивации гиббсита (ЦТА-ГБ) [10]. Для указанных носителей были приняты следующие обозначения: ОАПП-1 (марка А-64); ОАПП-2 (на основе ЦТА-ГБ).
Промышленный образец ОАПП-1 представлял собой гранулы с диаметром 3.0 ± 0.5 мм и длиной l = 3 ± 1 мм. Синтез данного промышленного носителя базируется на традиционном методе осаждения (“золь-гель” метод) аквакомплексов Al3+ из водных растворов сернокислого алюминия – Al2(SO4)3 ⋅ 9H2O (по сульфатной технологии).
Методика получения носителя ОАПП-2 по технологии термической активации порошка гиббсита (без соосаждения) состоит из стадии получения продукта термоактивации гиббсита (ГБ), стадии его гидратации и экструзионного формования. Продукт термоактивации гиббсита был получен с использованием аппарата ЦЕФРАР согласно ТУ 2175-040-03533913-2007. Термоактивацию гиббсита проводили при температуре теплоэлекторонагревателей 615°С, скорости вращения барабана 60 об./мин и расходе порошка ГБ 30 кг/ч. В качестве исходного сырья для получения продукта центробежно термической активации ГБ (ЦТА-ГБ) использовали гиббсит производства ОАО “Ачинский глиноземный комбинат” марки ГД 000 (ТУ-1711-99-039-2000).
Носитель ОАПП-2 был приготовлен путем гидратации в подкисленной водной среде порошка ЦТА-ГБ при pH 3.0–3.5, комнатной температуре в течение суток. Массовое соотношение твердой фазы к раствору составляло 1 : 10. После завершения гидратации полученный осадок отделяли от раствора методом декантации и далее проводили формовку пасты с помощью лабораторного шприца с диаметром фильеры 2.5 мм. Далее готовые гранулы с d = 2.5 мм и длиной 3 ± ± 1 мм “провяливали” при комнатной температуре в течение суток, сушили при 110°С в течение 6 ч и прокаливали при 550°С в течение 4 ч. Характеристики носителей приведены в табл. 1.
Катализаторы готовили методом однократной пропитки носителей по влагоемкости водными растворами азотнокислого никеля Ni(NO3)2 ⋅ 6H2O. Все образцы перед стадией пропитки сушили в среде воздуха при температуре 110°C в течение 6 ч и далее прокаливали при 400 К/4 ч для обеспечения чистоты поверхности от возможных адсорбированных примесей с атмосферы в процессе хранения.
Необходимую концентрацию катионов Ni2+ в пропиточных растворах рассчитывали исходя из влагоемкости носителей (табл. 1) и контролировали по плотности растворов. Общее содержание нанесенного никеля на каждый из носителей составляло 8 ± 1 мас. % в пересчете на Ni2+. Перед пропиткой все растворы подвергали фильтрованию с целью удаления возможного присутствия в них механических примесей. Далее образцы подвергали “провяливанию” на воздухе в течение суток. После этого проводили сушку и термообработку в токе воздуха при следующем ступенчатом режиме: 110°C/10 ч → 250°C/4 ч → 330 ± 5°C/6 ч. Во всех случаях объем пропиточного раствора определяли по формуле: Vр-ра = mнВ (где mн – навеска носителя [г], В – влагоемкость [мл/г]).
Дифрактограммы образцов регистрировали на дифрактометре D-500 фирмы “Siemens” с использованием CuKα-излучения и графитового монохроматора на отраженном пучке. Съемку образцов осуществляли методом сканирования в области значений углов 2θ = 10–70° с шагом 0.05° и временем накопления 3 с. Идентификацию фаз проводили путем сравнения экспериментальных дифрактограмм с дифрактограммами анализируемых образцов, собранными в базе данных ICDD, PDF 2.
Термический анализ выполнен на дериватографе фирмы “NETZSCH” (Германия) в интервале температур от 20 до 1000°C со скоростью нагрева 10 К/мин в токе воздуха. Для нанесенных Ni-образцов термограммы регистрировали в токе гелия с содержанием водорода 5 об. % до температуры 600°C. Во всех случаях количество исследуемого образца составляло 30 мг.
Морфологию образцов исследовали методом просвечивающей электронной микроскопии высокого разрешения (ПЭМВР) на электронном микроскопе JEM-2010 при ускоряющем напряжении 200 кВ с разрешающей способностью 1.4 Å. Образцы наносили на медную сетку из суспензии в спирте, получаемой с использованием ультразвукового диспергатора. Локальный анализ элементного состава образцов проводили с использованием энерго-дисперсионного EDAX спектрометра “Phoenix” с Si(Li) детектором и разрешением по энергии порядка 130 эВ.
Величину площади удельной поверхности (Sуд, м2/г) измеряли методом сорбции аргона при 77 К и последующей термодесорбции по четырем точкам сорбционного равновесия на приборе СОРБИ-М 4.1 фирмы “ЗАО МЕТА” (Россия) с использованием программы soft Sorbi-M Version 4.2. В качестве газа-носителя в смеси использовали гелий. Расчет значений Sуд проводили классическим методом БЭТ.
Элементный химический анализ нанесенных Ni-образцов выполнен рентгеноспектральным флуоресцентным методом на анализаторе ARL – Advant’x с Rh – анодом рентгеновской трубки.
Кислотные свойства поверхности образцов были изучены с помощью ИК-спектроскопии адсорбированного CO. ИК-спектры регистрировали на спектрометре Shimadzu FTIR-8300 в области 400–6000 см–1 с разрешением 4 см–1 и накоплением 100 сканов. Образцы прессовали в таблетки размером 1 × 2 см2, общим весом 20–40 мг. Таблетку помещали в ИК-кювету и прокаливали в вакууме в течение 1 часа при температуре 500°C и давлении остаточных газов не менее 10–4 Торр. Адсорбцию CO проводили в двух вариантах: при –196°C и давлении CO от 0.1 до 10 Торр, а также при комнатной температуре и давлении CO 10 Торр. Концентрации Льюисовских кислотных центров (ЛКЦ) и Бренстедовских кислотных центров (БКЦ) определяли из интегральных интенсивностей наблюдаемых характеристических полос поглощения с использованием коэффициентов интегрального поглощения.
Определение каталитической активности Ni-катализаторов в реакции ОПП проводили на установке проточного типа при давлении 10 атм. и температуре 77 K. Для проведения исследовательских работ использовали электролизный H2, который предварительно подвергали очистке от потенциально возможных нежелательных примесей H2O с помощью цеолита марки CaA-Y(5), азота и COx на колонке с активированным углем марки АГ-3 при температуре жидкого азота и микропримесей O2 на алюмоникелевом катализаторе. Исследуемый образец в виде имеющихся гранул и фракции (0.25–0.5 мм) объемом 3 см3 загружали в реактор и далее активировали в течение 4 ч при 110°C в токе осушенного водорода, подаваемого со скоростью 60–70 л/ч для удаления слабосвязанной молекулярной воды с катализатора, и затем при 250°C в течение 4 ч для его восстановления. После активации реактор с катализатором охлаждали до комнатной температуры и далее погружали в сосуд Дьюара, заполненный жидким азотом. Во время измерений реактор постоянно криостатировали жидким азотом и поддерживали давление 10 атм. Скорости потока водорода при измерениях варьировали в интервале от 200 до 900 л/ч.
Активность катализаторов характеризуется объемной или весовой константами скорости реакции первого порядка, в соответствии с уравнениями (1) и (2), соответственно [28, 30 ] :
(1)
${{k}_{v}} = \frac{n}{V}\ln \frac{{1 - Со{\text{/}}Ср}}{{1 - С{\text{/}}Ср}}\;\;\left[ {\frac{{{\text{моль}}}}{{{\text{с}}{{{\text{м}}}^{{\text{3}}}}\;{\text{с}}}}} \right],$(2)
${{k}_{в}} = \frac{n}{m}\ln \frac{{1 - Со{\text{/}}Ср}}{{1 - С{\text{/}}Ср}}\;\;\left[ {\frac{{{\text{моль}}}}{{{\text{г}}\;{\text{с}}}}} \right],$ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Выполненные исследования текстурных характеристик исследуемых носителей, представленных в табл. 1, свидетельствуют о значительных различиях, что следует учитывать при приготовлении нанесенных катализаторов. Носители различаются по общему объему пор и влагоемкости, а также среднему размеру пор при близких величинах удельной поверхности, что свидетельствует о том, что в носителе ОАПП-1 основной вклад в поверхность обеспечивается поверхностью мезопор, а в носителе ОАПП-2 – поверхностью микропор.
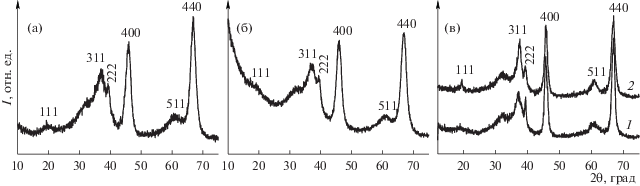
Носители различаются и фазовым составом. Приведенные на рис. 1 дифракционные картины промышленного (а) и приготовленного (б) носителей соответствуют низкотемпературной модификации γ-Al2O3 (ОАПП-1) и смеси γ-Al2O3 + η-Al2O3 (ОАПП-2). Положения рефлексов, а также набор межплоскостных расстояний этих образцов соответствуют индивидуальным γ-Al2O3 и η-Al2O3, полученным путем прокаливания хорошо окристаллизованных бемита и байерита при 550°С в течение 6 ч (рис. 1в). Результаты согласуются с базами данных ICDD, PDF 2; 00-0-33-0018, 00-0-21-1307.
Рис. 1.
Дифрактограммы промышленных носителей ОА и образцов сравнения: а – ОАПП-1, б – ОАПП-2, в – образцы сравнения: γ-Al2O3 (1) и η-Al2O3 (2).
Различные условия приготовления носителей влияют и на кислотные свойства поверхности, что может играть существенную роль, как в приготовлении нанесенных катализаторов, так и, возможно, для процесса ОПП. В связи с этим нами были исследованы кислотные центры поверхности методом ИК-спектроскопии адсорбированных молекул CO исходных носителей Al2O3 и полученных Ni-катализаторов на их основе.
В ИК-спектрах всех исходных носителей наблюдаются полосы поглощения в диапазоне 1300–1700 см–1, характеризующие валентные колебания в карбонатных и карбоксилатных структурах (рис. 2а, 1–3). Полосы поглощения при 1350–1380 и 1590 см–1 относятся, соответственно, к симметричным и асимметричным валентным колебаниям COO- в структуре карбоксилата. Полосы поглощения при 1460 см–1 соответствуют асимметричному валентному колебанию C–O в структуре монодентатного карбоната, который обычно образуется при взаимодействии атмосферного CO2 с основными центрами поверхности (ионами Oδ–) [11, 12].
Рис. 2.
ИК-спектры носителей ОАПП-1 ( 1) и ОАПП-2 (2) в области колебаний карбонатных групп и молекулярной воды (а). Область частот валентных колебаний OH-групп: 1 – ОАПП-1, 2 – ОАПП-2 (б).

В области валентных колебаний (рис. 2б) ОН-групп образцы носителей характеризуются полосами поглощения при 3590, 3675, 3730 и 3775–3780 см–1, являющиеся типичными для низкотемпературных модификаций оксидов алюминия [13]. Полоса поглощения при 3590 см–1 относится к H-связанным гидроксильным группам. Полосы поглощения при 3675 и 3730 см–1 характеризуют мостиковые гидроксильные группы (Al–OH–Al), а полоса поглощения при 3775 см–1 относится к ОН-группам пяти координированным атомам алюминия [12, 13].
Из полученных спектров (рис. 2а,б) видно, что интенсивности п.п. для ОАПП-2 заметно выше в области колебаний карбонатных и гидроксильных групп, что может свидетельствовать о более насыщенной поверхности этого носителя, как основными центрами, так и БКЦ, по сравнению с ОАПП-1.
На рис. 3 продемонстрированы ИК-спектры адсорбированного CO на носителях при температуре жидкого азота (77 K) и давлении 0.1–10 Торр. Полосы поглощения при 2154–2157 см–1 обусловлены адсорбцией CO на ОН-группах (Бренстедовские кислотные центры – БКЦ). Сдвиг полос поглощения гидроксильных групп при адсорбции CO составляет 190–195 см–1, что соответствует силе данных центров в 1240–1245 кДж/моль в шкале сродства к протону [11]. Полосы поглощения при 2169–2203 см–1 относятся к CO, адсорбированному на катионах алюминия (Льюисовские кислотные центры – ЛКЦ) [11].
Рис. 3.
ИК-спектры адсорбированного CO на носителях при 77 K и давлении от 0.1 до 10 Торр: а – ОАПП-1, б – ОАПП-2.
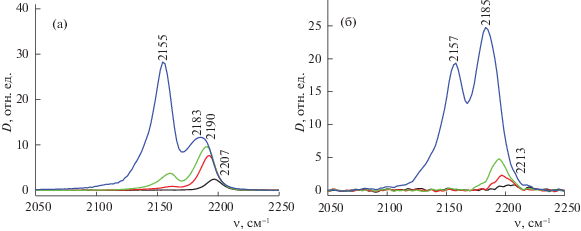
Полученные по данным ИК-спектроскопии параметры кислотных центров поверхности алюмооксидных носителей сведены в табл. 2. Из представленных результатов видно, что ОАПП-1 характеризуется несколько более высокой концентрацией БКЦ (п.п. 2155–2157 см–1). При этом, существенное различие между носителями проявляется в том, что концентрация ЛКЦ носителя, полученного на основе ЦТА-гиббсита (ОАПП-2), более чем в 2 раза превышает таковую для промышленного образца ОАПП-1.
Таблица 2.
Характеристики кислотных центров исходных носителей по данным ИК-спектров адсорбированного CO
| Образец | П.п. CO, см–1 | Тип центра | С, мкмоль/г | ∑ЛКЦ и БКЦ, мкмоль/г (мкмоль/м2) |
|---|---|---|---|---|
| ОАПП-1 | 2155 | БКЦ | 96 | 96 (0.38) |
| 2183 | ЛКЦ | 283 | ||
| 2190 | ЛКЦ | 31 | 321 (1.28) | |
| 2207 | ЛКЦ | 7 | ||
| ОАПП-2 | 2157 | БКЦ | 78 | 78 (0.27) |
| 2185 | ЛКЦ | 689 | ||
| 2213 | ЛКЦ | 17 | 706 (2.50) |
Таким образом, выявлены заметные различия в фазовом составе, текстурных характеристиках, а также кислотных свойствах поверхности носителей ОАПП-1 и ОАПП-2, что обусловлено различиями в методиках их приготовления.
На дифрактограммах готовых Ni-катализаторов с общим содержанием никеля 8 ± 1 мас. % (в пересчете на Ni2+) наблюдаются пики, принадлежащие только соответствующему носителю Al2O3 (рис. 4, 1–3). Последнее свидетельствует о том, что сформированные на поверхности носителей частицы оксида никеля должны быть не более 3–4 нм [14]. Действительно, по данным ПЭМВР (рис. 5) на электронно-микроскопических изображениях с высоким разрешением образцов-катализаторов 8 ± 1%Ni/ОАПП-1 и 8 ± 1%Ni/ОАПП-2 наблюдаются практически кластерные образования частиц оксида никеля с размерами около 3 нм, которые можно зафиксировать по слабой вариации контраста. Стрелками на изображениях обозначены области их локализации. Отметим, что количество нанесенного Ni2+ (8 ± 1%) выбрано из тех соображений, что именно эта концентрация активного компонента обеспечивает максимальную активность такого типа катализаторов в реакции ОПП согласно [15, 16].
Рис. 4.
Дифрактограммы нанесенных NiО/Al2O3 катализаторов: 1 – 8 ± 1% Ni/ОАПП-1, 2 – 8 ± ± 1% Ni/ОАПП-2.

Известно, что прокаливание нанесенных катализаторов NiО/Al2O3 выше 350°C приводит к взаимодействию NiО с алюмооксидным носителем с образованием псевдошпинельных или шпинельных структур типа NiAl2O4, что приводит к повышению температуры активации катализаторов в токе водорода, поскольку алюминаты никеля являются трудно восстанавливаемыми соединениями [17, 18]. С другой стороны, при прокаливании катализаторов при температуре 300°C или вблизи разложения нанесенной соли Ni(NO3)2 · 6H2O (при 230–250°C), формируются ультрадисперсные частицы оксида никеля, размер которых составляет около 1 нм [18–20]. Ультрадисперсный оксид никеля слишком чувствителен к отравлению парами воды, содержащимися в водороде. Таким образом, оптимальная температура приготовления нанесенных Ni-катализаторов должна быть в диапазоне 300–350°C. Именно при этих условиях термообработки образцов-катализаторов соединений со структурой шпинели NiAl2O4 в конечных NiО/Al2O3 по данным РФА и ПЭМВР нами не обнаружено. Это также подтверждается тем, что при указанных нами условиях приготовления катионы Ni2+ на поверхности Al2O3 стабилизированы только в октаэдрической кислородной координации $({\text{Ni}}_{{{\text{Oh}}}}^{{2 + }})$ фазы NiO [19]. Таким образом, оксид никеля на обоих вариантах носителя, по-видимому, находится в высокодисперсном состоянии, что следует, как отмечено выше, из данных РФА и ПЭМВР.
Максимальная активность никелевых катализаторов в низкотемпературной реакции ОПП достигается после его восстановления (активации) в токе водорода. Ранее в литературе достаточно подробно были исследованы процессы активации и кинетика восстановления нанесенных никелевых катализаторов с аналогичным (8 ± 1 мас. %) содержанием активного компонента NiO [17, 18]. Показано, что степень восстановления катализаторов в токе водорода при 300–320°C составляет порядка 40–47%. При этом начальная температура восстановления составляет около 130–140°C, конечная – 300°C. Использование новых носителей может повлиять на восстанавливаемость приготовленных катализаторов.
На рис. 6 приведены данные термического анализа образцов-катализаторов 8 ± 1%Ni/ОАПП-1 и 8 ± 1%Ni/ОАПП-2, полученных в среде 95%He и 5%H2. На термограммах образцов (рис. 7) наблюдаются четыре тепловых эффекта: эндотермические эффекты при 80–96°C, обусловленные удалением слабосвязанной воды; экзо-эффекты с максимумами при 130 и 140°C, связанные с началом восстановления высокодисперсных кристаллитов NiO на поверхности носителей; промежуточная область восстановления при 210–215°C и экзотермический тепловой эффект с максимумом около 300°C, свидетельствующий о полном завершении восстановления NiO. Отметим, что наблюдаемый интервал восстановления катализаторов соответствует ранее установленному. Некоторые различия в образцах по данным термического анализа наблюдаются в потерях веса (ППП). Так, общие потери веса для NiО/ОАПП-1 и NiО/ОАПП-2 составили 10.4 и 11.1 мас. %, соответственно. В области восстановления при 300°C для Ni/ОАПП-2 потери веса на 0.6 мас. % выше, по сравнению с первым катализатором (рис. 7). Эти различия в данных ТА отражаются в степени восстановления NiO в соответствующих температурных областях. Данные по степени восстановления Ni-катализаторов сведены ниже в табл. 3. Видно, что для катализатора NiО/ОАПП-2 во всех наблюдаемых температурных областях степень восстановления NiO несколько выше, по сравнению с катализатором NiO/ОАПП-1 (табл. 3), что может при одинаковом размере частиц быть обусловлено различной степенью взаимодействия частиц оксида никеля с носителями с заметно различающейся концентрацией ЛКЦ.
Рис. 6.
ИК-спектры адсорбированного CO при комнатной температуре на поверхности предварительно восстановленных катализаторов: а – 8 ± 1% Ni/ОАПП-1, б – 8 ± 1% Ni/ОАПП-2.
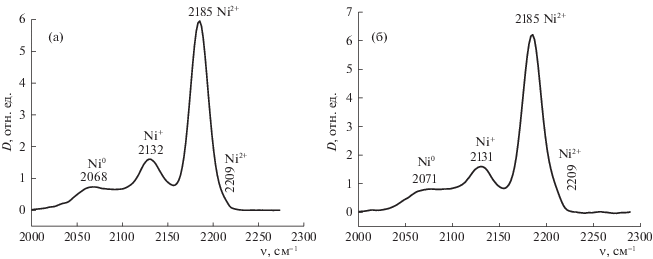
Рис. 7.
Термограммы NiО/Al2O3-катализаторов, полученные в среде 95% He + 5% H2: а – 8 ± 1% Ni/ОАПП-1, б – 8 ± ± 1% Ni/ОАПП-2.

Таблица 3.
Температуры и степень восстановления Ni-катализаторов
| Образец | αNiO, % | Твосст., °C |
|---|---|---|
| 8 ± 1% Ni/ОАПП-1 | 20 | 150 |
| 25 | 250 | |
| 35 | 300 | |
| 43 | 600 | |
| 8 ± 1% Ni/ОАПП-2 | 22 | 150 |
| 27 | 250 | |
| 40 | 300 | |
| 46 | 600 |
О несколько более легкой восстанавливаемости катализатора NiO/ОАПП-2 свидетельствуют и данные ИКС адсорбированного СО. На рис. 6 приведены ИК-спектры CO, адсорбированного при комнатной температуре и давлении 10 Торр. Отметим, что при температуре жидкого азота адсорбция CO происходит как на оксиде никеля, так и на кислотных центрах носителя (катионах Al3+) [11, 12], поэтому эксперименты были проведены при комнатной температуре. В этих условиях CO адсорбируется преимущественно на катионах никеля. На поверхности образцов 8 ± 1%Ni/ОАПП-1 и 8 ± 1%Ni/ОАПП-2 наблюдаются практически идентичные 4 полосы поглощения с максимумами 2068, 2132, 2184 и 2209 см–1. Полоса поглощения при 2068 см–1 относится к линейным комплексам металлического никеля с CO, полоса поглощения при 2132 см–1 характеризует адсорбцию CO на катионах Ni+, а полосы при 2184 и 2209 см–1 – адсорбцию CO на катионах Ni2+. Сила и концентрация центров рассчитаны по уравнениям, приведенным в работе [11]. Результаты расчетов обобщены в табл. 4. Из представленных данных видно, что поверхность нанесенного на различные носители оксида никеля характеризуется примерно одинаковым набором ЛКЦ, так и силой этих центров.
Таблица 4.
Характеристики различных центров по данным ИК-спектров адсорбированного CO на никеле с различной степенью окисления
| Образец | п.п. CO, см–1 | Тип центра | C, мкмоль/г | QCO, кДж/моль |
|---|---|---|---|---|
| 8 ± 1% Ni/ОАПП-1 | 2068 | Nio – CO | 3.7 | – |
| 2132 | Ni+ – CO | 6.7 | – | |
| 2185 | Ni2+ – CO | 15.0 | 22 | |
| 2209 | Ni2+ – CO | 0.4 | 63 | |
| 8 ± 1% Ni/ОАПП-2 | 2071 | Nio – CO | 4.0 | – |
| 2131 | Ni+ – CO | 7.2 | – | |
| 2185 | Ni2+ – CO | 16.2 | 22 | |
| 2209 | Ni2+ – CO | 0.9 | 63 |
Можно отметить, что количество восстановленных форм никеля (Ni+ и Ni0) в катализаторе NiO/ОАПП-2 по данным ИК-спектроскопии несколько выше, чем в катализаторе NiO/ОАПП-1, что согласуется с данными термического анализа катализаторов в восстановительной среде (7%). Однако данное различие можно нивелировать допустимой погрешностью самих методов анализа.
В табл. 5 приведены результаты исследования активности катализаторов в реакции ОПП при температуре жидкого азота. Из полученных данных видно, что активность образцов-катализаторов, определенная для фракции (0.25–0.5 мм), примерно в два раза выше, чем на гранулах. Это свидетельствует о протекании реакции ОПП в области внутренней диффузии при переходе от фракции к промышленному зерну и находится в хорошем согласии с литературными данными [4–6].
Таблица 5.
Данные по активности Ni-катализаторов реакции ОПП при температуре 77 K
| Образец | Sуд, м2/г | ${{k}_{v}}$ × 10–3, моль/(см3 с) | kв × 10–3, моль/(г с) | Тактивации, °C | ||
|---|---|---|---|---|---|---|
| фракция | гранулы | фракция | гранулы | |||
| 8 ± 1% Ni/ОАПП-1 | 217 | 1.25 | 0.6 | 1.6 | 0.8 | 150 |
| 4.5 | 2.2 | 6.3 | 3.1 | 250 | ||
| 8 ± 1% Ni/ОАПП-2 | 240 | 1.5 | 0.7 | 1.4 | 0.71 | 150 |
| 4.7 | 2.4 | 4.5 | 2.3 | 250 | ||
Несколько более низкая каталитическая активность (на единицу веса) для фракции катализатора на основе носителя ОАПП-2 при одинаковом содержании активного компонента может быть обусловлена более высокой концентрацией ЛКЦ на его поверхности, поскольку степень диспергирования (по данным РФА и ТЕМ), степень взаимодействия активного компонента с различающимися носителями (по данным ТА), а также свойства поверхности (ИК адсорбированного СО) достаточно близки. Вместе с тем, несмотря на меньший размер пор, снижающий степень использования гранул, активность гранулированного слоя катализатора (на единицу объема слоя) для носителя ОАПП-2 несколько выше, по сравнению NiO/ОАПП-1. Это с одной стороны обусловлено меньшим размером гранул, с другой более высокой насыпной плотностью катализатора на основе носителя ОАПП-2.
Таким образом, использованные два типа носителя Al2O3, полученные методом осаждения и по технологии ЦТА-гиббсита заметно различаются по ряду физико-химических характеристик: фазовому составу, величине удельной поверхности, влагоемкости, насыпной плотности, а также кислотным свойствам поверхности (концентрации ЛКЦ и БКЦ). На базе рассмотренных носителей представляется возможным приготовить гранулированные катализаторы с близкой активностью единицы слоя катализатора, что важно для практического применения.
Хотелось бы отметить, что с практической точки зрения наиболее существенным является возможность приготовления носителей Al2O3 по малоотходной технологии ЦТА-гиббсита для последующего получения нанесенных Ni-катализаторов ОПП, по своим конечным характеристикам, не уступающим катализатору предыдущего поколения ИК-5-4 на базе носителя A-1.
Работа выполнена в рамках государственного задания Института катализа СО РАН, проект АААА-А17-117041710090-3.
Список литературы
Farkas A. Orthohydrogen, Parahydrogen, and Heavy Hydrogen. Cambridge University Press, Cambridge. 1935.
Буянов Р.А., Зельдович А.Г., Пилипенко Ю.К. // Химическая промышленность. 1961. № 2. С. 31.
Buyanov R.A., Zel’dovich A.G., Pilipenko Yu.K. // Gryogenics. 1962. V. 2(3). P. 143.
Буянов Р.А., Зельдович А.Г., Пилипенко Ю.К. // Приборы и техника эксперимента. 1961. № 2. С. 188.
Буянов Р.А. // Кинетика и катализ. 1960. Т. 1. Вып. 2. С. 306.
Буянов Р.А. // Там же. 1960. Т. 1. Вып. 3. С. 418.
Буянов Р.А. // Там же. 1960. Т. 1. Вып. 4. С. 617.
Жужгов А.В., Криворучко О.П., Исупова Л.А., Мартьянов О.Н., Пармон В.Н. // Катализ в промышленности. 2017. № 5. С. 9.
Буянов Р.А., Пармон В.Н. // Там же. 2017. № 5. С. 390.
Танашев Ю.Ю., Мороз Э.М., Исупова Л.А. и др. // Кинетика и катализ. 2007. Т. 48. № 1. С. 161.
Паукштис Е.А., Юрченко Э.Н. // Успехи химии. 1983. Т. 52. № 3. С. 426.
Паукштис Е.А. Инфракрасная спектроскопия в гетерогенном кислотно-основном катализе. Новосибирск: Наука, Сиб. отд. 1992. С. 254.
Tsyganenko A.A., Smirnov K.S. Infrared spectroscopic evidence for the structural OH-groups of spinel alumina modifications // Materials Chemistry and Physics. 1990. V. 26. P. 35.
Чукин Г.Д. Строение оксида алюминия и катализаторов гидрообессеривания. Механизмы реакций. М.: Типография Паладин, ООО “Принта”, 2010. 288 с.
Буянов Р.А., Криворучко О.П., Малахов В.В. и др. // Кинетика и катализ. 1969. Т. 10. Вып. 4. С. 894.
Криворучко О.П., Буянов Р.А. // Там же. 1972. Т. 13. Вып. 4. С. 1050.
Носкова С.П., Борисова М.С., Дзисько В.А. и др. // Там же. 1974. Т. 15. Вып. 3. С. 592.
Носкова С.П., Борисова М.С., Дзисько В.А. // Там же. 1975. Т. 16. Вып. 2. С. 497.
Дзисько В.А., Носкова С.П., Борисова М.С. и др. // Там же. 1974. Т. 15. Вып. 3. С. 751.
Борисова М.С., Кузнецов Б.Н., Дзисько В.А. и др. // Там же. 1975. Т. 16. Вып. 4. С. 1028.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



