Журнал физической химии, 2020, T. 94, № 1, стр. 46-49
Новый редокс-метод осаждения CrOx на поверхность наночастиц Pd(0) – катализаторов селективного гидрирования фенилацетилена
О. А. Кириченко a, b, *, Л. М. Козлова a, Г. И. Капустин a, Е. А. Редина a
a Российская академия наук, Институт органической химии им. Н.Д. Зелинского
119991 Москва, Россия
b Российский технологический университет, Институт тонких химических технологий им. М.В. Ломоносова
119454 Москва, Россия
* E-mail: okiriche@ioc.ac.ru
Поступила в редакцию 08.05.2019
После доработки 08.05.2019
Принята к публикации 14.05.2019
Аннотация
Редокс-методом восстановления адсорбированным водородом впервые синтезирован катализатор, содержащий частицы оксида хрома на поверхности наночастиц палладия. В нем впервые обнаружены низкотемпературное восстановление оксида хрома и образование гидрида палладия. Показано значительное отличие его каталитических свойств в селективном гидрировании фенилацетилена по сравнению с исходным палладиевым катализатором.
Промотирование палладиевых катализаторов гидрирования вторым металлом широко используется для варьирования их каталитических свойств [1]. Образующиеся интерметаллиды различной структуры формируют изолированные активные центры и модифицируют электронное состояние Pd, что приводит к высокой каталитической активности, селективности и стабильности [2–4]. Наименее изучено промотирование палладиевых катализаторов хромом. Известно, что в процессе гидрирования двойной связи в 1,3-бутадиене нанесенные на силикагель Cr–Pd-катализаторы более селективны в образовании бутенов, чем палладиевые, хотя и менее активны [5]. Их частичное восстановление приводит к повышению каталитической активности, однако необходима длительная активация in situ в токе водорода при высокой температуре 600°С. Каталитические свойства биметаллических палладиевых катализаторов в реакциях гидрирования сильно зависят от метода их приготовления [1]. В работе [5] Cr–Pd-катализаторы были синтезированы пропиткой раствором дефицитной смешанной Cr–Pd-соли, а также осаждением высокотоксичных паров Cr(CO)6 на монометаллический палладиевый катализатор, что не обеспечило однородность состава нанесенных частиц и полноту восстановления оксидов хрома. Процесс восстановления оксидов хрома можно ускорить при их контакте с наночастицами металлического палладия, который, например, способствует восстановлению оксидов железа уже при температурах от –6 до 87°С [6]. Редокс-методы нанесения второго металла обеспечивают большую поверхность контакта в биметаллических частицах [7], что приводит к сильным синергетическим эффектам в биметаллических катализаторах [8–11]. Было показано, что редокс-метод может быть использован и для нанесения оксидов на поверхность наночастиц благородных металлов путем восстановления растворимых оксо-анионов до нерастворимых гидроксидов [12].
Цель настоящей работы – выявление возможности осаждения частиц оксида хрома на поверхность наночастиц палладия редокс-методом восстановления адсорбированным водородом, а также изучение каталитических свойств синтезированных биметаллических катализаторов в гидрировании кратных связей на примере фенилацетилена.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Катализатор 3%Pd/SiO2 синтезировали путем пропитки промышленного силикагеля марки КСКГ (Sуд = 98 м2/г, Dпр = 26 нм) по влагоемкости раствором [Pd(NH3)4]Cl2 с последующей сушкой и восстановлением в водороде при 400°С. Cинтез катализаторов Cr/3%Pd/SiO2 проводили редокс-методом восстановления адсорбированным водородом. Для этого восстановленный катализатор 3%Pd/SiO2 охлаждали до комнатной температуры в токе водорода и заливали раствором хромовой кислоты требуемой концентрации. При этом соотношение “объем раствора:влагоемкость навески Pd катализатора” брали равным 1.5:1. Суспензию периодически встряхивали и выдерживали при комнатной температуре определенное время. Образец катализатора отделяли центрифугированием. Полноту осаждения хромат-ионов определяли визуально по окрашиванию раствора после разделения суспензии. При наличии окрашивания образец многократно промывали бидистиллированной водой до отсутствия окрашивания. Образцы сушили на роторном испарителе при 40 мбар и 60°С.
Схема осаждения оксида хрома может быть представлена следующим образом:
Исследование катализаторов методом термопрограммированного восстановления проводили на установке, описанной ранее в [6], по аналогичной двухступенчатой методике, но промежуточное восстановление перед реокислением проводили при 500°С. Изучение каталитической активности в реакции жидкофазного гидрирования фенилацетилена осуществляли при 20 или 45°С и атмосферном давлении водорода по методике, представленной ранее [13, 14]. В ходе реакции отбирали пробы реакционной смеси, которые затем анализировали методом ГЖХ с внутренним стандартом (эйкозан), веденным в исходную реакционную смесь. В качестве продуктов реакции были обнаружены только стирол и этилбензол, при этом баланс по углероду составлял более 99%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Рентгенофазовый анализ монометаллического палладиевого образца 3%Pd/SiO2, восстановленного в токе водорода, выявил присутствие в нем кристаллической фазы металлического палладия с размером первичных частиц 22 нм. Результаты исследования образца методом ТПВ-Н2 также свидетельствуют о наличии фазы металлического палладия: на кривой ТПВ (рис. 1) при температурах 0–77°С наблюдается выделение водорода с отрицательным пиком при 59°С, характерное для разложения β-гидрида палладия [15], который образуется при взаимодействии металлического палладия с водородом в условиях охлаждения в токе водорода. После восстановления в водороде при 500°С и реокисления кислородсодержащим газом при комнатной температуре пик слегка сдвигается в область более низких температур (максимум при 55°С), а количество выделившегося водорода остается на том же уровне 90 ± ± 3 мкмоль/гкат.
Редокс-нанесение максимально возможного количества хрома (0.3 мас. %) сильно изменяет кривую ТПВ в области температур от –100 до 100°С (рис. 1) как для исходного, так и для реокисленного после восстановления при 500°С образца. В этой области на кривой ТПВ исходного катализатора появляется широкий пик поглощения водорода от – 80 до 27°С, на фоне которого можно выделить более острый максимум поглощения водорода при – 4°С (68 мкмоль/гкат). Минимум выделения водорода при 58°С практически соответствует пику разложения гидрида палладия в исходном палладиевом образце по положению, но его интенсивность почти вдвое меньше (52 мкмоль/гкат). Совершенно другая кривая наблюдается для образца, реокисленного при комнатной температуре после восстановления при 500°С. Практически полностью исчезают поглощение водорода в области – 80 до 27°С и пик выделения водорода при 58°С, но появляются более низкотемпературные перекрывающиеся пики выделения водорода при – 11 и 24°С. Суммарное выделение водорода при этом возрастает до 76 мкмоль/гкат. Такого изменения кривых ТПВ для биметаллических палладиевых катализаторов ранее не наблюдалось. Поглощение водорода в этой области отмечено ранее для образцов Pd–Fe–O/SiO2, полученных прокаливанием прекурсоров металлов после их совместного нанесения на силикагель, и было отнесено к восстановлению биметаллических наночастиц Fe2O3–PdO [6, 13], а также для нанокатализаторов FeOx/Pd/SiO2, полученных редокс-нанесением оксида железа на наночастицы палладия [16, 17]. Полученные в настоящей работе профили ТПВ кривой свидетельствуют о сильном взаимодействии нанесенного оксида хрома с палладием и подтверждают нанесение частиц оксида хрома на поверхность наночастиц палладия, а также указывают на доступность поверхности наночастиц палладия для адсорбции водорода с образованием гидрида палладия в невосстановленных образцах.
Типичные зависимости концентрации субстрата (ФА) и продуктов реакции (стирола и этилбензола), от времени реакции для образцов катализаторов, ТПВ которых представлены на рис. 1, приведены на рис. 2. На рис. 2 также приведено молярное отношение поглощенного водорода к начальному количеству вещества ФА. На основании полученных данных были рассчитаны конверсия ФА, селективность образования и выход стирола, а также начальная скорость расходования ФА (табл. 1, рис. 3).
Рис. 2.
Зависимости концентрации субстрата (ФА) и продуктов реакции (стирол, этилбензол) от времени реакции на исходном (пунктирные линии) и восстановленном при 500°С образцах катализатора 0.3Cr/3Pd/SiO2. Уcловия реакции: Т = 45°С, ФА : Pd = 180, mкт = 50 мг.

Таблица 1.
Основные показатели каталитической активности
| Катализатор | Тпр, °С | Тр, °С | ro (ФА) | t, мин | S15, % | S90, % | S99, % |
|---|---|---|---|---|---|---|---|
| 0.3Cr/3Pd/SiO2 | 60 | 20 | 0.0026 | – | 84 | – | – |
| 500, H2 | 45 | 0.042 | 72 | 96 | 89 | 76 | |
| 0.03Cr/3Pd/SiO2 | 60 | 20 | 0.48 | 12 | 97 | 91 | 82 |
| 60 | 45 | 0.31 | 11 | 97 | 93 | 78 | |
| 400, H2 | 45 | 0.45 | 6 | 97 | 89 | 81 | |
| 3Pd/SiO2 | 400, H2 | 20 | 0.16 | 30 | 92 | 90 | 72 |
Рис. 3.
Зависимости конверсии ФА и селективности по продуктам от времени реакции на исходном (пунктирные линии) и восстановленном при 400°С образцах катализатора 0.03Cr/3Pd/SiO2. Уcловия реакции: Т = 20°С, ФА : Pd = 290, mкт = 30 мг.
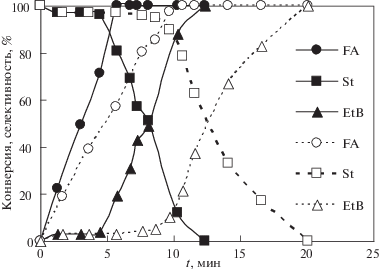
Нанесение 0.3 мас. % хрома приводит к сильному снижению начальной скорости гидрирования и конверсии ФА по сравнению с исходным палладиевым катализатором, а также к торможению процесса гидрирования. При этом конверсия ФА составила всего 16% через 300 мин (рис. 2). Образец, восстановленный водородом при 500°С, показал более высокую активность, чем исходный, и на нем была достигнута полная конверсия ФА при 45°С. Полная конверсия ФА на катализаторе с на порядок меньшим содержанием хрома (0.03 мас. %) достигается и при комнатной температуре за более короткое время (рис. 3).
Из полученных результатов видно, что синтезированный редокс-методом биметаллический Cr/Pd/SiO2-катализатор каталитически активен в гидрировании фенилацетилена до стирола и далее до этилбензола при сохранении высокой селективности процесса по стиролу.
Работа выполнена при финансовой поддержке Российского научного фонда (проект № 17-73-20282).
Список литературы
Coq B., Figueras F. // J. Mol. Catal. A: Chem. 2001. V. 173. P. 117.
Komatsu T., Inaba K., Uezono T. et al. // Appl. Catal. A: Gen. 2003. V. 251. P. 315.
Dasgupta A. // Catal. Today 2018. https://doi.org/10.1016/j.cattod.2018.05.048
Marakatti V.S., Peter S.C. // Progress in Solid State Chemistry 2018, https://doi.org/10.1016/j.progsolidstchem.2018.09.001
Borgna A., Moraweck B., Massardier J. et al. // J. Catal. 1991. V. 128. P. 99.
Kirichenko O.A., Kapustin G.I., Nissenbaum V.D. et al. // J. Therm. Anal. Calorim. 2014. V. 118. P. 749.
Barbier J. Redox Methods for Preparation of Bimetallic Cata1ysts. In Preparation of Solid Catalysts / Ed. by G. Ertl, H. Knozinger, J. Weitkamp. WILEY-VCH Verlag GmbH, 1999. P. 526.
Kirichenko O.A., Redina E.A., Davshan N.A. et al. // Appl. Catal. B: Environ. 2013. V. 134–135. P. 123.
Redina E.A., Greish A.A., Mishin I.V. et al. // Catal. Today. 2015. V. 241. P. 246.
Redina E., Greish A., Novikov R. et al. // Appl. Catal. A: General. 2015. V. 491. P. 170.
Redina E.A., Kirichenko O.A., Greish A.A. et al. // Catal. Today 2015. V. 246. P. 216.
Kustov L.M., Tarasov A.L., Kirichenko O.A. // Int. J. Hydrogen Energy. 2017. V. 42. P. 26723.
Shesterkina A.A., Kirichenko O.A., Kozlova L.M. et al. // Mendeleev Commun. 2016. V. 26. P. 228.
Shesterkina A.A., Kozlova L.M., Kirichenko O.A. et al. // Russ. Chem. Bull., Int. Ed. 2016. V. 65. P. 432.
Pinna F., Signoretto M., Strukul G. et al. // React. Kinet. Catal. Lett. 1997. V. 60. № 1. P. 9.
Kirichenko O.A., Strekalova A.A., Kapustin G.I. et al. // Russ. J. Phys. Chem. 2018. V. 92. P. 2396.
Kirichenko O.A., Strekalova A.A., Kapustin G.I. et al. // J. Therm. Anal. Calorim. 2019. DOI: 10.1007/s10973-019-08786-5.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



