Журнал физической химии, 2020, T. 94, № 1, стр. 32-39
Управление горением, взрывом и детонацией газов методами химической кинетики
В. В. Азатян a, *, В. М. Прокопенко b, Т. Р. Тимербулатов c
a Российская академия наук, Институт химической физики им. Семенова
Москва, Россия
b Российская академия наук, Институт структурной макрокинетики и проблем материаловедения
Московская область, Черноголовка, Россия
c Группа компаний ООО КОНТИ
Москва, Россия
* E-mail: vylenazatyan@yandex.ru
Поступила в редакцию 05.03.2019
После доработки 05.03.2019
Принята к публикации 12.03.2019
Аннотация
Описано использование методов для предотвращения возгораний и взрывов смесей метана с воздухом, в том числе, в угольных шахтах, воспламенения и взрыва водородо-воздушных смесей, а также перехода горения в детонацию в действующей модели прямоточного воздушно-реактивного двигателя. Приведены результаты межведомственных испытаний, а также экспериментальные данные, иллюстрирующие разрушения стационарной детонационной волны малыми примесями низших углеводородов.
Возрастающие объемы используемых в промышленности и в технике традиционных и новых видов энергоносителей, разработка и усовершенствование силовых установок, использующих процессы горения, предъявляют все более высокие требования к научным основам и методам управления горением, взрывом и детонацией. Важнейшие составляющие этой научно-технической проблемы – регулирование интенсивности горения и предотвращение неконтролируемых возгораний и взрывов газов, перехода горения в детонацию в стратегических объектах и в бытовых условиях. Высокий уровень опасности взрывов и пожаров сдерживает развитие перспективных областей техники и энергетики. Повышенная взрывоопасность водорода ограничивает развитие водородной энергетики, создает постоянную угрозу для ряда направлений химической и атомной промышленности, обороны, воздухоплавания. Поскольку в основе горения и взрыва лежат химические реакции, то наиболее эффективно влиять на эти процессы можно, воздействуя, прежде всего, на их химический механизм и на скорости ключевых реакций методами химической кинетики. Применяемые же до последнего времени способы предотвращения и подавления горения газов имели в основном не химический характер (огнепреградители, искрогасители, разбавление и др.). Такие способы имеют ограниченное применение и далеко не всегда эффективны. Использовавшиеся в качестве химических средств бромсодержащие хладоны токсичны, недостаточно эффективны и коррозионно агрессивны. В соответствии с решениями ряда международных конвенций, их промышленное производство прекращено.
Отмеченные выше проблемы управления горением и взрывом газов являются в основном результатом недостаточного развития теории этих процессов. Выявление цепной природы горения газов при атмосферном и повышенных давлениях открыло не только новые аспекты теории, но и широкие возможности для эффективного управления этими процессами горения, взрыва и детонации путем регулирования скоростей размножения и гибели активных промежуточных частиц – атомов и радикалов, с помощью ингибиторов и промоторов.
В настоящей работе вкратце рассмотрены научные основы химических методов управления горением, взрывом и детонацией газов, приведены примеры использования разработанных методов на практике.
ДВЕ МОДЕЛИ РЕАКЦИЙ ГОРЕНИЯ ГАЗОВ ПРИ АТМОСФЕРНОМ ДАВЛЕНИИ
Воспламенение и развивающееся горение происходит вследствие кинетического режима усиливающегося самоускорения химической реакции, приводящего к большим скоростям процесса с выделением света и тепла. Известно, что к воспламенению и горению способны привести два различных по своей природе фактора. Один – прогрессивное самоускорение реакции, вызванное только саморазогревом реакционной системы. При такой модели до недавнего времени (и нередко также в настоящее время) химический процесс горения представляют одностадийной реакцией, в которой продукт получается непосредственно из исходных валентно-насыщенных реагентов. Воспламенение, вызванное этим фактором и называемое тепловым, реализуется, если скорость тепловыделения (q+) в реакции больше, чем скорость теплоотвода (q–), и при этом с повышением температуры (T) тепловыделение ускоряется больше, чем теплоотвод [1, 2]:
Знаки равенства относятся к критическому условию воспламенения. Химический процесс представляется в виде реакций только исходных валентно-насыщенных реагентов. Поскольку эти вещества монотонно расходуются, то самоускорение реакции и воспламенение могут быть вызваны только саморазогревом. Теория, основанная на такой модели, называется теорией теплового горения. По этой теории предполагается, что в реакциях только валентно-насыщенных соединений соотношения (1) и (2) могут одновременно реализоваться и приводить к воспламенению.
Другим фактором, приводящим к воспламенению газов, является открытое Н.Н. Семеновым [2–4] и Хиншельвудом [5, 6] лавинообразное размножение активных промежуточных продуктов – свободных атомов и радикалов, в их повторяющихся реакциях, образующих реакционные цепи:
В этой схеме X и Y – свободные атомы и радикалы – носители цепей (НЦ), высокая химическая активность которых обеспечивается наличием у них свободной валентности, А и B – исходные молекулярные реагенты, Р – конечный продукт. В реакции (I) число НЦ возрастает. Вновь образующиеся НЦ начинают новые ветви реакционных цепей, т.е. происходит разветвление. НЦ вступают также в реакции уничтожения свободной валентности: т.е. в реакции обрыва цепей: адсорбируются или образуют продукт, не способный развивать реакционную цепь. Согласно этой схеме и закону действующих масс, скорость расходования исходного реагента В, т.е. скорость процесса, равна
(3)
$W = --d{\kern 1pt} [{\text{B}}]{\text{/}}dt = {{\omega }_{{\text{о}}}} + {{k}_{{\text{р}}}}n{\kern 1pt} [{\text{B}}],$Скорость изменения концентрации НЦ, равна алгебраической сумме скоростей их размножения и расходования [2, 4]:
Здесь f и g – скорости разветвления и обрыва цепей при единичной концентрации НЦ: где $k_{p}^{o}$ и Ep– предэкспоненциальный множитель и энергия активации реакции (I). Величина g – суммарная скорость обрыва цепей, в том числе, в реакции с ингибитором, при единичной концентрации НЦ: где kIn – константа скорости ингибирования [7, 8], [In] – концентрация ингибитора, g1 – скорости других реакций обрыва при единичной концентрации НЦ.В силу очень больших энергий активации реакций валентно-насыщенных соединений между собой, превышающих 200 кДж/моль, величина ωо крайне мала и, за исключением самых начальных времен, несравненно меньше φn.
Очевидно, что в условиях, при которых разветвление превалирует над обрывом, т.е. при
концентрация свободных атомов и радикалов n прогрессивно возрастает, достигая величин, намного превышающих термодинамически равновесные значения. Это подтверждается результатами измерений концентраций указанных активных частиц методами спектроскопии [8, 9]. Прогрессирующий рост концентраций активных частиц в условиях f > g показывает и дифференциальное уравнение (4), решения которого в условиях неравенства (7) неустойчивы (неустойчивость по Ляпунову). В силу соотношения (3) вместе с ростом n также прогрессивно возрастет скорость W. Происходит цепное воспламенение, которое может протекать даже при давлениях, в сотни раз ниже атмосферного давления [2, 4]. Саморазогрева при этом не требуется, но он сопровождает цепное горение, усиливая цепную лавину. В условиях же, при которых разветвление медленнее обрыва: нет лавинного размножения активных частиц, их концентрация чрезвычайно низка. Также незначительны скорости реакций исходных реагентов с активными частицами. И, поскольку крайне мала и константа скорости реакции непосредственно между исходными реагентами, то при превышении скорости обрыва цепей над разветвлением в системе фактически никакой реакции не происходит.НЕВОЗМОЖНОСТЬ ОБЪЯСНЕНИЯ ГОРЕНИЯ ГАЗОВ БЕЗ УЧЕТА ЦЕПНОЙ ПРИРОДЫ ПРОЦЕССА
Теория теплового горения, учитывающая ускорение реакции, вызванное только саморазогревом, успешно объясняет основные закономерности процессов горения и взрыва конденсированных веществ. Сильный саморазогрев, сопровождающий горение газов при атмосферном давлении и повышенных давлениях, а также быстрое самоускорение реакций при повышении температуры, послужили основной причиной того, что процессы горения при давлениях выше сотых долей атмосферного давления также считались результатом только саморазогрева. Длительное время было общепринято, что роль цепного механизма в горении значительна только при давлениях, в десятки и сотни раз ниже атмосферного давления, при которых саморазогрева практически нет (например, [2, 9–19]). В работах, использующих эти представления, роль реакционных цепей в горении при атмосферном давлении не учитывалась [10–19], а в ряде работ даже отрицалась [2, 10, 14].
Представления о горении газов, основанные на учете важной роли реакций только валентно-насыщенных соединений, оказались, однако, не способны объяснить фундаментальные закономерности указанных процессов. Это относится, прежде всего, к большим скоростям реакций горения, к чрезвычайно сильной зависимости скорости реакций горения от температуры, очень сильному влиянию малых посторонних примесей на горение. Было выяснено, что реакции между валентно-насыщенными соединениями в силу больших энергий активации, превышающих 200 кДж/моль, настолько медленны, что не способны обеспечить даже сколько-нибудь значительный саморазогрев и, тем более, не обеспечивают горение [8, 20, 21]. Например, энергии активации реакций Н2 и СН4 непосредственно с О2 превышают 225 кДж/моль [22–24]. Предэкспоненциальный же множитель константы скорости, естественно, не может превышать частоту бинарных столкновений. Поэтому, даже если не обращать внимания на то, что вопреки модели одностадийной реакции, конечные продукты не могут образоваться в одном акте из исходных молекул, то, например, при 900 K и атмосферном давлении для реагирования по межмолекулярному пути лишь 2% стехиометрической смеси горючего с воздухом, потребуется более 350 с. Между тем, смеси Н2, СН4 с О2 при этой начальной температуре легко самовоспламеняются и сгорают за миллисекунды. Кроме того, указанное время реагирования 2% смеси по межмолекулярному механизму в сотни раз больше характеристического времени теплоотвода из рассматриваемой смеси в реакторах обычного эксперимента. Учитывая количество выделившегося тепла от 2% выгоревшей смеси, ее теплоемкость, а также соотношение характеристических времен реакции, убеждаемся, что максимальный саморазогрев меньше 0.2 K. Таким образом, действительно, модель реакции только между молекулярными реагентами не может обеспечить горение. Очевидно, что межмолекулярные реакции не могут быть также лимитирующей стадией горения. Вывод о неспособности газофазных нецепных реакций обеспечить горение подтвержден экспериментами в широкой области температур и давлений (см. ниже).
При больших энергиях активации, присущих межмолекулярным реакциям, незначителен также рост их скорости даже при сильном нагревании горючей смеси внешним источником, например, падающей ударной волной [8]. Таким образом, традиционная теория теплового горения, основанная на модели реакции только валентно-насыщенных соединений, не способна объяснить и не объясняет наблюдаемые процессы горения газов. Было обращено также внимание на то, что согласие расчетов по одностадийной модели с экспериментом наблюдается только при использовании эмпирических параметров, определенных из данных по изучению макрокинетики того же процесса горения при необоснованном допущении о его одностадийности. Такие расчетные параметры противоречат их физическому смыслу.
ЦЕПНАЯ ПРИРОДА ГОРЕНИЯ, ВЗРЫВА ДЕТОНАЦИИ ГАЗОВ
Явления горения, взрыва и детонации газов получили объяснение, благодаря выявлению цепной природы этих процессов. Было установлено (например, [8, 20, 21]), что вопреки прежним представлениям, горение газов реализуется по цепному механизму не только при крайне низких давлениях, но и при высоких давлениях, важных для практики. Одно из доказательств цепной природы горения – предотвращение воспламенения и прекращение всех режимов горения с помощью малых примесей ингибиторов, перехватывающих свободные атомы и радикалы, тем самым обрывающих реакционные цепи и блокирующих процесс горения [8, 20, 21, 25]. При наличии ингибиторов воспламенение и взрыв не происходят также при высоких начальных температурах, например, при 1500 K [26]. Ингибиторы сильно уменьшают скорость развившегося горения до полного подавления процесса, предотвращают переход горения во взрыв и в детонацию. Присадки таких же количеств инертных газов практически никакого влияния на горение не оказывают.
С учетом основных закономерностей горения газов была создана теория неизотермических цепных процессов. На базе этой теории получают объяснение фундаментальные закономерности горения, взрыва и детонации газов, не находившие объяснения ранее. Это – прежде всего, факт протекания этих процессов, их большие скорости, переход горения во взрыв и в детонацию. Одним из основных уравнений, относящихся к кинетике неизотермической цепной реакции, является приведенное ниже выражение, получающееся из уравнений (3) и (4):
(8)
$\frac{W}{{[{\text{B}}]}} = {{k}_{p}}{{n}_{o}}{\text{exp}}\mathop \smallint \limits_{{{t}_{o}}}^t \left\{ {2k_{p}^{o}\exp \left( {--\frac{{{{E}_{p}}}}{{RT}}} \right)[{\text{B}}]--g} \right\}dt,$Уравнение (8) отражает экспоненциальную зависимость скорости цепной реакции от скорости реакции ингибирования, входящей в величину g, согласно формуле (6). Таким характером зависимости объясняется наблюдаемое очень сильное воздействие ингибиторов на различные режимы горения. В хорошем согласии с экспериментом, уравнение (8) вместе с выражением (7) показывает, что, если концентрация ингибитора настолько велика, что величина g больше первого слагаемого в подынтегральном выражении уравнения (8), то подынтегральная функция оказывается отрицательной, и, значит, прогрессирующий рост скорости процесса и воспламенение становятся невозможными, т.е. ингибитор предотвращает возгорание. Это подтверждается всеми результатами экспериментов, испытаний в больших объемах, а также на практике. Наличием же фактора Больцмана в положительном показателе степени в уравнении (8) объясняется наблюдаемая в экспериментах чрезвычайно сильная температурная зависимость скорости, обеспечивающая переход горения во взрыв и в детонацию, в отличие от нередко приводимого закона Аррениуса, относящегося не к скорости реакции, а к константе скорости.
Доказательство цепной природы реакций горения создало большие возможности для эффективного управления этими процессами путем регулирования конкуренции развития и обрыва реакционных цепей с помощью специально подобранных реагентов. Химические методы, основанные на использовании ингибиторов и промоторов, а также на химическом модифицировании контактирующих с реагирующим газом твердых поверхностей, позволяют предотвратить переход горения во взрыв и в детонацию, варьировать скорости распространяющегося пламени и стационарной детонационной волны [8, 26]. Ниже приводятся некоторые иллюстрации.
ПРЕДОТВРАЩЕНИЕ ВОСПЛАМЕНЕНИЯ И ГОРЕНИЯ ИНГИБИРОВАНИЕМ
На рис. 1 показано сильное сужение концентрационной области воспламенения водородо-воздушных смесей под воздействием двух предложенных нами ингибиторов из серии АКМ, состоящих в основном из низших углеводородов [8]. При каждой данной присадке правее соответствующей предельной кривой воспламенение не происходит. Видно, что, например, 1% АКМ предотвращает горение всех смесей, содержащих более 40% Н2. Видно также, что такие же и гораздо большие присадки инертных газов никакого влияния на горение не оказывают. Ключевой стадией ингибирования в данном случае является реакция
Рис. 1.
Влияние ингибиторов АКМ (1, 2), СО2 (3) и N2 (4) на концентрационные пределы воспламенения водородо-воздушных смесей при 1 атм.

Очевидно, что при предотвращении воспламенения исключаются также последующее распространение пламени и его переход во взрыв. Поэтому предельные концентрации воспламенения являются также и концентрационными пределами распространения пламени (КПРП), т.е. минимальным и максимальным содержанием горючего, ограничивающим область составов, в которой возможно самоподдерживающееся распространение пламени.
Из уравнения (8) следует также, что при разбавлении смеси инертным газом вследствие снижения концентрации окислителя – вещества В – экспоненциально уменьшается скорость реакции и, значит, скорость тепловыделения. Таким образом, даже небольшие присадки инертных газов экспоненциально усиливают воздействие ингибиторов. Этот эффект (синергизм инертным газом) был использован для усиленного ингибирования возгораний метано-воздушных смесей. На рис. 2 приведены результаты испытаний предотвращения возгораний и взрывов метано-воздушных смесей с помощью ингибитора – трифторметана с использованием (кривая 1) и без использования явления синергизма (кривая 2) [27, 28]. Результаты измерений, проведенных в различных организациях, обозначены соответствующими значками. Условия предотвращения возгорания, инициированного локальным источником, не зависят от объема реактора, поскольку ингибитор предотвращает возгорание с самого очага инициирования. Этим объясняется количественное согласие результатов всех испытаний, проведенных в различных организациях в объемах различной формы и в объемах от 3.2 л до 43 м3.
Рис. 2.
Сужение КПРП смесей метана с воздухом присадками CF3H с использованием (1) и без использования (2) синергизма; 3 – пограничная кривая (CF3H), I и II – результаты Межведкомиссии от 2010 г. (17% N2) и 2015 г. (15% N2), III и IV – данные ВНИИПО (15.5% N2) и ИСМАН соответственно. Квадратики – влияние азота.

Разработанный метод в 2018 г. был успешно применен горноспасательными службами на практике при ликвидации аварий на Кузбассе в шахте им. Ленина и в шахте “Грамотеинская”. Согласно протоколам, в аварийных участках метан присутствовал в опасных концентрациях. Таким образом, как межведомственные испытания, так и применение непосредственно в шахтах показывают целесообразность использования ингибирования как одного из важных методов устранения опасности взрывов.
УПРАВЛЕНИЕ ХАРАКТЕРИСТИКАМИ ВЗРЫВА И ДЕТОНАЦИИ С ПОМОЩЬЮ ПРИСАДОК
Уравнение (8) отражает также наблюдаемую чрезвычайно сильную температурную зависимость скорости реакции горения, определяемую наличием фактора Больцмана в положительном показателе степени экспоненты. Аналогичная зависимость присуща также скорости не разветвленного цепного горения.
Одновременное выполнение условий (1), (2) теплового и цепного (7) воспламенения вместе со специфической температурной зависимостью (8) скорости приводит к таким большим скоростям реакции, при которых нагревающийся газ не успевает расшириться до размеров, выходящих за зону горения, и тепло практически не успевает передаваться вне этой зоны. Поэтому в зоне горения процесс протекает адиабатически, давление и температура скачкообразно возрастают. Граница скачка давления и температуры продвигается в реакционной среде со скоростью, соответствующей скорости звука в нагретом участке среды и, значит, со сверхзвуковой скоростью по отношению к ненагретой среде. Движение сопровождается резким звуком. Такой режим горения называется взрывом, условие которого выражают следующим соотношением:
где ${v}$ – скорость звука в объеме реактора, tp – характеристическое время реакции, l – характерный размер очага горения [29].Если взрыв настолько сильный, что сопровождающая ударная волна в соседнем слое газа адиабатическим сжатием вызывает такую же сильную взрывную волну, то осуществляется детонация. Из экспоненциального характера уменьшения скорости реакции под влиянием ингибитора следовало, что путем ингибирования можно предотвратить переход горения во взрыв и в детонацию, а также эффективно разрушить уже сформировавшуюся детонационную волну. Предотвращение перехода горения в детонацию было осуществлено в работе действующей модели воздушно-реактивного двигателя в Центральном институте авиационного моторостроения РФ [30]. Схема стенда двигателя приведена на рис. 3. Из рис. 4 видно, что по мере увеличения содержания ингибитора концентрационные пределы перехода горения в детонацию сужаются, и при содержаниях присадки более 2.6 об. % переход предотвращается при всех соотношениях концентраций водорода и воздуха. Позже этот переход изучался также Институте им. М. Планка в Германии в совместной c нами работе [31].
Рис. 3.
Схема испытательного стенда прямоточного воздушно-реактивного двигателя: 1 – нагреватель воздуха, 2 – смеситель водорода, 3 – смеситель ингибитора, 4 – стабилизатор, 5 – искра, 6 – датчики давления, 7 – реакционная камера. Размеры в метрах.

Определяющую роль цепной лавины во взрывной волне и эффективное управление интенсивностью взрыва путем ингибирования демонстрирует рис. 5. Взрыв создавался в водородо-воздушной стехиометрической смеси в стальном коническом реакторе взрывом гексогена. Кружки с крестиками – результаты контрольных измерений, иллюстрирующих воспроизводимость и количественное управление интенсивностью взрыва.
Рис. 5.
Зависимости от содержания ингибитора концентрационных пределов перехода горения водородо-воздушной смеси в детонацию; 1 – горение без перехода в детонацию, 2 – детонация.

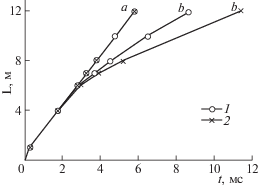
Решающая роль цепной лавины в детонации позволяет также варьировать скорость детонационной волны с помощью присадок и даже разрушить стационарную волну. Представленные на рис. 6 результаты показывают распад стационарной детонационной волны (a) в водородо-воздушной стехиометрической смеси присадками пропана. При инициировании в отсутствие ингибитора реализуется стационарная детонационная волна (прямая x–t-диаграмма a), в которой с постоянными скоростями совместно пробегают фронты давления ударной волны и взрывной реакции. При наличии же 3% пропана детонация распадается на затухающую волну горения (b), все больше отстающую от также затухающей ударной волны (b) [32].
УПРАВЛЕНИЕ ГОРЕНИЕМ ПУТЕМ ХИМИЧЕСКОЙ ОБРАБОТКИ КОНТАКТИРУЮЩЕЙ ГОРЮЧИМ С ГАЗОМ ТВЕРДОЙ ПОВЕРХНОСТИ
Гетерогенные реакции участвующих в цепном процессе атомов и радикалов являются важным специфическим каналом энергоотвода из зоны горения помимо теплоотвода [33–35]. Специфика состоит в том, что при гетерогенной рекомбинации наряду с отводом энергии происходит также обрыв реакционных цепей. Поскольку реакции непосредственно между исходными молекулами в силу очень больших энергий активации практически не протекают, то в той мере, в какой протекает гетерогенный обрыв цепей, блокируется процесс горения в целом. Отсюда следует, что путем варьирования эффективности гетерогенного обрыва цепей, можно регулировать условия воспламенения. Действительно, воспламеняемость, например, водородо-воздушных смесей в кварцевом реакторе, предварительно сполоснутом плавиковой кислотой, оказывается намного больше, чем в том же реакторе, предварительно сполоснутом тонкой суспензией оксида магния [2, 8]. Обнаруженное различие горючести соответствует известному из литературы различию коэффициентов рекомбинации атомов водорода на этих поверхностях. В отличие от критического условия воспламенения, влияние химических свойств поверхности на скорость распространения пламени зависит также от соотношения характеристического времени гетерогенной реакции и времени контакта пробегающей зоны пламени с поверхностью. В этом режиме проявляется известная нестабильность кинетики гетерогенных реакций, ухудшающая воспроизводимость результатов (например, [2] стр. 370).
Таким образом, разработанные на базе теории неизотермических цепных процессов кинетические методы позволяют эффективно управлять всеми режимами горения газов.
Работа выполнена при поддержке Российского фонда фундаментальных исследований (код проекта № 18-03-00489), за счет субсидии, выделенной ИХФ РАН на выполнение государственного задания, тема “Фундаментальные исследования процессов превращения энергоемких материалов и разработка научных основ управления этими процессами”, а также в рамках государственного задания ИСМАН (тема 45.1).
Работа выполнена при поддержке Российского фонда фундаментальных исследований (код проекта № 18-03-00489).
Список литературы
Семенов Н.Н. // Успехи физ. наук. 1940. Т. 23. № 1. С. 251.
Семенов Н.Н. Избранные труды. Т. 3. М.: Наука, 2005. 499 с.
Ceмeнoв H.H. // Z. Phys. 1927. V. 46. P. 109.
Семенов Н.Н. Цепные реакции. Ленинград: Госхимтехиздат, 1934. 555 с.
Hinshelwood C., Thomson // Proc. Roy. Soc. 1929. V. 122. P. 610.
Hinshelwood C.N., Williamson A.T. The Reaction between Hydrogen and Oxygen. New York: Oxford University Press, 1934.
Азатян В.В., Ведешкин Г.К., Филатов Ю.М. // Вестн. РАН. 2019. Т. 3. С.
Азатян В.В. // Цепные реакции в процессах горения, взрыва и детонации газов. М.: РАН, 2017. 448 с.
Korobeinichev O.P., Shvartsberg V.M., Shmakiv A.G. еt al. // Proc. Comb. Institute. 2007. V. 31. P. 2741. 3. Франк-Каменецкий Д.А. Диффузия и теплопередача в химической кинетике. М.: Наука, 1987. 491 с.
Вильямс Ф.А. Теория горения. М.: Наука, 1971. 615 с.
Зельдович Я.Б., Баренблат Г.И., Либрович В.Б., Махвиладзе Г.М. Математическая теория горения. М.: Наука, 1980. 478 с.
Lewis B., Von Elbe G. Combustion, Explosions and Flame in Gases. N.Y.-L.: Acad. Press, 1987. 592 p.
Мержанов А.Г., Хайкин Б.И. Теория волн горения в гомогенных средах. Черноголовка: Изд-во ОИХФ РАН, 1992. 160 с.
Большой Энциклопедический словарь “Физика”. Статья “Горение”. М.: Изд-во “Большая Российская Энциклопедия”, 1998. С. 134.
Франк-Каменецкий Д.А. Основы макрокинетики, диффузия, теплопередача в химической кинетике. Долгопрудный: “Интеллект”, 2008. 407 с.
Кукин П.П., Юшин В.В., Емельянов С.Г. // Теория горения и взрыва. М.: Изд-во “Юрайт”, 2012. 435 с.
Палесский Ф.С., Фурсенко Р.В., Минаев С.С. // Физика горения и взрыва. 2014. Т. 50. № 6. С. 3.
Сабденов К.И. Хим. физика. 2017. Т. 36. № 11. С. 39.
Бабкин В.С., Сеначин П.К. Процессы горения газов в ограниченных объемах. Изд-во Алт. ГТУ, 2017. 143 с.
Азатян В.В. // Успехи химии. 1999. Т. 62. № 12. С. 1122.
Азатян В.В. // Журн. физ. химии. 2011. Т. 85. № 8. С. 1405.
Michael J.V., Sutherland J.W., Harding L.B., Wagner A.F. // Proc. Comb. Inst. 2000. V. 28. P. 1471.
Baulch D.L., C.T. Bowman, Cobos C.J. et al. // J. Phys. and Chem. Ref. Data. 2005. V. 34. № 3. P. 757.
Srinivan N.K., Michael J.V. // Comb. Flame. 2007. V. 149. № 1/2. P. 104.
Азатян В.В. // Кинетика и катализ. 1996. Т. 37. № 4. С. 537.
Азатян В.В., Павлов В.А., Шаталов О.П. // Там же. 2005. Т. 46. № 6. С. 835.
Тимербулатов Т.Р., Азатян В.В., Сайкова Г.Р. и др. // Патент на изобретение.
Азатян В.В., Балаян Г.В., Прокопенко В.М., Чапышева Н.М. // Докл. РАН. 2016. Т. № 3. С.
Большая Российская энциклопедия. Статья “Взрыв”. 2006. Т. 5. С. 242.
Azatyan V.V., Vedeshkin G.K., Iskra V.A. // Proceedings of the 12th International Hydrogen Energy Conference. Buenos Aires, 1998. P. 1965.
Azatyan V.V., Wagner G.Gg., Vedeshkin G.K. // Gaseous and Heterogeneous Detonations. Moscow: ENAS Publishers, 1999. P. 331.
Азатян В.В., Абрамов С.К., Прокопенко В.М. и др. // Кинетика и катализ. 2013. Т. 54. № 5. С. 553.
Азатян В.В., Абрамов С.К. Борисов А.А. и др. // Журн. физ. химии. 2013. Т. 87. № 3. С. 407.
Азатян В.В., Прокопенко В.М., Абрамов С.К. // Там же. 2019 Т. 93. № 4.
Абрамов С.К., Азатян В.В., Казанский В.Б. и др. Горение и взрыв. 2019. Т.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии