Журнал физической химии, 2020, T. 94, № 1, стр. 26-31
Термодинамические функции инулина и абсолютные энтропии полисахаридов
А. В. Князев a, *, А. С. Шипилова a, М. И. Лелет a, С. С. Князева a, Е. В. Гусарова a, А. А. Амосов a
a Нижегородский государственный университет им. Н.И. Лобачевского
603950 Нижний Новгород, Россия
* E-mail: knyazevav@gmail.com
Поступила в редакцию 09.04.2019
После доработки 09.04.2019
Принята к публикации 14.05.2019
Аннотация
Методом точной вакуумной адиабатической калориметрии впервые измерена температурная зависимость теплоемкости инулина в диапазоне 5–340 K. Из экспериментальных данных определены термодинамические функции инулина (теплоемкость, энтальпия H°(T) – H°(0), энтропия S°(T) – S°(0) и функция Гиббса G°(T) – H°(0)) в интервале температур от T → 0 до 340 K. С использованием мультифрактальной модели обработки низкотемпературной теплоемкости твердых тел Дебая оценена величина фрактальной размерности D исследуемого образца. Состав инулина изучен также с помощью MALDI-TOF масс-спектрометрии. Оценены абсолютные энтропии некоторых полисахаридов.
Инулин (CAS: 9005-80-5) представляет собой водорастворимый полисахарид и относится к группе неусвояемых углеводов, называемых фруктанами. Инулин встречается в ∼36 000 видов растений, среди которых корни цикория считаются самым богатым источником данного соединения. Обладая способностью воздействовать на организм комплексно, инулин активно используется в пищевой и фармацевтической промышленности. Он используется в качестве пребиотика, заменителя жира, заменителя сахара, модификатора текстуры пищевых продуктов, а также для разработки функциональных пищевых продуктов питания [1]. Растительный инулин может содержать от 2 до 100 единиц фруктозы, длина, состав и полидисперсность которых зависят от вида растения, фазы его жизненного цикла, даты сбора урожая, процесса экстракции и процедур, последующих за ней [2]. Таким образом, фруктаны присутствуют в растениях в виде гетерогенных смесей с различной степенью полимеризации (DP) и различной химической структурой [3].
Эта работа – продолжение систематических исследований биологически активных соединений. Ранее [4–8] мы исследовали термодинамические свойства витаминов и гормонов. Цель данной работы – калориметрическое определение стандартных термодинамических функций инулина и описание биохимических и промышленных процессов с его участием.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образец инулина, полученный из цикория, приобретен у компании BENEO-Bio Based Chemicals, Бельгия. Согласно сертификату BENEO, содержание примесей в образце составило не более 0.5%, следовательно, исследуемый инулин представляет собой индивидуальное аморфное соединение. В качестве матрицы для MALDI-TOF масс-спектрометрии использовали 2,5-дигидроксибензойную кислоту (DHB), приобретенную у Sigma-Aldrich. Масс-спектр исследуемого образца показан на рис. 1. На основе данного спектра рассчитан состав инулина (табл. 1), а затем усредненная молекулярная масса, которая составила 1036.477 г моль–1.
Таблица 1.
Состав исследуемого инулина
| DP | Формула | Состав, % |
|---|---|---|
| 3 | C18H32O16 | 24.1 |
| 4 | C24H42O21 | 18.3 |
| 5 | C30H52O26 | 15.6 |
| 6 | C36H62O31 | 9.2 |
| 7 | C42H72O36 | 7.8 |
| 8 | C48H82O41 | 5.4 |
| 9 | C54H92O46 | 2.1 |
| 10 | C60H102O51 | 2.2 |
| 11 | C66H112O56 | 3.5 |
| 12 | C72H122O61 | 2.6 |
| 13 | C78H132O66 | 2.0 |
| 14 | C84H142O71 | 1.9 |
| 15 | C90H152O76 | 1.3 |
| 16 | C96H162O81 | 1.5 |
| 17 | C102H172O86 | 1.0 |
| 18 | C108H182O91 | 0.8 |
| 19 | C114H192O96 | 0.7 |
| Общее 100% |
Аппаратура и процедура измерений. Для измерения теплоемкости испытуемого вещества в диапазоне от 6 до 343 K использовали прецизионный вакуумный адиабатический калориметр БКТ-3.0 с дискретным нагревом. Описание конструкции установки и методика эксперимента представлены в [9]. Перед началом работы на установке с исследуемыми образцами измеряли теплоемкость меди марки “ОСЧ 11-4” высокой чистоты, эталонных образцов синтетического корунда и бензойной кислоты К-2. Анализ результатов показал, что погрешность измерения теплоемкости вещества при гелиевых температурах находилась в пределах ±2%, при повышении температуры до 40 K она снизилась до ±0.5% и составляла ±0.2% при Т > 40 K.
Степень полимеризации образца инулина определяли с использованием масс-спектрометра MALDI-TOF Axima Performance. Приготовление образца: 12 мг образца с 1 мл 2,5-дигидроксибензойной кислоты растворяли в 50%-ном ацетонитриле. После перемешивания полученный раствор дополнительно разводили в соотношении 1 : 9 и использовали для дальнейшего эксперимента. Образец помещали в 100-луночный планшет из нержавеющей стали и подвергали множественным ударам лазера.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Теплоемкость
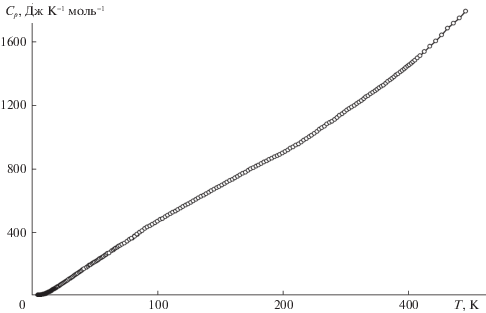
Измерение теплоемкости проводили в интервале температур от 5 до 340 K. Масса образца, загруженного в калориметрическую ампулу вакуумного адиабатического калориметра БКТ-3.0, составляла 0.5647 г. 242 экспериментальных значения получены в двух сериях экспериментов. Теплоемкость образца варьировалась от 20 до 50% от общей теплоемкости калориметрической ампулы с веществом в диапазоне от 5 до 340 K. Методом наименьших квадратов установлены экспериментальные точки $С_{p}^{ \circ }$ в интервале температур 5−340 K, а также получены полиномиальные уравнения зависимости теплоемкости от температуры:
(1)
$\begin{gathered} С_{p}^{ \circ } = {{A}_{1}} + {{B}_{1}}(T{\text{/}}30) + {{C}_{1}}{{(T{\text{/}}30)}^{2}} + {{D}_{1}}{{(T{\text{/}}30)}^{3}} + \\ + \;{{E}_{1}}{{(T{\text{/}}30)}^{4}} + {{F}_{1}}{{(T{\text{/}}30)}^{5}} + {{G}_{1}}{{(T{\text{/}}30)}^{6}} + \\ + \;{{H}_{1}}{{(T{\text{/}}30)}^{7}} + {{I}_{1}}{{(T{\text{/}}30)}^{8}} + {{J}_{1}}{{(T{\text{/}}30)}^{9}}, \\ \end{gathered} $(2)
$\begin{gathered} C_{p}^{o} = {{A}_{2}} + {{B}_{2}}\ln (T{\text{/}}30) + {{C}_{2}}{{\ln }^{2}}(T{\text{/}}30) + \\ + \;{{D}_{2}}{{\ln }^{3}}(T{\text{/}}30) + {{E}_{2}}{{\ln }^{4}}(T{\text{/}}30) + {{F}_{2}}{{\ln }^{5}}(T{\text{/}}30) + \\ + \;{{G}_{2}}{{\ln }^{6}}(T{\text{/}}30) + {{H}_{2}}{{\ln }^{7}}(T{\text{/}}30), \\ \end{gathered} $(3)
$\begin{gathered} \ln C_{p}^{o} = {{A}_{3}} + {{B}_{3}}\ln (T{\text{/}}30) + {{C}_{3}}{{\ln }^{2}}(T{\text{/}}30) + \\ + \;{{D}_{3}}{{\ln }^{3}}(T{\text{/}}30) + {{E}_{3}}{{\ln }^{4}}(T{\text{/}}30) + \\ + \;{{F}_{3}}{{\ln }^{5}}(T{\text{/}}30) + {{G}_{3}}{{\ln }^{6}}(T{\text{/}}30). \\ \end{gathered} $Соответствующие коэффициенты (A, B, C и т.д.), подобранные с помощью специальных программ, приведены в табл. 2. Среднеквадратичное отклонение экспериментальных значений $С_{p}^{ \circ }$ от усредненной кривой $С_{p}^{ \circ }$ = f(T) составляло 0.15% в интервале от 5 до 40 K, 0.075% от 40 до 80 K и 0.050% в диапазоне от 80 до 340 K. Экспериментальные значения молярной теплоемкости инулина в диапазоне от 5 до 340 K и усредняющая кривая зависимости $С_{p}^{ \circ }$ = f(T) представлены на рис. 2. Теплоемкость этого вещества постепенно увеличивается с повышением температуры и не проявляет каких-либо видимых аномалий.
Таблица 2.
Коэффициенты в полиномах $С_{p}^{ \circ }$ = f(T) для инулина
| Тип полинома | 5.3−20 K | 15−110 K | 100−340 K |
|---|---|---|---|
| A | 4.89137095354 | 102.344368996 | –32 740.5237198 |
| B | 3.17244642147 | 163.895403134 | 47 311.9218235 |
| C | 3.76031580194 | 96.0553303531 | –29 280.5154190 |
| D | 6.18141380175 | 0.456673708895 | 10 268.8692282 |
| E | 4.55489152494 | –53.2397303112 | –2241.06418933 |
| F | 1.94134242928 | 50.2741138156 | 315.546065183 |
| G | 0.419130805492 | 62.0548173169 | –28.6705305818 |
| H | –47.5829613777 | 1.62171702860 | |
| I | –0.0518394337621 | ||
| J | 0.000713610312437 |
По экспериментальным значениям в диапазоне 25–50 K была оценена величина фрактальной размерности D инулина. Согласно фрактальной теории теплоемкости [10], D – наиболее важный параметр, позволяющий делать заключения о типе топологии структуры твердых тел. Согласно теории, D = 1 для тел с цепной структурой, D = 2 для слоистой структуры и D = 3 для пространственной структуры [11]. В фрактальной теории теплоемкости показатель степени при T является функцией теплоемкости, обозначается через D и называется фрактальной размерностью. Это следует конкретно из уравнения [10]:
(4)
${{C}_{{v}}} = 3D(D + 1)kN\gamma (D + 1)\xi (D + 1){{(T{\text{/}}{{\theta }_{{{\text{max}}}}})}^{D}},$Термодинамические функции
Для расчета стандартных термодинамических функций (табл. 3) инулина его значения $С_{p}^{ \circ }$ экстраполировались от начальной температуры измерения (∼6 K) до 0 K по функции теплоемкости твердых тел Дебая [15]:
где D − символ функции Дебая, n = 3 и ${{{\theta }}_{{\text{D}}}}$ (инулин) = 61.2 K − специально выбранные параметры. Уравнение (5) описывает экспериментальные значения $С_{p}^{ \circ }$ соединения между 9 и 12 K с погрешностью 1.8%. При расчете функций предполагалось, что уравнение (5) воспроизводит значения $С_{p}^{ \circ }$ инулина при T < 6 K с той же ошибкой.Таблица 3.
Термодинамические функции инулина; M = 1036.477 г моль–1, pо = 0.1 МПа
| T, К | $С_{p}^{ \circ }(T)$, Дж K–1моль–1 | H°(T) – H°(0), кДж моль–1 | H°(T), Дж K–1 моль–1 | –[G°(T) – H°(0)], кДж моль–1 |
|---|---|---|---|---|
| 0 | 0 | 0 | 0 | 0 |
| 1 | 0.0085 | 0 | 0.0028 | 0.000001 |
| 2 | 0.0677 | 0 | 0.0226 | 0.000011 |
| 3 | 0.2284 | 0.0002 | 0.0761 | 0.000057 |
| 4 | 0.5411 | 0.0005 | 0.1804 | 0.000180 |
| 5 | 1.051 | 0.0013 | 0.3520 | 0.000440 |
| 6 | 1.893 | 0.0027 | 0.6050 | 0.000912 |
| 7 | 2.525 | 0.0051 | 0.9409 | 0.001527 |
| 8 | 3.666 | 0.0079 | 1.344 | 0.002813 |
| 9 | 5.317 | 0.0126 | 1.883 | 0.004299 |
| 10 | 7.489 | 0.0187 | 2.534 | 0.006594 |
| 15 | 25.22 | 0.0965 | 8.581 | 0.032234 |
| 20 | 50.02 | 0.2828 | 19.14 | 0.1000 |
| 25 | 75.59 | 0.5966 | 33.03 | 0.2293 |
| 30 | 102.3 | 1.041 | 49.16 | 0.4341 |
| 35 | 129.9 | 1.621 | 67.00 | 0.7238 |
| 40 | 157.2 | 2.339 | 86.14 | 1.106 |
| 45 | 183.9 | 3.192 | 106.2 | 1.587 |
| 50 | 210.0 | 4.177 | 126.9 | 2.169 |
| 60 | 261.2 | 6.534 | 169.8 | 3.652 |
| 70 | 313.0 | 9.404 | 213.9 | 5.569 |
| 80 | 366.0 | 12.80 | 259.1 | 7.933 |
| 90 | 419.0 | 16.72 | 305.3 | 10.75 |
| 100 | 469.5 | 21.17 | 352.1 | 14.04 |
| 110 | 515.0 | 26.10 | 399.0 | 17.80 |
| 120 | 558.7 | 31.46 | 445.7 | 22.02 |
| 130 | 603.7 | 37.28 | 492.2 | 26.71 |
| 140 | 649.6 | 43.54 | 538.6 | 31.87 |
| 150 | 694.8 | 50.26 | 585.0 | 37.48 |
| 160 | 738.3 | 57.43 | 631.2 | 43.56 |
| 170 | 780.0 | 65.02 | 677.2 | 50.11 |
| 180 | 821.1 | 73.03 | 723.0 | 57.11 |
| 190 | 863.0 | 81.45 | 768.5 | 64.57 |
| 200 | 907.2 | 90.30 | 813.9 | 72.48 |
| 210 | 954.6 | 99.60 | 859.3 | 80.84 |
| 220 | 1005 | 109.4 | 904.8 | 89.66 |
| 230 | 1059 | 119.7 | 950.7 | 98.94 |
| 240 | 1115 | 130.6 | 997.0 | 108.7 |
| 250 | 1171 | 142.0 | 1044 | 118.9 |
| 260 | 1228 | 154.0 | 1091 | 129.6 |
| 270 | 1285 | 166.6 | 1138 | 140.7 |
| 273.15 | 1303 | 170.7 | 1153 | 144.3 |
| 280 | 1342 | 179.7 | 1186 | 152.3 |
| 290 | 1403 | 193.4 | 1234 | 164.4 |
| 298.15 | 1455 | 205.1 | 1274 | 174.6 |
| 300 | 1468 | 207.8 | 1283 | 177.0 |
| 310 | 1539 | 222.8 | 1332 | 190.1 |
| 320 | 1617 | 238.6 | 1382 | 203.6 |
| 330 | 1698 | 255.2 | 1433 | 217.7 |
| 340 | 1773 | 272.5 | 1485 | 232.3 |
Расчеты H°(T) − H°(0) и S°(T) − S°(0) были проведены с помощью численного интегрирования кривых $С_{p}^{ \circ }$ = f(T) и $С_{p}^{ \circ }$ = f(ln T) соответственно, и функция Гиббса G°(T) − H°(0) была оценена по энтальпиям и энтропиям при соответствующих температурах. Стандартная неопределенность значений функции составила ±2% при T < < 40 K, ±0.5% между 40 и 80 K и ±0.2% в диапазоне от 80 до 340 K.
На основании полученных результатов и литературных данных [16] мы построили зависимость абсолютной энтропии полисахаридов от молекулярной массы (рис. 3) с использованием абсолютных энтропий известного моносахарида (глюкозы) и дисахарида (сахарозы). Впервые установлено, что наблюдаемая зависимость абсолютной энтропии полисахаридов от молекулярной массы линейна:
коэффициент корреляции практически равен единице (R2 = 0.9997).Рис. 3.
Зависимость абсолютных энтропий полисахаридов от молекулярной массы; 1 – α-D-глюкоза, 2 – сахароза, 3 – инулин.

В табл. 4 приведена оценка абсолютных энтропий некоторых полисахаридов; например, абсолютная энтропия 1-кестозы (это известный трисахарид [3]) равна 606 Дж K–1 моль–1.
Таблица 4.
Абсолютные энтропии некоторых полисахаридов (Дж K–1 моль–1)
| DP | Формула | S°(298.15) |
|---|---|---|
| 3 | C18H32O16 | 606 |
| 4 | C24H42O21 | 809 |
| 5 | C30H52O26 | 1012 |
| 6 | C36H62O31 | 1215 |
| 7 | C42H72O36 | 1418 |
| 8 | C48H82O41 | 1621 |
| 9 | C54H92O46 | 1824 |
| 10 | C60H102O51 | 2027 |
Таким образом, в результате термодинамического исследования инулина оценена фрактальная размерность D и впервые установлено, что наблюдается линейная зависимость абсолютной энтропии полисахаридов от молекулярной массы.
Работа выполнена при финансовой поддержке Фонда содействия развитию малых форм предприятий в научно-технической сфере (номер проекта 10510ГУ/2016).
Список литературы
Shoaib M., Shehzad A., Omar M. et al. // Carbohydrate Polymers. 2016. V. 147. P. 444.
Barclay T., Ginic-Markovic M., Cooper P., Petrovsky N. // J. Excipients and Food Chemicals. 2010. V. 1. P. 27.
Apolinario A.C., Damasceno B.P.G.L., Beltrão N.E.M. et al. // Carbohydrate Polymers. 2014. V. 101. P. 368.
Knyazev A.V., Letyanina I.A., Plesovskikh A.S. et al. // Thermochimica Acta. 2014. V. 575. P. 12.
Knyazev A.V., Smirnova N.N., Shipilova A.S. et al. // Ibid. 2015. V. 604. P. 115.
Knyazev A.V., Smirnova N.N., Plesovskikh A.S. et al. // Ibid. 2014. V. 582. P. 35.
Knyazev A.V., Emel’yanenko V.N., Shipilova A.S. et al. // J. Chem. Thermodyn. 2016. V. 100. P. 185.
Knyazev A.V., Smirnova N.N., Shipilova A.S. et al. // J. Thermal Analysis and Calorimetry. 2016. V. 123. P. 2201.
Varushchenko R.M., Druzhinina A.I., Sorkin E.L. // J. Chem. Thermodyn. 1997. V. 29. P. 623.
Yakubov T.S. // Dokl. Acad. Sci. 1990. V. 310. P. 145.
Tarasov V.V. // Z. Fiz. Khimii. 1950. V. 24. P. 111.
Knyazev A.V., Tananaev I.G., Kuznetsova N.Yu. et al. // Thermochim. Acta. 2010. V. 499. P. 155.
Karyakin N.V., Chernorukov N.G., Suleimanov E.V. et al. // Russ. J. Phys. Chem. 2000. V. 74. P. 1226.
Chernorukov N.G., Smirnova N.N., Knyazev A.V. et al. // Ibid. 2006. V. 80. № 1. P. 37.
Debye P. // Annalen der Physik. 1912. V. 39. P. 789.
Boerio-Goates J. // J. Chem. Thermodyn. 1991. V. 23. P. 403.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии