Журнал физической химии, 2020, T. 94, № 1, стр. 40-45
Кинетика переноса протонов от окта(м-трифторметилфенил)порфиразина к азотсодержащим основаниям в системе бензол–диметилсульфоксид
О. А. Петров a, *, Г. В. Осипова a, К. А. Аганичева a
a Ивановский государственный химико-технологический университет
Иваново, Россия
* E-mail: poa@isuct.ru
Поступила в редакцию 14.03.2019
После доработки 14.03.2019
Принята к публикации 09.04.2019
Аннотация
Изучено кислотно-основное взаимодействие окта(м-трифторметилфенил)порфиразина с пиридином, 2-метилпиридином, морфолином и пиперидином в системе бензол–диметилсульфоксид. Установлено, что межмолекулярный перенос протонов NH-групп от окта(м-трифторметилфенил)порфиразина к морфолину и пиперидину характеризуется необычно низкими значениями констант скорости. Показано влияние β,β-бензоаннелирования в порфиразиновом макроцикле и природы основания на кинетические параметры процесса. Предложено строение комплексов с переносом протонов замещенных порфиразинов. Обнаружено, что они подвергаются распаду с течением времени.
Порфиразины представляют собой класс ароматических макрогетероциклических соединений, которые благодаря разнообразным возможностям модификации их структуры находят широкое применение в качестве электро- и фотокатализаторов окисления и восстановления, жидкокристаллических веществ, химических сенсоров и фотосенсибилизаторов [1]. Всестороннее изучение физико-химических свойств порфиразинов позволяет расширить спектр практического применения этого класса соединений. Одно из малоизученных свойств порфиразинов – их способность вступать в кинетически контролируемые кислотно-основные взаимодействия с кислород- и азотсодержащими основаниями с образованием различных по устойчивости комплексов с переносом протонов. Кинетические параметры образования этих компонентов достаточно сильно зависят от кислотности порфиразинного макроцикла, величины pKa основания и пространственного экранирования его реакционного центра, а также от диэлектрической проницаемости среды [2].
С целью более полного понимания факторов, влияющих на процесс образования комплексов с переносом протонов порфиразинов, в настоящей работе впервые изучено взаимодействие окта(м-трифторметилфенил)порфиразина с азотосодержащими основаниями (B) в системе бензол–диметилсульфоксид (ДМСО), а также показано влияние структуры окта(м-трифторметилфенил)порфиразина (H2Pa(C6H4CF3)8), гекса(м-трифторметилфенил)бензопорфиразина (H2Pa(C6H4CF3)6(C4H4)) и тетра(м-трифторметилфенил)дибензопорфиразина (H2Pa(C6H4CF3)4(C4H4)2):
на их реакционную способность в кислотно-основном взаимодействии с В. В качестве В были взяты пиридин (Рy), 2-метилпиридин (МеРy), морфолин (Моr) и пиперидин (Pip).ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Окта(м-трифторметилфенил)порфиразин синтезировали по методике [3]. Бензол и основания подвергали очистке [4]. Диметилсульфоксид выдерживали в течение суток над MgSO4 и CaO, а затем перегоняли под уменьшенным давлением (2–3 мм рт.ст., температура кипения – 50°С). Для проведения кинетических измерений в термостатируемую кювету спектрофотометра SHIMADZU-UV-1800 помещали свежеприготовленный раствор H2Pa(C6H4CF3)8 с постоянной концентрацией и основания с различной концентрацией в системе бензол – ДМСО. Скорость кислотно-основного взаимодействия (КОВ) определяли по уменьшению оптической плотности наиболее интенсивной полосы при длине волны λ = 659 нм. Минимальное значение оптической плотности в конце реакции свидетельствовало об отсутствии в реагирующей системе молекулярной формы H2Pa(C6H4CF3)8 и указывало на образование продукта реакции. Различие в максимумах полос поглощения H2Pa(C6H4CF3)8 и соединения, образующегося при взаимодействии с В, позволило определить текущую (C) и конечную (Co) концентрации H2Pa(C6H4CF3)8 по формуле:
Здесь Ao, Aτ и A∞ – оптические плотности растворов в начальный момент времени, в момент времени τ и после завершения реакции (τ∞). Все измерения проводили в условиях реакции псевдопервого порядка, поэтому эффективную (наблюдаемую) константу скорости реакции рассчитывали по формуле: Погрешность в кинетических параметрах определяли по методу Стьюдента.ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Предварительными спектрофотометрическими методами было установлено, что кинетически контролируемое взаимодействие H2Pa(C6H4CF3)8 с морфолином и пиперидином наблюдается только в системе бензол – 5% ДМСО при $C_{{{\text{Mor}}}}^{{\text{o}}}$ > 2.30 и $C_{{{\text{Pip}}}}^{{\text{o}}}$ > 0.65 моль/л. В электронном спектре поглощения (ЭСП) H2Pa(C6H4CF3)8 (λI = 659, λII = 594 нм) независимо от природы основания с течением времени наблюдается рост интенсивности полосы поглощения при λ = 632 нм на фоне уменьшения интенсивности полос поглощения λI, и λII (рис. 1). Спектральные изменения, сопровождающие реакцию, идентичны изменениям ЭСП при взаимодействии тетрагалоген- и октафенилзамещенных порфиразинов с азотсодержащими основаниями в бензоле [2], в ходе которых симметрия макроциклического π-хромофора молекулы повышается от D2h до D4h вследствие сильной дестабилизации низшей свободной молекулярной орбитали (НСМО) $\pi _{1}^{*}$ и особенно высшей заполненной молекулярной орбитали (ВЗМО) π1 [5, 6]. Это означает, что H2Pa(C6H4CF3)8 в реакции с морфолином и пиперидином проявляет свойства двухосновной NH-кислоты, а D4h-симметрия указывает на вывод из плоскости порфиразинового макроцикла двух протонов NH-групп молекулами основания, приводящий к образованию комплексов с переносом протонов – (Pa(C6H4CF3)8)2–···(НВ+)2:
Рис. 1.
Изменение электронного спектра поглощения H2Pa(C6H4CF3)8 в присутствии морфолина в течение 30 мин при 323 K и CMor = 10.90 моль/л в системе бензол – 5% ДМСО.

Эти комплексы следует рассматривать как ион-ионные ассоциаты, в которых протоны от NH-групп Н2Pa(C6H4CF3)8, связанные с молекулами основания и внутрициклическими атомами азота посредством водородных связей, располагаются над и под плоскостью макроцикла на оси симметрии четвертого порядка, что является необходимым условием соблюдения высокой симметрии распределения зарядов [2, 7].
Дальнейшие исследования показали, что комплексы (Pa(C6H4CF3)8)2–···(НВ+)2 обладают сравнительно низкой кинетической устойчивостью. В ЭСП с течением времени регистрируется уменьшение интенсивности полосы поглощения при λ = 632 нм (рис. 1). При этом исчезает полоса Соре, свидетельствующая о наличии пиррольных фрагментов в порфиразинном макроцикле. Аналогичная картина ранее была обнаружена для H2Pa(C6H4CF3)6(C4H4)] [8] и H2Pa(C6H4CF3)4(C4H4)2 [9] в присутствии азотосодержащего основания в системе бензол – 5% ДМСО. Представляется вполне вероятным, что деструкция комплексов (Pa(C6H4CF3)8)2–···(НВ+)2 связана с протеканием конкурентной реакции за протон, в результате которой образуется дианионная форма порфиразина – (Pa(C6H4CF3)8)2–. В отсутствие компенсации избыточного отрицательного заряда в макроцикле она подвергается самопроизвольному распаду, приводящему к образованию низкомолекулярных бесцветных продуктов реакции пиррольного типа:
(3)
$\begin{gathered} {{{\text{(Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}{\text{)}}}^{{2--}}}{\kern 1pt} \cdots {\kern 1pt} {{({\text{Н}}{{{\text{В}}}^{{\text{ + }}}})}_{2}} + 2{\text{В}} \to \\ \to {{{\text{(Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}{\text{)}}}^{{2--}}} + {{({\text{В}}{\kern 1pt} \cdots {\kern 1pt} {\text{Н}}{\kern 1pt} \cdots {\kern 1pt} {\text{В}})}^{ + }}, \\ \end{gathered} $(4)
${{{\text{(Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}{\text{)}}}^{{{\text{2--}}}}} \to {\text{продукты}}\;{\text{деструкции}}.$Кинетические исследования показали, что реакция Н2Pa(C6H4CF3)8 с В в системе бензол – 5% ДМСО имеет первый порядок по NH-кислоте (рис. 2) и близкий к единице (в пределах экспериментальной ошибки) – по морфолину и пиперидину (рис. 3). Из этого следует, что
(6)
$--d{{C}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}}}}{\text{/}}d\tau = k{{С}_{{{{{\text{Н}}}_{{\text{2}}}}{\text{Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}}}}{{С}_{{\text{в}}}},$Рис. 2.
Зависимости ln(Cо/C) от времени реакции H2Pa(C6H4CF3)8 c морфолином (1) и пиперидином (2) в системе бензол – 5% ДМСО при Т = 323 K и CMor = 10.90 моль/л (1), CPip = 2.56 моль/л (2).

Рис. 3.
Зависимости lg kэ от lg CB для реакции H2Pa(C6H4CF3)8 c морфолином (1) и пиперидином (2) в системе бензол – 5% ДМСО при 323 K.
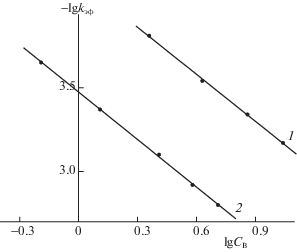
Полученные данные указывают на бимолекулярный характер лимитирующей стадии процесса, а повышение симметрии π-хромофора порфиразиновой молекулы от D2h до D4h (рис. 1) свидетельствует о двухстадийном процессе переноса протонов от Н2Pa(C6H4CF3)8 к морфолину и пиперидину в соответствии со следующей схемой:
(7)
$\begin{gathered} {{{\text{Н}}}_{{\text{2}}}}{\text{Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}} + {\text{В}}\;\mathop \to \limits^{{{k}_{1}}} \\ \mathop \to \limits^{{{k}_{1}}} \;{{{\text{(НPa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}{\text{)}}}^{--}}{\kern 1pt} \cdots {\kern 1pt} {{({\text{НВ}})}^{ + }}, \\ \end{gathered} $(8)
$\begin{gathered} {{{\text{(НPa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}{\text{)}}}^{{\text{--}}}} + {\text{В}}\;\mathop \to \limits^{{{k}_{2}}} \\ \mathop \to \limits^{{{k}_{2}}} \;{{{\text{(Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}{\text{)}}}^{{2--}}}{\kern 1pt} \cdots {\kern 1pt} {{({\text{Н}}{{{\text{В}}}^{ + }})}_{2}}. \\ \end{gathered} $Судя по изменениям ЭСП (рис. 1), уменьшение концентрации Н2Pa(C6H4CF3)8 в условиях значительного избытка основания происходит без спектральной регистрации промежуточного комплекса – (НPa(C6H4CF3)8)–···(НВ)+ (рис. 1), имеющего ${{C}_{{2{v}}}}$-симметрию [5]. Это обстоятельство дает основание полагать, что k1 < k2. Следует однако отметить, что детальный механизм реакции КОВ с участием порфиразинов представляется чрезвычайно сложным и требует дальнейшего углубленного изучения.
Результаты эксперимента (табл. 1) показывают, что реакция переноса протонов от Н2Pa(C6H4CF3)8 к морфолину и пиперидину характеризуется достаточно низкими значениями констант скорости, не свойственными для большинства относительно простых жидкофазных кислотно-основных систем [10]. Причина этого явления связана с действием стерической составляющей макроциклического эффекта [11], которая в кислотно-основном взаимодействии с участием порфиразинов изменяется несимбатно электронной составляющей. Последняя способствует росту полярности внутрициклических NH-связей за счет электроноакцепторного влияния мезо-атомов азота и м-трифторметилфенильных заместителей. В результате этого создаются благоприятные условия для переноса протонов от кислоты к основанию. Напротив, непрерывное π,π-перекрывание по 16-членнному макроциклу (С8N8), включение в n,π-сопряжение n-электронных пар пирролениновых атомов азота, а также увеличение числа π-электронов в сопряженной системе за счет мезо-атомов азота, способствуют росту ароматичности и конформационной жесткости молекулы Н2Pa(C6H4CF3)8. Высокая жесткость плоской конформации порфиразинового макроцикла, а также наличие в его пиррольных кольцах объемных трифторметилфенильных заместителей способствует экранированию атомами и π-электронами внутрициклических протонов NH-групп. Это противодействует благоприятному контакту реакционных центров молекул-партнеров и играет ключевую роль в кинетике переноса протонов от Н2Pa(C6H4CF3)8 к В.
Таблица 1.
Кинетические параметры кислотно-основного взаимодействия H2Pa(C6H4CF3)8 с азотсодержащими основаниями в системе бензол – 5% ДМСО, $C_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{8}}}}}}^{ \circ }$ = 1.24 × 10–5 моль/л
| $C_{{\text{B}}}^{ \circ }$, моль/л | Т, K | kэ × 104, с–1 | k × 105, л/(моль с) | Ea, кДж/моль | –∆S≠, Дж/(моль K) |
|---|---|---|---|---|---|
| Морфолин | |||||
| 2.30 | 298 323 333 343 |
0.56 1.55 2.15 3.10 |
2.55 7.05 9.80 14.05 |
32 | 227 |
| 4.30 | 298 323 333 343 |
0.99 2.85 3.90 5.60 |
2.50 7.15 9.75 14.00 |
30 | 229 |
| 7.20 | 298 323 333 343 |
1.56 4.59 6.45 9.20 |
2.40 7.05 9.90 14.10 |
32 | 218 |
| 10.90 | 298 323 333 343 |
2.50 6.80 9.50 13.70 |
2.60 7.00 9.80 14.20 |
32 | 215 |
| Пиперидин | |||||
| 0.65 | 298 323 333 343 |
1.15 2.25 2.80 3.60 |
17.50 34.20 42.15 54.60 |
22 | 250 |
| 1.28 | 298 323 333 343 |
2.15 4.27 5.25 6.80 |
17.20 33.90 41.70 53.70 |
21 | 253 |
| 2.56 | 298 323 333 343 |
4.30 8.30 10.30 13.35 |
17.70 34.10 42.10 54.70 |
22 | 243 |
| 3.84 | 298 323 333 343 |
6.25 12.10 15.00 19.20 |
17.50 33.70 41.80 53.40 |
21 | 244 |
| 5.11 | 298 323 333 343 |
8.05 16.00 19.90 25.80 |
17.10 34.00 42.20 54.85 |
22 | 238 |
Из данных табл. 1 следует, что максимальной реакционной способностью при взаимодействии с Н2Pa(C6H4CF3)8 обладает пиперидин (pKа = = 11.23 [12]), который является достаточно сильным акцептором протона и имеет стерически доступный атом азота, находящийся в пирамидальной конфигурации [13]. Введение в четвертое положение пиперидинового цикла дополнительного гетероатома кислорода не влияет на пространственное строение амина [13], однако приводит к понижению pKа на ∼2.5 единицы. В результате этого при переходе от пиперидина к менее протоноакцепторному морфолину (pKа = 8.50 [12]) величина k298 уменьшается в ∼7 раз на фоне незначительного роста величин Еа и ∆S≠ процесса. Уменьшение pKа оснований на ∼6 единиц в ряду Pip → Mor → MePy → Py приводит к дальнейшему ингибированию реакции переноса протона от кислоты к основанию, причем таким образом, что кинетически контролируемое КОВ Н2Pa(C6H4CF3)8 с пиридином (pKа = 5.23 [12]) и 2-метилпиридином (pKа = 6.00 [12]) в системе бензол – 5% ДМСО не наблюдается. На это указывает характер ЭСП Н2Pa(C6H4CF3)8 (λI = 659, λII = 594 нм), который не претерпевает изменений в интервале концентраций СPy = СMePy = = 0.31–9.93 (моль/л) при Т = 343 K в течение ∼17 ч.
Анализ кинетических данных (табл. 1, 2) показывает, что при переходе от H2Pa(C6H4CF3)8, к H2Pa(C6H4CF3)6(C4H4) и H2Pa(C6H4CF3)4(C4H4)2 скорость переноса протонов от кислоты к основанию, судя по величинам k298, существенно уменьшается на фоне роста активационных параметров реакции. Этот факт указывает на то, что последовательное β,β-бензоаннелировние в порфиразиновом макрогетероцикле приводит к уменьшению кислотных свойств молекулы и, как следствие, затрудняет перенос протонов NH-групп от кислоты к основанию.
Таблица 2.
Кинетические параметры кислотно-основного взаимодействия H2Pa(C6H4CF3)6(C4H4) [8] и H2Pa(C6H4CF3)4(C4H4)2 [9] с азотсодержащими основаниями в системе бензол – 5% ДМСО, $C_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{6}}}}({{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}})}}^{ \circ }$ = = 1.17 × 10–5 моль/л, $C_{{{{{\text{H}}}_{{\text{2}}}}{\text{Pa(}}{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{4}}}}{\text{C}}{{{\text{F}}}_{{\text{3}}}}{{{\text{)}}}_{{\text{4}}}}{{{({{{\text{C}}}_{{\text{4}}}}{{{\text{H}}}_{{\text{4}}}})}}_{2}}}}^{ \circ }$ = 0.92 × 10–5 моль/л
| Порфиразин | Основание | k298 × 105, л2/(моль2с) | Ea, кДж/моль | –∆S≠, Дж/(моль K) |
|---|---|---|---|---|
| H2Pa(C6H4CF3)6(C4H4) | Морфолин | 0.25 | 47 | 198 |
| Пиперидин | 1.65 | 27 | 240 | |
| H2Pa(C6H4CF3)4(C4H4)2 | Морфолин | р-я не идет | ||
| Пиперидин | 0.062 | 73 | 118 |
Список литературы
The Porphyrins Handbook. Applications: Past, Present and Future / Ed. by K.M. Kadish, M.K. Smith, R. Guilard., V.G. S. Diego, S. Francisco, N.Y., Boston, London, Sydney, Tokio: Acad. Press, 2000. 346 p.
Петров О.А. // Журн. общ. химии. 2013. Т. 83. № 4. С. 681.
Vagin S.I., Hanack M. // Eur. J. Org. Chem. 2002. P. 2859.
Титце Л., Айхер Г. Препаративная органическая химия. М.: Мир, 1999. 704 с.
Stuzhin P., Khelevina O., Berezin B. // Phthalocyanines: Properties and Applications. New York: VCH Publ., 1996. V. 4. P. 23.
Novakova V., Donzello M., Ercolani C., Zimcik P., Stuzhin P. // Coord. Chem. Rev. 2018. V. 361. № 4. P. 1.
Петров О.А. Реакционная способность тетраазапорфиринов в процессах кислотно-основного взаимодействия и образования молекулярных комплексов: Дис. … докт. хим. наук. Иваново: ИГХТУ, 2004. 264 с.
Петров О.А. // Журн. физ. химии. 2017. Т. 91. № 11. С. 1845.
Петров О.А. // Там же. 2015. Т. 89. № 2. С. 214.
Базилевкий М.В., Венер М.В. // Успехи химии. 2003. Т. 72. № 1. С. 3.
Березин Д.Б. Макроциклический эффект и структурная химия порфиринов. М.: Красанд, 2010. 424 с.
CRC Handbook of Chemistry and Physics / Ed. by William M. Haynes. Taylor and Francis. 2013. 2668 p.
Ballard R.E. Photoelectron spectroscopy and molecular orbital theory. Bristol: Adan Hilger, 1978. 192 p.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




