Журнал физической химии, 2020, T. 94, № 1, стр. 82-88
Влияние энергии гидратации ионов на степень набухания геля сшитого поливинилового спирта
А. Н. Гагарин a, М. Г. Токмачев b, *, Х. Т. Тробов c, Н. Б. Ферапонтов a
a Московский государственный университет имени М.В. Ломоносова, Химический факультет
119991 Москва, Россия
b Московский государственный университет имени М.В. Ломоносова, Физический факультет
119991 Москва, Россия
c Самаркандский государственный университет
140104 Самарканд, Узбекистан
* E-mail: miket@mail.ru
Поступила в редакцию 16.02.2019
После доработки 12.04.2019
Принята к публикации 14.05.2019
Аннотация
Проанализированы результаты взаимодействия растворенных веществ с полярными группами гидрофильного полимера. Исследовано и проанализировано влияние размеров и энергии гидратации катионов первой и второй групп, а также анионов седьмой группы на строение полимерной матрицы и состав полимерного геля. Проведены количественные оценки объемов и составов гелей из поливинилового спирта при изменении концентрации внешнего раствора.
Характерная отличительная черта сшитых гидрофильных полимеров – их способность образовывать в воде и в водных растворах полимерные гели – системы полимер–растворитель (часто бинарные, но возможно наличие растворенных веществ и/или нескольких растворителей), в которых существует пространственная сетка из сшитых полимерных молекул, способная удерживать большое количество растворителя. На воздухе полимерные гели сохраняют свою форму и этим отличаются от растворов полимеров. Полимерные гели (ПГ), это двухфазные системы, состоящие из полимерного раствора (ПР) и внешнего раствора (ВР), заполняющего пространство между гидратированными полимерными цепями. В свою очередь ПР – это раствор, состоящий из полимера, сорбированной им воды и, в общем случае, растворенных веществ, которые могут проникать в фазу ПР из внешнего раствора [1–5].
Один из наиболее широко используемых в настоящее время гидрофильных полимеров – как линейный, так и сшитый поливиниловый спирт (ПВС) [6]. В этом полимере полярны ОН-группы. Это – слабые диполи, количество сорбируемой ими воды невелико, и поэтому объем фазы ПР мало изменяется при изменении состава внешнего раствора. В то же время объем фазы ВР обычно составляет значительную часть объема полимерного геля, что приводит к заметному изменению объема всего геля при изменении природы и концентрации растворенного вещества [7].
Экспериментально установлено, что изменение концентрации раствора, в который перенесен набухший в воде полимер, приводит к изменению степени набухания геля ПВС. Это изменение в растворах разных веществ может сопровождаться как ростом, так и уменьшением объема геля. Следовательно, природа растворенного вещества и его концентрация оказывают влияние на строение полимерной сетки. Данное свойство полимера дает возможность проследить влияние природы растворенных веществ, их катионов и анионов на степень набухания полимерного геля [8].
Один из факторов, влияющих на степень набухания геля ПВС, – количество водородных связей между полимерными цепями, определяющее объем всего ПГ [9]. В отличие от ковалентных связей, количество которых в полимерах постоянно, водородные связи в геле на основе ПВС присутствуют всегда, но их количество различно и изменяется в соответствии с природой растворенного вещества и концентрацией раствора. В связи с этим в работе рассмотрены механизмы взаимодействия полярных групп полимера с водой и ионами растворенных веществ. Исследовано и проанализировано влияние размеров и энергии гидратации катионов первой и второй групп, а также анионов седьмой группы на строение полимерной матрицы и состав ПГ. Проведены количественные оценки объемов и составов гелей при изменении концентрации внешнего раствора.
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ
Типы взаимодействия геля сшитого поливинилового спирта с растворенными веществами. Строение водных растворов
При растворении электролитов происходит гидратация ионов, которая сопровождается изменением теплового движения молекул воды. Ионы, находящиеся в растворе, могут устойчиво взаимодействовать с ближайшими молекулами воды, уменьшая их подвижность. Такое явление называется положительной гидратацией. Она характерна для ионов с малым радиусом и большим зарядом, т.е. имеющих большую плотность заряда. К ним в нашем случае относятся ионы: Mg2+, Ca2+, Ba2+, Na+. С другой стороны, явление, вызывающее разупорядочивание структуры воды, называют отрицательной гидратацией. К ионам с малой плотностью заряда и отрицательной гидратацией относятся K+, Cl–, Br–, I–. Так как в растворе одновременно находятся катионы и анионы и каждый из них влияет на структуру воды, то суммарное их воздействие зависит от того, какой из ионов производит более интенсивное изменение.
Механизм гидратации катионов и анионов неодинаков. Катионы, имеющие незаполненный квантовый уровень, связываются с молекулами воды за счет донорно-акцепторной связи с неподеленной парой атома кислорода. Гидратная оболочка анионов формируется за счет водородных связей. Поэтому катионам свойственна более сильная гидратация, чем анионам.
Адсорбционная способность ионов зависит от их природы, радиуса и величины заряда. Ионы в воде находятся в гидратированном состоянии, окруженными молекулами (диполями) воды – так называемой “гидратной” оболочкой или “гидратной шубой”. Поскольку плотность поверхностного заряда у ионов разная, то и толщина этой оболочки также будет отличаться. Чем больше радиус иона, тем меньше он гидратируется, тем легче поляризуется, тем выше адсорбционная способность. По возрастающей адсорбционной способности ионы одного заряда можно расположить в так называемые лиотропные ряды. Для катионов: Li+ < Na+ < K+ < Rb+ < Cs+; Mg2+ < Ca2+ < < Sr2+ < Ba2+; для анионов: F– < Cl– < Br– < I–. Адсорбционная способность ионов заметно возрастает при увеличении их заряда. Вклад заряда в адсорбционную способность ионов преобладает над влиянием их размера.
Взаимодействие гидрофильного полимера с водой
Особенно важное значение энергий гидратации ионов при рассмотрении вопросов набухания ПГ состоит в преобразующей роли количества координационных связей в образующихся супрамолекулярных соединениях, в частности в полимерных гелях [10]. Существование гидратных оболочек вокруг полярных фрагментов ПГ и взаимодействие с ними гидратных оболочек растворенных веществ обычно приводит к значительным структурным изменениям геля.
Как видно из рис. 1, в сухом ПВС среднее расстояние между главными осями полимерных цепей составляет 0.44 нм, а в паре, в результате сорбции воды, это расстояние увеличивается до 0.75 нм. Соответственно толщина слоя сорбированной воды между цепями составит в среднем 0.31 нм. При помещении полимера в воду (рис. 1а), расстояние между осями соседних полимерных цепей в ПГ увеличивается, в среднем, до 1.08 нм, а между гидратированными полимерными цепями – до 0.33 нм.
Рис. 1.
Расстояния между главными осями полимерных цепей: а – в сухом ПВС; б – в ПВС, набухшем в паре; в – в ПВС, набухшем в воде.

Известно [11], что длина водородной связи между спиртовой ОН-группой и молекулой воды составляет от 0.166 до 0.176 нм. Следовательно, в полимере в местах образования водородных связей между двумя ОН-группами полимерных цепей расстояние между ними не должно превышать 0.17 нм, т.е. водородные связи между соседними полимерными цепями испытывают серьезные напряжения вследствие расклинивающего действия молекул воды.
Варианты взаимодействия полимерного геля с растворенными веществами
Если полимер находится не в воде, а в растворе какого-либо вещества, то напряжения на сшивки между цепями будут либо увеличиваться, либо уменьшаться в зависимости от концентрации раствора, природы ионов растворенного вещества и их энергии гидратации. Заранее можно считать, что при увеличении концентрации раствора уменьшается активность воды и соответственно количество воды, сорбированной ОН-группами полимера, а это уменьшает расстояние между полимерными цепями и полярными группами. Помимо этого, вода, находящаяся в полимерном геле (ПГ), может быть ориентирована и связана растворенным веществом таким образом, что ее влияние на межцепные водородные связи будет меньшим по сравнению с чистой водой. Совокупность таких явлений приведет к образованию новых водородных связей и соответственно к уменьшению объема всего ПГ. Например, известно [12–14], что при одинаковой величине заряда иона, чем больше размер катиона, тем меньше его энергия гидратации, и соответственно тем меньше его собственная гидратная оболочка и влияние на гидратные оболочки полярных групп. В этом случае влияние катиона заключается в том, что с увеличением концентрации раствора уменьшается количество сорбированной полимером воды, а значит, уменьшается расстояние между полимерными цепями, что способствует увеличению количества водородных связей между ними. Возможен и альтернативный вариант. Для катионов с малыми ионными радиусами и большими зарядами характерны большие числа гидратной воды, которая достаточно прочно удерживается такими ионами. Если такой ион проникает между полимерными цепями, то это увеличивает расстояние между ними, что приводит к разрыву ближайших водородных связей и соответственно к увеличению объема всего ПГ.
В случае анионов ситуация иная. В результате уменьшения радиуса аниона увеличение его энергии гидратации приводит к тому, что в его гидратную оболочку попадают ОН-группы соседних полимерных цепей, при этом увеличивается число межцепных водородных связей.
Другой способ влияния растворенного вещества на объем геля ПВС состоит в разрыве межцепных водородных связей вследствие образования новых связей между полярной группой и анионом растворенного вещества. Для этого растворенный анион должен иметь большой ионный радиус и соответственно малое значение энергии гидратации. Такой ион из-за малости гидратной оболочки может близко подойти к полярной группе. В этом случае по причине более близкого расстояния и более удобного расположения связь между протоном ОН-группы и большим анионом будет более прочной, чем между ОН-группами соседних полимерных цепей. Таким образом, ионы растворенных веществ могут, не вступая непосредственно в контакт с полярными группами полимера, влиять на степень его набухания. В табл. 1 приведены данные о размерах ионных радиусов некоторых ионов, их гидратированных радиусов, чисел гидратации и энергии гидратации.
Таблица 1.
Основные характеристики гидратированных ионов первой, второй и седьмой групп (ri – радиус иона, ri(гидр) – радиус гидратированного иона)
| Ион | ri, нм | ri(гидр), нм | nw, моль Н2O/моль иона | Eгидр, кДж/моль |
|---|---|---|---|---|
| Li+ | 0.068 | 0.379 | 5.33 | 502 |
| Na+ | 0.098 | 0.339 | 4.03 | 410 |
| K+ | 0.133 | 0.285 | 2.29 | 329 |
| Rb+ | 0.149 | 0.248 | 1.99 | 314 |
| Cs+ | 0.165 | 0.225 | 1.67 | 264 |
| Mg2+ | 0.074 | 1.23 | 12.2–13.2 | 1887 |
| Ca2+ | 0.104 | 0.845 | 8.45–12.0 | 1569 |
| Sr2+ | 0.120 | 0.802 | 7.05–10.7 | 1474 |
| Ba2+ | 0.138 | 0.602 | 6.0–7.7 | 1339 |
| F– | 0.133 | 0.287 | 2.69 | 473 |
| Cl– | 0.181 | 0.228 | 1.69 | 330 |
| Br– | 0.196 | 0.212 | 1.48 | 296 |
| I– | 0.220 | 0.195 | 1.20 | 264 |
| ОН– | 0.153 | 0.264 | 5.0 | 339 |
Природа полярных групп ПВС такова, что исключает химические взаимодействия между полимером и растворенным НМС. Увеличение или уменьшение объема геля в этом случае связано с образованием или разрывом разного рода координационных связей, в основном – водородных, возникающих между полимерными цепями. Подобные взаимодействия заметно изменяют степень набухания геля ПВС.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Исследование свойств геля ПВС-20
Исследовано влияние фазового состава воды на состав и степень набухания поливинилового спирта, сшитого эпихлоргидрином по методике [15]. Характеристики геля одного моля полярных групп ПВС-20, находящегося в равновесии с насыщенным водяным паром и водой при нормальных условиях приведены ниже:
| М (полимера) = = 65 г, | объем 1 моля ПВС Vr = 51 ± ± 2 мл/моль ROH, | объем ПВС в паре VR = 149 ± ± 5 мл/моль ROH, | Объем геля в воде Vg = 770 ± ± 5 мл/моль ROH |
Отметим, что сшивка не изменяет свойств полярных групп, но позволяет ПГ сохранять форму при изменении степени набухания.
В дальнейшем методом оптической микрометрии (МОМ) [16] было изучено влияние перечисленных выше ионов на степень набухания геля ПВС. Для определения концентрации и количества растворенного низкомолекулярного вещества в ПГ был применен колоночный метод [17]. Его результаты в совокупности с данными, полученными оптическим методом, позволили рассчитать количества и концентрации растворенных веществ в ПГ. Таким образом, изучено влияние природы и концентрации растворенных веществ на набухание и состав геля, сшитого ПВС.
Влияние природы иона на изменение объема геля
Как следует из приведенных выше данных, концентрация полярных групп в геле ПВС-20, набухшем в воде, равна 1.3 моль/л. Эти образцы геля, измеренные в воде, помещали в растворы разных веществ с той же концентрацией, что концентрация ОН-групп в геле. В процессе установления равновесия вода вытеснялась из ВР, а ее место занимал раствор того же состава, что и снаружи. При этом было отмечено, что после установления равновесия объемы геля в растворах разных электролитов изменялись по-разному (табл. 2).
Таблица 2.
Изменение степени набухания геля ПВС в зависимости от природы растворенного вещества в растворах с активностью воды аw = 0.95
| Катион | Анион Cl– |
|---|---|
| Li+ | 0.97 |
| Na+ | 0.85 |
| K+ | 0.81 |
| Rb+ | 0.82 |
| Cs+ | 0.83 |
| Mg2+ | 1.07 |
| Ca2+ | 0.97 |
| Sr2+ | 0.95 |
| Ba2+ | 0.92 |
Как видно из табл. 2, в большинстве случаев объем ПГ уменьшался, но иногда он был больше, чем в воде. При этом наблюдалась общая тенденция влияния ионных радиусов на степень набухания ПГ. Однозначно прослеживался факт большего, по сравнению с катионами, влияния анионов на степень набухания ПГ. Как видно из табл. 2, увеличение ионного радиуса анионов всегда ведет к увеличению объемов геля. В растворах иодидов этот объем превышает объем геля в воде.
В растворах хлоридов катионов первой группы степень набухания заметно уменьшается от лития к калию, а затем изменяется в пределах погрешности (рис. 2).
Для катионов второй группы ситуация похожая, но видно, что в растворе хлорида магния относительный объем геля >1.0. Таким образом, установлено, что увеличение степени набухания ПГ происходит при увеличении ионного радиуса аниона и (или) при уменьшении ионного радиуса катиона.
Влияние концентрации на степень набухания геля ПВС-20
Если влияние размеров гидратированных катионов первой группы, их влияние на степень набухания ПГ и уменьшение объема геля с ростом концентрации раствора вполне предсказуемо, то влияние катионов второй группы носит более сложный характер. Как показано на рис. 3, в растворах хлоридов значительный размер гидратированного радиуса иона магния (см. табл. 1), приводит к разрыву части водородных связей в ПГ. Это количество увеличивает объем геля, который тем больше, чем больше концентрация раствора.
Рис. 3.
Влияние природы растворенного вещества и активности воды на относительный объем геля ПВС-20 в растворах MgCl2 (1), CaCl2 (2), SrCl2 (3), ВаСl2 (4).
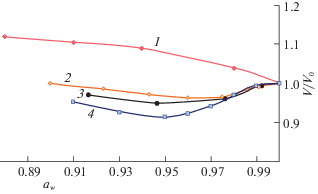
Степень гидратации остальных катионов этого ряда не так велика. В области малых концентраций их рост сопровождается только уменьшением активности воды в растворе и соответственно уменьшением количества сорбированной воды в ПР и приводит к незначительному уменьшению объема всего ПГ. После достижения определенного значения активности воды как величина заряда, так и размер каждого иона начинают оказывать основное влияние на степень набухания ПГ. В результате степень набухания геля начинает увеличиваться и тем медленнее, чем больше ионный радиус катиона.
Значительно большее влияние на степень набухания ПГ оказывали анионы седьмой группы. Влияние их размеров и соответственно степени гидратации на объем ПГ показано на рис. 4. Ярко выраженное влияние фторид-иона как компонента, сшивающего полимерные цепи, на увеличение равновесного объема при переходе от брома к хлору и разрушающее сшивки действие иодида натрия, приводящее к заметному увеличению степени набухания ПГ, убедительно подтверждают причину изменения объема ПГ при изменении состава внешнего раствора.
Рис. 4.
Влияние природы и концентрации растворенного вещества на относительный объем геля ПВС-20 в растворах NaF (1), NaCl (2), NaBr (3), NaI (4).

Еще более эффектно происходит изменение степени набухания ПГ в растворах галогенидов с катионом второй группы. На рис. 5 приведены результаты, иллюстрирующие изменение степени набухания геля ПВС-20 в растворах хлорида, бромида и иодида кальция. На фоне описанного выше влияния анионов влияние двухзарядного катиона приводит к значительному увеличению степени набухания по сравнению с однозарядными катионами. Как было установлено в экспериментах, объединенный двухзарядным ионом ансамбль из гидратированных ионов разного заряда, занимая значительный объем, способен разрывать соединяющие полимерные цепи водородные связи в таком количестве, что объемные полимерные сетки превращаются в отдельные цепи. Подобный результат был получен при работе с растворами иодида кальция.
Возможное влияние взаимного расположения ионов в растворах на степень набухания геля ПВС
Учитывая влияние энергии гидратации растворенных веществ на степень набухания ПГ, следует помнить, что в ПГ проникают не отдельные ионы, а ионные пары или молекулы разной степени диссоциации. Это требует учета влияния обоих ионов растворенного вещества на строение сетки полимерного геля. Как известно, кристаллические решетки минералов стремятся к максимально полному заполнению своего пространства соответствующими атомами для их межатомного взаимодействия [19]. Чем больше различие в радиусах катионов и анионов, тем меньшее количество (число) крупных анионов способно соединиться с малыми (мелкими) катионами. С увеличением отношения радиуса катиона к радиусу аниона (Rkat/Rаn), катион будет последовательно проходить вначале через взаимодействие его с двумя анионами, образуя гантель при Rkat/Rаn < 0.155. Затем при росте этого отношения до 0.155–0.225 катион способен взаимодействовать с тремя анионами. В результате получается треугольник. В том случае, когда отношение Rkat/Rаn находится в диапазоне 0.225–0.415, катион окружен четырьмя анионами. В этом варианте образуется тетраэдр. При дальнейшем росте этого отношения в пределах 0.415–0.732 катион будет окружен уже шестью анионами и даст октаэдр. (Природа избегает пентаграмм, т.е. пятиконечных построений, как на плоскости, так и в объеме.) В диапазоне Rkat/Rаn = 0.732–1.0 катион взаимодействует сразу с восемью анионами и образует координационный многогранник в виде куба. И, наконец, при близости отношения Rkat/Rаn к 1.0 образуется додекаэдр. В этом последнем случае катион связывает (ориентирует вокруг себя) сразу двенадцать анионов.
Следовательно, чем меньше размеры катионов относительно анионов, тем меньшее количество анионов может удержать катион. Очевидно, что взаимное влияние ионов на их расположение в растворах не так сильно, как в кристаллах, но не менее очевидно, что, во-первых, физические свойства ионов в обоих случаях одинаковы и, во-вторых, распределение ионов противоположного заряда в растворах, так же, как и в кристаллах, всегда равномерно. Если допустить, что в растворах возможно взаимное расположение ионов, аналогичное их расположению в кристаллах, то, проводя эксперименты, можно проследить связь между взаимным расположением ионов в растворах и изменением степени набухания ПГ при изменении концентрации раствора. Отношение ионных радиусов (Rkat/Ran) и получаемые в результате структуры приведены в табл. 3.
Таблица 3.
Отношение ионных радиусов (Rkat/Ran), число анионов, ориентированных катионом, (n) и получаемые в результате структуры
| NaF 0.737 8 куб |
||||||
| LiCl ∼0.400 4 тетраэдр |
NaCl 0.541 6 октаэдр |
KCl 0.735 8 куб |
MgCl2 0.204 3 треугольник |
CaCl2 0.287 4 тетраэдр |
SrCl2 0.331 4 тетраэдр |
BaCl2 0.381 4 тетраэдр |
| NaBr 0.500 6 октаэдр |
MgBr2 0.189 3 треугольник |
CaBr2 0.265 4 тетраэдр |
||||
| NaI 0.445 6 октаэдр |
MgI2 0.168 3 треугольник |
CaI2 0.236 4 тетраэдр |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Представленные результаты показывают наличие различных типов взаимодействий между полимером, водой и растворенными НМС, оказывающих влияние на степень набухания ПГ. Исследовано влияние заряда, размера и степени гидратации ионов на причину и степень набухания геля сшитого поливинилового спирта. Из полученных результатов следует, что увеличение ионных радиусов катионов первой группы и соответственно уменьшение их гидратированных радиусов (рис. 2), сопровождается симбатным уменьшением объема ПГ. Кроме того, в условиях как равных концентраций, так и равных активностей воды увеличение заряда катиона увеличивает степень набухания ПГ по сравнению с аналогичным ионом меньшего заряда (Li+–Mg2+, Na+–Ca2+, K+–Sr2+).
Радиусы катионов приблизительно в 2 раза меньше радиусов анионов. Кроме того, если попарно сравнивать размеры катионов первой и второй групп, то видно, что различие между ними невелико. При этом формы равновесных концентрационных зависимостей степени набухания от величины заряда различаются весьма заметно. Проявляется влияние величины заряда и, как следствие, различного количества окружающих катион анионов.
Характерная особенность свойств растворов, содержащих катионы второй группы (кроме магния), – экстремальное изменение объема ПГ при увеличении концентрации раствора. Глубина экстремума увеличивается с ростом радиуса, т.е. порядкового номера катиона. При этом, как показано в [19], увеличение радиуса катиона не изменяет количества окружающих его анионов, т.е. квазикристаллическое расположение ионов в растворе остается неизменным. Тенденция к уменьшению степени набухания ПГ при увеличении концентрации раствора для катионов второй группы (кроме магния) сравнима с тенденцией для катионов первой группы, но в случае катионов второй группы из-за значительно большей степени гидратации появляется новый фактор, влияющий на количество межцепных сшивок. В результате свойство образовывать сшивки проявляется (и то слабо) только в растворах малых концентраций, а при увеличении концентрации начинает работать расклинивающее действие ансамблей из нескольких гидратированных ионов. Анализ данных, приведенных в табл. 3 показывает, что увеличение количества анионов в окружении катиона уменьшает степень набухания ПГ. Из этого следует, что чем больше анион, тем больше степень набухания геля ПВС, а значит, в результате увеличения радиуса аниона происходит увеличение объема ПГ.
Список литературы
Роговина Л.З., Васильев В.Г., Браудо Е.Е. // Высокомолек. соединения. 2008. Т. 50. № 7. С. 1397.
Гнусин Н.П., Гребенюк В.Д. Электрохимия гранулированных ионитов. Киев: Наукова думка, 1972. 180 с.
Архангельский Л.К. В кн.: Иониты в химической технологии / Под ред. Б.П. Никольского, П.Г. Романкова. Л.: Химия, 1982. 416 с.
Ферапонтов Н.Б., Горшков В.И., Тробов Х.Т., Парбузина Л.Р. // Журн. физ. химии. 1994. Т. 68. № 6. С. 1109.
Ferapontov N.B., Gorshkov V.I., Parbuzina L.R., Trobov H.T., Strusovskaya N.L. // Reactive & Functional Polymers. 1999. V. 41. P. 213.
Ушаков С.Н. Поливиниловый спирт и его производные // М.-Л.: Изд-во АН СССР, 1960. Т. 1. 552 с.
Ковалева С.С., Рубин Ф.Ф., Ферапонтов Н.Б. // Сорбционные и хроматографические процессы. Воронеж, 2006. Т. 6. № 2. С. 198.
Ферапонтов Н.Б., Ковалева С.С., Рубин Ф.Ф. // Журн. аналит. химии. 2007. Т. 62. № 10. С. 1028.
Билобров В.М. Водородная связь. Внутримолекулярные взаимодействия. Киев: Наук. думка, 1991. 320 с.
Зоркий П.М., Лубнина И.Е. // Вестн. Моск. ун-та. Сер. 2. Химия, 1999. Т. 40. № 5. С. 300.
Терентьев В.А. Термодинамика водородной связи. Саратов: Изд. Саратовск. ун-та, 1973. 246 с.
Танганов Б.Б. // Успехи современного естествознания. 2009. № 12. С. 25.
Балданов М.М., Балданова Д.М., Жигжитова С.Б. и др. // Изв. вузов. Физика. 2006. Т. 49. № 3. С. 59.
Балданова Д.М., Танганов Б.Б. Плазменно-гидродинамическая концепция состояния ионов в растворах электролитов в оценке некоторых свойств. М.: Академия естествознания, 2012. ISBN: 978-5-91327-170-9.
Ямсков И.А., Буданов М.В., Даванков В.А. // Биоорганическая химия. 1979. Т. 5. № 11. С. 1728.
Ферапонтов Н.Б., Ковалева С.С., Рубин Ф.Ф. // Журн. аналит. химии. 2007. Т. 62. № 10. С. 1028.
Ферапонтов Н.Б., Горшков В.И., Тробов Х.Т. и др. // Журн. физ. химии. 1994. Т. 68. № 6. С. 1109.
Медведев П.И. Физическая и коллоидная химия (краткий курс). М.: ГИСХЛ, 1954. 269 с.
Сауков А.А. Геохимия. М.: Наука, 1975. 480 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии




