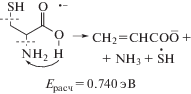Журнал физической химии, 2020, T. 94, № 1, стр. 89-97
Резонансный захват электронов молекулами цистеина и N-ацетилцистеина
М. В. Муфтахов a, *, П. В. Щукин a
a оссийская академия наук, Уфимский федеральный исследовательский центр,
Институт физики молекул и кристаллов
450075 Уфа, Россия
* E-mail: LMSNI@anrb.ru
Поступила в редакцию 18.02.2019
После доработки 18.02.2019
Принята к публикации 12.03.2019
Аннотация
Исследованы процессы образования отрицательных ионов при резонансном присоединении электронов молекулами цистеина и его N-замещенного производного. Идентифицированы структуры ионов в области энергий <4 эВ. Установлено, что в ацетилцистеине дополнительные каналы фрагментации молекулярных ионов связаны с отрывом или деструкцией заместителя. Предположено, что некоторые процессы могут быть ассоциированы с антиоксидантными, антитоксическими, радиопротекторными и муколитическими свойствами соединений.
Цистеин – заменимая серосодержащая аминокислота, образующаяся в организме человека из метионина. Он обладает свойствами, характерными для всех аминокислот, но присутствие тиоловый группы (–SH) в составе бокового заместителя предопределяет особые функции. Основные функции цистеина [1–4]: обмен серы в организме, синтез цистина и таурина, производство желчи, активизация лейкоцитов и лимфоцитов, сжигание жиров, обезвреживание токсических веществ, противовирусное, противоопухолевое, противовоспалительное, антиоксидантное и муколитическое действие.
N-ацетилцистеин (АЦЦ) – производное цистеина и имеет похожие функции, а некоторые отличия в свойствах могут быть обусловлены ацетатной группой. Существует ряд лекарственных средств, интерес к которым со временем не только не ослабевает, но и усиливается, открываются новые области и возможности их применения. К числу препаратов, потенциал которых до сих пор не исчерпан, относится и АЦЦ. В мировой литературе опубликованы результаты сотен работ в разных областях медицины, посвященных новым направлениям применения ацетилцистеина или расширению уже существующих показаний [5–8]. В настоящее время этот препарат в основном используется в качестве муколитического средства [9].
В работе [10] была сформулирована идея о связи электроно-акцепторных свойств молекул и их биологической активности. Использование спектральных методов исследования вещества для решения биохимических задач основывается на этой идее. Мы полагаем, что некоторые аналогии и различия в свойствах цистеина и АЦЦ обусловлены процессами в живых тканях с участием отрицательных ионов (ОИ) этих соединений, и, следовательно, могут проявиться в их масс-спектрах. С целью выяснения этого вопроса был проведен сравнительный анализ спектров резонансного присоединения электронов молекулами цистеина и его производного:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Эксперимент выполнен на модифицированном для работы с ОИ магнитном масс-спектрометре МИ-1201В (Украина, г. Сумы), подробно описанном в работе [11]. Вкратце, электроны, эмиттируемые катодом, проходят через камеру ионизации, где взаимодействуют с парами исследуемых образцов, что приводит к образованию ОИ. Последние извлекаются из камеры, формируются в пучок, ускоряются, масс-анализируются, регистрируются вторично-электронным умножителем. Управление энергией электронного пучка осуществляется компьютером, в который синхронно заносится регистрируемый ионный сигнал. Для калибровки шкалы электронной энергии мы использовали SF$_{6}^{ - }$/SF6 (∼0 эВ) и [M–H]–/CH3COOH (∼1.55 эВ, [12]). Энергии появления ионов (см. табл. 1) определялись по началу кривой эффективного выхода SF$_{6}^{ - }$/SF6 (∼0 эВ). Методика определения сечения образования фрагментных ОИ описана в [13].
Таблица 1.
Измеренные энергии появления ионов (Еэксп) и максимумы резонансных пиков (Emax) на кривых эффективного выхода некоторых ионов из АЦЦ
| m/z | Eэксп, эВ | Emax, эВ |
|---|---|---|
| 162 | 0.83 | 0.90 |
| 161 | 0.5 | 0.86 |
| 130 | – | 0.86 |
| 120 | 0.74 | 1.18 |
| 119 | 0.67 | 0.76 |
| 104 | 1.08 | 1.25 |
| 71 | 1.19 | 1.53 |
| 33 | 1.13 | 1.24 |
| 32 | 1.27 | 1.51 |
Цистеин (L-сysteine, 99%) и ацетилцистеин (N-аcetyl-L-cysteine, 99%) приобретены в Sigma/Aldrich Chemical Co. и исследовались без дальнейшей очистки. Напуск цистеина осуществлялся непосредственно из камеры ионизации, куда образец помещался во время сборки ионного источника перед проведением экспериментов. Такой метод позволяет повысить интенсивность регистрируемого ионного тока за счет достижения более высокой плотности паров исследуемого соединения. С целью выявления в масс-спектрах пиков от возможных посторонних объектов и процессов (фон, примеси, термодеструкция образца и пр.) эксперименты проводились при двух температурах: 54 и 90°С. Соотношение интенсивностей пиков ионов при этом составило 1 : 23. Образец АЦЦ также исследовался при двух температурах. При 52°С напуск осуществлялся внутри камеры ионизации, а при 102°С применялась система прямого ввода, подогреваемая до температуры оптимальной сублимации вещества (64°С), в обоих случаях напуск образца был примерно равным. Во время проведения экспериментов при низких температурах, камера ионизации прогревалась только за счет накала катода, тогда как для достижения высоких температур ее нагрев осуществлялся с помощью печки.
МЕТОДИКА РАСЧЕТОВ
Энергетический порог диссоциативных реакций (Eрасч) вычислялся на основе энтальпий образования нейтральных частиц и ионов (см. табл. 2), рассчитанных с использованием широко известного метода функционала плотности B3LYP (базисные наборы 6-311+G(d,p) и 6-311+G(3df,2p)) и откорректированных нейронным методом X1 [14].
Таблица 2.
Вычисленные и взятые из NIST* значения энтальпий образования ионов и нейтральных частиц (ΔfH°,эВ)
| A | ΔfH°, A |
|---|---|
| Молекула цистеина | –4.072 |
| Молекула АЦЦ | –6.375 |
| NH2CH(CH2SH)COO– | –5.468 |
| NH2CH(COOН)CH2S– | –4.826 |
| CH3CONHCH(CH2SH)COO– | –7.962 |
| CH3CONHCH(COOН)CH2S– | –7.259 |
| CH3CONHCH(CH2)COOH$^{ \bullet }$ | –4.349 |
| CH3CONHCH(CH3)COOH | –6.565 |
| CH3CONHCH(CH3)COO– | –8.009 |
| SHCH2CH(NH)COO$^{{ \bullet --}}$ | –3.513 |
| НOOСCH(NH)CH2S$^{{ \bullet --}}$ | –3.096 |
| НOOСCHCH2S$^{{ \bullet --}}$ | –4.254 |
| CH2=CHCOO– | –4.299 |
| CH3CONH2 | –2.470* |
| CH3CHO | –1.769* |
| CH3CO$^{ \bullet }$ | –0.126* |
| NH3 | –0.477* |
| NH$_{2}^{ \bullet }$ | 1.917* |
| H2S | –0.218* |
| HS$^{ \bullet }$ | 1.444* |
| HS– | –0.871* |
| ${{{\text{S}}}^{{ \bullet - }}}$ | 0.794* |
| H$^{ \bullet }$ | 2.260* |
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Резонансный захват электронов молекулами цистеина исследован в работах [15, 16], в полученных масс-спектрах зарегистрировано около десятка отрицательных ионов. Зарегистрированные нами кривые эффективного выхода отрицательных ионов цистеина и ацетилцистеина как функции энергии захватываемых электронов представлены на рис. 1 и 2 соответственно. По сравнению с алифатическими аминокислотами отличительной чертой процессов ионообразования в цистеине является формирование ряда ионов в области тепловых и надтепловых энергий (например, ${{{\text{S}}}^{{ \bullet - }}}$ и НS‒), что авторы работы [15] связали с изотермическим характером протекающих диссоцативных реакций. Однако факт образования интенсивных ионов m/z = 71 (СН2=СНСОО–) в этой области энергий (ниже энергетического порога реакции) не нашел исчерпывающего объяснения. Аналогичная проблема с низкоэнергетическими ОИ возникла при исследовании АЦЦ, поэтому для ее решения эксперименты с этими объектами проводились при двух температурах.
Рис. 1.
Зависимости эффективного выхода ОИ из цистеина от электронной энергии при условиях: Т = 54°С, ΔE1/2 ∼ ~ 0.5 эВ (а), Т = 90°С, ΔE1/2 ∼ 0.55 эВ (б). На панелях справа указано массовое число (m/z) ионов, на панели со значком “∑” приведен суммарный ток ионов. Максимумы резонансных пиков, отмеченных символом (↓), демонстрируют неадекватную температурную зависимость, что может указывать на их происхождение в результате сторонних процессов (пояснения в тексте).

Рис. 2.
Зависимости эффективного выхода ОИ из ацетилцистеина от электронной энергии при условиях: Т = 52°С, ΔE1/2 ∼ 0.54 эВ (а), Т = 102°С, ΔE1/2 ∼ 0.6 эВ (б). Остальные обозначения см. рис. 1.

В масс-спектрах обоих исследованных соединений максимальными по интенсивности являются пики ионов [M–H]–, которые генерируются в энергетическом диапазоне 0–4 эВ. Образование этих ионов обусловлено элиминированием Н‑атомов из тиоловой и карбоксильной функциональных групп [17] (см. реакции (1)–(4)). Сечения их образования в максимумах резонансов отличаются незначительно: в цистеине 2 × 10–18 см2 (1.34 эВ), в АЦЦ 4 × 10–18 см2 (0.9 эВ). Для удобства в обоих соединениях интенсивность фрагментных отрицательных ионов была нормирована к интенсивности соответствующих ионов [M‒H]–.
(1)
$\begin{gathered} {\text{Цистеин}} + {{{\text{е}}}^{--}} \to {\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{CH(C}}{{{\text{H}}}_{{\text{2}}}}{\text{SH)CO}}{{{\text{O}}}^{--}} + {{{\text{H}}}^{ \bullet }} \\ {{E}_{{{\text{расч}}}}} = 0.864\;{\text{эВ}}, \\ \end{gathered} $(2)
$\begin{gathered} {\text{Цистеин}} + {{{\text{е}}}^{--}} \to {\text{N}}{{{\text{H}}}_{{\text{2}}}}{\text{CH(COOН)C}}{{{\text{H}}}_{{\text{2}}}}{{{\text{S}}}^{--}} + {{{\text{H}}}^{ \bullet }} \\ {{E}_{{{\text{расч}}}}} = 1.506\;{\text{эВ}}, \\ \end{gathered} $(3)
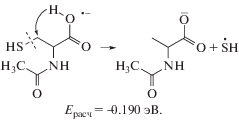
$\begin{gathered} {\text{АЦЦ}}\, + \,{{{\text{е}}}^{--}}\, \to \,{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CONHCH}}({\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{SH}}){\text{CO}}{{{\text{O}}}^{--}}\, + \,{{{\text{H}}}^{ \bullet }} \\ {{E}_{{{\text{расч}}}}} = 0.673\;{\text{эВ}}, \\ \end{gathered} $(4)
$\begin{gathered} {\text{АЦЦ}}\, + \,{{{\text{е}}}^{--}}\, \to \,{\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CONHCH(COOН)C}}{{{\text{H}}}_{{\text{2}}}}{{{\text{S}}}^{--}}\, + \,{{{\text{H}}}^{ \bullet }} \\ {{E}_{{{\text{расч}}}}} = 1.376\;{\text{эВ}}. \\ \end{gathered} $В цистеине при 54°С интенсивность ОИ была незначительной (например, ток ионов m/z = 102 составлял ∼1.5 × 10–18 А), и нам не удалось зарегистрировать ионы m/z = 86, 44 и 27. Из рис. 1 следует, что с ростом температуры относительные интенсивности почти всех ионов в области низких энергий уменьшаются. Это может быть следствием наличия легко летучих примесей в образце и присутствием фоновых пиков. Например, после чистки источника ионов и длительного прогрева вакуумной системы прибора мы регистрировали при низких энергиях малоинтенсивные фоновые пики ионов (m/z): 26, 32, 33, 42 и др. в отсутствие образца. Только для ионов m/z = 71 наблюдается увеличение интенсивности при повышении температуры. Пороговая энергия образования ионов с m/z = 71 составляет 0.74 эВ, реакция:
и максимум кривой эффективного выхода должен наблюдаться при энергии свыше 0.9 эВ. В эксперименте он зарегистрирован при 0.4 эВ и уменьшается до 0.34 эВ с повышением температуры. Процессы, происходящие ниже энергетического порога, обычно интерпретируют в рамках эффекта “горячей полосы”, который отражает больцмановское распределение населенности возбужденных колебательных уровней молекул. Другой причиной занижения экспериментальных энергий появления осколочных ионов может быть их образование при взаимодействии электронов с продуктами термодеструкции образца на катоде [18]. Вероятно, возникновение ионов с m/z = 71 в районе энергии 0.4 эВ обусловлено одной из перечисленных причин, и, возможно, наличием примесей в образце. Относительная интенсивность ионов в районе 0.9 эВ составляет менее 5%. Максимумы резонансных пиков демонстрирующих неадекватную температурную зависимость, на рис. 1 при 90°С отмечены стрелками. В АЦЦ при низкой температуре мы не регистрировали малоинтенсивные ионы m/z = 44 , а также не представляющие интереса для области малых энергий ионы с m/z = 41, 27 и 17. Анализ данных, полученных при двух температурах, также привел к заключению о неадекватном поведении многих низкоэнергетических резонансных пиков, максимумы которых как и для цистеина помечены стрелками (рис. 2).Поскольку результаты исследования ОИ из цистеина обсуждались в [15], нет смысла подробно анализировать данные, полученные в настоящей работе для этого объекта. Отметим лишь, что относительные интенсивности пиков ионов НS– (m/z = 33) и ${{{\text{S}}}^{{ \bullet - }}}$ (m/z = 32) в масс-спектре составляют 2–3%, а таковые для остальных ионов не превышают 1%. В масс-спектре АЦЦ относительные интенсивности пиков ионов НS– и ${{{\text{S}}}^{{ \bullet - }}}$ немного больше, чем в масс-спектре цистеина. В области низких энергий эти ионы образуются в реакциях:
а в области энергии свыше 5 эВ они могут образоваться в трехчастичных и последовательных распадах молекулярных ионов.В АЦЦ кроме упомянутых выше ионов обнаружены ионы [M–СH3СНО]$^{{ \bullet - }}$ (m/z = 119), [M–СH3СОNH2]$^{{ \bullet - }}$ (m/z = 104) и [M–СH3СОNH2–SH]– (m/z = 71) с относительной интенсивностью пиков в масс-спектре более 1% в области низких энергий. Ионы m/z = 119 образуются в результате Н-сдвига в реакции:
Пороговая энергия процесса составляет 1.093 эВ, и максимум кривой выхода ионов должен наблюдаться при энергии свыше 1.2 эВ. В эксперименте он зарегистрирован при 0.76 эВ и уменьшается до ∼0.6 эВ с повышением температуры. Относительная интенсивность ионов в районе 1.2 эВ составляет <1%. По аналогичному перегруппировочному механизму протекает реакция с образованием ионов [M–СH3СО]– (m/z = 120):Эти процессы обусловлены присутствием в молекуле N-ацетатной группы, которая вместе с атомом азота представляет модель пептидной группировки. Вероятно, при захвате электрона в молекулярном ионе возникает водородная связь между Н-атомом карбоксилатсодержащей группы и пептидной группой. Поэтому при разрыве О–Н-связи возможен не только выброс атома водорода, но и его миграция к атомам азота и углерода. Похожие реакции в ди- и трипептидах обсуждались в [19, 20]. Ионы m/z = 104 также образуются в процессе Н-сдвига, но к пептидной группе мигрирует Н-атом тиоловой группы:
Согласно расчетам, ион структуры HS–CH2–CH–COO$^{{ \bullet - }}$ нестабилен и распадается на фрагменты CH2=CHCOO– + H${{{\text{S}}}^{{ \bullet - }}}$. Поэтому при миграции Н-атома карбоксилатсодержащей группы к атому азота происходит трехчастичный процесс образования ионов с m/z = 71: Этот процесс дает максимальный выход НS-радикалов при деградации молекулярных ионов АЦЦ; другие процессы, сопровождающиеся выходом НS$^{ \bullet }$, протекают с малой интенсивностью, например, реакция для ионов m/z = 130:Согласно рис. 1, 2, основное сходство масс-спектров цистеина и ацетилцистеина определяется ионами [M–H]–, НS– и ${{{\text{S}}}^{{ \bullet - }}}$, а связанные с ними процессы, возможно, коррелируют с антиоксидантной и антитоксической активностью соединений, обусловленных способностью нейтрализовать свободные радикалы в живых тканях. Отличительная особенность масс-спектра АЦЦ заключается в образовании ряда ионов посредством выброса ацетатной или ацетамидной групп, что, возможно определяет повышенную муколитическую активность молекулы.
В процессе образования интенсивного иона [M–H]– из цистеина и АЦЦ в паре с ним выделяется атомарный водород – очень реакционный радикал. Эта особенность всех аминокислот обсуждалась ранее в работе [21] в контексте с их способностью усиливать защиту организма от действия радиационного облучения. При действии радиации в живых тканях образуются ионы и радикалы, обладающие значительной окислительно-восстановительной активностью. В цепи химических реакций с их участием повреждаются важные для организма молекулы (белки, нуклеиновые кислоты и т.д.) и образуются биологически вредные продукты реакций. При воздействии радиации кроме радикалов и ионов образуются также свободные электроны, в том числе, термализованные. При захвате таких электронов выделяются ионы [M–H]– и Н-атомы, и последние при взаимодействии со свободными радикалами нейтрализуют их. Возможно, что таким образом осуществляется защита живых организмов от последствий воздействия на них космического излучения [21], значительно ослабленного атмосферой, а степень защиты зависит от сечения образования ионов [M–H]–, которые в ряду аминокислот мало отличаются. В цистеине и АЦЦ выделение этих ионов происходит в двух независимых процессах при разных энергиях, и поэтому суммарное сечение для ионов должно быть больше, чем в других аминокислотах.
Процесс образования обсуждаемых ионов может быть рассмотрен также в контексте с антиоксидантной активностью цистеина и АЦЦ. При определенных условиях от цистеина отделяется водород, молекулы цистеина соединяются через атомы серы, и образуется новая аминокислота – цистин. Выделившийся водород нейтрализует окислительные радикалы, превращая их в воду в цепи последовательных реакций [22, 23]. Поэтому образование ионов [M–H]– при выбросе Н-атома тиоловой группы в масс-спектрометрическом эксперименте с цистеином и АЦЦ может быть ассоциировано с антиоксидантной активностью этих соединений в живых клетках при условии наличия свободных электронов, например, вблизи электронно-транспортной цепи митохондрий [24]. Малоинтенсивный процесс образования ионов [M–H2]$^{{ \bullet - }}$ (m/z = 119 в цистеине и m/z = 161 в АЦЦ) также может вносить вклад в нейтрализацию оксидантов [25]. Распады молекулярных ионов в ионы НS– и ${{{\text{S}}}^{{ \bullet - }}}$, а также в ионы СН2=СНСОО– (m/z = 71) с выбросом НS-радикала могут быть инициаторами последовательных реакций связывания молекулярного и радикального кислорода или гидроксильных радикалов в оксиды серы и пр. с превращением их в неопасные для организма продукты.
Согласно классификации муколитических препаратов по их влиянию на бронхиальную секрецию, различают лекарства прямого и непрямого действия [26]. Прямое действие оказывают препараты, разрушающие полимеры мокроты. Ферментные лекарственные средства разрывают пептидные связи в молекулах нуклеиновых кислот и белка и расщепляют высокомолекулярные продукты их распада. Неферментные тиоловые муколитики (цистеин, ацетилцистеин, месна) разрушают дисульфидные связи кислых мукополисахаридов бронхиальной слизи. В результате происходит деполимеризация мукопротеидов, и бронхиальная слизь становится менее вязкой и адгезивной. Механизм действия серосодержащих препаратов на молекулярном уровне до конца не изучен. Вероятно, он связан с переносом протонов от тиоловой группы молекул лекарства на дисульфидную связь в белке, и соединением депротонированных молекул через атомы серы с образованием дисульфидной связи; на каком-то этапе этот процесс сопровождается электронным переносом.
В масс-спектрометрическом эксперименте исследуются ОИ, образовавшиеся захватом свободных электронов молекулами, и для полной аналогии с процессами, протекающими в живых тканях, в последних также необходимо наличие свободных электронов. По-видимому, в бронхиальной секреции таковые отсутствуют, поскольку в противном случае дисульфидные связи в мукопротеидах могли бы быть разрушены в электронно-молекулярных реакциях без участия лекарств. Это следует из результатов недавнего исследования ОИ из диметилцистина – дисульфидная связь в молекуле диссоциирует при воздействии электронов тепловых и надтепловых энергий [17]. Аналогичные результаты были получены ранее при изучении диметилдисульфида CH3SSCH3 [27].
Межмолекулярный перенос протона условно можно разделить на два элементарных акта – полярную диссоциацию первой молекулы на ионы [M–H]– и Н+ и захват выделившегося протона второй молекулой. Первый акт имеет некоторое сходство с процессом фрагментации молекулярного отрицательного иона на ион [M–H]– и Н-атом при диссоциативном захвате электрона молекулой. Основное отличие заключается в наличии или отсутствии заряда выбрасываемого водорода и в энергетике процессов – полярная диссоциация требует дополнительной энергии на ионизацию атома водорода. При диссоциативном захвате электронов тиоловая группа легко выбрасывает Н-атом, о чем свидетельствуют интенсивные ионы [M–H]– в масс-спектрах исследованных соединений. Пороговая энергия этого процесса в АЦЦ на 0.13 эВ меньше, чем в цистеине, и эта различие сохраняется в случае полярной диссоциации молекул. Следовательно, константа скорости реакции выделения протона в молекуле АЦЦ (и соответственно константа скорости реакции переноса протона) должна быть больше, чем в молекуле цистеина.
В отличие от газовой фазы в растворах аминокислот существуют так называемые цвиттер-ионы, образующиеся внутримолекулярным переносом протона от карбоксилат-содержащей группы к аминогруппе. Известно также, что такие объекты подвержены дезаминированию, при котором в составе выбрасываемого иона NH$_{4}^{ + }$ присутствует Н-атом Сβ-углерода [1]. При воздействии цистеина и АЦЦ на бронхиальную секрецию ионы NH$_{4}^{ + }$ (СН3СОNH$_{3}^{ + }$) могут быть источниками протонов, разрушающими дисульфидные связи в мукопротеидах. Аналог образования цвиттер-ионов – миграция Н-атома СООН-группы в молекулярном отрицательном ионе к атому азота (к пептидной группе), в результате чего происходят реакция (5) в цистеине и реакции (8), (9), (11) в АЦЦ. Но такие реакции Н-сдвига в масс-спектрометрическом эксперименте происходят в ОИ и других аминокислот и их производных, не обладающих муколитическим действием. Вероятно, цвиттер-ионы могут образовываться также при внутримолекулярном переносе протона от тиоловой группы к аминогруппе в цистеине и к пептидной группе в АЦЦ с последующим процессом полярной диссоциации молекул на ионы NH$_{4}^{ + }$ (СН3СОNH$_{3}^{ + }$) и –SСН=СНСООН. Положительный момент предполагаемого процесса заключается в возможности потери электрона отрицательными ионами в результате электронного переноса и объединения SСН=СНСООН-радикалов через атомы серы в молекулы с дисульфидной связью. Аналогом процесса полярной диссоциации является миграция Н-атома HS-группы в молекулярном отрицательном ионе к атому азота, в результате чего происходит реакция (10) в АЦЦ.
ЗАКЛЮЧЕНИЕ
В методе масс-спектрометрии резонансного захвата электронов регистрируются отрицательные ионы в определенных энергетических областях, что дает информацию об интенсивности фрагментации молекулярных ионов по различным каналам и о структурах продуктов реакций. Этот метод не позволяет получать информацию о реакциях межмолекулярного переноса протона или электрона, а также ионно-молекулярных или радикальных реакциях. Перечисленные процессы с участием радикалов и положительных ионов играют основную роль при воздействии цистеина и АЦЦ на организм, чем и обусловлены их свойства, а отрицательные ионы представляют побочные или промежуточные продукты этих процессов. Кроме того, действие препаратов на молекулярном уровне может быть прямым, косвенным или комбинированным. Например, ацетилцистеин защищает клетки организма от влияния свободных радикалов как путем прямой реакции с ними, так и поставляя цистеин для синтеза глутатиона; ряд исследователей считают, что именно второй механизм действия препарата наиболее важен [28].
На основании данных масс-спектрометрического эксперимента можно предложить другой пример комбинированного действия АЦЦ. В качестве незаряженных продуктов реакций (8)–(11) выделяются молекулы ацетамида и ацетальдегида. Если похожие реакции происходят в организме, то они могут оказывать токсическое действие, в том числе, на болезнетворные бактерии. Возможно, что таким образом ацетилцистеин уменьшает способность микроорганизмов колонизироваться на поверхности слизистой дыхательных путей, проявляя спарринг-эффект с антибиотиками, вследствие чего АЦЦ представляется более эффективным муколитическим препаратом, чем цистеин. Таким образом, исследуемые масс-спектрометрическим методом процессы образования и распада молекулярных отрицательных ионов в некоторых случаях представляют аналогии процессов, происходящих в живых организмах с участием анионов. Эти аналогии могут проявляться на отдельных этапах в цепи реакций, и дают ключ к пониманию механизмов протекания таких реакций.
Работа выполнена при частичной поддержке Российского фонда фундаментальных исследований (проект № 16-08-00384-a).
Список литературы
Мецлер Д. Биохимия. М.: Мир, 1980. Т. 3, 487 с.
Мецлер Д. Биохимия. М.: Мир, 1980. Т. 2, 606 с.
Досон Р., Эллиот Д., Эллиот У., Джонс К. Справочник биохимика. М.: Мир, 1991. С. 36
Химическая энциклопедия / Редкол.: Зефиров Н.С. и др. М.: Большая Российская энциклопедия, 1998. Т. 5 (Три-Ятр). 783 с.
Mayer M., Noble M. // Proc. Natl. Acad. Sci. USA. 1994. V. 91. № 16. P. 7496.
Lindner H., Holier E., Erd B. et al. // Blood. 1997. V. 89. № 6. P. 1931.
Erkkila K., Hirvonen V., Wuokko E. et al. // J. Clin. Endocr. Metab. 1998. V. 83. № 7. P. 2523.
Matinez M., Martinez N., Hernandez A.I., Ferrandiz M.L. // Life Sci. 1999. V. 15. P. 1253.
Мукоактивная терапия / Под ред. А.Г. Чучалина, А.С. Белевского. М.: Атмосфера, 2006. 127 с.
Lovelock J.E. // Nature. 1961. V. 189. P. 729.
Мазунов В.А., Щукин П.В., Хатымов Р.В., Муфтахов М.В. // Масс-спектрометрия. 2006. Т. 3. № 1. С. 11.
Muftakhov M.V., Vasil’ev Yu.V., Mazunov V.A. // Rapid Commun. Mass Spectrom. 1999. V. 13. P. 1104.
Khatymov R.V., Muftakhov M.V., Mazunov V.A. // Ibid. 2003. V. 17. P. 2327.
Wu J., Xu X. // J. Chem. Phys. 2007. V. 127. P. 214105.
Abdoul-Carime H., Gohlke S., Illenberger E. // Phys. Chem. Chem. Phys. 2004. V. 6. P. 161.
Aflatooni K., Hitt B., Gallup G.A., Burrow P.D. // J. Chem. Phys. 2001. V. 115. P. 6489.
Муфтахов М.В., Щукин П.В., Хатымов Р.В., Туктаров Р.Ф. // Изв. АН. Сер. хим. 2016. № 3. С. 658.
Thornburn R. // Brit. J. Appl. Phys. 1965. V. 16. № 5. P. 1397.
Muftakhov M.V., Shchukin P.V. // Phys. Chem. Chem. Phys. 2011. V. 13. P. 4600.
Муфтахов М.В., Щукин П.В. // Изв. АН. Сер. хим. 2014. № 3. С. 642.
Vasil’ev Y.V., Figard B.J., Voinov V.G. et al. // J. Am. Chem. Soc. 2006. V. 128. P. 5506.
Korotkova E.I., Karbainov Y.A., Shevchuk A.V. // J. Electroanal. Chem. 2002. V. 518. P. 56.
Дорожко Е.В., Короткова Е.И. // Химико-фармацевтический журнал. 2010. Т. 44. № 10. С. 53.
Siefermann K.R., Liu Y., Lugovoy E. et al. // Nature Chemistry. 2010. V. 2. P. 274.
Pshenichnyuk S.A., Komolov A.S. // J. Phys. Chem. Lett. 2015. V. 6. P. 1104.
Braga P.C., Allegra L. Drugs in Bronchial Mucology. New York: Raven Press, 1989. 368 p.
Modelli A., Jones D., Distefano G., Tronc M. // Chem. Phys. Lett. 1991. V. 181. P. 361.
Shattuck K.E., Rassin D.K., Grinnell C.D. // J. Parenter. Enteral. Nutr. 1998. V. 22. № 4. P. 228.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии