Журнал физической химии, 2020, T. 94, № 1, стр. 136-142
Низкотемпературный фотолиз пероксида бензоила
С. И. Кузина a, А. И. Большаков a, А. В. Куликов a, А. И. Михайлов a, *
a Российская академия наук, Институт проблем химической физики
142432 Черноголовка, Московской обл., Россия
* E-mail: alfaim@icp.ac.ru
Поступила в редакцию 04.03.2019
После доработки 15.05.2019
Принята к публикации 18.06.2019
Аннотация
Методом ЭПР исследован фотолиз сухого пероксида бензоила (ПБ) при 77 K в диапазоне 480–236 нм и в растворе этилового спирта. Установлено, что первичным фотохимическим актом при облучении ПБ λ = 480–365 нм является прямая фотодиссоциация пероксидной связи О–О и С–Н-связей бензольных колец с образованием бензоил-оксирадикалов и атомарного водорода, образующегося, очевидно, по двухквантовому механизму. Квантовый выход первичных интермедиатов φ ≈ 2.7 × 10−5. При дальнейшем облучении образца светом λ = 300–236 нм бензоил-оксирадикалы отщепляют углекислый газ и превращаются в фенильные радикалы с квантовым выходом φ ≈ 3 × 10–4. При 120–145 K фенильные радикалы реагируют с двойными связями ароматических колец ПБ с образованием фенил-замещенных циклогексадиенильных радикалов, исчезающих при 273 K. Методом функционала плотности (B3LYP/6-311g) выполнены квантово-химические расчеты радикальных структур фотолизованного пероксида, отмечено хорошее соответствие экспериментальных и теоретических параметров. Расчет показал, что в структуре бензоил-оксирадикала происходит выравнивание спиновой плотности на двух кислородных атомах радикала вследствие сопряжения неспаренного электрона с неподеленной р-электронной парой на атоме кислорода С=О-группы. При фотолизе λ ≥ 365 нм растворов ПБ в этаноле радикалы растворителя образуются в результате сенсибилизированного фотолиза посредством реакции первичных бензоил-оксирадикалов с молекулами растворителя.
Пероксид бензоила (ПБ) – известный инициатор радикальных реакций, отвердитель полиэфирных смол, вулканизатор, окислитель, отбеливатель, дезодорант широко применяемый в полимерной химии, органическом синтезе, медицине и быту. Интенсивное изучение ПБ началось в 20-х гг. прошлого века после того, как было обнаружено разложение молекулы ПБ на свободные радикалы в растворах при температурах 60–80°С. Истолкование реакций, как радикальных процессов, проводилось на основании анализа продуктов реакции. Большое количество работ, посвященных изучению термического и фотолитического разложения этого вещества в различных растворителях, обобщено в монографиях Уоллинга (Walling) [1] и Нонхибела и Уолтона (Nonhebel, Walton) [2]. Из литературных данных следует, что термическое разложение ПБ в растворе протекает в две стадии: сначала по реакции гомолитического расщепления О–О-связи образуются бензоил-оксирадикалы, затем при декарбоксилировании бензоил-оксирадикалов происходит выделение СО2 и образование фенильных радикалов. В растворе образуются также радикалы растворителя.
Фотолиз пероксида изучен в меньшей степени, хотя фотолитическое разложение ПБ часто используют для радикального инициирования различных реакций, вводя пероксид бензоила в реакционную систему в качестве добавки [2, 3]. Несмотря на большое количество материала, накопленного о ПБ, до настоящего времени практически нет полного обобщения фотолиза этого пероксида. Это связано как с несовершенством исследования, так и с неясностью ряда вопросов.
Настоящая работа посвящена задаче установления природы первичных продуктов фотохимической деструкции пероксида бензоила. Для этой цели методом ЭПР 3 см диапазона исследовали фотолиз (при 77 K) фильтрованным светом в диапазоне λ ≥ 500–236 нм сухого пероксида и раствора ПБ в этаноле. Данные могут представить интерес для выяснения роли пероксидов как инициаторов реакций окисления в твердой фазе, как вещественных инициаторов полимеризации.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Пероксид бензоила С14Н10О4 очищали трехкратным переосаждением метанолом из холодного раствора хлороформа. Фотолиз пероксида и 2% раствора ПБ в этаноле проводили в кварцевых и стеклянных ампулах в вакууме при 77 K. Источником УФ-света была ртутная лампа высокого давления ДРШ-1000 (интенсивность потока 3.8 × × 1017 квант/(см2 с) для λ = 236–500 нм). Отдельные участки спектра лампы выделяли с помощью набора стеклянных светофильтров. Разогрев облученных образцов (выше 77 K) проводили в термостате, охлаждаемом парами жидкого азота. Облученный образец выдерживали в течение нескольких минут при заданной температуре, а спектры ЭПР регистрировали при 77 K на радиоспектрометре 3 см диапазона ЭПР-21 (ν0 = = 9.6 ГГц, мощность СВЧ-поля ∼10−3 Вт). Квантово-химические расчеты радикальных структур проводили с помощью программного пакета GAUSSIAN 03 методом функционала плотности B3LYP/6-311g. Спектры оптического поглощения растворов ПБ в этаноле и ацетоне снимали на спектрофотометре Specord M-40, используя ячейки шириной 1 см. Анализ газовых продуктов фотолиза ПБ проводили на масс-спектрометре MI-1201B.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Бензоил-оксирадикалы, атомарный водород
При проведении фотолиза и определения граничной длины волны, вызывающей фотодиссоциацию, образец ПБ последовательно облучали фильтрованным светом с λ ≥ 500, ≥480, ≥440, ≥400, ≥365 нм (общее время облучения 1 ч) и после каждой экспозиции регистрировали спектр ЭПР. Сигналы в спектрах ЭПР появились при действии света с λ ≥ 480 нм, интенсивность сигналов увеличивалась с увеличением энергии кванта (вплоть до 365 нм) и времени экспозиции. Спектр, зарегистрированный после облучения λ = 480–365 нм, приведен на рис. 1. В спектре одновременно регистрировались три сигнала с разными значениями g-фактора: широкий двухкомпонентный сигнал с g = 2.065 (спектр 1а), дублет атомарного водорода с расщеплением линий ααН = 505 Гс и слабый бесструктурный сигнал, который по величине g-фактора (g = 2.001) следует отнести к силильным радикалам в кварцевой ампуле [4] (до фотолиза сигнал с g = 2.001 в ампуле отсутствовал).
Рис. 1.
Спектры ЭПР УФ-облученного при 77 К сухого пероксида бензоила: 1 – фотолиз λ = 480–365 нм в течение 1 ч, затем 5 мин λ ≥ 236 нм (2); 3 – фотолиз исходного пероксида λ ≥ 236 нм; 4 – разогрев фото-облученного образца 3 до 145 K.
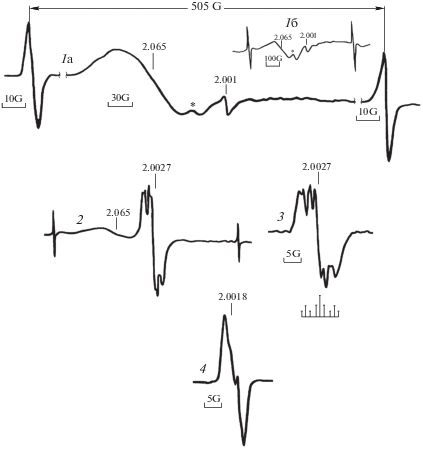
Приведенные данные ЭПР указывают на то, что фотодиссоциация ПБ с образованием радикальных интермедиатов происходит под действием видимого света λ = 480–365 нм. Однако в спектре оптического поглощения ПБ, приведенном (в растворе этанола) на рис. 2, диапазон 365–480 нм не содержит никаких полос.
Максимумы полос поглощения двух хромофорных групп находятся в области ∼290 нм (n‒π*-переход в карбонильной группе) и ∼235 нм (π–π*-переход в ароматическом кольце). Длинноволновый край оптического спектра ПБ (в растворе ацетона) заканчивается на ∼360 нм. Полоса поглощения третьего хромофора – пероксидной группы О–О – отсутствует, поскольку спектры поглощения пероксидных соединений даже в газовой фазе не содержат структуры. По данным [5] при поглощении кванта света ПБ сразу гомолитически диссоциирует по О–О-связи (по механизму прямой фотодиссоциации) с образованием двух оксирадикалов. Активации света в видимом диапазоне происходит также из-за сдвига полосы n–π*-перехода в длинноволновую область, обусловленного нарушением плоскостной конфигурации молекулы ПБ [6]. Искривление молекулы вызывает сильное взаимодействие двух электронных пар на атомах кислорода и их сопряжение с π-электронами двойных связей фенильных групп. Эффект сопряжения приводит к некоторому смешиванию n–π*- и π–π*-возбужденных состояний. Таким образом, можно заключить, что первичный фотохимический акт при фотолизе ПБ светом λ 480–365 нм инициируют возбужденные пероксидные группы, распадающиеся по О‒О связи на два бензоил-оксирадикала, и n–π*- и π–π*-возбужденные состояния карбонильных и фенильных групп, вызывающие разрывы С‒Н‑связей. Энергия кванта света с λ = 480 нм составляет ∼65 ккал/моль и ее достаточно для разрыва О–О-связи (∼30 ккал/моль). При разрыве О–О-связи два бензоил-оксирадикала находятся в одной структурной ячейке в виде радикальной пары (РП)1:
(1)
$\begin{gathered} {{{\text{С}}}_{6}}{{{\text{Н}}}_{5}}{\kern 1pt} --{\kern 1pt} {\text{С}}({\text{О}}){\kern 1pt} --{\kern 1pt} {\text{О}}{\kern 1pt} --{\kern 1pt} {\text{О}}{\kern 1pt} --{\kern 1pt} {\text{С}}({\text{О}}){\kern 1pt} --{\kern 1pt} {{{\text{С}}}_{6}}{{{\text{Н}}}_{5}} + h\nu \to \\ \to 2{{{\text{С}}}_{6}}{{{\text{Н}}}_{5}}{\kern 1pt} --{\kern 1pt} {\text{С(О)}}{\kern 1pt} --{\kern 1pt} {{{\text{О}}}^{ * }}. \\ \quad ({{{\text{R}}}_{{\mathbf{1}}}}) \\ \end{gathered} $По данным ЭПР в первичном акте фотолиза ПБ выделяется еще атомарный водород. Его характерный дублет с расщеплением линий α = 505 Гс заметен уже при действии света с λ ≥ 480 нм (отметим, что для генерации атомарного водорода непосредственно в кварцевой ампуле необходимо действие света короче 280 нм). Образование водорода в ПБ происходит при разрыве С–Н-связи (энергия связи 102 ккал/мол), а избыточная энергия системы после поглощения первого кванта (λ ≥ 480 нм) составляет всего ∼35 ккал/моль. Поэтому необходимо допустить, что радикальная пара (РП)1 сразу поглощает второй квант (за счет участия n–π*- и π–π*-возбужденных состояний) и атомарный водород образуется уже во второй ячейке по двухквантовому механизму (двуквантовый механизм образования первичных радикальных интермедиатов при фотолизе ПБ отмечается также в [5]):
Атом Н легко выходит из второй клетки (РП)2, что подтверждает величина константы сверхтонкого расщепления (СТР) дублета водорода, равная α = 505 Гс. В составе радикальной пары константа СТР дублета ${{{\text{Н}}}^{ \bullet }}$ была бы в 2 раза меньше [7]. При выходе ${{{\text{Н}}}^{ \bullet }}$ из состава второй пары (РП)2 оставшийся бензоил-оксирадикал не испытывает клеточных эффектов и является одиночным бензоил-оксирадикалом R1.В спектрах ЭПР оксирадикалы регистрируются в виде синглетов без какой-либо сверхтонкой структуры (ядерный спин атома кислорода равен нулю). Однако спектр 1а (на рис. 1), включающий сигнал радикалов R1, представляет суперпозицию двух сигналов: широкого интенсивного синглета, который превалирует в спектре и закрывает первую линию слабого дублета. Вторая линия дублета (отмечена на рисунке звездочкой) более четко регистрируется при записи спектра на узкой развертке (рис. 1б на врезке). Широкий синглет в спектре 1а (ΔН ≅ 100 Гс, g = 2.065) можно отнести к синглету вышедших из клетки индивидуальных бензоил-оксирадикалов, а дублет (расщепление линий α ≈ 60 Гс, g ≈ 2.045) может быть сигналом небольшой доли (∼8%) оставшихся в клетке радикальных пар. Известно, что сигналы радикальных пар с g ≈ 2 (Δm = 1 переход) регистрируются в виде широкого дублета [7], и их наличие может быть причиной уширения синглета. Квантовый выход R1 и радикальных пар (РП)1 в диапазоне λ = 480–365 нм при 77 K составил φ ≈ ≈ 2.7 × 10−5.
Бензоил-оксирадикал – сопряженный радикал, в котором неспаренный π-электрон на атоме кислорода находится в π–р-сопряжении с неподеленной р-электронной парой на атоме кислорода карбонильной группы. Квантово-химические расчеты показали, что из-за эффектов сопряжения и обменных взаимодействий спиновая плотность в радикале R1 распределяется практически поровну (по ∼0.54) между двумя кислородными атомами и структурную формулу R1 можно представить следующим образом
Вызывает интерес большая ширина спектра 1а (ΔН ≈ 100 Гс) и существенное смещение g-фактора (g = 2.065) от чисто спинового значения. Как отмечалось выше, основной причиной уширения спектра может быть присутствие радикальных пар, имеющих различные расстояния между радикалами в паре [7], не исключено также увеличение ширины синглета вследствие спин-спинового взаимодействия двух спиновых центров в радикале. Существенное смещение g-фактора от чисто спинового значения свидетельствует о заметном вкладе орбитального магнетизма в полный эффективный магнитный момент радикала.В литературе доказательства образования бензоил-оксирадикалов, как первичного продукта деструкции ПБ, основываются на анализе продуктов реакции, которые можно ожидать при превращениях бензоил-оксирадикалов [1, 2]. Зарегистрированный в процессе низкотемпературного фотолиза ПБ спектр ЭПР (на рис. 1), включающий синглет индивидуальных бензоил-оксирадикалов, дублет их радикальных пар и дублет атомарного водорода, является доказательством прямого фотолиза (под действием видимого света) пероксидной О–О-группы и С–Н-связей фенильных групп с образованием бензоил-оксирадикалов и атомов Н• как первичных радикальных интермедиатов.
Фенильные радикалы
При облучении пероксида бензоила, содержащего бензоил-оксирадикалы УФ-светом с λ = = 300–236 нм, последние деструктируют по С‒С(О)О связи с образованием фенильных радикалов R2 и углекислого газа:
(4)
$\begin{gathered} {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{5}}{\kern 1pt} --{\kern 1pt} {\text{C(O)}}{\kern 1pt} --{\kern 1pt} {{{\text{O}}}^{ \bullet }} + h\nu \to {{{\text{C}}}_{{\text{6}}}}{\text{H}}_{5}^{ \bullet } + {\text{C}}{{{\text{O}}}_{2}}. \\ \quad \quad \quad \quad \quad \quad \quad \quad ({{{\text{R}}}_{2}}) \\ \end{gathered} $Спектр ЭПР радикалов R2 представляет собой биномиальный триплет триплетов с неравномерным взаимодействием неспаренного электрона с протонами кольца. Константа сверхтонкого расщепления α1 = 23–24 Гс (от взаимодействия с орто-протонами), α2 = 7.5 Гс (от мета-протонов), g = 2.0027, что хорошо согласуется с известными данными [8]. Константы СТР для орто- и мета-протонов экспериментальных спектров ЭПР значительно различаются (23–24 Гс и 7.5 Гс), а теоретические значения констант, рассчитанные квантово-химическим методом для радикалов в газовой фазе, мало отличаются друг от друга и равны соответственно α = 18–15 Гс. Отклонение экспериментальных констант от теоретических можно связать с особенностью твердой фазы и влиянием молекул окружения на углы и длину С–Н связей радикала.
Летучие продукты фотолиза ПБ
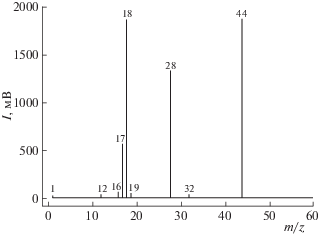
Разрывы О–О-, С–Н- и С–С-связей молекул ПБ сопровождаются образованием летучих продуктов фотолитического разложения пероксида. На рис. 3 приведены данные основных продуктов фотодеструкции ПБ. На масс-спектрограмме видны следы атомарного водорода (${{{\text{H}}}^{ \bullet }}$), а интенсивные пики воды и углекислого газа свидетельствуют об основных продуктах низкотемпературного фотолиза ПБ.
Фенилзамещенные циклогексадиенильные радикалы
При разогреве фотолизованных (при 77 K) образцов ПБ, содержащих фенильные радикалы, последние сохраняются до 120 K, а в области 120–145 K спектр R2 трансформируется в дублет (рис. 1, спектр 4) с константой СТР $\alpha _{\beta }^{{\text{H}}}$ = 24 Гс, g = = 2.0018. Согласно [9], дублет принадлежит фенилзамещенным циклогексадиенильным радикалам R3, которые являются продуктом реакции фенильных радикалов с двойной связью ароматических колец молекулы ПБ. При взаимодействии фенильного радикала с молекулой ПБ происходит разрыв двойной связи кольца и присоединение радикала к молекуле пероксида:
С появлением радикалов R3 образец приобретает коричневую окраску. Квантово-химические расчеты показали, что основная спиновая плотность в радикале R3 локализуется (относительно заместителя) на углеродных атомах в орто-, пара-положениях кольца 0.4, 0.4, 0.5 соответственно. Взаимодействие неспаренного электрона (локализованного на атомах углерода в орто-положении) с ближайшим β-протоном атома водорода (Н показан в структурной формуле R3) приводит к возникновению дублетной структуры с расщеплением α = 24 Гс, что полностью согласуется с квантово-химическим расчетом (α = 24 Гс). Дополнительное расщепление линий теоретического дублета на двух протонах кольца (с константой СТР α = 3.4 Гс) в твердой фазе экспериментальных спектров не заметно.В радикале R3 диенильный фрагмент в ароматическом кольце в сопряжении с неспаренным электроном (π–π-сопряжение) и неподеленной электронной парой на атоме кислорода карбонильной группы (π–р-сопряжение) образуют единую сопряженную систему. Такая система с делокализованной электронной плотностью резко снижает энергию радикала, повышая его термодинамическую устойчивость, но при этом одновременно снижается реакционная способность радикала. В облученном пероксиде бензоила радикалы R3 сохраняются до 273 K.
Изменения пероксида бензоила в процессе хранения
При разогреве облученного (λ = 480–236 нм при 77 K) пероксида бензоила до комнатной температуры сигналы радикальных структур исчезают, остается один сигнал с g = 2.001 силильных радикалов в кварцевой ампуле. При повторном УФ-облучении (при 77 K) этого образца дублет атомарного водорода отсутствует. Еще более существенные изменения наблюдаются в спектрах ЭПР и в ИК-спектрах пероксида, долго хранившейся в лабораторных условиях. При облучении такого пероксида λ = 480–365 нм (при 77 K) в спектрах ЭПР не наблюдается никаких сигналов, не изменяется и белый цвет порошкообразных образцов. В ИК-спектре, приведенном на рис. 4б (в сравнении со стандартным ИК-спектром ПБ, рис. 4а) полностью отсутствует самая интенсивная полоса валентных колебаний С–Н-связей при ν ≈ 2924 см–1, заметно также уменьшение интенсивности полос в диапазоне 1600–1450 см−1, связанных с деформационными колебаниями СН2-связей (эффект изменений в ИК-спектрах ПБ требует дополнительных исследований). Однако облучение долго хранившегося пероксида коротковолновым светом с λ ≥ 236 нм сопровождается эффективным образованием фенильных радикалов, регистрируемых в спектрах ЭПР. В белом образце ПБ появляется ярко-рыжее пятно – это цвет фенильных радикалов. По мере их гибели рыжее пятно исчезает. Таким образом, в обычных условиях хранения ПБ тепло и свет губительно действуют на вещество, вызывая реакции деструкции. При этом первичные бензоил-оксирадикалы, обладающие высокой возбудимостью и реакционной способностью, не всегда удается зафиксировать методом ЭПР. Но способность генерировать фенильные радикалы сохраняется и ПБ можно использовать в качестве инициатора радикальных реакций.
Фотолиз пероксида бензоила в растворе
При низкотемпературном (77 K) облучении λ ≥ 365 нм 2% раствора ПБ в этиловом спирте через несколько минут в спектрах ЭПР наблюдается хорошо разрешенный семикомпонентный сигнал (рис. 5). Концентрация парамагнитных центров достигает ∼7 × 1016 спин в 1 г раствора и по мере дальнейшего облучения уменьшается вследствие убыли содержания ПБ.
Рис. 5.
Спектр ЭПР при фотолизе (λ ≥ 365 нм, 77 K) 2% раствора пероксида бензоила в этиловом спирте.

Анализ формы спектра показал, что радикалы образуются из ароматической и спиртовой компонентов смеси и наблюдаемый спектр является суперпозицией двух сигналов. Две крайние компоненты спектра (отмечены звездочкой в спектре и кружками в схеме линий СТС) на расстоянии 90 Гс принадлежат триплету с $\alpha _{\beta }^{{2{\text{H}}}}$ = 45 Гс циклогексадиенильных (RCGD) радикалов, образующихся по реакции атомарного водорода с ароматическими кольцами молекул ПБ.
Источником атомарного водорода являются молекулы спирта. Отрыв Н от алкильной группы спирта приводит к образованию спиртовых радикалов СН3С$^{ \bullet }$НОН (Ral) через реакцию сенсибилизированного фотолиза бензоил-оксирадикалов с молекулой спирта:
Атомарный водород эффективно присоединяется к двойной связи ароматических колец молекул ПБ, образуя циклогексадиенильные радикалы. Согласно [7], присоединение Н происходит в орто‑, пара-положения кольца (по отношению к заместителю), дополнительное расщепление α = 7.5 Гс обусловлено взаимодействием неспаренного электрона с двумя протонами кольца: При фотолизе λ ≥ 365 нм чистого спирта, без ПБ, радикалы не обнаружены. Пятикомпонентный спектр радикала СН3С$^{ \bullet }$НОН расположен в центре спектра рис. 5 между двумя крайними компонентами. Соотношение интенсивностей квинтиплета (! : 2 : 3 : 2 : 1) и различные константы СТР (α = 18–11 Гс) свидетельствуют о неэквивалентности α- и β-протонов, что характерно для радикалов этилового спирта в твердой фазе и согласуется с данными [7]. Однако в нашем спектре спиртовых радикалов (Ral) константы СТР немного занижены, по-видимому, вследствие суперпозиции с сигналом RCGD. Содержание RCGD и Ral в смеси радикалов составляет 70 и 30% соответственно.Таким образом, при низкотемпературном фотолизе растворов ПБ λ ≥ 365 нм радикалы растворителя образуются в результате сенсибилизированного фотолиза посредством реакции первичных бензоил-оксирадикалов с молекулами растворителя.
Таким образом в диапазоне длин волн 480–236 нм исследован низкотемпературный (77 K) фотолиз пероксида бензоила (ПБ). Основное внимание уделено радикальным интермедиатам, регистрируемых методом ЭПР. Показано, что длина волны фотолизующего света влияет на природу образующихся радикалов. Свет λ = = 480‒365 нм вызывает прямую фотодиссоциацию О–О- и С‒Н-связей молекулы с образованием двух бензоил-оксирадикалов и атомарного водорода, образующегося по двухквантовому механизму. Спектр ЭПР бензоил-оксирадикалов, представляющий широкий синглет с ΔН ≅ 100 Гс, g-фактор 2.065, зарегистрирован в суперпозиции с дублетным сигналом радикальных пар.
Фотолиз ПБ λ ≥ 236 нм генерирует фенильные радикалы, образующиеся при декарбоксилировании бензоил-оксирадикалов. При 120–145 K фенильные радикалы по реакции с двойными связями молекул пероксида образуют устойчивые фенил-замещенные циклогексадиенильные радикалы, сохраняющиеся до 273 K. Методом функционала плотности проведен квантово-химический расчет радикальных структур фотолизованного пероксида, отмечено хорошее соответствие теоретических и экспериментальных параметров.
При фотолизе λ ≥ 365 нм растворов ПБ радикалы растворителя образуются в результате сенсибилизированного фотолиза посредством реакции бензоил-оксирадикалов с молекулами растворителя.
Работа выполнена в рамках Государственного задания № 0089-2019-0011.
Список литературы
Уоллинг Ч. / Свободные радикалы в растворе. М.: Изд-во. Иностр. лит., 1960, 512 с. (Cheves Walling / Free Radicals in Solution. New York–London: J. Wiley Inc., 1957).
Нонхебел Д., Уолтон Дж. Химия свободных радикалов. Структура и механизм реакций. М.: Мир, 1977. 582 с. (D.C. Nonhebel, J.C. Walton / Free Radical Chemistry. Structure and Mechanism. Cambridge University Press. 1974).
Большаков А.И., Кузина С.И., Кирюхин Д.П. // Журн. физ. химии. 2017. Т. 91. № 3. С. 466. (Russ. J. Phys. Chem. A. 2017. V. 91. № 3. Р. 482.)
Кузина С.И., Михайлов А.И. // Химия в интересах устойчивого развития. 2017. Т. 25. № 4. С. 399.
Карпухин О.Н., Слободецкая Е.М. // Успехи химии. 1973. Т. 42. Вып. 3. С. 391.
Мельников М.Я., Смирнов В.А. Фотохимия органических радикалов. Издательство Московского университета, 1994.
Пшежецкий С.Я., Котов А.Г., Милинчук В.К. и др. ЭПР свободных радикалов в радиационной химии. М.: Химия, 1972, 480 с.
Kasai P.H., Hedaya E., Whipple E.B. // JACS. 1969. V. 91. P. 4364.
Корицкий А.Т., Зубков А.А. // Высокомолекуляр. соединения. 1967. Т. 9-А. № 4. С. 789.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии