Журнал физической химии, 2020, T. 94, № 10, стр. 1547-1551
Кинетические и термодинамические характеристики процесса сорбции фторид-ионов с использованием композиционного материала на основе целлюлозы и оксида алюминия
А. В. Долганов a, А. В. Баландина a, b, *, Д. Б. Чугунов a, А. С. Тимонина a, Л. А. Климаева a, В. В. Шиндина a, А. В. Князев b
a Национальный исследовательский Мордовский государственный университет им. Н.П. Огарева
430005 Саранск, Россия
b Университет Лобачевского. Химический факультет
603950 Нижний Новгород, Россия
* E-mail: balandina.av@yandex.ru
Поступила в редакцию 16.03.2020
После доработки 16.03.2020
Принята к публикации 17.03.2020
Аннотация
Детально изучен процесс адсорбции фторид-ионов композиционным материалом на основе оксида алюминия и целлюлозы. На основе изотерм адсорбции Ленгмюра вычислены константы адсорбционного равновесия K, параметр Г∞ и ΔG0ad. Определены сорбционные характеристики, а также кинетика и механизм протекающих процессов. Показана высокая сорбционная способность композиционным материалом на основе оксида алюминия и целлюлозы по сравнению с ранее описанными сорбентами.
С развитием цивилизации загрязнение водных ресурсов стало основной проблемой, требующей срочного решения [1]. В настоящее время в России и в мировой практике продолжается использование воды с достаточным содержанием фтора, а для ее обесфторирования используют различные фильтры, в которых сорбенты имеют низкий ресурс потребления, низкую абсорбционную емкость и очень высокую стоимость. Питьевая вода с высоким содержанием фтора вредна для здоровья человека [2]. Долгосрочное употребление воды с избытком фтора может привести к деструкции эмали зубов у детей и деформации конечностей у взрослых [3]. Различные методы удаления фтора имеют свои ограничения, но метод адсорбции считается наиболее перспективным методом благодаря его простоте использования и низкой стоимости [4]. В последние годы для удаления ионов фтора из воды активно изучается использование оксида алюминия, поскольку он имеет мезопористую структуру и низкую токсичность [5–8]. Однако все сорбенты на основе оксида алюминия обладают существенным недостатком – невысокой сорбционной емкостью. Поиск новых сорбентов, содержащих оксид алюминия и обладающих высокими значениями сорбционной емкости, в настоящее время представляет актуальную задачу. В данной работе предложено использовать в качестве сорбента тонкие пленки (100 нм) из оксида алюминия, нанесенные на поверхность кристаллической микроцеллюлозы. Для полученного композиционного материала подробно изучены кинетические и термодинамические параметры процесса сорбции фторид-ионов из воды.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве сорбента использовали микрокристаллическую целлюлозу, на которую с помощью технологии АСО наносили пленку Al2O3 различной толщины. Принцип нанесения тонких пленок методом АСО заключается в следующем. Подложка, находящаяся в вакуумной камере, при рабочей температуре подвергается поочередно воздействию двух реагентов (прекурсоров), которые находятся в виде пара. Прекурсоры, реагируя только на поверхности подложки, образуют монослой тонкопленочного соединения, которое образовалось в результате проводимых реакций. Толщина нанесенных слоев определялась по ранее полученным калибровочным графикам [9].
При нанесении пленки оксида алюминия (Al2O3) в качестве прекурсоров использовали триметилалюминий (Al(CH3)3 – ТМА) и воду (H2O), температура реактора 100°С. Этот процесс хорошо изучен – рост пленки идет за счет самоограниченных реакций, и алюминийсодержащий прекурсор обладает высокой реакционной способностью [10]. Модельный раствор фторид-ионов определенной концентрации готовили путем разбавления стандартного образца ГСО 7261-96.
Эксперименты до адсорбции проводили в стационарном режиме. Образцы сорбента массой от 0.01 до 0.02 г вводили в раствор фторид-ионов с концентрацией 5 мг/л и перемешивали в течение 1 ч при скорости 200 об./мин на орбитальном шейкере Biosan PSU-10i. После достижения равновесия массовую концентрацию фторид-ионов измеряли фотометрическим методом по ГОСТ 4386-89 на УФ-видимом спектрофотометре UV-1800 SHIMADZU. С помощью метода атомно-абсорбционной спектроскопии определяли содержание оксида алюминия, нанесенного на целлюлозу (от 41.40 до 66.94 мас. % в зависимости от слоя сорбента). Каждый эксперимент проводили трижды при комнатной температуре и нормальном атмосферном давлении. Стандартное отклонение измерений ± 2%.
Далее расчет адсорбционной емкости вели в пересчете на оксид алюминия по формуле:
где А – адсорбционная емкость сорбента, мг/г; С0 – начальная концентрация фторид-ионов в растворе, мг/л; С – равновесная концентрация фторид-ионов в растворе после сорбции, мг/л; m – масса сорбента в пересчете на Al2O3, г; V – объем раствора, из которого ведется сорбция, л [11].ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для выбора времени адсорбции, при котором достигается сорбционное равновесие, была изучена зависимость величины адсорбции фторид-ионов от продолжительности процесса. Концентрация и объем исходного раствора фторид-ионов составили 5 мг/л и 10 мл соответственно. Полученная зависимость представлена на рис. 1. Видно, что в первые 40–50 мин эксперимента реакция завершается на 80–90%. Оптимальная продолжительность адсорбции составляет 60 мин. На рис. 2 представлена зависимость величины адсорбции от равновесной концентрации. Как видно, изотерма адсорбции имеет ленгмюровский тип, описываемый уравнениями Ленгмюра в стандартном и линейном виде:
где Γ∞ – величина максимальной адсорбции, мг/г; K – постоянная, характеризующая сродство адсорбируемого вещества к поверхности адсорбента; С – равновесная концентрация адсорбтива в растворе, мг/л.Для вычисления параметров адсорбции строится зависимость в координатах 1/Г – 1/С (рис. 3), после чего вычисляются константы Γ∞ и K. Из уравнения (3) следует, что отрезок, отсекаемый прямой на оси ординат, равен 1/Γ∞, а тангенс угла между прямой и осью абсцисс равен 1/Γ∞K [12]. Как видно из представленной изотермы, она хорошо подвергается линеаризации в координатах Ленгмюра, коэффициент достоверности аппроксимации имеет высокое значение. Определенные из рис. 3 ранее указанным способом константы адсорбции Ленгмюра Γ∞ и K равны 0.00025 и 9302 соответственно.
После подстановки вычисленных констант адсорбции в уравнение Ленгмюра (2) получено следующее уравнение, описывающее зависимость величины адсорбции от концентрации адсорбтива:
Равновесная концентрация, при которой адсорбция стремится к предельному значению, составляет 5–11 мг/л. Следовательно, при определенном соотношении объема и массы сорбента найден оптимальный интервал концентрации, выше которого адсорбция неэффективна.Для практического использования полученных результатов необходимо получить кинетические данные о процессах адсорбции фтора. В связи с этим использовано представление о реакции адсорбции как об обратимой реакции первого порядка [13]:
(5)
${\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}} + {{{\text{F}}}^{ - }}\mathop \rightleftharpoons \limits_{{{k}_{2}}}^{{{k}_{1}}} {{[{\text{A}}{{{\text{l}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{3}}}}{\text{F}}]}^{ - }}.$Графическое решение уравнения (8) в координатах $\frac{{\ln \left( {{{C}_{0}} - {{C}_{\infty }}} \right)}}{{C - {{C}_{\infty }}}}$ – t позволяет определить эффективную константу k = k1+ k2:
(8)
$\begin{gathered} kt = ({{k}_{1}} + {{k}_{2}})t = \\ = \ln \left( {{{C}_{0}} - \frac{{{{C}_{\infty }}}}{{\left( {{{C}_{0}} - {{C}_{\infty }}} \right) - ({{C}_{0}} - C)}}} \right) = \\ = \frac{{\ln \left( {{{C}_{0}} - {{C}_{\infty }}} \right)}}{{C - {{C}_{\infty }}}}, \\ \end{gathered} $Для вычисления кинетических характеристик процессов адсорбции были проведены эксперименты по изучению изменения концентрации адсорбтива от времени адсорбции. Полученные результаты представлены на рис. 4 в виде кинетических кривых [14]. Адсорбция проводилась в интервалах температур от 10 до 37°С. Как видно из рис. 4, скорость реакции адсорбции максимальна в первые 20 мин, и система приближается к равновесию ближе к 60 мин. Обработка полученных данных в координатах уравнения (8) представлена на рис. 5.
Рис. 4.
Кинетические кривые адсорбции фторид-ионов при различных температурах: 1 – 10, 2 – 25, 3 – 37°С.

Рис. 5.
Логарифмические анаморфозы кинетических кривых процесса адсорбции фторид-ионов при различных температурах: 1 – 10, 2 – 25, 3 – 37°С.

Так как кинетика химических реакций хорошо описывает реакции до неполного их завершения, то для анализа и построения логарифмической зависимости использовался именно тот участок, когда реакция протекала на 70–80%. На рис. 4 этот участок соответствует временному интервалу от 0 до 30 мин. Как видно из рис. 5, логарифмические зависимости имеют линейный характер, что доказывает протекание адсорбции ионов в виде реакции первого порядка.
Эффективная (суммарная) константа скорости реакции k определяется из анаморфоз как тангенс угла наклона прямой. Рассчитанные значения k1 и k2 приведены в табл. 1.
Таблица 1.
Константы скорости реакций адсорбции и десорбции фторид-ионов
| Т, K | Kс | k1 × 10–4, с–1 | k2 × 10–5, с–1 |
|---|---|---|---|
| 283 | 15.67 | 1.78 | 1.20 |
| 298 | 7.33 | 2.25 | 1.43 |
| 310 | 4.55 | 2.73 | 6.10 |
С возрастанием температуры наблюдается увеличение констант скоростей реакции как прямой, так и обратной. Это может свидетельствовать об активированном характере адсорбции фторид-ионов на поверхности сорбента на основе целлюлозы, модифицированной нанослоем оксида алюминия. Для расчета энергий активации адсорбции и десорбции строится зависимость логарифмов указанных выше констант от обратной температуры (рис. 6).
Рис. 6.
Зависимости логарифмов констант скоростей адсорбции (1) и десорбции (2) от обратной температуры.
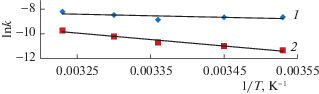
Зависимости k1 и k2 изученных процессов от температуры удовлетворительно описываются уравнением Аррениуса. Энергия активации находится из тангенса угла прямолинейной зависимости по формуле:
Энергия активации адсорбции составила 10.25 кДж/моль, а энергия активации десорбции равна 42.63 кДж/моль. Энергия активации процесса десорбции выше энергии активации процесса адсорбции, что характерно для ионной адсорбции.Для полного представления адсорбции фторид-ионов, рассчитаны следующие термодинамические параметры: ΔG0, ΔH0, ΔS0 [15]. Расчет ΔH0 производился графическим способом по уравнению изобары в координатах ln Kc – 1/T (рис. 7):
Рис. 7.
Логарифмическая зависимость констант равновесия реакции адсорбции фторид-ионов от обратной температуры.
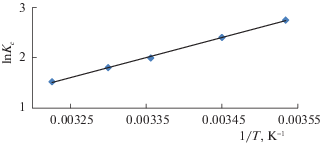
Энтальпия адсорбции определялась по данным рис. 7:
Изменение свободной энергии Гиббса рассчитывали по формуле Гиббса–Гельмгольца:
Определив ΔG0 и ΔH0, рассчитали энтропию процесса адсорбции ΔS0:
Результаты расчетов сведены в табл. 2.
Таблица 2.
Термодинамические параметры адсорбции фторид-ионов
| Т, K | Kс | ΔH0, кДж/моль | –ΔG0, кДж/моль | –ΔS0, Дж/(моль K) |
|---|---|---|---|---|
| 283 | 15.67 | –33.53 | 6.47 | 95.62 |
| 298 | 7.33 | 4.93 | 95.97 | |
| 310 | 4.55 | 3.87 | 95.69 |
Из полученных данных следует, что адсорбция фторид-ионов эффективно протекает при пониженных температурах, процесс экзотермический. Отрицательная величина энтропии указывает на то, что в ходе процесса адсорбции образуется комплекс AlF$_{6}^{{3 - }}$, в котором система более упорядоченная, ион металла находится в растворе. Незначительные отличия энтропии адсорбции фторид-ионов могут указывать на то, что адсорбционный комплекс имеет одно и то же строение.
ЗАКЛЮЧЕНИЕ
Показано, что адсорбция фторид-ионов – процесс экзотермический и эффективно протекает при пониженных температурах. Оптимальная продолжительность адсорбции составляет 60 мин, а ее изотерма проявляет склонность к линеаризации в координатах Ленгмюра, коэффициент достоверности аппроксимации имеет достаточно высокое значение (99.9). Адсорбция фторид-ионов протекает по реакции первого порядка. Энергия активации процесса десорбции выше энергии активации процесса адсорбции, что характерно для ионной адсорбции. В ходе процесса выявлено, что образуется комплекс AlF$_{6}^{{3 - }}$, на это указывает отрицательная величина энтропии. Незначительные отличия энтропии адсорбции фторид-ионов могут указывать на то, что адсорбционный комплекс имеет одно и то же строение.
Список литературы
World Heaith Organization. Guidelines for Drinking-Water Quality: Recommendations. World Health Organization. Geneva, Switzerland, 2004. 540 p.
Spittle B. // Fluoride. 2019. V. 52. P. 7.
Nayak B.B., Roy M.M., Das B. et al. // Clinic. Toxicol. 2009. V. 47. P. 292. https://doi.org/10.1080/15563650802660349
Mondal P., George S. A Review on Adsorbents Used for Defluoridation of Drinking Water// Reviews in Environmental Science and Bio/Technology. 2014. V. 14. № 2. P. 195. https://doi.org/10.1007/s11157-014-9356-0
Ma Z., Zhang Q., Weng X. et al. // J. Water Reuse and Desalin. 2018. V. 8. P. 479. https://doi.org/10.2166/wrd.2017.037
Sabu U., Rashad M., Logesh G. et al. // Ceramics Int. 2018. V. 44. P. 4615. https://doi.org/10.1016/j.ceramint.2017.11.173
Yang C., Gao L., Wang Y. et al. // Micropor. Mesopor. Mat. 2014. V. 197. P. 156. https://doi.org/10.1016/j.micromeso.2014.06.010
Yami T.L., Du J., Brunson L.R. et al. // Int. J. Life Cycle Ass. 2015. V. 20. P. 1277. https://doi.org/10.1007/s11367-015-0920-9
Nishchev K.N., Novopoltsev M.I., Ruzavina N.A. et al. // Proc. 14th International Baltic Conference on Atomic Layer Deposition, BALD 2016–24 March. 2017. P. 13–14; 14th International Baltic Conference on Atomic Layer Deposition, BALD 2016. St. Petersburg; Russian Federation; 2–4 October 2016. https://doi.org/10.1109/BALD.2016.7886524
Малыгин А.А. // Рос. нанотехнологии. 2007. Т. 2. № 3. С. 87.
Maranescu B., Lupa L., Visa A. // Appl. Surf. Sci. 2019. V. 481. P. 83. https://doi.org/10.1016/j.apsusc.2019.03.067
Ординарцев Д.П., Свиридов А.В., Свиридов В.В. // Вестн. ЮУрГУ. Сер. “Металлургия”. 2016. Т. 16. № 2. С. 14. https://doi.org/10.14529/met160202
Subramani B.S., Shrihari S., Manu B., Babunarayan K.S. // J. Environ. Manage. 2019. V. 246. P. 345. https://doi.org/10.1016/j.jenvman.2019.04.122
Darezereshki E., Darban A. Khodadadi, Abdollahy M., Jamshidi-Zanjani A. // Environ. Nanotechnol. Monit. Manage. 2018. V. 10. P. 51. https://doi.org/10.1016/j.enmm.2018.04.002
Baghdadi M., Ghaffari E., Aminzadeh B. // J. Environ. Chem. Eng. 2016. V. 4. P. 3309. https://doi.org/10.1016/j.jece.2016.06.034
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии





