Журнал физической химии, 2020, T. 94, № 10, стр. 1539-1546
Квантово-размерный эффект в биметаллических наночастицах, полученных термолизом твердых растворов солей малеиновой кислоты Co(II), Ni(II), Zn(II)
Л. И. Юданова a, *, В. А. Логвиненко a, b, А. В. Ищенко b, c, Н. А. Рудина b
a Российская академия наук, Сибирское отделение, Институт неорганической химии им. А.В. Николаева
Новосибирск, Россия
b Новосибирский государственный университет
Новосибирск, Россия
c Российская академия наук, Сибирское отделение, Институт катализа им. Г.К. Борескова
Новосибирск, Россия
* E-mail: judanova@niic.nsc.ru
Поступила в редакцию 08.11.2019
После доработки 05.03.2020
Принята к публикации 17.03.2020
Аннотация
Проведено сравнение рентгенофазовых и термоаналитических характеристик твердых растворов состава [(CoxNi1 – x)(H2O)4(C4H3O4)2], [(CoxZn1 – x)(H2O)4(C4H3O4)2], [(NixZn1 – x)(H2O)4(C4H3O4)2] (0 < x < 1). Процесс разложения твердых растворов, как и компонентов их составляющих, при нагревании до 500°C в токе He условно разделен на три стадии. Установлено, что продуктами термолиза твердых растворов являются биметаллические наночастицы Co/Ni, Co/ZnO, Ni/Zn соответственно, внедренные в полимерную матрицу композитов. Показано, что распад твердых растворов при термическом разложении на кривой Кюри при фазовом переходе II рода с образованием двухфазной области, обнаруженный в биметаллических наночастицах Co/Ni, – квантово-размерный эффект. Разложение твердого раствора [(Co0.1Zn0.9)(H2O)4(С4H3O4)2] приводит к выделению атомов Co (d = 2.5 Å), внедренных в каналы структуры ZnO, которые выступают катализатором роста “нанощетки” углеродных нанотрубок (УНТ) на поверхности композита при температуре ≤500°C, что также является следствием квантово-размерного эффекта. Сделан вывод, что использование подобного катализатора при выращивании УНТ может привести к значительному снижению энергоемкости процесса.
Создание новых конструкционных материалов, содержащих металлические и биметаллические наноразмерные частицы (НРЧ), которые могут применяться, в частности, для эффективной защиты от электромагнитного излучения, в том числе и биологических объектов, в катализе, для создания конденсированного металлизированного топлива, требует разработки новых способов получения, как индивидуальных частиц, так и композитов, содержащих НРЧ металлов [1–5].
Эффективный способ получения НРЧ – термическое разложение солей карбоновых непредельных (акриловой, малеиновой) и ароматических (орто- и терефталевой) кислот переходных металлов Fe(II), Co(II), Ni(II), Cu(II) и Zn(II). В качестве примера можно привести термическое разложение в токе He при нагревании до 500°C солей малеиновой [M(H2O)n(С4H2O4)](H2O)m (n = = 1, 2; m = 0, 1), [M(H2O)4(С4H3O4)2] (M = Fe(II), Co(II), Ni(II), Cu(II), Zn(II)) и орто-фталевой [M(H2O)n(С8H4O4)](H2O)m (n = 1, 2; m = 0–2); [M(H2O)6(С8H5O4)2] (M = Fe(II), Co(II), Ni(II)), [Cu(H2O)2(С8H5O4)2] кислот [1, 4, 6, 7].
Средний размер наночастиц металлов, полученных термическим разложением малеатов или орто-фталатов переходных металлов, внедренных в полимерную матрицу и находящихся дополнительно в полимерной или графеновой оболочке композитов, увеличивается от 3.5 до 5 нм (Co) и от 4.5 до 7 нм (Ni) при переходе от малеатов ко фталатам. При термолизе соединений меди в полимерную матрицу композитов внедрены сферические конгломераты (50–200 нм), содержащие сферические НРЧ меди без оболочки, средний размер которых увеличивается от 7.5 до 50 нм. Диаметр металлических НРЧ Fe, вокруг которых наблюдается некоторое уплотнение полимерной матрицы, при переходе от малеата ко фталату изменяется от 150 до 175 нм [6]. При термолизе малеатов Zn(II) обнаружена оксидная фаза, восстановление которой до металла начинается при 675°C. НРЧ ZnO овальной формы размером 13.5 × 40 нм внедрены в полимерную матрицу [7].
Поскольку размер металлических НРЧ, полученных разложением малеатов переходных металлов, меньше, чем аналогичных орто-фталатов, предпочтительнее выбрать их в качестве прекурсоров при синтезе наночастиц. Термическое разложение твердых растворов в системах кислых малеатов Fe(II), Co(II) и Ni(II) приводит к образованию биметаллических НРЧ, внедренных в полимерную матрицу композитов. Например, термолизом твердых растворов в системе кислых малеатов Co(II)–Ni(II) получены наночастицы Co/Ni, диаметр которых не превышает 25 нм [8].
На примере этой системы показано, что в биметаллических НРЧ возможно проявление квантово-размерного эффекта, связанного с квантованием энергии носителей заряда. Наличие такого эффекта возможно, когда один из геометрических размеров частиц становится соизмеримым с длиной волны де Бройля электронов (λ = 1.67 × 10–10 м = 0.167 нм) [9–11].
Цель настоящей работы – изучение изменения термодинамических и кинетических характеристик вследствие квантово-размерного эффекта в биметаллических наночастицах, полученных термическим разложением твердых растворов в системах кислых малеатов: Co(II)–Ni(II), Co(II)–Zn(II), Ni(II)–Zn(II).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы твердых растворов в бинарных системах кислых солей 1) Co(II)–Ni(II); 2) Co(II)–Zn(II); 3) Ni(II)–Zn(II) получали методом кристаллизации из водных растворов [9] во всем концентрационном интервале с шагом изменения содержания компонентов 10 мол. %. Выход продуктов составил 90–95%. Определение содержания металлов в твердых растворах проводили методами комплексонометрического титрования и атомно-абсорбционным на АА-спектрофотометре Z-8000. Элементный анализ на содержание углерода и водорода выполняли на CHN-анализаторе (серия Euro EA 3000) на образцах выборочно. При точности определения в обоих случаях ±0.5 мас. % соотношение элементов в этих образцах соответствует расчетному. Состав твердых растворов отвечает формулам [(CoxNi1 – x)(H2O)4(С4H3O4)2], [(CoxZn1 – x)(H2O)4(С4H3O4)2], [(NixZn1 – x)(H2O)4 (С4H3O4)2] (0 < x < 1).
Изучение термического разложения образцов твердых растворов проводили в токе He (60 см3/мин) на С-дериватографе (МОМ, Венгрия) методами: термогравиметрического (ТГ), дифференциально-термического (ДТА) и дифференциально-термогравиметрического (ДТГ) анализа. Нагревание образцов состава [(CoxNi1 – x)(H2O)4 (С4H3O4)2] осуществляли до температур 500, 850 и 1200°C, [(CoxZn1 – x)(H2O)4(С4H3O4)2] и [(NixZn1 – x) (H2O)4(С4H3O4)2] – до 500 и 800°C (точность измерения температуры ±10 K) при скорости нагрева 2 K/мин. Массу образцов изменяли от 20 до 50 мг при точности определения потери массы – ±0.1% (в соответствии с паспортом дериватографа).
Рентгенографическое исследование твердых растворов, а также продуктов их термического разложения на различных стадиях этого процесса проводили на дифрактометрах ДРОН-УМ1, Shimadzu XRD-7000 (CuKα-излучение, Ni-фильтр, комнатная температура).
Композиты, полученные при термическом разложении твердых растворов, исследовали методом электронной сканирующей микроскопии (СЭМ) на электронном микроскопе JSM-6460LV (JEOL-Япония) и методом просвечивающей электронной микроскопии высокого разрешения (ПЭМ) на электронном микроскопе JEM-2010 (JEOL, Япония) с ускоряющим напряжением 200 кВ и разрешением по решетке 1.4 Å. Обработку проводили в программе DigitalMicrograph (Gatan) методом фурье-анализа (FFT) с выявлением периодического мотива изображения кристаллической структуры.
Энергодисперсионный рентгеновский микроанализ элементного состава образцов (ЭДРМА) проводили на спектрометре “Phoenix” с Si(Li) детектором и разрешением по энергии ∼130 эВ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
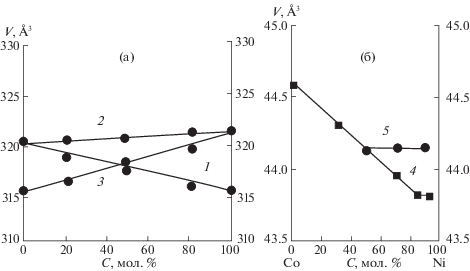
Предварительным этапом изучения процесса термического разложения служил синтез твердых растворов в системах кислых малеатов: Co(II)–Ni(II) (I), Co(II)–Zn(II) (II), Ni(II)–Zn(II) (III). Кислые малеаты состава [M(H2O)4(С4H3O4)2] (M = Co(II), Ni(II), Zn(II)), являющиеся компонентами в этих системах, кристаллизуются в триклинной сингонии (пр. гр. P$\bar {1}$, Z = 1). В данной работе установлено образование непрерывного ряда однофазных твердых растворов замещения одного катиона на другой в системах: [(CoxZn1 – x) (H2O)4(С4H3O4)2], [(NixZn1 – x)(H2O)4(С4H3O4)2] (0 < x < 1), как и в изученной ранее системе [(CoxNi1 – x)(H2O)4(С4H3O4)2] [8]. Подтверждением служит линейная зависимость (правило Ретгерса) изменения объемов элементарных ячеек от состава: Vx = xV1 + (1 – x)V2, где V1 и V2 – объемы ячеек исходных компонентов (рис. 1а).
Рис. 1.
Зависимости изменения объема элементарной ячейки твердых растворов [(CoxNi1 – x)(H2O)4(С4H3O4)2] (1), [(CoxZn1 – x)(H2O)4(С4H3O4)2] (2), [(NixZn1 – x)(H2O)4(С4H3O4)2] (3) при комнатной температуре (а) и Cox/Ni1 – x в биметаллических НРЧ при температурах 500 (4) и 850°C (5) (б) от состава.
Процесс термического разложения твердых растворов, как и составляющих их компонентов, условно можно разделить на три стадии. Показано, что кинетически менее устойчивый компонент твердого раствора снижает его температуру разложения (рис. 2). Например, если на третьей стадии температура начала декарбоксилирования кислых малеатов [M(H2O)4(С4H3O4)2] уменьшается в ряду: Zn (375°C) > Co (350°C) > Ni (300°C), то в ряду твердых растворов состава [(CoxZn1 – x) (H2O)4(С4H3O4)2], [(CoxNi1 – x)(H2O)4(С4H3O4)2], [(NixZn1 – x)(H2O)4(С4H3O4)2] (x = 0.5) температура начала разложения также уменьшается и составляет 365, 320 и 315°C соответственно.
Рис. 2.
Термогравиметрические кривые процесса разложения твердых растворов [(CoxNi1 – x)(H2O)4(С4H3O4)2] (1), [(CoxZn1 – x)(H2O)4(С4H3O4)2] (2), [(NixZn1 – x)(H2O)4(С4H3O4)2] (3) (0 ≤ x ≤ 1).

Дегидратация в образцах твердых растворов, как и в кислых малеатах Co(II), Ni(II), Zn(II), проходит в две ступени, на каждой из которых отщепляются по две молекулы воды. На второй стадии разложения всех твердых растворов происходит элиминирование половины бималеат-анионов. В качестве примера показано, что потеря массы, рассчитанная по кривой ТГ при разложении твердых растворов [(CoxZn1 – x)(H2O)4 (С4H3O4)2], [(CoxNi1–)(H2O)4(С4H3O4)2], [(NixZn1 – x) (H2O)4(С4H3O4)2] (x = 0.5), составляет 30.5, 30.8 и 30.7% и практически равна расчетной (31.6, 31.9 и 31.6% соответственно).
На третьей стадии декарбоксилирования процессы разложения твердых растворов кардинально отличаются. Можно указать две причины такого различия. По-видимому, одна из причин при термолизе [(CoxZn1 – x)(H2O)4(С4H3O4)2] и [(NixZn1 – x)(H2O)4(С4H3O4)2] (0 < x < 1) – изомеризация цис-формы (малеата) в транс- (фумарат), которая сопровождаетя экзотермическим эффектом на кривых ДТА. Подобный эффект обнаружен при нагревании малеатов Zn(II) в токе He и в вакууме [7, 12]. В то же время на кривых ДТА твердого раствора [(CoxNi1 – x)(H2O)4(С4H3O4)2], как и составляющих его компонентов, такой эффект отсутствует. Вторая причина может быть связана с кинетическими характеристиками процесса. Косвенное подтверждение этого, как показано в [13], – отличие в составе и строении биметаллических НРЧ. Продуктами разложения твердых растворов [(CoxNi1 – x)(H2O)4(С4H3O4)2] и [(NixZn1 – x)(H2O)4(С4H3O4)2] являются наночастицы Co/Ni или Ni/Zn соответственно. Тогда как как при разложении твердого раствора [(CoxZn1 – x)(H2O)4(С4H3O4)2] образуются биметаллические НРЧ (Co\ZnO) и металлические Co.
Следует отметить корреляцию термогравиметрических характеристик процесса разложения твердых растворов состава [(CoxNi1 – x)(H2O)4 (С4H3O4)2] (I), [(CoxZn1 – x)(H2O)4(С4H3O4)2] (II), [(NixZn1 – x)(H2O)4(С4H3O4)2] (III) с результатами исследования строения и состава НРЧ, полученных их термолизом.
Методом РФА установлено, что наночастицы Cox/Ni1 – x, полученные разложением системы I, являются твердыми растворами, кристаллизующимися в структуре с гранецентрированной кубической (ГЦК) решеткой (пр. гр. Fm$\bar {3}$m, Z = 4), как и компоненты, а именно, металлические β-Co и Ni – их составляющие.
При элементном анализе композитов, полученных разложением твердых растворов в системе I при x = 0.1, 0.5 и 0.9, соответственно, найдено, %: C 28.0, 29.5, 30.7; H 1.0, 1.3, 1.7; Co 7.0, 34.85, 60,3; Ni 64.0, 34.3, 7.0. Рассчитанное (по остатку) количество кислорода указывает на его отсутствие в первом образце и присутствие в виде примеси во втором и третьем: 0.05 и 0.1%.
Зависимости изменения объема (V) элементарной ячейки от значения x в твердых растворах Cox/Ni1 – x (0 < x < 1) в биметаллических НРЧ, получаемых разложением образцов в системе I, имеют перегиб, свидетельствующий о распаде твердых растворов (правило Ретгерса). При нагревании образцов до 500°C распад происходит при x = 0.12, до 850°C – при x = 0.5 (рис. 1б). Температура точек распада соответствует температуре Кюри для этого состава (согласно фазовой диаграмме системы Co–Ni [14]).
Методом ПЭМ установлено, что при нагревании образцов до 500°C средний размер наночастиц составляет 15 нм, до 850°C – 25 нм, до 1200°C – 250 нм (рис. 3). НРЧ внедрены в полимерную матрицу и дополнительно находятся в графитизированной оболочке.
Рис. 3.
ПЭМ-изображение и рентгеновский спектр композита, полученного разложением твердого раствора состава [(Co0.5Ni0.5)(H2O)4(С4H3O4)2] при нагревании до 1200°C.

Можно предположить, что в структуре твердых растворов Cox/Ni1 – x ниже точки Кюри атомы кобальта и никеля располагаются в узлах решетки упорядоченно, выше точки Кюри – хаотично. Перестройка атомов в структуре сопровождается сдвигом кристаллической решетки, который приводит к замене всех атомов Co на Ni и наоборот. Уменьшение размеров частиц кобальта и никеля сопровождается увеличением вектора сдвига и образованием двух независимых решеток, в результате чего происходит распад твердых растворов. Существование двухфазной области, обнаруженной в твердых растворах Cox/Ni1 – x (0 < x < 1) выше температуры Кюри, по-видимому, является следствием квантово-размерного эффекта.
Образование двух видов CNx-нанотрубок с диаметром и толщиной стенок 15–30 нм и 5–7 нм или 60–90 нм и 20–35 нм [15] соответственно при выращивании их методом CVD с использованием в качестве катализатора биметаллических частиц состава Co0.5Ni0.5, получаемых разложением твердого раствора в системе I с таким же соотношением компонентов, также можно объяснить проявлением квантово-размерного эффекта.
В композитах, полученных разложением твердых растворов в системе II (x = 0.1, 0.7, 0.8, 0.9), найдено, %: C 28.8, 37.1, 38.3, 39.3; H 1.6, 1.9, 2.2, 2.2; Co 5.8, 38.5, 44.3, 50.6; Zn 51.8, 18.0, 12.3, 6.2. Рассчитанное количество кислорода в твердых продуктах указывает на наличие в них оксида цинка. При термолизе образцов с таким же соотношением компонентов в системе III в композитах найдено, %: C 31.1, 30.8, 30.8, 30.6; H 1.0, 1.0, 1.0, 1.0; Ni 6.2, 46.2, 53.5, 60.9; Zn 61.7, 22.0, 14.9, 7.5. Кислород в образцах не обнаружен. Оксид цинка отсутствует также [7].
На дифрактограммах композитов, полученных разложением образцов [(CoxZn1 – x)(H2O)4(С4H3O4)2] (x = 0.1, 0.7 и 0.9) при нагревании до 500°C, обнаружены рефлексы двух фаз: β-модификации Co с кубической гранецентрированной решеткой (пр. гр. Fm$\bar {3}$m, Z = 4, a = = 3.544(3) Å), интенсивность которых уменьшается по мере возрастания x, и оксида Zn, кристаллизующегося в гексагональной структуре типа вюрцита (пр. гр. P63mc, Z = 2, a = 3.250(3) Å, c = = 5.207(3) Å).
В полимерную матрицу композита, полученного разложением твердого раствора состава [(Co0.1Zn0.9)(H2O)4(С4H3O4)2], внедрены, в основном, кобальт-цинковые НРЧ размером 15 × 40 нм (равным размеру частиц ZnO при термолизе [Zn(H2O)4(С4H3O4)2] [7]) с незначительной примесью наночастиц металлического Co диаметром 3–5 нм, дополнительно находящихся в полимерной оболочке с неупорядоченными слоями. При сравнении микрофотографий композитов видно, что размер наночастиц, как (Co\ZnO), так и Co практически не изменяется во всем интервале концентраций (0.1 ≤ x ≤ 0.9) (рис. 4, 5). Полимерная оболочка вокруг НРЧ, как (Co\ZnO), так и ZnO отсутствует.
Рис. 4.
Микрофотографии и рентгеновский спектр композита, полученного разложением [(Co0.9 Zn0.1)(H2O)4(С4H3O4)2] при нагревании до 500°C.

Рис. 5.
Микрофотографии и рентгеновский спектр композита, полученного разложением [(Co0.7Zn0.3)(H2O)4(С4H3O4)2] при нагревании до 500°C.

В [7] показано, что атомы Co, внедренные в матрицу ZnO, полученные разложением [(Co0.1Zn0.9)(H2O)4(С4H3O4)2], служат катализаторами самопроизвольного роста “нанощетки”, из однородных углеродных трубок, что является следствием квантово-размерного эффекта. На поверхности композитов, полученных разложением твердых растворов при x = 0.7, 0.8 и 0.9, видны отдельные углеродные волокна, “нанощетка” из углеродных трубок не наблюдается. Объяснение можно найти в том, что в этом случае каналы структуры ZnO со встроенными цепочками атомов Co, которые служат катализаторами роста “нанощетки”, перекрыты НРЧ металического кобальта.
В образцах, полученных разложением твердых растворов в системе III, присутствует только биметаллическая фаза NixZn1 – x, состав и строение которой достаточно сложны, что хорошо согласуется с результатами исследования фазовой диаграммы системы металлов [14]. В [7] показано, что дифрактограмма биметаллической фазы состава (Ni0.1Zn0.9), полученная разложением твердого раствора кислых малеатов с таким же соотношением металлов, может быть проиндицирована в рамках моноклинной структуры (пр. гр. C2/m, Z = 2). Тогда как на дифрактограммах фаз состава NixZn1 – x (0.72 < x < 1) присутствуют рефлексы твердых растворов замещения на основе гранецентрированной кубической (ГЦК) решетки металлического никеля (пр. гр. Fm$\bar {3}$m, Z = 4, aNi = a =3.525(3) Å).
Методом ПЭМ установлено, что биметаллические НРЧ состава (Ni0.1Zn0.9), имеющие овальную форму с размерами 50–120 × 150–300 нм, внедрены в полимерную матрицу композита. Средний диаметр сферических наночастиц NixZn1 – x (x = 0.9 и 0.8), увеличивается от 6.5 до 10 нм соответственно. Частицы внедрены в полимерную матрицу композитов, вокруг них видны углеродные слои, по морфологии близкие к графеновым, количество которых изменяется от 3 до 8 [7]. (Для сравнения средний диаметр НРЧ никеля, полученных разложением [Ni(H2O)4(С4H3O4)2] – 4.5 нм, вокруг каждой частицы находится от двух до пяти графеновых слоев.)
Следует отметить, что образование биметаллических НРЧ NixZn1 – x при термолизе твердых растворов в системе III заканчивается до температуры 420°C. При термическом разложении кислого малеата [Zn(H2O)4(С4H3O4)2] восстановление образующейся первоначально оксидной фазы до Zn при нагревании в атмосфере He происходит в интервале температур 675–740°C.
Методом ЭДРМА в спектре композита, полученного разложением твердого раствора состава [(Co0.5Ni0.5)(H2O)4(С4H3O4)2], обнаружены, в основном, рефлексы CK, CoL, CoK, NiL, NiK. Присутствие слабых рефлексов OK может быть связано, как с наличием примеси оксидов Co, образующихся при распаде твердых растворов металлов, так и с окислением углеродных групп, находящихся на поверхности полимерной матрицы (рис. 3).
При термолизе [(CoxZn1 – x)(H2O)4(С4H3O4)2] (x = 0.1, 0.7, 0.9) в спектрах композитов обнаружены рефлексы CK, CoL, CoK, ZnL, ZnK и OK, интенсивность последних возрастает при уменьшении x (рис. 4, 5).
В рентгеновских спектрах композитов, полученных разложением [(NixZn1 – x)(H2O)4(С4H3O4)2] (x = 0.1, 0.8, 0.9), присутствуют рефлексы CK, NiL, NiK, ZnL, ZnK. Обнаруженные в спектрах всех композитов линии CuL, CuK относятся к медной подложке, на которую нанесены образцы.
Исследование проявления квантово-размерного эффекта в биметаллических наночастицах при термолизе твердых растворов солей малеиновой кислоты Co(II), Ni(II), Zn(II) позволяет предложить новый способ синтеза однородных углеродных нанотрубок с использованием в качестве катализатора атомов Co (d = 2.50 Å), внедренных в каналы структуры ZnO и полученных разложением [(Co0.1Zn0.9)(H2O)4(С4H3O4)2]. Использование подобного катализатора может привести к значительному снижению энергоемкости процесса, поскольку синтез заканчивается до температуры 500°C, что на 350°C ниже, чем при выращивании углеродных азотсодержащих CNx-нанотрубок методом CVD с использованием в качестве катализатора НРЧ Co, полученных разложением кислого малеата [Co(H2O)4(С4H3O4)2] [15].
Авторы выражают глубокую благодарность Н.Ф. Бейзель, А.П. Зубаревой и О.С. Кощеевой – за проведение элементного анализа.
Список литературы
Pomogailo A.D., Kestelman V.N. Metallopolymer Nanocomposites. Berlin, Heidelberg, New York: Springer, 2005. 564 p.
Фионов А.С. // Автореф. дис. … канд. хим. наук. М.: Ин-т металлургии и материаловедения РАН, 2011. 24 с.
Nanoparticles and Catalysis / Ed. by D. Astruc. Weinheim: Wiley – VCH Verlag, 2008. 398 p.
Помогайло А.Д., Джардималиева Г.И. Металлополимерные гибридные нанокомпозиты. М.: Наука, 2015. 494 с.
Федоров А.В., Шульгин А.В. Моделирование физических и химических превращений в микро- и наночастицах металлов. Новосибирск: Изд-во НГТУ, 2017. 268 с.
Юданова Л.И., Логвиненко В.А., Шелудякова Л.А. и др. // Журн. физ. химии. 2019. Т. 93. № 7. С. 1053.
Юданова Л.И., Логвиненко В.А., Корольков И.В. и др. // Там же. 2018. Т. 92. № 11. С. 1753.
Юданова Л.И., Логвиненко В.А., Шелудякова Л.А. и др. // Там же. 2017. Т. 91. № 1. С. 136.
Физическая энциклопедия. Т. 2. Главный редактор А.М. Прохоров. М.: Сов. энциклопедия, 1990. С. 324–329.
Васильев Р.Б., Дирин Д.Н. Квантовые точки: синтез, свойства, применение. М.: Изд-во МГУ, 2007. 50 с.
Chou Fang-Cheng // Appl. Phys. Rev. 2019. V. 6. P. 011304; https://doi.org/10.1063/1.5066031
Весновский Б.П. // Журн. неорган. химии. 1976. Т. 21. № 10. С. 2651.
Юданова Л.И., Логвиненко В.А., Шелудякова Л.А. и др. // Коорд. химия. 2017. Т. 43. № 7. С. 421.
Диаграммы состояния двойных металлических систем: справочник (Под общей ред. Н.П. Лякишева) Co–Ni. М.: Машиностроение, 1997. Т. 2. С. 283–284. Ni–Zn. М.: Машиностроение, 2001. Т. 3. Кн. 1. С. 669–671.
Kudashov A.G., Okotrub A.V., Bulusheva L.G. et al. // J. Phys. Chem. B. 2004. V. 108. P. 9048.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


