Журнал физической химии, 2020, T. 94, № 10, стр. 1552-1560
Гидродинамический диаметр наночастиц серебра в растворах неионных ПАВ
П. С. Поповецкий a, *, А. Н. Колодин a
a Российская академия наук, Сибирское отделение, Институт неорганической химии им. А.В. Николаева
630090 Новосибирск, Россия
* E-mail: popovetskiy@niic.nsc.ru
Поступила в редакцию 12.11.2019
После доработки 13.03.2020
Принята к публикации 17.03.2020
Аннотация
Исследованы зависимости ряда физико-химических характеристик наночастиц серебра известного размера от концентрации неионных поверхностно-активных веществ и от концентрации металла. Использованы поверхностно-активные вещества, образующие мицеллы разного размера и с разной интенсивностью рассеяния света. Показано, что поверхностное натяжение и адгезионные свойства растворов неионных поверхностно-активных веществ определяются растворителем в диапазоне концентраций до 1 моль/л. С привлечением методов спектрофотометрии и вискозиметрии предложен подход, позволяющий определить наиболее вероятные причины, вызывающие расхождения в величине гидродинамического диаметра наночастиц в растворах неионных поверхностно-активных веществ и фактического диаметра наночастицы.
Наночастицы – один из наиболее популярных объектов современных научных исследований. Области их возможных применений крайне широки: от электроники [1, 2] до медицины [3, 4]. Для практических целей зачастую более важны не сами размеры нанообъектов, а высокая степень их монодисперсности, так как в случае узкого распределения частиц по размеру можно добиться предсказуемых и воспроизводимых свойств [5, 6]. Когда речь идет о получении наночастиц с высокой степенью монодисперсности, на первый план выходят методы “мокрой” химии, а именно синтез наночастиц в жидкой (в том числе и органической) среде с использованием стабилизаторов, в частности молекул поверхностно-активных веществ (ПАВ) [7]. Этот метод известен как способ “снизу–вверх”, т.е. от атомов или молекул к наночастицам; при таком подходе используемые в качестве нанореакторов мицеллы ПАВ имеют близкие числа агрегации и практически одинаковый размер, благодаря чему наночастицы, полученные с их помощью, также близки по размеру [8, 9].
Один из наиболее важных параметров наночастиц в жидких средах, влияющий, в том числе и на их стабильность, – гидродинамический диаметр, определяемый как размером самой наночастицы (обычно определяется микроскопическими методами), так и толщиной ее адсорбционного слоя (может быть определен сопоставлением данных электронной микроскопии и динамического рассеяния света) [10, 11]. Толщина адсорбционного слоя напрямую определяет устойчивость наночастиц к агломерации – чем толще адсорбционный слой наночастиц, тем сложнее им сблизиться на достаточное расстояние для формирования стабильных агрегатов. Однако корректное определение гидродинамического диаметра наночастиц на фоне мицелл ПАВ, не содержащих наночастицу, – нетривиальная задача [12]. Обусловлено это значительным (до 6 порядков) численным избытком мицелл без наночастицы по сравнению с наночастицами. В наших предыдущих работах предложен подход, позволяющий методом динамического рассеяния света в рамках моно- и полимодального анализов автокорреляционной функции корректно определять эффективный гидродинамический диаметр [13] и исследовать структуру адсорбционного слоя наночастиц серебра в обратных микроэмульсиях бис-2-(этилгексил)сульфосукцината натрия (АОТ) в н-декане [14]. Подход основан на выделении жидкого электрофоретического концентрата наночастиц [15, 16] и создании на его основе модельных систем с различным соотношением концентраций наночастиц и “пустых” мицелл. Наночастицы при этом выступают в качестве своего рода “стандарта” размера, что позволяет корректно определять толщину их адсорбционного слоя, разумеется, при отсутствии их агломерации.
Тем не менее, в вопросах строения адсорбционного слоя наночастиц в растворах ПАВ есть много белых пятен. Расхождения значений фактического размера наночастиц и их гидродинамического диаметра в растворах ПАВ, особенно в случае высоких концентраций, могут быть значительны. Эти расхождения были изучены нами для случая анионного АОТ [14]. Мы связали их с электростатическим взаимодействием наночастиц и заряженных мицелл АОТ (заряд мицелл АОТ обусловлен флуктуационными явлениями и связан с ионной природой этого ПАВ [17]). В случае же неионных ПАВ в неполярной среде наличие электростатических взаимодействий маловероятно. Но это вовсе не означает, что гидродинамический диаметр и фактический размер наночастиц будут совпадать. Растворы ПАВ, особенно с высокой концентрацией, как правило, весьма вязкие. В случае достаточно крупных наночастиц в растворах ПАВ под вязкостью следует понимать вязкость не растворителя, а среды, в которой частица совершает броуновское движение. Для их характеристики вводится понятие “микровязкость” [18, 19]. Обычно эффект микровязкости проявляется в полидисперсных системах сильно различающихся по размеру частиц. Для близких по размеру частиц он обычно не учитывается, что может быть не всегда оправдано.
С учетом того, что при использовании разных неионных ПАВ для синтеза наночастиц затруднительно подобрать условия таким образом, чтобы полученные наночастицы обладали одинаковым размером, а определение реального размера металлического ядра наночастицы микроскопическими методами в таких системах затруднительно по причине большого количества ПАВ, оценка толщины адсорбционного слоя наночастиц в растворах неионных ПАВ представляет весьма нетривиальную задачу. Наиболее заметно важность контроля гидродинамического диаметра наночастиц и толщины их адсорбционного слоя проявляется при их использовании в печатных технологиях получения функциональных материалов. Если увеличение гидродинамического диаметра обусловлено агломерацией наночастиц, то такие агломераты могут приводить к засорению печатной головки принтера, что в свою очередь может негативно повлиять на его работоспособность и качество печати [20, 21]. Если же увеличение гидродинамического диаметра обусловлено утолщением адсорбционного слоя наночастиц, состоящего из более “мягких” и лабильных молекул ПАВ, последствия для печатного оборудования будут менее плачевными.
Цель данной работы – характеризация растворов н-ПАВ, содержащих наночастицы серебра известного размера. Растворы н-ПАВ были предварительно охарактеризованы набором физико-химических методов (были определены гидродинамический диаметр и интенсивность светорассеяния мицелл, поверхностное натяжение, объем капли, краевые углы, работа адгезии растворов – также важных параметров при их использовании в печатных технологиях). Особое внимание в данной работе уделено исследованию зависимости гидродинамического диаметра наночастиц от концентрации н-ПАВ и оценке влияния различных эффектов (увеличения вязкости раствора, возможной агломерации наночастиц) на полученные результаты. Кроме того, в некоторых случаях также варьировалась концентрация металла для оценки корректности определения гидродинамического диаметра наночастиц.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Реактивы
Использовали следующие реактивы: растворитель – н-декан (99%), исходные вещества для синтеза наночастиц – нитрат серебра (“х. ч.”) и аскорбиновая кислота (фарм.). В качестве мицеллообразующего ПАВ для синтеза наночастиц использовали АОТ (производства Sigma Aldrich, заявленное содержание основного компонента не менее 97%). Для исследования изменений гидродинамического диаметра наночастиц использовали распространенные маслорастворимые н‑ПАВ – Span 80 (сорбитан моноолеат, производство Sigma Aldrich) и оксиэтилированные Brij 30 и Tergitol NP4 (додеканол и п-нонилфенол со средней степенью оксиэтилированния 4, производство Sigma Aldrich и Dow Chemical соответственно). Все реактивы использовали без дополнительной очистки.
Выбор ПАВ обусловлен следующими причинами: для синтеза наночастиц был выбран АОТ – один из наиболее изученных ионных маслорастворимых ПАВ. В наших предыдущих работах с помощью методики электрофоретического концентрирования были получены стабильные органозоли, содержащие наночастицы серебра в достаточной для определения гидродинамического диаметра концентрации, при том, что концентрация АОТ была ниже ККМ [14]. Для таких органозолей было показано, что адсорбционный слой наночастиц состоит именно из монослоя АОТ: результаты определения гидродинамического диаметра наночастиц и размера их металлического ядра совпадали с учетом удвоенной длины молекулы АОТ. Подобные системы удобно использовать в качестве стандарта частиц малого размера.
Неионные ПАВ подбирали таким образом, чтобы их характеристики, такие как размер мицелл и интенсивность светорассеяния, значительно различались. Brij 30 формирует мицеллы наименьшего размера с самой низкой интенсивностью светорассеяния, а Tergitol NP4, напротив, – самые крупные и наиболее интенсивно рассеивающие свет мицеллы, Span 80 занимает промежуточное положение. Кроме того, данные ПАВ коммерчески доступны и хорошо изучены.
Оборудование
Эффективный гидродинамический диаметр частиц определяли на спектрометре динамического рассеяния света Nanobrook Omni (Brookhaven, США) с использованием мономодального анализа по методу куммулянтов и полимодального анализа при помощи алгоритма Non-Negatively Constrained Least Squares, NNLS. В работе, как правило, приводятся только данные полимодального анализа ввиду большей информативности. В случае наличия только одной моды данные полимодального и мономодального анализа обычно совпадали. Перед измерением органозоли очищали от пыли пятикратным циклическим фильтрованием через тефлоновый мембранный фильтр с диаметром пор 0.2 мкм (Sartorius, Германия) непосредственно в измерительную кювету из стекла. Мощность твердотельного лазера с длиной волны 640 нм составляла 35 мВт, рассеянные частицами фотоны детектировались под углом 90° к источнику излучения. Время накопления фотонов для одного измерения составляло 10 с, гидродинамический диаметр определялся как среднее из 20–30 измерений.
Электрокинетический потенциал (ζ-потенциал) наночастиц определяли при помощи того же прибора методом phase analysis light scattering (PALS). Рассеянные частицами фотоны детектировались под углом 15°. Измерения проводили в специальной ячейке SRR2 (Brookhaven, United States), устойчивой к действию органических растворителей, с плоскопараллельными палладиевыми электродами площадью ∼45 мм2 с межэлектродным зазором 3.45 мм. Органозоли очищали от пыли 10-кратным циклическим фильтрованием. Электроды также очищались от пыли непрерывным пропусканием через них растворителя в течение 20 мин с помощью специализированной фильтрующей системы BI-SFS (Brookhaven, United States), скорость потока растворителя составляла 7.8 мл/мин. Измерения скорости движения наночастиц проводили в ручном режиме при напряженности внешнего поля 550 В/см, скорость частиц определялась из 10–20 измерений. Для всех исследованных систем зависимости скорости от напряженности поля линейны, что свидетельствует о выполнимости критериев “истинного” неводного электрофореза [22]. Электрофоретическую подвижность определяли из угла наклона соответствующей зависимости, а расчет ζ-потенциала производили по формуле Хюккеля–Онзагера [23, 24].
Измерения вязкости растворов проводили на вискозиметре microVISC фирмы Rheosense, Inc., оснащенном микродатчиком давления VROC®. Определение динамической вязкости органозолей выполняли в термостатированном боксе при температуре 298 ± 2 K и атмосферном давлении. Конечное значение вычисляли как среднее 5–8 измерений.
Плотность растворов оценивали путем измерения массы аликвот известного объема (1 мл) на термостатированных аналитических весах Adventurer Pro фирмы Ohaus Corporation. Конечное значение массы вычисляли как среднее измерений трех навесок.
Измерения краевых углов и силы поверхностного натяжения проводили на приборе OCA 15 PRO (Dataphysics, Германия), оснащенном измерительной видеосистемой с USB-камерой, а также светосильным измерительным объективом с настраиваемым углом наблюдения. Все образцы находились в термостатированном боксе, оснащенном элементом Пельте, при T = 298 ± 2 K и p = 1 бар. Диаметр иглы составлял 1.65 мм.
Силу поверхностного натяжения определяли по методу висящей капли с помощью уравнения Лапласа–Юнга. Конечное значение энергии вычисляли как среднее пяти измерений.
Значения краевых углов смачивания измеряли в режиме лежащей капли на гладкой поверхности покровного стекла G100 (Levenhuk, США). Подложки предварительно подвергали травлению в 10 М азотной кислоте, обезжириванию в ацетоне и этаноле, а также высушиванию в атмосфере чистого воздуха в течение 15 мин. Конечное значение краевого угла вычисляли как среднее трех измерений на различных участках подложки.
Микроэмульсионный синтез и электрофоретическое концентрирование наночастиц
Синтез наночастиц осуществляли традиционным способом [25, 26]: в две пробирки с 0.25 М раствором АОТ в н-декане методом инъекционной солюбилизации вводили по 1 об. % водных растворов нитрата серебра (1 М) и аскорбиновой кислоты (1.5 М). Содержимое пробирок интенсивно перемешивали в течение нескольких секунд; за это время раствор приобретал характерную темно-коричневую окраску. Полученный органозоль выдерживали 10–15 ч при комнатной температуре.
Электрофоретическое концентрирование осуществляли на следующий день. Полученный после синтеза органозоль помещали в электрофоретическую ячейку (стеклянная кювета 70 × 70 мм) с горизонтально ориентированными плоскопараллельными медными электродами с межэлектродным зазором 15 мм. На электроды подавали напряжение 200 В. После включения поля частицы двигались к катоду, расположенному на дне ячейки. Этот факт указывает на наличие положительного электрокинетического потенциала у наночастиц. Через 20–30 мин частицы скапливались на катоде в виде темного слоя. Далее поле отключали, ячейка наклонялась на один из углов, куда и стекал полученный концентрат, который отбирали шприцем аликвотами по 20 мкл в тарированный бюкс. В дальнейших экспериментах использовали аликвоты с массой не менее 20 мкг. Такой концентрат представляет собой вязкую жидкость практически черного цвета, с содержанием металла не менее 2 моль/л (определяли спектрофотометрически). Аликвоты концентрата высушивали на воздухе до постоянной массы и объединяли. В дальнейшем полученный твердофазный композит Ag/AOT служил основой для создания модельных систем с различным соотношением наночастиц и мицелл ПАВ, которые использовали для изучения структуры адсорбционного слоя наночастиц и их взаимодействия с мицеллами ПАВ.
Приготовление модельных растворов
Полученный твердофазный композит Ag/AOT растворяли в 1 мл н-декана. Аликвоту полученного органозоля разбавляли растворами ПАВ с концентрацией, варьируемой в диапазоне 0.05–1 М. Концентрация серебра в таких органозолях была постоянна и составляла 10–3 М. Содержание АОТ в полученных системах не превышало 10–4 М, что значительно ниже критической концентрации мицеллообразования. Мы полагаем, что при столь низких концентрациях АОТ не оказывал существенного влияния на изменение гидродинамического диаметра наночастиц при варьировании концентрации ПАВ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Поверхностное натяжение
Методом определения краевых углов смачивания в режиме висящей капли определены значения удельной свободной поверхностной энергии на границе раздела жидкость–газ (силы поверхностного натяжения, Еl) органозолей Brij 30, Tergitol NP4 и Span 80 в н-декане. Результаты приведены на рис. 1.
Рис. 1.
Концентрационные зависимости удельной свободной поверхностной энергии на границе раздела жидкость–газ для растворов Brij 30, Tergitol NP4 и Span 80 в н-декане (T = 298 K, p = 1 бар).

Как известно, добавки ПАВ способствуют снижению значения El. Тем не менее, согласно полученным результатам, напротив, наблюдается незначительное увеличение силы поверхностного натяжения с ростом концентрации ПАВ для всех исследуемых ПАВ. Наибольшее различие в силе поверхностного натяжения относительно чистого н-декана (23.63 ± 0.09 мН/м) наблюдалось для раствора Brij 30 при концентрации ПАВ 1 М (24.76 ± 0.05 мН/м). Различие не превышает 5%. При аналогичных условиях для растворов Tergitol NP4 и Span 80 различия еще меньше и не превышают 3%.
Эксперименты по оценке поверхностного натяжения дополнены измерениями критического (максимального) объема создаваемых капель органозолей ПАВ. Для всех трех систем максимальный объем капель медленно снижается с ростом концентрации ПАВ (рис. 2). Важно отметить, что все измерения объемов осуществляли сразу после создания капель и проводили в герметичном боксе при фиксированных термодинамических условиях (T = 298 K и p = 1 бар). Таким образом, вклад процессов испарения растворителя с поверхности капель незначителен, а полученные тенденции снижения объема капли с ростом концентрации ПАВ имеют иную природу. Уменьшение объемов обусловлено увеличением плотности соответствующих растворов с увеличением концентрации ПАВ при сохранении постоянного значения поверхностного натяжения. Следовательно, с ростом концентрации капли органозолей становятся тяжелее и условие отрыва капли от поверхности иглы (Fmg > 2Fσl, где Fmg и Fσl – силы тяжести и сила поверхностного натяжения капли) реализуется раньше, при меньших значениях объема капли.
Адгезионные свойства растворов ПАВ
Найденные значения El были использованы для расчета работы когезии (Wc = 2El) и работы адгезии (согласно уравнению Дюпре–Юнга, Wa = = El(1 + cos θsm), θsm – краевой угол раствора ПАВ на гладкой химически однородной поверхности подложки). В качестве модельных подложек были использованы протравленные и обезжиренные поверхности покровных стекол. Прежде всего, было показано, что все растворы ПАВ и чистый растворитель демонстрируют полное растекание на поверхности гладких подложек. Таким образом, для каждой системы значения работ адгезии и когезии совпадают.
Рассчитанные значения приведены в табл. 1. С учетом того, что поверхностное натяжение растворов ПАВ практически не зависит от концентрации, вполне ожидаемо что величины работ адгезии и когезии также будут меняться незначительно: для всех систем эти величины лежат в диапазоне от 47.6 до 49.5 мДж/м2 и очень близки к значению работы когезии и адгезии чистого растворителя (47.3 ± 0.2 мДж/м2). Таким образом, по когезионным и адгезионным свойствам растворы исследованных ПАВ в диапазоне концентраций до 1 М достаточно близки к растворителю. Это делает весьма удобным контроль свойств чернил на их основе путем простого подбора более подходящего растворителя. Лабильность наночастиц серебра, стабилизированных АОТ, к замене растворителя продемонстрирована в нашей предыдущей работе [27]. Следует отметить, что наночастицы серебра также не оказывают существенного влияния на энергетические характеристики в диапазоне концентраций до 0.1 М.
Таблица 1.
Значения работы когезии (Wс, мДж/м2; значения работы адгезии совпадают со значениями работы когезии) растворов Brij/н-декан, Tergitol NP-4/н-декан и Span 80/н-декан (T = 298 K, p = 1 бар)
| C, моль/л | Brij 30 | Tergitol NP-4 | Span 80 |
|---|---|---|---|
| 0 | 47.3 ± 0.2 | 47.3 ± 0.2 | 47.3 ± 0.2 |
| 0.1 | 47.93 ± 0.03 | 47.65 ± 0.06 | 47.6 ± 0.1 |
| 0.25 | 48.5 ± 0.1 | 47.86 ± 0.05 | 47.48 ± 0.03 |
| 0.5 | 48.81 ± 0.02 | 47.69 ± 0.05 | 48.23 ± 0.06 |
| 0.75 | 49.43 ± 0.06 | 48.04 ± 0.09 | 48.5 ± 0.1 |
| 1 | 49.5 ± 0.1 | 48.3 ± 0.1 | 48.6 ± 0.3 |
Гидродинамический диаметр и интенсивность светорассеяния мицелл н-ПАВ
На рис. 3 приведены зависимости гидродинамического диаметра и интенсивности светорассеяния мицелл исследуемых ПАВ от концентрации. Наибольшим гидродинамическим диаметром обладают мицеллы Tergitol NP-4 (от 4 до 9.6 нм). При всех концентрациях регистрируется одна мода, диаметр увеличивается с ростом концентрации. Интенсивность светорассеяния растворов Tergitol NP4 довольно высокая, достигает 300 kcps (здесь и далее для краткости будет использоваться данная аббревиатура от “kilo count per second” (тысяч фотонов в секунду)). Для систем с Brij 30 и Span 80 в некоторых случаях регистрируется мода от агрегатов, для Span 80 при концентрации 0.25 и 0.15 М регистрируется только мода от агрегатов размером 130 нм, на рисунке агрегаты не приводятся. Размер мицелл Brij 30 составляет 4–5 нм, Span 80 – 6–7 нм. Следует отметить, что мицеллы Brij 30 и Span 80 имеют низкую интенсивность светорассеяния, ∼30 и 60 kcps соответственно. Для случая Brij 30 при концентрации 0.1 М интенсивность составляет всего ∼15 kcps, при такой низкой интенсивности корректное определение гидродинамического диаметра методом динамического светорассеяния не представляется возможным.
Вязкость растворов н-ПАВ
Зависимость динамической вязкости растворов ПАВ от концентрации представлена на рис. 4. Согласно полученным результатам, динамическая вязкость увеличивается для всех трех систем с ростом концентрации ПАВ. Наибольшее увеличение вязкости наблюдается для растворов Span 80, наименьшее – для Brij 30. Подобные результаты коррелируют с данными по динамической вязкости для чистых ПАВ: вязкость увеличивается в ряду Brij 30 – Tergitol NP4 – Span 80. При этом динамика роста вязкости неравномерна для всех трех систем: до концентрации ПАВ 0.25 М вязкость практически не увеличивается, тогда как далее, для растворов с большей концентрацией имеет место постепенное увеличение динамической вязкости.
Рис. 4.
Концентрационные зависимости динамической вязкости растворов неионных ПАВ в н-декане: Brij 30 (1), Tergitol NP4 (2), Span 80 (3) (T = 298 K, p = 1 бар).
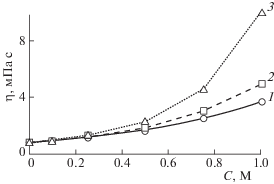
Плотность растворов растет линейно с увеличением концентрации ПАВ до 0.837, 0.863 и 0.856 г/см3 для 1М растворов Brij 30, Tergitol NP4 и Span 80 соответственно. По известным значениям плотности и динамической вязкости были проведены также расчеты кинематической вязкости (${v}$, мм2/с): ${v}$ = η/ρ. Так как плотность растворов с увеличением концентрации ПАВ возрастает линейно, вполне ожидаемо, что вид зависимости кинематической и динамической вязкости от концентрации идентичен (зависимости кинематической вязкости не приводятся).
Характеризация наночастиц серебра без добавок неионных ПАВ
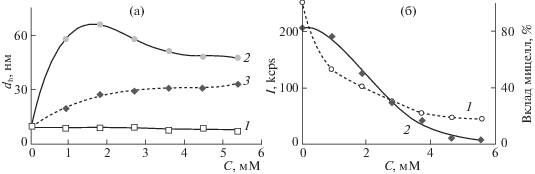
В исходной системе до концентрирования при концентрации АОТ 0.25 М в оптическом спектре присутствует характерная полоса локализованного плазмонного резонансного поглощения (ЛПРП) с максимумом при 400 нм, молярным коэффициентом экстинкции 1.7 × 104 л моль/см в приближении количественного восстановления серебра до наночастиц и полной шириной на полувысоте 57 нм. Гидродинамический диаметр наночастиц в исходной системе составляет 17.6 нм, а в системе, полученной разбавлением концентрата наночастиц серебра н-деканом таким образом, чтобы концентрация АОТ в полученном золе составляла менее 10–4 М (не менее чем в 2500 раз) гидродинамический диаметр наночастиц составляет 13.1 нм и не меняется при более сильном разбавлении. Значимых отличий в оптических спектрах исходной системы и концентрата не наблюдается. Важно отметить, что полученные наночастицы обладают крайне высокой степенью монодисперсности: индекс полидисперсности составляет всего 9%, ζ-потенциал наночастиц в исходной системе при концентрации АОТ 0.25 М составляет 25 ± 2 мВ по данным PALS. Зависимость дзета-потенциала от напряженности поля отсутствовала. Для электрофоретического концентрирования таких наночастиц требуется ∼30 мин при напряженности внешнего электрического поля 300 В/см. Содержание металла в рафинате не превышало 2% от исходного (определено спектрофотометрически). Результаты характеризации наночастиц в данных системах представлены на рис. 5.
Рис. 5.
Результаты измерения гидродинамического диаметра (а) наночастиц серебра в микроэмульсии после синтеза и в разбавленном в 2500 раз электрофоретическом концентрате, а также результаты определения электрокинетического потенциала (б) наночастиц серебра в микроэмульсии после синтеза.

Следует отметить, что при концентрации АОТ ниже ККМ данный ПАВ присутствует в молекулярной форме, а адсорбционный слой наночастиц представляет собой монослой АОТ. Причины различий значений гидродинамического диаметра наночастиц при разных концентрациях АОТ подробно описаны в нашей работе [14] и обусловлены, на наш взгляд, электростатическим взаимодействием заряженных мицелл АОТ и наночастиц. Величина гидродинамического диаметра наночастиц в растворах АОТ с концентрацией ниже ККМ взята нами в качестве ориентира. Можно ожидать, что при отсутствии заряженных мицелл, а, значит, и электростатического взаимодействия типа “мицелла–наночастица”, будет наблюдаться именно такое значение гидродинамического диаметра. Важно, чтобы при этом не происходило агломерации наночастиц.
Гидродинамический диаметр наночастиц серебра в растворах неионных ПАВ при постоянной концентрации серебра
Зависимость гидродинамического диаметра наночастиц от концентрации ПАВ приведена в табл. 2. В случае Brij 30 при концентрациях 0.1 и 0.25 М полученные органозоли были нестабильны, наблюдались значительное (более 100 нм) смещение пика ЛПРП в длинноволновую область, снижение его интенсивности, приводившее к помутнению органозоля и образованию осадка металлического серебра. При более высоких концентрациях полученные органозоли стабильны, значимого изменения положения максимума ЛПРП не наблюдается. Регистрируется только одна мода от наночастиц серебра. Гидродинамический диаметр наночастиц растет от 43 до 54 нм с увеличением концентрации Brij 30 от 0.5 до 1 М. Мода от мицелл Brij 30 не регистрируется, чего можно было ожидать, учитывая весьма низкую интенсивность их светорассеяния. С учетом отсутствия второй моды результаты определения гидродинамического диаметра можно считать корректными. Отметим, что полученные значения значительно выше ожидаемых, а увеличение гидродинамического диаметра коррелирует с увеличением вязкости раствора.
Таблица 2.
Зависимость гидродинамического диаметра (dh, нм) наночастиц серебра от концентрации н-ПАВ в н-декане
| С, моль/л | Span 80 | Tergitol NP 4 | Brij 30 | ||||||
|---|---|---|---|---|---|---|---|---|---|
| Мода 1 | Мода 2 | I, kcps | Мода 1 | Мода 2 | I, kcps | Мода 1 | Мода 2 | I, kcps | |
| 0.1 | 7 | 118 | 204 | 10.4 | 121 | 269 | Системы нестабильны | ||
| 0.25 | 11 | 151 | 233 | 12.7 | 160 | 222 | |||
| 0.5 | – | 47 | 202 | 11.3 | 150 | 201 | – | 43 | 590 |
| 0.75 | – | 60 | 490 | 8.2 | 49 | 197 | – | 44 | 300 |
| 1 | – | 103 | 309 | 8.5 | 57 | 191 | – | 54 | 270 |
В случае Span 80 при низких концентрациях (0.1 и 0.025 М) наблюдается две моды: меньшая мода 7–11 нм с малым вкладом и большая – 120–150 нм. При больших концентрациях Span 80 меньшая мода исчезает, гидродинамический диаметр большей моды увеличивается с ∼50 до ∼100 нм с ростом концентрации Span 80. Видимо, при более низких концентрациях Span 80 наблюдается формирование агрегатов наночастиц за счет более низкой стабильности (аналогично случаю с Brij 30).
В случае растворов Tergitol NP4 при всех концентрациях регистрируется строго две моды: от мицелл Tergitol NP4 с диаметром 8–13 нм и от наночастиц с диаметром 50–160 нм. Зависимость диаметров от концентраций в обоих случаях имеет сложный вид и проходит через максимум при концентрации Tergitol NP4, равной 0.25 М. Как в случае мицелл, так и в случае наночастиц, наблюдается увеличение гидродинамического диаметра по сравнению с однокомпонентными системами.
На основании полученных данных можно заключить, что интерпретация полученных результатов определения гидродинамического диаметра наночастиц в растворах ПАВ является крайне нетривиальной задачей. Но во всех случаях можно отметить некие общие закономерности: при низких концентрациях неионных ПАВ системы менее стабильны – наблюдается или формирование крупных агрегатов размером более 100 нм, или даже помутнение органозоля и образование осадка металлического серебра. При более высоких концентрациях ПАВ наблюдается тенденция к росту гидродинамического диаметра с ростом концентрации ПАВ, что наблюдалось ранее для случая анионного АОТ. Отметим, что в случае Brij 30 и Span 80 при концентрациях ПАВ 0.5 М и выше наблюдается только одна мода от наночастиц. Это служит критерием корректности определения их гидродинамического диаметра. В данном случае можно отметить корреляцию увеличения определяемого гидродинамического диаметра и увеличение вязкости органозоля. Подобный эффект наблюдался нами ранее для молекул биополимеров в водных растворах, когда крупные молекулы декстрана и полисахарозы “воспринимали” молекулы полиэтиленгликоля меньшего размера в качестве компонента среды [28]. Видимо, в данном случае наблюдается аналогичный эффект так называемой “микровязкости” по причине отсутствия в системах на основе неионных ПАВ электростатических взаимодействий, способных привести к утолщению адсорбционного слоя. Также увеличение гидродинамического диаметра может быть обусловлено взаимодействием Ван-дер-Ваальса. Однако обычно сила такого взаимодействия невелика и вряд ли может объяснить столь существенное увеличение гидродинамического диаметра.
Гидродинамический диаметр наночастиц серебра в растворах неионных ПАВ при варьируемой концентрации серебра
В случае растворов Tergitol NP4 наблюдаются две моды сопоставимой интенсивности: от наночастиц и от мицелл Tergitol NP4. В таком случае для наиболее корректного определения гидродинамического диаметра наночастиц требуется максимально снизить вклад мешающего компонента (мицелл Tergitol NP4) в общую интенсивность светорассеяния системы. В случае мицелл АОТ этого можно было добиться увеличением концентрации наночастиц добавлением концентрата [13]. Но для случая более крупных мицелл Tergitol NP4, даже при концентрации серебра в системе ∼5.5 мМ (органозоль серебра темно-коричневого цвета) и при концентрации ПАВ в 1 М их вклад в общее светорассеяние системы будет составлять ∼20% (рис. 6). Следует отметить, что при увеличении концентрации металла интенсивность светорассеяния полученных органозолей резко снижается (с ∼200 до 8 kcps), а также наблюдается небольшое уменьшение определяемого гидродинамического диаметра наночастиц (с 65 до 50 нм), что может быть обусловлено увеличением поглощения лазерного излучения наночастицами серебра и искажением результатов. Результаты мономодального анализа при этом существенно не меняются, что также указывает на уменьшение точности полимодального анализа при увеличении поглощения образца.
ЗАКЛЮЧЕНИЕ
Исследованы зависимости гидродинамического диаметра наночастиц серебра известного размера от концентрации неионных поверхностно-активных веществ и от концентрации металла. Показано, что при низких концентрациях ПАВ (до 0.5 М) органозоли серебра обладают меньшей стабильностью, Tergitol NP4 и Span 80 приводят к формированию агрегатов наночастиц размером до 150 нм, а в случае Brij 30 – к образованию осадка серебра низкой дисперсности. При использовании метода вискозиметрии при спектрофотометрическом контроле отсутствия агломерации показано увеличение гидродинамического диаметра наночастиц в растворах неионных поверхностно-активных веществ при увеличении их концентрации в диапазоне 0.5–1 М. Подобные изменения, наиболее вероятно, обусловлены эффектом микровязкости среды вследствие корреляции гидродинамического диаметра и макроскопической вязкости раствора. Агломерация наночастиц и формирование адсорбционного слоя из мицелл при высоких концентрациях ПАВ маловероятны. Таким образом, неионные ПАВ могут быть весьма удобными для регулирования вязкости чернил на основе наночастиц серебра, особенно Brij 30, формирующего мицеллы малого размера.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 18-33-00064 мол-а).
Список литературы
Calvert P. // Chem. Mater. 2001. V. 13. № 10. P. 3299.
Hayes R.A., Feenstra B.J. // Nature. 2003. V. 425. P. 383.
Lawrence M.J., Rees G.D. // Adv. Drug Deliv. Rev. 2000. V. 45. № 1. P. 89.
Lopez F., Cinelli G., Colella M. et al. // Biotechnology Progress. 2014. V. 30. № 2. P. 360.
Kamyshny A., Ben-Moshe M., Aviezer S., Magdassi S. // Macromol. Rapid Commun. 2005. V 26. № 4. P. 281.
Rae A., Hammer-Fritzinger D. // Solid State Technology. 2006. V. 49. № 4. P. 53.
Capek I. // Adv. Colloid Interf. Sci. V. 110. № 1–2. P. 49.
Kamyshny A., Magdassi S. // Small. 2014. V. 10. № 14. P. 3515.
Lopez-Quintela M.A., Rivas J. // J. Colloid Interface Sci. 1993. V. 158. № 2. P. 446.
Phillies G.D.J. // Anal. Chem. 1990. V. 62. № 20. P. 1049.
Хлебцов Б.Н., Хлебцов Н.Г. // Коллоидн. журн. 2011. Т. 73. № 1. С. 105.
Булавченко А.И., Татарчук В.В., Булавченко О.А., Арымбаева А.Т. // Журн. неорган. химии. 2005. Т. 50. № 5. С. 862.
Булавченко А.И., Поповецкий П.С. // Журн. физ. химии. 2012. Т. 86. № 6. С. 1108.
Bulavchenko A.I., Popovetskiy P.S. // Langmuir. 2014. V. 30. № 42. P. 12729.
Bulavchenko A.I., Pletnev D.N. // J. Phys. Chem. C. 2008. V. 112. № 42. P. 16365.
Bulavchenko A.I., Popovetskiy P.S. // Langmuir. 2010. V. 26. № 2. P. 736.
Beunis F., Strubbe F., Neyts K., Verschueren A.R.M. // Appl. Phys. Lett. 2007. V. 90. № 182103. P. 1.
Alvarez-Lorenzo C., Gómez-Amoza J.L., Martínez-Pacheco R. et al. // Int. J. Pharm. 1999. V. 180. № 1. P. 91.
Ruenraroengsak P., Florence A.T. // Int. J. Pharm. 2005. V. 298. № 2. P. 361.
Vassem M., McKerricher G., Shamim A. // ACS Appl. Mater. Interfaces. 2016. V. 8. № 1. P. 177.
Calvert P. // Chem. Mater. 2001. V. 13. № 10. P. 3299.
van der Minne J.L., Hermanie P.H.J. // J. Colloid. Sci. 1952. V. 7. № 6. P. 600.
O’Brien R.W., White L.R. // J. Chem. Soc. Faraday Trans. II. 1978. V. 74. P. 1607.
Delgado A.V., Gonzalez-Caballero F., Hunter R.J. et al. // J. Colloid Interface Sci. 2007. V. 309. № 2. P. 194.
Pileni M.P. // J. Phys. Chem. 1993. V. 97. № 27. P. 6961.
Арымбаева А.Т., Шапаренко Н.О., Поповецкий П.С., Булавченко А.И. // Журн. неорган. химии. 2017. Т. 62. № 7. С. 1001.
Поповецкий П.С., Шапаренко Н.О., Арымбаева А.Т., Булавченко А.И. // Коллоид. журн. 2016. Т. 78. № 4. С. 458.
Поповецкий П.С., Булавченко А.И. // Там же. 2016. Т. 78. № 2. С. 179.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии