Журнал физической химии, 2020, T. 94, № 10, стр. 1567-1575
Характеристики удерживания и энтальпии сорбции сложных эфиров пентаэритрита и кислот С2–С8 на неполярной неподвижной фазе
В. В. Емельянов a, Е. Л. Красных a, *, С. В. Портнова a
a ФГБОУ ВО “Самарский государственный технический университет”
Самара, Россия
* E-mail: kinterm@samgtu.ru
Поступила в редакцию 19.11.2019
После доработки 11.03.2020
Принята к публикации 17.03.2020
Аннотация
Методом газожидкостной хроматографии на неполярной фазе, в интервале температур 433.2–563.2 K определены характеристики удерживания и энтальпии сорбции для 38 сложных эфиров пентаэритрита и карбоновых кислот С2–С8 различного строения. Показано влияние строения молекулы эфиров на изменение индекса удерживания от температуры. Выявлено, что среднее изменение энтальпий сорбции тетраэфиров пентаэритрита, приходящееся на CH2-группу, в абсолютном значении ниже аналогичного вклада для нормальных алканов. Оценены значения избыточной энтальпии смешения при 298.2 K для четырех полностью замещенных эфиров пентаэритрита.
Сложные эфиры пентаэритрита (2,2-бис-(гидроксиметил)пропан-1,3-диола) применяются для производства пластификаторов, лаков и красок, косметических продуктов. Наибольший интерес они представляют для производства синтетических масел различного назначения. Сложные эфиры пентаэритрита и монокарбоновых кислот обладают хорошей термоокислительной стабильностью [1, 2], а низкие температуры кристаллизации позволяют эксплуатировать синтетические масла на их основе в арктической зоне [3–5]. Подобные масла представляют собой смеси сложных эфиров пентаэритрита и монокарбоновых кислот с добавлением различных присадок [4, 5]. Для их количественного анализа используют метод газожидкостной хроматографии, а для идентификации компонентов – логарифмические индексы удерживания [6–9]. Индексы удерживания, полученные в условиях газо-жидкостной хроматографии на капиллярной колонке с неподвижной неполярной фазой, находят широкое применение на практике, так как кроме идентификации эти величины могут использоваться для расчета температуры кипения [10, 11] и давления пара [12, 13]. Корреляции между индексами удерживания и энтальпиями испарения в пределах одного гомологического ряда позволяют оценить значения энтальпий испарения соединений, для которых отсутствуют экспериментальные данные [14–18].
Хроматографический анализ позволяет получить не только значения индексов удерживания, но и термодинамические характеристики сорбции. Так, энтальпия сорбции важна для понимания механизма хроматографического удерживания и изучения межмолекулярных взаимодействий сорбат–сорбент [11]. Корреляция между энтальпией сорбции и энтальпией испарения соединений позволяет оценивать энтальпии испарения сложных органических соединений [19–23].
Анализ литературных данных показал, что для сложных эфиров пентаэритрита не изучены характеристики удерживания на неполярной неподвижной фазе в условиях газожидкостной хроматографии. Таким образом, работа посвящена определению индексов удерживания и энтальпий сорбции, анализу их температурных зависимостей и изменений в гомологических рядах сложных эфиров пентаэритрита и кислот С2–С8 различного строения. Данная работа продолжает цикл публикаций по исследованию процесса сорбции в условиях газо-жидкостной хроматографии на неполярной фазе сложных эфиров карбоновых кислот и многоатомных спиртов с различным содержанием эфирных и гидроксильных групп в молекуле [24–29].
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез эфиров осуществляли этерификацией соответствующей карбоновой кислоты пентаэритритом с использованием восьмикратного мольного избытка кислоты [1]. Реакцию проводили в среде инертного газа (азота) без катализатора для снижения вероятности образования продуктов конденсации и для предотвращения окисления пентаэритрита. Температура синтеза соответствовала температуре кипения используемой карбоновой кислоты. Реакционную воду удаляли при помощи ловушки Дина–Старка. Пробу для анализа (20 мкл) отбирали шприцем после 1–1.5 ч с начала отделения воды, разбавляли метанолом (1 мл) и направляли на анализ. Все пробы находились в жидком состоянии. В пробу добавляли по 1 мкл н-алканов, подобранных таким образом, чтобы время удерживания исследуемых соединений находилось между временами удерживания алканов. В хроматограф пробу вводили с помощью шприца. Объем вводимой пробы 0.2 мкл.
Анализ реакционной массы и определение времен удерживания проводили с использованием программно-аппаратного комплекса “Хроматек-Аналитик” на базе хроматографа “Кристалл-2000М”. Для анализа сложных эфиров пентаэритрита и кислот С2–С6 использовали капиллярную колонку 100 м × 0.2 мм × 0.5 мкм с привитой неподвижной жидкой фазой DB-1. Для анализа сложных эфиров пентаэритрита и кислот С7–С8 – капиллярную колонку 30 м × 0.32 мм × 0.5 мкм с привитой неподвижной жидкой фазой BP-1. Фазы DB-1 и BP-1 имеют одинаковый химический состав (100% диметилполисилоксан) и относятся к неполярным. Условия анализа: газ-носитель – гелий, деление потока 1/50, детектор – пламенно-ионизационный, температура испарителя – 623.2 K, температура детектора – 573.2 K, температура колонки – 433.2–563.2 K, объем вводимой пробы 0.2 мкл.
Идентификация компонентов смеси проводилась с помощью масс-спектрометра Finnigan Trace DSQ c базой Nist 2002, Xcalibur 1.31. Sp 5. Условия проведения анализа: капиллярная колонка ZB 5MS со слабополярной фазой, длина 30 м; внутренний диаметр 0.32 мм; температура инжектора – 623.2 K; температура трансферлайна – 573.2 K; режим термостатирования колонки – tнач = 353 K – 1 мин, скорость подъема 10 К/мин до 573.2 K; газ-носитель – гелий; расход газа-носителя – 1.3 мл/мин.
В реакционной массе были идентифицированы следующие ожидаемые продукты:
где R – н-CnH2n–1 (n = 1–6), изо-C3H7, изо-C4H9, трет-C4H9, 2-этил-C5H11.Определение времен удерживания проводилось в изотермическом режиме по методикам, представленным в работах [24, 25].
Расчет индексов удерживания проводили по формуле Ковача [30]:
(1)
${{I}_{x}} = \frac{{\lg (t_{x}^{'}) - \lg (t_{z}^{'})}}{{\lg (t_{{z + 1}}^{'}) - \lg (t_{z}^{'})}}100 + 100z,$Экспериментальные величины индексов удерживания определяли из 3–7 измерений, доверительный интервал величин индексов составлял не более ±1.0 единицы индекса (е.и.).
Величины изменения внутренней энергии ${{\Delta }_{{{\text{сорб}}}}}\bar {U}$ (кДж/моль) и энтальпии ${{\Delta }_{{{\text{сорб}}}}}\bar {H}$ (кДж/моль) сорбции при средней температуре эксперимента определяли из зависимостей [26, 31]:
где R – универсальная газовая постоянная (8.314 Дж/(моль K)), k – фактор удерживания, рассчитываемый по формуле: где tR – время элюирования исследуемого соединения, tM – время элюирования несорбируемого соединения.Полученные по уравнению (2) значения энтальпий сорбции соответствуют средней температуре эксперимента. Приведение к стандартной температуре (298.2 K) осуществляли по уравнению (5) [26]:
(5)
$\begin{gathered} {{\Delta }_{{{\text{сорб}}}}}H(298.2) = {{\Delta }_{{{\text{сорб}}}}}\bar {H}({{T}_{{{\text{ср}}}}}) + \\ + \;( - \Delta _{{\text{ж}}}^{n}C_{p}^{^\circ })(298.2 - {{T}_{{{\text{ср}}}}}), \\ \end{gathered} $Избыточную энтальпию смешения $\Delta {{H}^{{E,\infty }}}(298.2)$ рассчитывали по уравнению [31]:
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Индексы удерживания
Полученные значения индексов удерживания сложных эфиров пентаэритрита и коэффициенты уравнения зависимостей индексов удерживания от температуры представлены в табл. 1.
Таблица 1.
Экспериментальные значения индексов удерживания и коэффициенты температурных зависимостей сложных эфиров пентаэритрита (I = aTc + b, Tc – температура колонки, K. Значения выделены курсивом)
| nС | I, ед. | I513.2, ед.* | ΔI/ΔT | a | b | R2 | |||
|---|---|---|---|---|---|---|---|---|---|
| Моноэфиры пентаэритрита | |||||||||
| 1 | 433.2 | 443.2 | 453.2 | 463.2 | |||||
| 1451.9 ± 0.1 | 1455.7 ± 0.1 | 1459.7 ± 0.1 | 1464.2 ± 0.1 | 1483.4 | 4.1 | 0.409 | 1274.6 | 0.998 | |
| 2 | 453.2 | 463.2 | 473.2 | 483.2 | |||||
| 1551.5 ± 0.1 | 1556.1 ± 0.1 | 1561.0 ± 0.1 | 1566.2 ± 0.1 | 1580.8 | 4.9 | 0.492 | 1329.3 | 0.999 | |
| 3 | 493.2 | 503.2 | 513.2 | 523.2 | |||||
| 1660.3 ± 0.1 | 1666.3 ± 0.1 | 1672.8 ± 0.1 | 1679.9 ± 0.1 | 1673.0 | 6.5 | 0.65 | 1338.0 | 0.999 | |
| 4 | 513.2 | 523.2 | 533.2 | 543.2 | |||||
| 1772.8 ± 0.1 | 1778.4 ± 0.1 | 1784.5 ± 0.1 | 1795.2 ± 0.1 | 1771.4 | 7.3 | 0.732 | 1395.6 | 0.974 | |
| 5 | 503.2 | 513.2 | 523.2 | 533.2 | |||||
| 1862.2 ± 0.1 | 1868.9 ± 0.1 | 1875.3 ± 0.1 | 1882.2 ± 0.1 | 1868.1 | 6.7 | 0.664 | 1528.1 | 0.999 | |
| 3 | 493.2 | 503.2 | 513.2 | 523.2 | |||||
| изо- | 1617.0 ± 0.1 | 1622.9 ± 0.1 | 1629.1 ± 0.1 | 1635.5 ± 0.1 | 1629.1 | 6.2 | 0.619 | 1311.8 | 0.999 |
| 4 | 503.2 | 513.2 | 523.2 | 533.2 | |||||
| трет- | 1359.1 ± 0.1 | 1364.0 ± 0.1 | 1369.3 ± 0.1 | 1374.3 ± 0.1 | 1364.5 | 5.1 | 0.508 | 1103.7 | 0.999 |
| 4 | 513.2 | 523.2 | 533.2 | 543.2 | |||||
| изо- | 1726.91 ± 0.1 | 1733.2 ± 0.1 | 1739.9 ± 0.1 | 1746.9 ± 0.1 | 1726.1 | 6.7 | 0.667 | 1384.5 | 0.999 |
| 5 | 533.2 | 543.2 | 553.2 | 563.2 | |||||
| 2-этил- | 2285.7 ± 0.1 | 2290.4 ± 0.1 | 2295.4 ± 0.1 | – | 2276.2 | 4.7 | 0.486 | 2026.4 | 0.999 |
| Диэфиры пентаэритрита | |||||||||
| 1 | 433.2 | 443.2 | 453.2 | 463.2 | |||||
| 1549.4 ± 0.1 | 1552.8 ± 0.1 | 1555.4 ± 0.1 | 1559.6 ± 0.1 | 1575.9 | 3.3 | 0.332 | 1405.5 | 0.992 | |
| 2 | 453.2 | 463.2 | 473.2 | 483.2 | |||||
| 1734.5 ± 0.1 | 1738.6 ± 0.1 | 1742.6 ± 0.1 | 1746.9 ± 0.1 | 1758.2 | 4.1 | 0.412 | 1547.8 | 0.999 | |
| 3 | 493.2 | 503.2 | 513.2 | 523.2 | |||||
| 1918.5 ± 0.1 | 1923.1 ± 0.1 | 1927.5 ± 0.1 | 1932.6 ± 0.1 | 1927.6 | 4.7 | 0.467 | 1688.1 | 0.999 | |
| 4 | 513.2 | 523.2 | 533.2 | 543.2 | |||||
| 2116.8 ± 0.1 | 2120.8 ± 0.1 | 2125.3 ± 0.1 | 2135.2 ± 0.1 | 2114.5 | 6.0 | 0.597 | 1809.2 | 0.947 | |
| 5 | 503.2 | 513.2 | 523.2 | 533.2 | |||||
| 2304.6 ± 0.1 | 2306.1 ± 0.1 | 2311.2 ± 0.1 | 2316.1 ± 0.1 | 2307.5 | 3.4 | 0.396 | 2104.3 | 0.957 | |
| 6 | 533.2 | 553.2 | 263.2 | ||||||
| 2509.7 ± 0.1 | 2521.6 ± 0.1 | 2526.5 ± 0.1 | 2498.4 | 5.6 | 0.564 | 2208.6 | 0.998 | ||
| 3 | 493.2 | 503.2 | 513.2 | 523.2 | |||||
| изо- | 1828.9 ± 0.1 | 1833.8 ± 0.1 | 1838.8 ± 0.1 | 1844.1 ± 0.1 | 1838.7 | 5.1 | 0.506 | 1579.3 | 0.999 |
| 4 | 503.2 | 513.2 | 523.2 | 533.2 | |||||
| трет- | 1551.6 ± 0.1 | 1556.2 ± 0.1 | 1561.2 ± 0.1 | 1566.4 ± 0.1 | 1556.12 | 4.9 | 0.494 | 1302.9 | 0.999 |
| 4 | 513.2 | 523.2 | 533.2 | 543.2 | |||||
| изо- | 2023.8 ± 0.1 | 2028.9 ± 0.1 | 2033.8 ± 0.1 | 2039.2 ± 0.1 | 2023.4 | 5.1 | 0.510 | 1761.5 | 0.999 |
| 5 | 533.2 | 543.2 | 553.2 | ||||||
| 2-этил- | 2484.7 ± 0.1 | 2489.6 ± 0.1 | 2496.3 ± 0.1 | 2472.7 | 5.8 | 0.580 | 2175.1 | 0.993 | |
| Триэфиры пентаэритрита | |||||||||
| 1 | 433.2 | 443.2 | 463.2 | ||||||
| 1648.5 ± 0.1 | 1649.4 ± 0.1 | 1651.3 ± 0.1 | 1655.3 | 1.0 | 0.094 | 1608.0 | 0.998 | ||
| 2 | 453.2 | 463.2 | 473.2 | 483.2 | |||||
| 1908.1 ± 0.1 | 1909.6 ± 0.1 | 1911.1 ± 0.1 | 1912.9 ± 0.1 | 1917.2 | 1.6 | 0.159 | 1836.0 | 0.998 | |
| 3 | 493.2 | 503.2 | 513.2 | 523.2 | |||||
| 2154.7 ± 0.1 | 2156.4 ± 0.1 | 2157.9 ± 0.1 | 2159.8 ± 0.1 | 2157.6 | 1.7 | 0.168 | 2071.8 | 0.998 | |
| 4 | 513.2 | 523.2 | 533.2 | ||||||
| 2425.7 ± 0.1 | 2427.2 ± 0.1 | 2428.7 ± 0.1 | 2425.0 | 1.5 | 0.15 | 2348.7 | 0.997 | ||
| 5 | 503.2 | 513.2 | 523.2 | 533.2 | |||||
| 2703.8 ± 0.1 | 2704.2 ± 0.1 | 2705.8 ± 0.1 | 2707.1 ± 0.1 | 2704.3 | 1.2 | 0.115 | 2645.6 | 0.955 | |
| 6 | 533.2 | 543.2 | 553.2 | 263.2 | |||||
| 2986.6 ± 0.1 | 2987.5 ± 0.1 | 2989.4 ± 0.1 | 2991.8 ± 0.1 | 2982.0 | 1.8 | 0.175 | 2892.9 | 0.964 | |
| 3 | 493.2 | 503.2 | 513.2 | 523.2 | |||||
| изо- | 2020.8 ± 0.1 | 2022.9 ± 0.1 | 2025.2 ± 0.1 | 2027.5 ± 0.1 | 2025.24 | 2.3 | 0.224 | 1910.3 | 0.999 |
| 4 | 503.2 | 513.2 | 523.2 | 533.2 | |||||
| трет- | 1734.6 ± 0.1 | 1738.7 ± 0.1 | 1742.7 ± 0.1 | 1746.9 ± 0.1 | 1738.4 | 4.1 | 0.409 | 1528.8 | 0.999 |
| 4 | 513.2 | 523.2 | 533.2 | 543.2 | |||||
| изо- | 2287.1 ± 0.1 | 2288.9 ± 0.1 | 2290.5 ± 0.1 | 2292.8 ± 0.1 | 2286.4 | 1.9 | 0.187 | 2191.1 | 0.994 |
| 5 | 533.2 | 543.2 | 553.2 | 563.2 | |||||
| 2-этил- | 2918.4 ± 0.1 | 2919.4 ± 0.1 | 2920.4 ± 0.1 | 2922.3 ± 0.1 | 2916.2 | 1.3 | 0.127 | 2850.5 | 0.971 |
| Тетраэфиры пентаэритрита | |||||||||
| 1 | 433.2 | 443.2 | 453.2 | 463.2 | |||||
| 1721.5 ± 0.1 | 1719.8 ± 0.1 | 1718.2 ± 0.1 | 1717.1 ± 0.1 | 1709.0 | –1.5 | –0.148 | 1785.5 | 0.991 | |
| 2 | 453.2 | 463.2 | 473.2 | 483.2 | |||||
| 2053.1 ± 0.1 | 2052.2 ± 0.1 | 2051.5 ± 0.1 | 2050.8 ± 0.1 | 2050.0 | –0.8 | –0.076 | 2089.0 | 0.993 | |
| 3 | 493.2 | 503.2 | 513.2 | 523.2 | |||||
| 2350.4 ± 0.1 | 2348.5 ± 0.1 | 2346.8 ± 0.1 | 2345.2 ± 0.1 | 2346.2 | –1.7 | –0.173 | 2435.6 | 0.999 | |
| 4 | 513.2 | 523.2 | 533.2 | – | |||||
| 2687.5 ± 0.1 | 2685.1 ± 0.1 | 2682.5 ± 0.1 | – | 2686.2 | –2.4 | –0.250 | 2815.8 | 0.997 | |
| 5 | 503.2 | 513.2 | 523.2 | 533.2 | |||||
| 3042.0 ± 0.1 | 3039.3 ± 0.1 | 3036.3 ± 0.1 | 3033.4 ± 0.1 | 3039.1 | –2.9 | –0.288 | 3187.0 | 0.999 | |
| 6 | 543.2 | 563.2 | – | – | |||||
| 3445.1 ± 0.1 | 3438.1 ± 0.1 | – | – | 3455.7 | –3.5 | –0.347 | 3593.0 | – | |
| 3 | 493.2 | 503.2 | 513.2 | 523.2 | |||||
| изо- | 2174.6 ± 0.1 | 2173.7 ± 0.1 | 2172.8 ± 0.1 | 2172.0 ± 0.1 | 2172.9 | –0.9 | –0.087 | 2217.5 | 0.999 |
| 4 | 503.2 | 513.2 | 523.2 | 533.2 | |||||
| трет- | 2223.7 ± 0.1 | 2224.1 ± 0.1 | 2224.8 ± 0.1 | 2225.7 ± 0.1 | 2223.8 | 0.7 | 0.067 | 2208.2 | 0.973 |
| 4 | 533.2 | 543.2 | – | – | |||||
| изо- | 2494.4 ± 0.1 | 2492.6 ± 0.1 | – | – | 2497.8 | –1.8 | –0.18 | 2541.2 | – |
| 5 | 533.2 | 543.2 | 553.2 | 563.2 | |||||
| 2-этил- | 3259.6 ± 0.1 | 3255.9 ± 0.1 | 3252.3 ± 0.1 | 3249.2 ± 0.1 | 3266.4 | –3.5 | –0.348 | 3445.0 | 0.998 |
Зависимости индексов удерживания от температуры в исследованном интервале температур являются линейными, что подтверждается высокими величинами коэффициентов корреляции R2 (табл. 1). Это свидетельствует об отсутствии взаимодействия между молекулами сорбатов на поверхности сорбента [33].
Анализ величин изменения индексов при увеличении температуры на 10 К (ΔI/ΔT), рассчитанных внутри гомологических рядов моно-, ди-, три- и полностью замещенных эфиров пентаэритрита, показал, что при замещении гидроксильной группы на сложноэфирную среднее приращение индекса удерживания снижается, а в случае полностью замещенных тетраэфиров – ΔI/ΔT становится отрицательным (табл. 2).
Одной из причин снижения значения индекса при увеличении температуры может быть перегрузка хроматографической колонки [34], но фактор асимметрии пиков для всех эфиров близок к 1 и, следовательно, причина не в этом. Вторая причина может быть связана с изменением свойств неподвижной фазы за счет ее динамической модификации анализируемыми компонентами [35]. Однако, как указано выше, концентрация анализируемых компонентов за счет разбавления была минимальной, следовательно, модификация фазы маловероятна.
Были проанализированы температурные зависимости индексов удерживания гомологических рядов моно-, ди- и полностью замещенных сложных эфиров трех многоатомных спиртов (глицерина, неопентилгликоля и триметилолпропана), определенные на капиллярной колонке с неполярной неподвижной фазой [24, 27, 28] (табл. 2). Полученные значения подтверждают тенденцию снижения средней величины ΔI/ΔT при замещении гидроксильных групп сложноэфирными.
В работе [36] были изучены температурные зависимости индексов удерживания на капиллярной колонке с неполярной неподвижной фазой TBR-1 (100% диметилполисилоксан) в широком температурном интервале (333–423 K) для различных классов органических соединений, в том числе для сложных эфиров монокарбоновых кислот. По результатам анализа работы [36], было выявлено, что значения индексов удерживания для сложных эфиров при увеличении температуры снижаются, и величина ΔI/ΔT в среднем составляет –1.1…–0.5 е.и. Ранее нами были определены индексы удерживания сложных эфиров дикарбоновых кислот на капиллярной колонке с неполярной неподвижной фазой OV-101 в температурном интервале 30 K [29]. Было показано, что величины индексов удерживания в исследованных температурных интервалах также снижаются при повышении температуры для большинства сложных эфиров линейного строения (ΔI/ΔT в среднем составляет от –1.7 до –0.5 е.и.), кроме диметиловых эфиров щавелевой и малоновой кислот.
С другой стороны, значения индексов удерживания сложных эфиров гидроксокарбоновых кислот, полученных на капиллярной колонке с неполярной неподвижной фазой DB-1, в пределах исследованного температурного интервала увеличиваются [25]. И если величина ΔI/ΔT для сложных эфиров гликолевой и молочной кислоты невелика и составляет 0.2–1 е.и., то для сложных эфиров яблочной и винной кислот увеличение индекса удерживания с повышением температуры более выражено (ΔI/ΔT находится в пределах 1.7–4.0 е.и.).
Таким образом, можно сделать предположение, что для соединений, содержащих в структуре гидроксильные и сложноэфирные функциональные группы, значения индекса удерживания увеличиваются с повышением температуры. Эта тенденция связана с наличием в молекуле гидроксильной группы, так как для полностью замещенных сложных эфиров величина индекса удерживания изменяется незначительно или снижается при повышении температуры.
Зависимости индексов удерживания эфиров от числа углеродных атомов (nC) в линейном алкильном заместителе при температуре колонки 513.2 K описываются следующими уравнениями:
для моноэфиров
для диэфиров
для триэфиров
для тетраэфиров
В методологии расчета индекса удерживания постулируется, что изменение индекса удерживания, приходящееся на один углеродный атом (ΔI/nC), для нормальных алканов равно 100. Известно, что для сложных эфиров некоторых моно- и дикарбоновых кислот индекс удерживания увеличивается на 90–95 е.и. на группу СН2 [29, 37]. Изменение индексов удерживания при увеличении алкильного заместителя (R) на одну CH2-группу для сложных эфиров пентаэритрита составило: 95.8 е.и. – для моноэфиров, 92.1 е.и. – для диэфиров; 88.2 е.и. – для триэфиров и 85.3 е.и. – для тетраэфиров. При этом зависимость изменения индекса на CH2-группу приближается к линейной (рис. 1), что подтверждает отсутствие взаимодействий между молекулами эфира на поверхности фазы. Подобное увеличение (менее 100 на СН2-группу) было получено и для эфиров глицерина (88–95 ед.) [27], неопентилгликоля (91–96 ед.) [28], триметилолпропана (82–90 ед.) [24] (рис. 1).
Энтальпия сорбции
Результаты расчета энтальпии сорбции сложных эфиров пентаэритрита представлены в табл. 3. Анализ полученных данных показывает, что значения энтальпий сорбции при 298.2 линейно зависят от числа углеродных атомов (nC) в линейном алкильном заместителе для моно-, ди-, три- и тетраэфиров (рис. 2).
Таблица 3.
Результаты расчета энтальпии сорбции
| nC | $ - \Delta _{{\text{ж}}}^{n}C_{p}^{^\circ }$, Дж/(моль К) | Тср, K | $ - {{\Delta }_{{{\text{сорб}}}}}\bar {H}$(Тср), кДж/моль | $ - {{\Delta }_{{{\text{сорб}}}}}H^\circ $(298.2), кДж/моль |
|---|---|---|---|---|
| Моноэфиры пентаэритрита | ||||
| 1 | 193.2 | 448.2 | 57.5 ± 0.3 | 86.5 |
| 2 | 200.4 | 468.2 | 58.7 ± 0.2 | 92.8 |
| 3 | 207.6 | 508.2 | 58.5 ± 0.4 | 102.1 |
| 4 | 214.7 | 528.2 | 60.4 ± 0.5 | 109.8 |
| 5 | 221.8 | 518.2 | 63.9 ± 0.3 | 112.7 |
| 3, изо- | 205.1 | 508.2 | 57.2 ± 0.4 | 100.3 |
| 4, изо- | 212.5 | 528.2 | 59.0 ± 0.4 | 107.8 |
| 4, трет- | 208.4 | 518.2 | 56.1 ± 0.1 | 94.2 |
| 5, 2-этил- | 233.9 | 548.2 | 73.3 ± 2.1 | 131.7 |
| Диэфиры пентаэритрита | ||||
| 1 | 185.2 | 448.2 | 61.5 ± 0.3 | 89.2 |
| 2 | 194.9 | 468.2 | 65.2 ± 0.2 | 98.4 |
| 3 | 205.6 | 508.2 | 67.6 ± 0.4 | 110.8 |
| 4 | 216.9 | 528.2 | 71.9 ± 0.5 | 121.8 |
| 5 | 228.7 | 518.2 | 78.2 ± 0.3 | 128.6 |
| 6 | 240.9 | 548.2 | 79.7 ± 2.6 | 139.9 |
| 3, изо- | 201.2 | 508.2 | 64.6 ± 0.4 | 106.9 |
| 4, изо- | 213.1 | 528.2 | 68.9 ± 0.4 | 117.9 |
| 4, трет- | 205.7 | 518.2 | 56.1 ± 2.3 | 101.3 |
| 5, 2-этил- | 249.2 | 548.2 | 96.2 ± 0.5 | 158.5 |
| Триэфиры пентаэритрита | ||||
| 1 | 174.1 | 448.2 | 66.6 ± 0.4 | 92.7 |
| 2 | 185.6 | 468.2 | 72.6 ± 0.3 | 104.1 |
| 3 | 199.4 | 508.2 | 76.9 ± 0.5 | 118.7 |
| 4 | 214.6 | 528.2 | 83.3 ± 0.4 | 132.6 |
| 5 | 230.9 | 518.2 | 92.3 ± 0.5 | 143.1 |
| 6 | 247.9 | 548.2 | 95.8 ± 0.7 | 157.7 |
| 3, изо- | 193.2 | 508.2 | 72.4 ± 0.5 | 112.9 |
| 4, изо- | 209.1 | 528.2 | 78.5 ± 0.4 | 126.6 |
| 4, трет- | 259.5 | 548.2 | 94.8 ± 2.8 | 159.7 |
| Тетраэфиры пентаэритрита | ||||
| 1 | 160.6 | 448.2 | 70.6 ± 0.4 | 94.7 |
| 2 | 173.6 | 488.2 | 77.0 ± 0.3 | 110.0 |
| 3 | 190.3 | 508.2 | 84.9 ± 0.6 | 124.9 |
| 4 | 209.3 | 528.2 | 93.2 ± 0.5 | 141.4 |
| 5 | 230.0 | 518.2 | 104.8 ± 0.5 | 155.4 |
| 6 | 251.8 | 548.2 | 109.6 ± 0.4 | 172.6 |
| 3, изо- | 182.3 | 508.2 | 79.1 ± 0.5 | 117.4 |
| 4, изо- | 202.2 | 528.2 | 84.6 ± 0.7 | 131.1 |
| 4, трет- | 188.1 | 518.2 | 79.0 ± 0.3 | 120.4 |
| 5, 2-этил- | 266.6 | 548.2 | 106.8 ± 1.2 | 173.4 |
Рис. 2.
Зависимости ${{\Delta }_{{{\text{сорб}}}}}H^\circ (298.2)~$ от числа атомов углерода в линейном алкильном заместителе для моно- (1), ди- (2), три- (3) и тетра- (4) эфиров пентаэритрита.

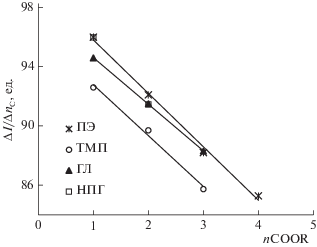
Изменение энтальпий сорбции, рассчитанное внутри гомологических рядов моно-, ди-, три- и полностью замещенных эфиров пентаэритрита и приходящееся на один углеродный атом в алкильном заместителе $\Delta ({{\Delta }_{{{\text{сорб}}}}}H^\circ ){\text{/}}{{n}_{{\text{C}}}}$ в зависимости от числа COOR-групп в молекуле эфиров, также имеет линейный характер (рис. 3), что говорит об аддитивном вкладе гидроксильной и сложноэфирных групп в энтальпию сорбции. Аналогичная зависимость наблюдалась для эфиров триметилолпропана и неопентилгликоля [24, 28] (рис. 3), причем численные значения величин $\Delta ({{\Delta }_{{{\text{сорб}}}}}H^\circ ){\text{/}}{{n}_{{\text{C}}}}$ у этих соединений практически совпадают.
Рис. 3.
Изменение энтальпии сорбции $\Delta ({{\Delta }_{{{\text{сорб}}}}}H^\circ (298.2)){\text{/}}{{n}_{{\text{C}}}}~$ от числа COOR-групп в молекуле эфиров пентаэритрита (ПЭ), триметилолпропана (ТМП) и неопентилгликоля (НПГ).

Среднее изменение энтальпий сорбции, приходящееся на один метиленовый фрагмент, составляет 6.9, 5.1, 4.3, 3.9 кДж/моль соответственно для моно-, ди-, три- и полностью замещенных эфиров пентаэритрита. В работе [31] показано, что в интервале температур 323–328 K величина энтальпии сорбции для нормальных алканов на неполярной фазе (HP-1) снижается в среднем на 4.4–4.5 кДж/моль на CH2-группу. В нашей предыдущей работе был определен аналогичный вклад в энтальпию сорбции (298.2 K) для линейных алканов, который составил 5.4 кДж/моль [28]. Таким образом, более низкое значение вклада метиленового фрагмента в энтальпию сорбции полностью замещенных эфиров пентаэритрита, вероятнее всего обуславливает снижение индекса удерживания при повышении температуры.
Для оценки избыточной энтальпии смешения $\Delta {{H}^{{E,\infty }}}(298.2)$, исходя из имеющихся в литературе данных по давлениям насыщенных паров [38], были рассчитаны значения энтальпии испарения при 298.2 K четырех сложных эфиров пентаэритрита. Избыточная энтальпия смешения является отрицательной величиной (табл. 4), т.е. существующие между эфиром и неполярной фазой межмолекулярные взаимодействия больше, чем взаимодействия между молекулами полностью замещенного эфира пентаэритрита при испарении. Для количественной оценки этих взаимодействий необходим больший объем данных по энтальпиям испарения эфиров пентаэритрита.
Таблица 4.
Результаты расчета избыточной энтальпии смешения $\Delta {{H}^{{E,\infty }}}(298.2)$ для сложных эфиров пентаэритрита
| nC | ${{\Delta }_{{{\text{исп}}}}}H^\circ (298.2)$, эксп., кДж/моль | $ - {{\Delta }_{{{\text{сорб}}}}}H^\circ (298.2)$, кДж/моль | $\Delta {{H}^{{E,\infty }}}(298.2)$, кДж/моль |
|---|---|---|---|
| 4 | 134.0 | 141.4 | –7.4 |
| 6 | 167.5 | 172.6 | –5.1 |
| 8 | 193.6 | 206.1* | –12.5 |
| 5, 2-этил- | 151.6 | 173.4 | –21.8 |
* Значение получено из зависимости энтальпии сорбции тетраэфиров пентаэритрита от числа углеродных атомов в линейном алкильном заместителе (рис. 2).
Таким образом, методом газожидкостной хроматографии на неполярной фазе в температурном интервале 433.2–563.2 K определены характеристики удерживания и сорбции сложных эфиров пентаэритрита и кислот С1–С8 различного строения. Проведен анализ величин индексов удерживания и энтальпий сорбции для сложных эфиров, содержащих различное число эфирных и гидроксильных групп. Показано, что для полностью замещенных сложных эфиров величина индекса удерживания при повышении температуры изменяется незначительно или снижается. Для гомологических рядов моно-, ди-, три- и полностью замещенных эфиров пентаэритрита изменение индекса на один метиленовый фрагмент снижается с 95.8 до 85.3 е.и.
Среднее изменение энтальпий сорбции, приходящихся на один метиленовый фрагмент, для полностью замещенных эфиров пентаэритрита составляет 3.9 кДж/моль, что в абсолютном значении ниже аналогичного вклада для нормальных алканов (4.4–4.5 кДж/моль [31] и 5.4 кДж/моль [28]). Это вероятнее всего обуславливает снижение индекса удерживания при повышении температуры у полностью замещенных эфиров пентаэритрита.
Межмолекулярные взаимодействия между тетраэфирами пентаэритрита и неполярной фазой больше, чем взаимодействия между молекулами эфиров при испарении, что доказывается отрицательными значениями избыточных энтальпий смешения.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 19-08-00928 A).
Список литературы
Громова В.А., Мамарасулова З.В. // Изв. СПбГТИ (ТУ). 2013. № 20(46). С. 64.
Кязимова Н.С. // ХТТМ. 2008. № 3 (547). С. 29.
Nur A.M.A., Robiah Y., Umer R., Nurin W.M.Z. // Tribology International. 2016. V. 93. P. 43.
Quinchia L.A., Delgado M.A., Reddyhoff T., Gallegos C. et al. // Tribol. Int. 2014. V. 69. P. 110.
Yunus R., Fakhru’l-Razi A., Ooi T.L., Omar R. et al. // Ind. Eng. Chem. Res. 2005. V.44. P. 8178.
Ахмедов Р.Л., Кравцова С.С., Дычко К.А., Рамусь И.В. // Аналитика и контроль. 2019. Т. 23. № 4. С. 532.
Яценко Л.А., Воронцова А.А., Чешко И.Д. // ТиПСЕ. 2017. № 1. С. 6.
Fuentes M.J., Font R., Gomez-Rico M.F., Martin-Gullon I. // J. Anal. Appl. Pyrolysis. 2007. V. 79. P. 215.
Babushok V.I. // TrAC-Trend. Anal. Chem. 2015. V. 69. P. 98.
Panneerselvam K., Antony M.P., Srinivasan T.G., Vasudeva Rao P.R. // Termochim. Acta. 2009. V. 495. P. 1.
Яшкин С.Н., Кудашева Н.В. // Химия и хим. технология. 2009. Т. 52. В. 7. С. 48.
Hoskovec M., Grygarova D., Cvačka J. et al. // J. Chromatogr. 2005. V. 1083. P. 161.
Van Roon A., Parsons J.R., Govers H.A.J // Ibid. 2002. V. 955. P. 105.
Emel’yanenko V.N., Yermalayeu A.V., Portnova S.V. et al. // J. Chem. Therm. 2019. V. 128. P. 55.
Pozdeev V.A., Verevkin S.P. // Ibid. 2011. V. 43. P. 1791.
Emel’yanenko V.N., Verevkin S.P. // Fluid Phase Equilibria. 2008. V. 266. P. 64.
Zaitseva K.V., Zaitsau D.H., Varfolomeev M.A., Verevkin S.P. // Ibid. 2019. V. 494. P. 228.
Krasnykh E.L., Druzhinina Y.A., Portnova S.V., Smirnova Y.A. // Ibid. 2018. V. 462. P. 111.
Chickos J.S., Hosseini S., Hesse D.G. // Thermochim. Acta. 1995. V. 249. P. 41.
Srisaipet A., Aryusuk K., Lilitichan S., Krisnangkura K. // J. Chem. Therm. 2007. V. 39. P. 1077.
Siripoltangman N., Chickos J. // Ibid. 2019. V. 138. P. 107.
Nelson C., Chikos J. // Ibid. 2018. V. 121. P. 175.
Orf M., Kurian M., Espinosa L., Nelson C. et al. // Ibid. 2018. V. 126. P. 128.
Красных Е.Л., Александров А.Ю., Соколова А.А. и др. // Журн. физ. химии. 2017. Т. 91. № 2. С. 372.
Портнова С.В., Ямщикова Ю.Ф., Красных Е.Л. // Там же. 2019. Т. 93. № 3. С. 464.
Жабина А.А., Красных Е.Л. // Там же. 2017. Т. 91. № 12. С. 2132.
Леолько А.С., Красных Е.Л., Леванова С.В. // Журн. аналит. химии. 2009. Т. 64. № 11. С. 1154.
Лукина О.Д., Красных Е.Л., Портнова С.В. и др. // Журн. физ. химии. 2020. Т. 94. № 3. С. 1.
Липп С.В., Красных Е.Л., Леванова С.В. // Журн. аналит. химии. 2008. Т. 63. № 4. С. 383.
Яшин Я.И., Яшин Е.Я., Яшин А.Я. Газовая хроматография. М.: ТрансЛит, 2009. 528 с.
Görgenyi M., Heberger K. // J. Chromatogr. Sci. 1999. V. 37. P. 11.
Портнова С.В., Красных Е.Л. // Журн. структур. химии. 2017. Т. 58. № 4. С. 739.
Pavlovskii A.A., Hérberger K., Zenkevich I.G. // J. Chromatogr. A. 2016. V. 1445. P. 126.
Зенкевич И.Г., Павловский А.А. // Аналитика и контроль. 2014. Т. 18. № 2. С. 171.
Зенкевич И.Г., Павловский А.А. // Журн. физ. химии. 2016. Т. 90. № 5. С. 792.
Santiuste J.M., Quintanilla-López J.E., Becerra R., Lebrón-Aguilar R. // J. Chromatogr. A. 2014. V. 1365. P. 204.
Peng C.T. // Ibid. 2000. V. 903. P. 117.
Razzouk A., Mokbel I., Garcıa J., Fernandez J. et al. // Fluid Phase Equil. 2007. V. 260. P. 248.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии