Журнал физической химии, 2020, T. 94, № 10, стр. 1484-1489
Масс-спектрометрическое исследование реакции фтора с бензолом
Е. С. Васильев a, *, Н. Д. Волков a, Г. В. Карпов a, С. В. Савилов b, И. И. Морозов a, В. В. Лунин b
a Российская академия наук, Федеральный исследовательский центр химической физики им. Н.Н. Семёнова
Москва, Россия
b Московский государственный университет имени М.В. Ломоносова,
Химический факультет
Москва, Россия
* E-mail: vasiliev@chph.ras.ru
Поступила в редакцию 20.03.2020
После доработки 20.03.2020
Принята к публикации 14.04.2020
Аннотация
Экспериментально изучена кинетика реакции фтора с бензолом при температуре T = 293 K. Для определения константы скорости реакции применен метод конкурирующих реакций. Взаимодействие изучено в проточном реакторе низкого давления, для контроля концентрации реагентов и продуктов применена масс-спектрометрия. В качестве конкурирующей реакции использована реакция атомов фтора с метаном. Впервые определено соотношение констант скорости исследуемой реакции (k1) и конкурирующей (k2), k1/k2 = 4.4 ± 0.3. С привлечением литературных данных рассчитана константа скорости реакции атомов фтора с бензолом: k1 (293 K) = (2.7 ± 0.5) × 10–10 см3 молекула–1 с–1.
Бензол относится к одному из наиболее распространенных в промышленности типов химических веществ. Известно его негативное воздействие на окружающую среду [1, 2]. В связи с этим представляют значительный интерес его реакции с основными окислителями атмосферы: гидроксильными радикалами и атомами хлора:
Образующийся фенил-радикал далее реагирует с молекулярным кислородом атмосферы. При лабораторном изучении атмосферной химии реакции углеводородов с атомом фтора представляют собой удобный суррогатный источник радикалов, формирующихся в атмосфере. Знание точных кинетических параметров реакции фтора с бензолом позволит планировать эксперимент по определению константы скорости реакции молекулярного кислорода с фенил-радикалом.
В литературе имеется сравнительно небольшое число [3–5] публикаций, демонстрирующих кинетические характеристики реакций молекул бензола с атомами фтора, причем они частично друг другу противоречат. Поэтому целесообразно дополнить данные, доступные научному сообществу.
В работе [3] описано люминесцентное изучение с применением метода конкурирующих реакций процессов взаимодействия фтора с рядом органических соединений, в том числе, с CH4, C2H6, (CH3)2O, CH3CHO, C6H6. Отношение константы скорости реакции с отрывом атома водорода (k1a) к константе скорости реакции атома фтора с метаном (k2) было определено при комнатной температуре, k1а/k2 = 0.97.
(I)
${\text{F}}{\kern 1pt} \bullet + \;{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}} \to {\text{Продукты}},$(Ia)
$\begin{gathered} {\text{F}}{\kern 1pt} \bullet + \;{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}} \to {\text{HF}} + \bullet {\kern 1pt} {{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{5}}, \\ \Delta H_{R}^{0}{\text{(Iа)}} = - {\text{108}}{\text{.4}}\;{\text{кДж/моль}}\;{\text{[6],}} \\ \end{gathered} $(Iб)
$\begin{gathered} {\text{F}}{\kern 1pt} \bullet + \;{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}} \to {\text{H}}{\kern 1pt} \bullet + \;{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{5}}}}{\text{F}}, \\ \Delta H_{R}^{0}{\text{(Iб)}} = - {\text{53}}{\text{.2}}\;{\text{кДж/моль}}\;{\text{[6]}}, \\ \end{gathered} $В [4] методом ИК-спектроскопии установлено, что в реакции атомов фтора с бензолом возможны два канала ее протекания – отрыв атома водорода от молекулы (Ia) и канал замещения атома водорода атомом фтора (Iб). На основе анализа ИК-спектров продуктов установлено, что преобладает замещение – канал (Iб). Отношение сечений реакционных каналов (Iб) и (Ia), σ1b/σ1a, составило величину 3. В этой работе, однако, реагенты при смешивании имели различные температуры. Молекулы бензола находились при комнатной температуре, атомы фтора – при 1100 K. Авторы [7] оценили среднюю температуру реакционной смеси ∼700 K.
Измерение абсолютной величины константы скорости реакции (I) при комнатной температуре также описано для проточного реактора низкого давления с идентификацией продуктов методом масс-спектрометрии [5]. Авторами получено значение k1 = (5.0 ± 1.2) × 10–11 см3 молекула–1 с–1 и определено также отношение констант скорости каналов реакции (Iа) и (Iб) по отношению к константе скорости реакции (I). Канал с отрывом атома водорода был весьма мал: отношение k1а/k1 составляет величину менее 0.08. Канал замещения (Iб) при комнатной температуре основной и отношение k1б/k1 = 0.8. Рекомендуемое значение константы скорости реакции атомов фтора с метаном: k2 = 6.3 × 10–11 см3 молекула–1 с–1 [8]. Это позволяет, используя данные [3], рассчитать значение k1a = (k1a/k2) × k2 = 0.97 × 6.3 × 10–11 = 6.1 × × 10–11 см3 молекула–1 с–1. Мы обратили внимание на то, что это находится в противоречии с результатом исследования [5], где суммарная константа скорости всех каналов реакции (I) меньше и k1 = 5.0 × 10–11 см3 молекула–1 с–1. Исходя из скорости реакции по каналу (Ia) [3] и данным для отношения скоростей каналов [5], можно оценить k1 ≥ 7.6 × 10–10 см3 молекула–1 с–1. Таким образом, имеющиеся данные для константы скорости реакции (I) различаются значительно. Поэтому определение величины k1 с учетом неопределенности ее оценки в этих работах представляет значительный интерес.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В настоящей работе константу скорости реакции атома фтора с бензолом определяли при температуре 293 K. Концентрации реагентов определяли с помощью молекулярно-пучковой масс-спектрометрии. Схема экспериментальной установки представлена на рис. 1.
Рис. 1.
Схема экспериментальной установки: 1 – линии напуска бензола и метана в смеси с гелием, 2 – ВЧ-разряд на линии подачи молекулярного фтора в смеси с гелием, 3 – термостатируемая рубашка, 4 – зона реакции, 5 – система молекулярного напуска, 6 – модулятор пучка, 7 – ионный источник, 8 – электроды квадрупольного масс-спектрометра, 9 – ВЭУ, 10 – синхронный детектор, 11 – ЭВМ.
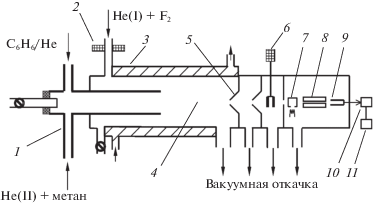
Эксперименты выполняли, используя проточный реактор низкого давления (1–4 на рис. 1), соединенный с масс-спектрометром [9]. Цилиндрический реактор из пирекса имел длину 50 см и внутренний диаметр 2.3 см. По трубке реактора протекал регулируемый поток газа-носителя гелия в смеси с атомами фтора. Вдоль оси реактора располагалась цилиндрическая трубка диаметром 1.7 см. По ней в реактор подавалась газовая смесь, состоящая из бензола и реагента конкурирующей реакции – метана. Типичная скорость газового потока в реакторе составляла 2.7 м/с, общее давление в реакторе 1.0 мбар. Атомы фтора получали в высокочастотном разряде смеси F2 и He (избыток He более 99%). Разрядная кварцевая трубка помещалась в 40 см от напускного сопла масс-спектрометра. Внутри разрядной трубки находилась керамическая вставка из синтетического сапфира (Al2O3), которая препятствовала реакции атомов фтора с пирексом разрядной трубки. Метан – реагент конкурирующей реакции, подавался из колбы, содержащей смесь 5.6% метана с гелием при давлении 0.5–0.9 бар. Бензол также подавался из колбы, в которой он хранился в виде 8.8% смеси c Не. При подаче в реактор происходило смешивание потока бензола и газа-носителя – гелия.
Концентрации веществ в реакторе рассчитывали, осуществляя измерение потоков газовых смесей метана, бензола и молекулярного фтора и сравнение этих потоков с потоком газа-носителя. Расходование компонентов определяли по скорости падения давления при истечении газов из калиброванного объема. В опыте концентрация бензола в реакторе менялась в диапазоне от 11 до 26, метана – от 8 до 25, и молекулярного фтора – от 10 до 13, в единицах 1012 молекула см–3. Степень диссоциации фтора составляла 97%, что для концентрации атомов дает верхнюю границу – 25 × × 1012 атом см–3. Регулировка и стабилизация потока газа-носителя осуществлялись с помощью расходомера Mass Flow Controller 1100 Series (Type 1160 B). Давление в реакторе измеряли мембранным манометром MKS Baratron (Type 122A). Отбор пробы из реакционной зоны в масс-спектрометр осуществляли в форме модулированного молекулярного пучка. Система его формирования состояла из сопла и сепаратора. Пучок модулировался в камере между сепаратором и входной диафрагмой ионного источника масс-спектрометра.
Для достижения вакуума между соплом и входной диафрагмой использовались паромасляные диффузионные насосы, а для ионизации – электронный удар в диапазоне энергии электронов 12–100 эВ. Электронный ток можно было устанавливать в диапазоне от 0 до 2 мА. В качестве фильтра масс использовался квадрупольный масс-спектрометр МС 7303. После разделения по массам ионы регистрировались с помощью вторичного электронного умножителя. Система регистрации включала в себя синхронный детектор (Princeton Applied Research, Model 124A), cоединенный с персональным компьютером. Предел детектирования C6H6 и CH4 составлял ∼1010 молекула см–3 при накоплении сигнала в течение 300 с.
Методика кинетических измерений
Бензол и вещество конкурирующей реакции в различных концентрациях в смесях с избытком газа-носителя (гелия) через центральную трубку поступали в проточный реактор, где совместно протекали два процесса. Из количества превращений обоих веществ определяли отношение констант скоростей исследуемой реакции (k) и конкурирующей реакции (kref) согласно уравнению:
(1)
$\ln ({{[{{C}_{6}}{{H}_{6}}]}_{0}}{\text{/}}[{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{\text{6}}}}]){\text{/}}\ln ({{[{\text{REF}}]}_{0}}{\text{/}}[{\text{REF}}]) = k{\text{/}}{{k}_{{{\text{ref}}}}},$Использованный метод конкурирующих реакций имеет преимущество по сравнению с методами прямого измерения констант скорости – нет необходимости измерять абсолютную концентрацию атомов, что является нетривиальной задачей.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Измерение масс-спектра бензола
В предварительном опыте перед началом кинетического эксперимента было проведено измерение масс-спектра электронного удара бензола (M = 78, масса в а.е.м.), который сравнивался со спектром, известным из базы данных NIST [10]. Спектр получали при энергии электронов 70 эВ. Напуск вещества в смеси с гелием в ионный источник масс-спектрометра осуществляли из реактора в виде молекулярного пучка, что обеспечивало минимальное влияние гетерогенных процессов на стенках электродов ионного источника на характер спектра. Результат представлен на рис. 2 для диапазона m/z = 30–80, в котором расположены 20 основных наиболее интенсивных пиков.
Рис. 2.
Масс-спектр электронного удара бензола при напуске в виде молекулярного пучка. Сравнение с литературными данными (NIST).

Полученный нами спектр оказался подобен спектру по данным NIST. Важно, во-первых, что в масс-спектре присутствует интенсивный молекулярный пик m/z = 78, более того, он наиболее интенсивен. Во-вторых, существенно, что в спектре отсутствовал осколочный пик m/z = 16, по крайней мере, его интенсивность, по данным нашего эксперимента, менее 1% от интенсивности основного пика спектра m/z = 78. Следует отметить, что при проведении эксперимента стремились создать условия, чтобы глубина превращения веществ в реакции была минимальна, хотя для бензола выполнить это было сложно.
В силу этого важно было провести анализ масс-спектра основного по литературным данным [4, 5] продукта реакции (I) – фторбензола, чтобы исключить возможный в результате диссоциативной ионизации вклад ионов продукта в интенсивности молекулярных пиков масс-спектров молекул реагирующих веществ. Предполагали, что возможные изменения масс-спектра, связанные с характером напуска, незначительны, и потому анализировали известный спектр [10]. Большое значение имеют две особенности масс-спектра фторбензола. Первая состоит в том, что в нем отсутствует пик m/z = 78, который мог бы привести к его вкладу в основной пик бензола. Другая существенная черта – отсутствие пика m/z = 16. Масс-спектр метана имеет молекулярный пик m/z = 16, который является основным. Такой характер масс-спектров позволяет проводить независимый контроль изменений концентраций бензола и метана, измеряя интенсивности пиков m/z = 78 и 16 соответственно.
Измерение k1. Конкурирующая реакция – реакция атомов фтора с метаном
Для реакции (I) в [3] приведена величина отношения константы скорости канала с отрывом атома водорода (k1а) к константе скорости реакции F c CH4 (k2), близкая к единице (0.97), поэтому для определения характера ветвления реакции было важно провести измерение k1/kref также по отношению к реакции (II). Кроме того, реакция (II), для которой имеются многочисленные и достаточно точные значения k2, может выступать как эталонная при определении абсолютного значения k1.
Конкурирующая реакция была подобрана так, чтобы бензол можно было бы детектировать по молекулярному пику масс-спектра. Наложения масс-спектров бензола и метана при этом не происходило. Эти условия выполняются в полной мере.
Результат измерений глубины превращения реагента бензола по отношению к глубине превращения метана представлен на рис. 3. Результаты получены при температуре 293 K. Отношение констант k1/kref = (k1/k2)экс определено из наклона прямой линии, полученного в результате линейного регрессионного анализа, согласно уравнению (1). Следует отметить, что в этом опыте глубина превращения бензола была существенно большей, чем глубина превращения метана. Было определено значение (k1/k2)экс = 4.4 ± 0.3 (2σ), полученное с небольшой погрешностью – 7% при существенном различии констант скорости реакции k1 и k2. Расчет значения k1 проводили, умножая полученное в опыте отношение констант на величину k2, согласно уравнению:
Рис. 3.
Зависимость глубины превращения бензола по отношению к глубине превращения метана в реакциях с атомом фтора при температуре 293 K.

В настоящее время существуют три литературных источника [8, 11, 12], в каждом из которых предлагаются разные значения k2 при комнатной температуре. Рекомендуемые значения лежат в диапазоне от 6.22 до 6.7 в единицах 10–11 см3 молекула–1 с–1. Следует отметить достаточно высокую погрешность k2 (∼35%), указанную в [8, 11]. Принимая во внимание только абсолютные измерения k2 (пять публикаций с 1978 г. [13–17]: 7.51, 5.71, 6.59, 6.64, 6.59 × 10–11 см3 молекула–1 с–1) получаем среднее значение k2 = (6.6 ± 1.3) × 10–11 см3 молекула–1 с–1 (погрешность в скобках составляет 2σ). Мы посчитали необходимым добавить к списку еще значение из [18] (6.22 × 10–11 см3 молекула–1 с–1), которое было получено из непрямых измерений. Добавление последней достоверной величины приводит к значению k2 = (6.5 ± 1.2) × × 10–11 см3 молекула–1 с–1. Для этого ряда значений k2 погрешность составляет 18%. Эта величина была использована при расчете погрешности k1. Заметим, что при расчете значения k1 основная погрешность связана с точностью, с которой известна константа эталонной реакции. С использованием (k1/k2)экс = 4.4 ± 0.3 и величины k2 = = 6.22 × 10–11 см3 молекула–1 с–1, рекомендуемой в [18] было рассчитано значение k1(293 K) = (2.7 ± ± 0.5) × 10–10 см3 молекула–1 с–1.
Из сопоставления полученного нами отношения k1/k2 = 4.4 ± 0.3 с данными работы [3], где для канала реакции с отрывом водорода было получено отношение k1а/k2 = 0.97, в предположении механизма, который включает только канал замещения и канал отрыва атома водорода, k1/k2 = = (k1а + k1б)/k2, можно сделать вывод, что канал замещения является доминирующим. Можно оценить роль канала замещения, если вычесть из (k1а + k1б)/k2 величину k1а/k2, что дает k1б/k2 = 3.4. Таким образом, величина k1б/k1а = 3.5 и соотношение между каналами реакции (Iа) и (Iб) – 22 и 78%. Такой расчет для комнатной температуры показывает хорошее соответствие с результатом работы [4] для высокой температуры, в которой была получена близкая оценка отношения сечений каналов реакции – σ1б/σ1а = 3.
В результате абсолютных измерений в [5] получено значение k1 = (5.0 ± 1.2) × 10–11 см3 молекула–1 с–1, которое существенно меньше величины, определённой в нашей работе: (2.7 ± 0.5) × × 10–10 см3 молекула–1 с–1. С использованием следующих данных: k1а/k2 = 0.97 [3], k1а/k1 ≤ 0.08 [5] и k2 = 6.3 × 10–11 см3 молекула–1 с–1 [8], был рассчитан нижний предел k1 ≥ 7.6 × 10–10 см3 молекула–1 с–1. Таким образом, определенное нами значение для k1 = (2.7 ± 0.5) × 10–10 заметно превышает результат абсолютных измерений (5.0 ± 1.2) × 10–11, но находится ниже нижней границы по оценке ряда литературных данных – 7.6 × 10–10 (размерности – см3 молекула–1 с–1).
Необходимо отметить, что в работе мы старались исключить протекание вторичных реакций, понижая концентрации реагирующих веществ до минимальных измеримых уровней, и стремились создать такие условия, чтобы глубины превращения веществ в реакциях были минимальны.
Полностью исключить возможность протекания вторичных реакций в описываемых условиях нельзя, но, по нашей оценке, они не оказывают значительного влияния на концентрации бензола и метана. Так, реакция (III) приводит к некоторому восстановлению концентрации метана, который расходуется в первичной реакции:
(III)
$\begin{gathered} {\text{H}}{\kern 1pt} \bullet + \bullet {\kern 1pt} {\text{C}}{{{\text{H}}}_{3}} + {\text{He}} \to {\text{C}}{{{\text{H}}}_{4}} + {\text{He}}, \\ k_{3}^{ \circ } = 6.2 \times {{10}^{{--29}}}\;{\text{с}}{{{\text{м}}}^{6}}\;{\text{молекул}}{{{\text{а}}}^{{--2}}}\;{{{\text{с}}}^{{--1}}}\;[19]. \\ \end{gathered} $Существует ряд вторичных реакций, которые снижают вклад метана из реакции (III). Концентрация радикала CH3 уменьшается, во-первых, в ходе быстрой вторичной реакции с участием атомарного фтора, протекающей по двум каналам:
(IVa)
$ \bullet {\kern 1pt} {\text{C}}{{{\text{H}}}_{3}} + {\text{F}} \bullet \to \bullet {\kern 1pt} {\text{C}}{{{\text{H}}}_{2}} + {\text{HF}},$(IVб)
$ \to \bullet {\kern 1pt} {\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{F}} + {\text{H}} \bullet ,$Кроме того, вторичная реакция:
(V)
$ \bullet {\kern 1pt} {\text{C}}{{{\text{H}}}_{3}} + \bullet {\kern 1pt} {\text{C}}{{{\text{H}}}_{3}} + {\text{He}} \to {{{\text{C}}}_{{\text{2}}}}{{{\text{H}}}_{6}} + {\text{He}},$Другая вторичная реакция, которая влияет на кинетику реакции радикала CH3, снижая его концентрацию, – взаимодействие метильного радикала с молекулярным фтором (который не диссоциировал в разряде). В высокочастотном разряде глубина диссоциации молекулярного фтора ∼97%:
(VI)
$ \bullet {\kern 1pt} {\text{C}}{{{\text{H}}}_{3}} + {{{\text{F}}}_{2}} \to {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{F}} + \bullet {\text{F}},$Влияние реакций (VI) и (VII) невелико, так как концентрация молекулярного фтора составляет лишь около процента от концентраций реагентов первичных реакций и на порядок меньше, чем возможные концентрации продуктов первичных реакций. В то же время, реакции (VI) и (VII), понижая концентрации радикала CH3 и атомов H, уменьшают влияние реакции (III) на результаты измерений.
ЗАКЛЮЧЕНИЕ
При температуре 293 K изучена кинетика реакции атомов фтора c бензолом: определена константа скорости реакции k1 = (2.7 ± 0.5) × 10–10 см3 молекула–1 с–1. Методом конкурирующих реакций определено отношение констант скорости k1/kref, в качестве реакции сравнения использована реакция атомов фтора с метаном, k1/k2 = 4.4 ± 0.3 (2σ). Значение k1 получено с использованием данных [18] для константы скорости конкурирующей реакции k2. Определено соотношение между двумя возможными каналами реакции, составляющее 22 и 78%, что хорошо согласуется с данными [4], полученными при высоких температурах.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 19-05-50076 (Микромир)), ГЗ РФ (Тема V.45.12, 0082-2014-0012, № АААА-А20-120021390044-2).
Список литературы
Bruckner J.V., Anand S.S., Warren D.A. Toxic Effects of Solvents and Vapors. Ch. 24 in Casarett and Doull’s Toxicology. 7th Edition. Ed. by C.D. Klaasen. N.Y.: McGraw Hill Medical, 2008. P. 1007−1010.
Омельяненко Л.М., Сенкевич Н.А. Клиника и профилактика отравлений бензолом. М.: Наука, 1957. С. 80−87.
Smith D.J., Setser D.W., Kim K.C. et al. // J. Phys. Chem. 1977. V. 81. № 9. P. 898. https://doi.org/10.1021/j100524a019
Moehlmann J.G., McDonald J.D. // J. Chem. Phys. 1975. V. 62. № 8. P. 3061. https://doi.org/10.1063/1.430904
Ebrecht J., Hack W., Wagner H.Gg. // Ber. Bunsenges. Phys. Chem. 1989. V. 93. №. 5. P. 619. https://doi.org/10.1002/bbpc.19890930520
Гурвич Л.В., Караченцев Г.В., Кондратьев В.Н, Лебедев Ю.А., Медведев В.А., Потапов В.К., Ходеев Ю.С. Энергии разрыва химических связей. Потенциалы ионизации и сродство к электрону. М.: Наука, 1974. С. 351.
Moehlmann J.G., Gleaves J.T., Hudgens J.W. et al. // J. Chem. Phys. 1974. V. 60. № 12. P. 4790. https://doi.org/10.1063/1.1680982
Atkinson R., Baulch D.L., Cox R.A. et al. // Atmos. Chem. Phys. 2006. V. 6. № 11. P. 3625. https://doi.org/10.5194/acp-6-3625-2006
Васильев Е.С., Морозов И.И., Хак В. и др. // Кинетика и катализ. 2006. Т. 47. № 5. С. 1.
NIST Mass Spec Data Center, Stein S.E., director, “Mass Spectra” in NIST Chemistry WebBook, NIST Standard Reference Database Number 69, Eds. Linstron P.J., Mallard W.G. National Institute of Standards and Technology, Gaithersburg MD, 20899, (retrieved October 8, 2018).
DeMore W.B., Sander S.P., Golden D.M. et al. // Chemical Kinetics and Photochemical Data for Use in Stratospheric Modeling, Evaluation No. 12, JPL Publication 97–4, JPL: Pasadena, CA, January 15, 1997.
Persky A. // Chem. Phys. Lett. 1998. V. 298. № 4–6. P. 390. https://doi.org/10.1016/S0009-2614(98)01154-3
Clyne M.A.A., Nip W.S. // Int. J. Chem. Kinet. 1978. V. 10. № 4. P. 367. https://doi.org/10.1002/kin.550100404
Fasano D.M., Nogar N.S. // Chem. Phys. Lett. 1982. V. 92. № 4. P. 411. https://doi.org/10.1016/0009-2614(82)83438-6
Clyne M.A.A., Hodgson A. // Chem. Phys. 1983. V. 79. № 3. P. 351. https://doi.org/10.1016/0301-0104(83)85259-8
Pagsberg P., Munk J., Sillesen A. et al. // Chem. Phys. Lett. 1988. V. 146. № 5. P. 375. https://doi.org/10.1016/0009-2614(88)87462-1
Worsdorfer U., Heydtmann H. // Ber. Bunsenges. Phys. Chem. 1989. V. 93. № 10. P. 1132. https://doi.org/10.1002/bbpc.19890931016
Persky A. // Chem. Phys. Lett. 2006. V. 430. № 4–6. P. 251. https://doi.org/10.1016/j.cplett.2006.09.013
Baulch D.L., Cobos C.J., Cox R.A. et al. // J. Phys. Chem. Ref. Data. 1994. V. 23. № 6. P. 847. https://doi.org/10.1063/1.555953
Beiderhase Th., Hack W., Hoyermann K. // Z. Phys. Chem. (Munchen). 1995. V. 188. №. 1. P. 227. https://doi.org/10.1524/zpch.1995.188.Part_1_2.227
Riffault V., Bedjanian Y., Le Bras G. // J. Phys. Chem. A. 2003. V. 107. № 28. P. 5404. https://doi.org/10.1021/jp0226127
Moore C.M., Smith I.W.M., Stewart D.W.A. // Int. J. Chem. Kinet. 1994. V. 26. № 8. P. 813. https://doi.org/10.1002/kin.550260804
Cohen N., Westberg K.R. // J. Phys. Chem. Ref. Data. 1983. V. 12. № 3. P. 531. https://doi.org/10.1063/1.555692
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


