Журнал физической химии, 2020, T. 94, № 11, стр. 1698-1705
Спектральное исследование “обратного” влияния металла на свойства носителя
Л. М. Кустов a, b, *, Е. А. Редина a, О. П. Ткаченко a, А. Л. Кустов a, b, В. Б. Казанский a
a Российская академия наук, Институт органической химии имени Н.Д. Зелинского
119991 Москва, Россия
b Московский государственный университет имени М.В. Ломоносова,
Химический факультет
119992 Москва, Россия
* E-mail: lmk@ioc.ac.ru
Поступила в редакцию 27.04.2020
После доработки 27.04.2020
Принята к публикации 29.04.2020
Аннотация
Рассмотрены эффекты взаимного влияния нанесенных металлических наночастиц и носителя для различных случаев, когда носитель представляет собой твердую кислоту, твердое основание, полупроводник или проводящий материал. Особое внимание уделено обратной стороне такого взаимного влияния, т.е. модификации свойств самого носителя за счет влияния металлических частиц, которое ранее практически не исследовалось и не рассматривалось.
Металлические наночастицы, нанесенные на пористые носители, являются предметом постоянного интереса в связи с их разнообразными практическими применениями. Особенно широко такие материалы применяются в катализе, при этом свойства катализаторов в значительной мере определяются структурными, электронными и другими характеристиками нанесенных наночастиц. Высокая каталитическая активность металлических катализаторов может быть обусловлена такими факторами, как морфология и размер металлических наночастиц, взаимодействие металла с носителем, а также метод синтеза образцов [1]. Носитель способствует стабилизации наночастиц малого размера, в некоторых случаях, с размером менее 1 нм, а также в значительной мере определяет морфологию нанесенной наночастицы и равномерность распределения наночастиц по размерам. Это справедливо даже в тех случаях, когда носитель представляет собой инертный материал, который не взаимодействует с нанесенными металлическими частицами, но за счет своей пористой структуры, особенно в случае наличия микропор способствует стабилизации очень мелких частиц за счет топологических (геометрических) эффектов.
Подбор оптимальных условий синтеза металлических катализаторов может приводить к сильному взаимодействию металла с носителем, в результате чего наблюдается явление переноса электронов с металла на носитель с образованием частичного положительного заряда на металле либо перенос в обратном направлении, в результате чего металл приобретает частичный отрицательный заряд [2–4]. Данный факт весьма интересен, поскольку в результате переноса заряда изменяются свойства металлических частиц, включая каталитические свойства, такие, как активность и селективность. Так, например, для нанесенных частиц золота показано, что с уменьшением размера частицы уменьшается длина связи металл–металл и увеличивается плотность d-электронов [5]. Относительное число атомов металла на гранях, ребрах и в вершинах наночастицы однозначно определяются ее размером [6].
Перенос заряда достаточно надежно определяется физико-химическими методами исследования, в частности, методами рентгеновской фотоэлектронной спектроскопии (РФЭС), тонкой структуры поглощения рентгеновского излучения при использовании синхротронного излучения (XAFS), ИК-спектроскопии с использованием молекулы CO в качестве зонда. Наиболее часто влияние эффекта переноса заряда на каталитические свойства в литературе описано для металлических наночастиц, содержащих в своем составе благородные (Pt, Pd, Au, Rh, Ir, Ru) металлы [7].
Отметим, что носители могут иметь принципиально разную природу, как с точки зрения кислотно-основных свойств (твердые кислоты, например, цеолиты, сульфатированные оксиды, глины, и твердые основания, такие как гидротальциты, оксиды щелочно-земельных металлов и др.), так и с точки зрения электропроводящих свойств: изоляторы (цеолиты, оксиды непереходных металлов), полупроводники (оксиды и халькогениды переходных металлов) и проводники (углеродные материалы, некоторые полимеры). В настоящем миниобзоре рассмотрены случаи взаимодействия нанесенных наночастиц металлов с носителями кислотного или основного типов, оксидными полупроводниками и проводящими материалами (углеродные носители).
МЕТАЛЛЫ, НАНЕСЕННЫЕ НА КИСЛОТНЫЕ НОСИТЕЛИ
Большинство кислотных носителей представляют собой оксидные материалы со свойствами изоляторов (кислотные формы цеолитов, сульфатированные оксиды, гетерополикислоты и др.). Присутствие достаточно сильных кислотных центров в непосредственной близости от нанесенных металлических наночастиц в большинстве случаев приводит к образованию электронодефицитных металлических частиц, имеющих небольшой положительный заряд, как правило, значительно меньше +1, который распределен по всей наночастице [2–4]. Очевидно, подобные эффекты могут наблюдаться только при условии достаточно малых размеров наночастиц, как правило, меньше 1–2 нм или 100–1000 атомов, иначе эффекты заряжения нивелируются. Очевидно, топология носителя или архитектура его пор в значительной мере определяют морфологию или форму нанесенных наночастиц. В то же время для частиц очень малого размера (до 2–3 нм) обычно наблюдается не столь значительное многообразие форм частиц, в большинстве случаев, это – сферы, полусферы, диски или стержни. Именно размер наночастицы в большей степени, нежели форма, является критическим параметром, определяющим свойства наночастицы и степень их отличия от свойств массивного металла, с одной стороны, и свойств единичных атомов металла, с другой стороны.
Как уже было отмечено, существуют три основных метода определения степени заряженности металлических наночастиц, два из них – прямые методы: (1) рентгеновская фотоэлектронная спектроскопия (РФЭС) и (2) рентгеновская абсорбционная спектроскопия с использованием синхротронного излучения (EXAFS/XANES). Третий метод – ИК-спектроскопия с использованием адсорбированных молекул-зондов, главным образом, СО, не является прямым, поскольку косвенная оценка степени заряжения металлических частиц может быть получена из величин сдвигов полос карбонильных комплексов металлов по отношению к наблюдаемым для комплексов нейтральных (незаряженных частиц). Так, например, полоса линейной формы комплекса СО с платиной на силикагеле наблюдается при 2085 см–1, в то время как платина, нанесенная на кислотные или основные формы цеолитов, дает комплексы, максимумы которых смещаются в область более высоких частот (2090–2110 см–1, электронодефицитные частицы). Отметим, что все три метода имеют определенные недостатки, в том числе возможность электростатического заряжения образца (и металлических частиц) под действием рентгеновского излучения, а также перенос электронной плотности или модифицирование металлических частиц в результате адсорбции СО, которая, как известно, в ряде случаев, например, для частиц иридия или родия, может приводить к дезинтеграции наночастиц [8], что, однако, не наблюдается в случае Pt, Pd, Au и некоторых других металлов. Для контроля свойств носителя могут быть использованы разные методы, но метод ИК-спектроскопии с применением молекул-зондов является чрезвычайно чувствительным. При этом по спектрам, например, адсорбированного СО можно одновременно получать оценку степени заряжения наночастицы металла и степень изменения донорно-акцепторных свойств локальных центров на поверхности носителя, в том числе, льюисовских кислотных центров [9].
Рентгеновская абсорбционная спектроскопия (XAS) при изучении края L3 металла позволяет получить информацию о структуре и электронном состоянии металлической частицы. Уровень Ферми или край L3 металла смещаются в случае положительного заряжения частицы в область более низких энергий [10]. Более того, интенсивность так называемой белой линии увеличивается в случае положительного заряжения частиц.
Весьма эффективным и чувствительным методом исследования электронного состояния нанесенных металлов зарекомендовал себя метод рентгеновской фотоэлектронной спектроскопии (РФЭС). Положение энергии связи электрона указывает на окислительное состояние металла [11]. Однако, следует отметить, что должно быть принято во внимание смещение остовных уровней при изменении размера частицы. Исследования нанесенных наночастиц металлов размером менее 10 нм методом РФЭС указывают на значительный сдвиг энергии связи электронов остовных уровней по сравнению со значением для массивного металла. Обычно причиной этого сдвига служит перенос электронной плотности между металлом и носителем, однако, размерные и геометрические эффекты могут вносить свой вклад в величину сдвига. В частности, геометрические факторы, такие как форма частиц или морфология, в том числе, отклонение от сферической формы и образование плоских (дискообразных) или вытянутых (нити, стержни) частиц могут играть существенную роль в изменении электронного состояния нанесенных металлических наночастиц [10].
Размерный эффект, связанный с уменьшением координационного числа поверхностных атомов металла при уменьшении размера частицы, в основном, ответственен за снижение энергии связи остовных электронов. Электронный обмен с носителем может приводить к изменению энергии связи электронов, излучаемых наночастицей [12].
Очевидно, что не только носитель влияет на электронные свойства и заряд металлической наночастицы, но и металл должен изменять свойства носителя. Таких работ, в которых бы был надежно установлен обратный эффект взаимодействия носителя с металлом, практически не существует, за исключением одной чисто каталитической работы по гидрированию, в которой было показано уменьшение скорости реакции, протекающей по кислотному механизму, после нанесения металлических наночастиц платины на Н-форму цеолита, и наблюдаемый эффект был объяснен снижением кислотности цеолита после нанесения платины. Единственная работа, в которой этот “обратный” эффект влияния металла на кислотность различных кислотных катализаторов, включая цеолиты и сульфатированные оксиды, был доказан как спектральными методами (с использованием низкочастотных сдвигов полос поглощения кислотных ОН-групп при образовании комплексов с молекулами слабых оснований), так и кинетическими методами – по снижению после нанесения платины скорости кислотно-катализируемой реакции олигомеризации этилена, протекающей на бренстедовских кислотных центрах, была опубликована нами [13]. Было показано, что благодаря взаимодействию наночастиц металла с носителем наблюдается формирование электронодефицитных (частично положительно заряженных) частиц металла на кислотных носителях, при этом за счет переноса электронной плотности с металла на носитель ослабляются кислотные свойства (бренстедовские кислотные центры) самого носителя.
Таким образом, при взаимодействии металлической наночастицы с кислотным носителем происходят (а) частичное положительное заряжение металла и (б) ослабление кислотных свойств самого кислотного носителя.
МЕТАЛЛЫ НА ОСНÓВНЫХ НОСИТЕЛЯХ
К твердым основаниям, проявляющим сильные основные свойства, относятся, в первую очередь, щелочные формы цеолитов, оксиды щелочно-земельных металлов, оксиды, содержащие нанесенные карбонаты металлов и некоторые другие. В отличие от систем с металлами, нанесенными на сильнокислотные носители, присутствие на поверхности носителя сильных основных центров – как правило, решеточных атомов кислорода, реже фтора, может приводить к некоторому отрицательному заряжению частиц металла и формированию электроноизбыточных наночастиц [14]. Этот тип заряженных наночастиц существенно отличается по своим свойствам, в том числе адсорбционным и каталитическим, от нейтральных, незаряженных наночастиц или от положительно заряженных, электроно-акцепторных частиц, которые образуются на кислотных носителях. Отметим, что на электронное состояние металла может также влиять адсорбция электронодонорных и электроноакцепторных молекул.
Оценка степени заряжения металлических частиц может быть получена из величин сдвигов полос карбонильных комплексов металлов по отношению к полосам комплексов незаряженных частиц металла. Так, если полоса линейной формы комплекса СО с платиной на силикагеле наблюдается при 2085 см–1, то для платины, нанесенной на основные формы цеолитов, полосы поглощения линейных карбонилов смещаются в область более низких частот (2040–2070 см–1, электроноизбыточные частицы), в отличие от ранее рассмотренного случая электронодефицитных частиц металла [14]. Подобные низкочастотные сдвиги полос адсорбированного СО наблюдались и для оксидных систем, например, для Pt/Cs2CO3/ZrO2, Pt/MgO-Al2O3, Pt/MgO и других систем на основных носителях [14].
При исследовании подобных металлических частиц на основных носителях методом рентгеновской абсорбционной спектроскопии (XAS) по положению края L3 металла уровень Ферми или край L3 металла смещаются в случае отрицательного заряжения частицы в область более высоких энергий, т.е. в противоположном направлении по сравнению с металлами на кислотных носителях. В отличие от случая положительного заряжения металлической частицы, для металла на носителе, проявляющем сильноосновные свойства, интенсивность “белой” линии, наоборот, уменьшается при их отрицательном заряжении [5].
Подобные эффекты отрицательного заряжения металла отмечены также для родия на модифицированных оксидах циркония, а также для рутения на оксидах щелочно-земельных металлов, которые применяются как катализаторы синтеза аммиака [15]. В последнем случае положительный эффект основных носителей или промоторов на активность рутениевых систем объяснен донированием электронов от носителя на металлическую частицу. В таком случае при адсорбции двухатомной молекулы азота на Ru избыточная электронная плотность с d-орбиталей Ru переносится на антисвязывающую орбиталь молекулы N2, что приводит к ослаблению связи N–N и облегчает диссоциативную адсорбцию азота, которая, как известно, является лимитирующей стадией синтеза аммиака. Для Ru/MgO и Ru/CaO энергия связи электронов (Eb) Ru 3d5/2 равна 279.8 и 279.5 эВ соответственно [16]. Эти величины Eb существенно меньше, чем Eb для металлического рутения (280.0 эВ). Напротив, значения Eb (Ru 3d5/2) для Ru/Al2O3 и Ru/SiO2 близки или несколько больше наблюдаемого для массивного рутения. В работе [17] было также показано, что после модифицирования Ru/MgO добавками CsNO3 и восстановления при 400°C наблюдается значительный сдвиг энергии связи электрона Ru 3d5/2 и Ru 3d3/2 на ∼1 эВ в сторону более низких значений относительно массивного рутения, что согласуется также с данными [18–21].
В подобных системах уменьшение Eb Ru 3d5/2 для Ru–Cs+/MgO (279.7 эВ) по отношению к металлическому рутению (280.2 эВ) трактуется как снижение работы выхода рутения за счет переноса электронной плотности на частицу рутения, что связано с возрастанием активности Ru–Cs+/MgO относительно Ru/MgO в синтезе аммиака при 250–400°C [15].
Существуют и другие довольно многочисленные примеры отрицательного заряжения металла за счет влияния основного носителя, причем этот эффект приводит к усилению гидрирующих свойств металла. Отметим, что в литературе нет ни одного свидетельства обратного влияния отрицательного заряжения наночастиц металла на свойства основного носителя. Этот вопрос обходится стороной, видимо, в силу того, что именно металл определяет активность в каталитических реакциях. Единственная работа, в которой установлен такой обратный эффект наночастиц металла на свойства основного носителя, опубликована нами и посвящена изучению систем Pt/Cs2CO3/ZrO2 и Pt/ZrO2 [12]. В этой работе показано, что более основный носитель способствует более значительному отрицательному заряжению платины, при этом основные свойства решеточных ионов кислорода, ответственных за основные свойства, ослабевают за счет переноса электронной плотности с носителя на металл. В качестве меры силы основных центров был использован сдвиг полосы в спектрах молекул адсорбированного ацетилена в комплексе: Н–С≡С–Н···Ореш.
Таким образом, при взаимодействии металлической наночастицы с основным носителем происходят (а) частичное отрицательное заряжение металла и (б) ослабление основных свойств самого основного носителя.
НАНОЧАСТИЦЫ МЕТАЛЛОВ НА ОКСИДНЫХ ПОЛУПРОВОДНИКАХ
Большинство оксидных систем с полупроводниковыми свойствами, применяемых в качестве носителей катализаторов, представляют собой полупроводники n-типа. Среди них наиболее часто изучаются оксиды титана, церия, цинка и некоторые смешанные оксидные системы на их основе. В подавляющем большинстве публикаций для таких систем с нанесенными благородными металлами (Pt, Au) обнаружено появление электроно-избыточных, т.е. отрицательно заряженных металлических наночастиц с размерами 1–3 нм [22]. Так, частицы Pt или Pd на CeO2 или TiO2, которые приобретали отрицательный заряд за счет переноса электронной плотности с носителя, проявляли повышенную способность к диссоциации водорода [23–25], что в результате приводило к увеличению активности в реакциях гидрирования алкенов, циннамальдегида или хлоронитробензолов [26].
Процессы, протекающие на границе контакта нанесенного металла и полупроводникового носителя, можно рассматривать с использованием понятия работы выхода электрона. Под работой выхода электрона (А) понимается то минимальное значение энергии, которую должен получить (либо затратить) электрон, чтобы преодолеть силы внутренних связей в веществе и выйти из металла или полупроводника. Очевидно, что чем меньше значение работы выхода у материала, тем легче электрону покинуть материал.
Для нанесения металлических частиц при приготовлении катализаторов обычно используются не собственные, а примесные полупроводники, т.е. полупроводники с электронным типом проводимости (n-типа), например, смешанные оксиды на основе церия, титана, цинка и некоторых других металлов. Гораздо реже в качестве носителей применяются полупроводники с дырочным типом проводимости (p-типа), например, оксиды меди, это связано, как правило, с низкой величиной удельной поверхности таких оксидных систем. Однако, возможен вариант, и он достаточно часто реализуется в синтезе сложных оксидных катализаторов, когда и оксид с полупроводниковыми свойствами, и металл наносят на один пористый носитель, и в этом случае их контакт становится неизбежным. Рассмотрим процессы, происходящие в случаях контакта металла и полупроводника при различных соотношениях величин работ выхода электрона у контактируемых частиц, при этом мы вынуждены допустить, что работа выхода для нанесенной частицы не сильно отличается от работы выхода массивного вещества (полупроводника или металла). Данные по работам выхода электрона для некоторых металлов и оксидов приведены в табл. 1.
Таблица 1.
Данные по работам выхода электрона (А) для некоторых металлов и оксидов
| Металл | А, эВ |
|---|---|
| Ag | 4.7 |
| Au | 4.8 |
| Co | 4.40 |
| Cr | 4.60 |
| Cu | 4.36 |
| Fe | 4.40–4.71 |
| Ir | 4.57 |
| Ni | 4.91–5.01 |
| Os | 4.55 |
| Pd | 4.98 |
| Pt | 5.30–5.55 |
| Re | 4.98 |
| Rh | 4.75 |
| Ru | 4.52 |
| CuO | 4.35–5.34 |
| Cu2O | 5.15 |
| FeO | 3.85 |
| MoO3 | 4.25 |
| NiO | 5.55 |
| ThO2 | 2.54–2.67 |
| TiO | 2.96–3.1 |
| TiO2 | 4.7 |
| WO2 | 4.96 |
Из приведенной таблицы видно, что в большинстве своем работа выхода для металлов, может быть, за исключением меди, существенно выше, чем работа выхода для оксидного полупроводника n-типа, особенно в тех случаях, когда полупроводниковый оксид частично восстановлен, как это происходит в случае реализации сильного взаимодействия металла с носителем, например, для системы Pt/TiOx (где х < 2). В этом случае работа выхода частично восстановленного диоксида титана находится в интервале от 2.96 до 4.7 эВ, видимо, где-то посредине этого интервала (∼3.85 эВ), что значительно меньше работы выхода для любого металла, даже меди.
Хотя не все варианты электронных равновесий между металлом и полупроводником реализуются в каталитических системах, тем не менее, рассмотрим все четыре возможных случая.
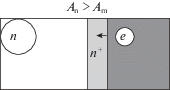
1. Пусть работа выхода электрона из полупроводника с электронным типом проводимости (n-типа) больше работы выхода электрона из металла: An > Am. Это может быть вариант, когда медь (металл с наиболее низкой работой выхода) нанесена на оксид никеля или вольфрама (оксиды с наиболее высокой работой выхода). Тогда электроны из полупроводникового материала не могут его покинуть, в то же время электроны из металла переходят на полупроводник. В месте контакта в полупроводнике образуется слой с повышенной концентрацией основных носителей заряда – электронов (рис. 1). При этом металл, отдающий электроны, приобретает частичный положительный заряд.
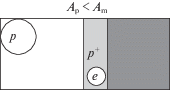
2. Для контакта полупроводника с дырочным типом проводимости (р-типа), когда работа выхода электрона из металла больше работы выхода электрона из полупроводника, Аm > Ap, электроны из контактной области полупроводника переходят на металл, а в контактной области образуется избыточная концентрация основных носителей – дырок (рис. 2). Это чисто теоретический вариант, который практически не реализуется в каталитических системах.
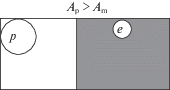
3. Пусть работа выхода электрона из полупроводника n-типа меньше работы выхода электрона из металла: An < Am. В этом случае электроны из контактной области полупроводника переходят на металл, и он заряжается частично отрицательно (рис. 3). В полупроводнике, непосредственно прилегающем к контактной области, образуется слой, обедненный основными носителями для данного типа полупроводника (т.е. образуется не- скомпенсированный положительный заряд). Это – наиболее часто реализуемый вариант взаимодействия в каталитических системах, например, платина, нанесенная на частично восстановленные оксиды и смешанные оксиды (TiO2, CeO2, CeO2–ZrO2, ZnO, SnO2).
4. При соединении полупроводника с дырочным типом проводимости (полупроводник р-типа), для которого работа выхода электрона больше, чем работа выхода контактирующего с ним металла, т.е. Аm < Ap, электроны из металла переходят на полупроводник (рис. 4). В контактной области в полупроводнике при этом образуется пониженная концентрация основных носителей заряда – дырок, а перенесенные электроны заряжают контактный слой отрицательно. Это – типичный случай взаимодействия оксида меди (I) – полупроводника р-типа (А = 5.15 эВ) с любым металлом, обладающим меньшей работой выхода (все, кроме платины).
В литературе приводится масса примеров реализации случая (3). Для таких систем методами РФЭС, ИК-спектроскопии адсорбированного СО, и EXAFS экспериментально установлен эффект частичного отрицательного заряжения частиц металла за счет электронного взаимодействия с полупроводниковым материалом (оксидом) n-типа.
Ранее нами в ряде работ было также показано, что восстановленные частицы золота, платины или рутения на TiO2 или CeO2–ZrO2 приобретают отрицательный заряд, в результате это приводит к эффекту “гигантского” спилловера, т.е. значительного возрастания отношения Н/Me, которое в некоторых случаях достигает 20–30, а при очень низких содержаниях металла и 100 [22, 27–31]. Такой эффект спилловера приводит к резкому возрастанию каталитической активности в низкотемпературном гидрировании нитроароматических соединений, еналей и енонов, причем высокая активность и селективность по целевым продуктам наблюдается даже при минусовых температурах (от –30 до 0°С).
Другая особенность подобных систем, помимо “гигантского” спилловера, – легкость протекания процесса восстановления ионов носителя за счет каталитического эффекта благородного металла [22, 27–30]: температура начала восстановления ионов Се4+ до Се3+ или Ti4+ до Ti3+ в решетке носителя снижается на 100–200 K по сравнению с восстановлением чистого носителя. Частичное восстановление титана до Ti3+ приводит к уменьшению ширины запрещенной зоны, тем самым, изменяет оптические и фотокаталитические свойства оксида титана.
Для подобных каталитических систем также достаточно детально изучен размерный эффект. При уменьшении размера наночастицы уменьшается и длина связи металл–металл. Так, для частиц золота размером менее 3 нм, нанесенных на оксиды титана, циркония, церия и ниобия длина связи Au–Au уменьшается на 0.15 Å [5, 31]. Как уже упоминалось, уменьшение размера частицы приводит также к уменьшению интенсивности “белой” линии в спектре XANES. Как уменьшение длины связи металл–металл, так и снижение интенсивности “белой” линии свидетельствуют об увеличении плотности d-электронов в атомах Au в составе очень малых частиц.
При уменьшении размеров частиц металла не только увеличивается доля поверхностных атомов металла, но также происходят другие изменения свойств металла: например, кубическая гранецентрированная решетка, типичная для крупных частиц и массивного золота трансформируется в декаэдрическую или икосаэдрическую структуру в случае очень малых частиц (менее 3 нм). Предположительно, переход от кубической гранецентрированной решетки к декаэдрической должен происходить в случае частиц, содержащих ∼200 атомов металла (размер ∼2.5 нм), а переход к икосаэдрической структуре – в случае частиц, включающих не более 100 атомов (1.6 нм).
В дополнение к сжатию (уменьшению длины связей металл–металл) наблюдаются соответствующие изменения в электронных, магнитных и химических свойствах Cu, Ag, Au, и Pt, если толщина металлической пленки или размер частицы составит несколько нанометров.
Вместе с тем, в литературе отсутствуют какие-либо сведения об обратном влиянии металла на свойства самого носителя со свойствами полупроводника n- или p-типа. Можно предположить, что наблюдаемое отрицательное заряжение металлической наночастицы на полупроводниковом оксиде будет приводить к уменьшению ширины запрещенной зоны самого носителя, однако, величина этого изменения, очевидно, зависит в первую очередь от содержания металла на его поверхности.
Таким образом, в литературе имеются многочисленные свидетельства электронных равновесий в системах металл–полупроводник, которые в случае наночастиц металла на полупроводниковом носителе будут приводить к формированию отрицательно заряженных металлических частиц на оксидных носителях с полупроводниковыми свойствами, а такжек формированию новых центров на поверхности полупроводника (восстановленные ионы решетки, а также, возможно, кислородные вакансии, образующиеся в результате восстановления решеточных ионов). С этими двумя факторами, в первую очередь, связан эффект значительной диссоциации водорода и спилловера водорода, которые, в свою очередь, обусловливают повышение активности таких каталитических систем в реакциях гидрирования различных классов органических соединений.
НАНЕСЕННЫЕ МЕТАЛЛЫ НА ЭЛЕКТРОПРОВОДЯЩИХ НОСИТЕЛЯХ
Очевидно, в случае носителей с электропроводящими свойствами, такими как углеродные носители (нанотрубки, графен, графит), проводящие полимеры (PEDOT и др.), графеноподобные материалы типа C3N4, эффекты взаимного заряжения частиц металла и носителя, электронные равновесия и явления переноса электронной плотности будут в значительной степени нивелироваться за счет проводящих свойств подложки.
Так, теоретическое изучение углеродных нанотрубок с нанесенными частицами металла [32] показало, что геометрия кольцевых структур придает углеродным нанотрубкам либо металлические, либо полуметаллические свойства, что оказывает влияние на свойства нанесенного металла. Дука исследовал квантово-химическими методами свойства графита и одностенных углеродных нанотрубок, содержащих частицы Pd0 [33]. Показано, что частицы Pd0 сильнее взаимодействуют с нанотрубками, чем с плоскими двойными листами графита благодаря кривизне нанотрубок.
Состояние металла на углеродных носителях в значительной степени определяется наличием функциональных групп или гетероатомов на поверхности носителя, созданных либо путем окислительной обработки, либо химической функционализации [34–37]. Так, гетероатомы довольно сильно изменяют электронные свойства графена и графеноподобных материалов [38, 39]. Введение кислорода приводит к изменению оптоэлектронных свойств и ширины запрещенной зоны [40].
Наличие кислотных групп (карбоксильных групп) может приводить к положительному заряжению частиц металла, как это было показано для палладия, и увеличению энергии связи Pd в спектрах РФЭС (Eb = 335.1 эВ для Pd0, Eb = 335.95 эВ для Pdδ+ [41]. Существование Pdδ+ было также установлено для коммерческих образцов Pd/C [24, 42, 43].
Уменьшение работы выхода электронов углеродных материалов с уменьшением концентрации кислородсодержащих групп наблюдалось также в [44, 45]. Смещение d-зоны в сторону, характерную для изолированных атомов с уменьшением размера наночастицы, наблюдалось при уменьшении размера частиц Pt и Pd, нанесенных на угли.
Таким образом, взаимодействие металла с носителем определяется природой носителя и приводит к изменению свойств как нанесенного металла, так и самого носителя, причем, чем меньше размеры нанесенных частиц, тем более выражены эти эффекты. Безусловно, эффекты заряжения наночастиц металлов, изменения кислотно-основных и электронных свойств носителя и сопутствующие эффекты (возникновение новых адсорбционных центров, связанных с частичным восстановлением ионов решетки носителя, спилловер водорода и другие) необходимо учитывать при интерпретации результатов каталитических исследований.
Авторы выражают благодарность Российскому научному фонду за финансовую поддержку (грант № 17-73-20282).
Список литературы
Bond G.C. // Metal-Support and Metal Additive Effects in Catalysis / Ed. by B. Imelik, C. Naccache, G. Courier Amsterdam: Elsevier, 1982. Ch. 1.
Boudart M., Diega-Maradossou G. // Kinetics of Heterogeneous Catalytic Reaction. Princeton; NJ: Princeton University Press, 1984.
Gallezot P., Datka J., Massardier J. et al. // in: Bond G.C. et al. (Eds.). Proc. 6th Int. Cong. on Catalysis. L.: The Chemical Society, 1977. P. 696.
Sheu L.L., Knözinger H., Sachtler W.M.H. // J. Am. Chem. Soc. 1989. V. 111. P. 8125.
van Bokhoven J.A., Miller J.T. // AIP Conference Proceedings. 2007. V. 882. P. 582.
van Hardefeld R., Hartog F. // Surf. Sci. 1969. V. 15. P. 189.
Alayoglu S., Somorjai G. // Catal. Lett. 2015. V. 145. P. 249.
Berkó A., Solymosi F. // Surf. Sci. 1998. V. 411. P. L900.
Davydov A. // Molecular Spectroscopy of Oxide Catalyst Surfaces. Chichester: John Wiley & Sons, 2003.
Radnik J., Mohr C., Claus P. // Phys. Chem. Chem. Phys. 2003. V. 5. P. 172.
Ertl G., Kuppers J. // Low Energy Electrons and Surface Chemistry. Weinheim: VCH, 1985.
Henry C.R. // Surf. Sci. Rep. 1998. V. 31. P. 231.
Kustov L.M., Stakheev A.Yu. // Proc. North American Catalysis Society Meeting. Toronto. 2001. P. 173.
Stakheev A.Yu., Kustov L.M. // Appl. Catal. A: General. 1999. V. 188. P. 3.
Larichev Yu.V., Moroz B.L., Zaikovskii V.I. et al. // J. Phys. Chem. C. 2007. V. 111. P. 9427.
Aika K., Ohya A., Ozaki A. et al. // J. Catal. 1985. V. 92. P. 305.
Muhler M., Rosowski F., Hinrichsen O. et al. // Stud. Surf. Sci. Catal. 1996. V. 101. P. 317.
Aika K., Kubota J., Kadowaki Y. et al. // Appl. Surf. Sci. 1997. V. 121/122. P. 488.
Hinrichsen O., Rosowski F., Hornung A. et al. // J. Catal. 1997. V. 165. P. 33.
Dahl S., Logadottir A., Jacobsen C.J.H., Norskov J.K. // Appl. Catal. A: Genreral. 2001. V. 222. P. 19.
Cattania M.G., Parmigiani F. and Ragaini V. // Surf. Sci. 1989. V. 211/212. P. 1097.
Redina E.A., Vikanova K.V., Kapustin G.I. et al. // Eur. J. Org. Chem. 2019. V. 2019. P. 4159.
Hsu C.Y., Chiu T.C., Shih M.H. et al. // J. Phys. Chem. C. 2010. V. 114. P. 4502.
Cardenas-Lizana F., Hao Y., Crespo-Quesada M. et al. // ACS Catal. 2013. V. 3. P. 1386.
Zhang S., Li J., Xia Z. et al. // Nanoscale. 2017. V. 9. P. 3140.
Zhang S., Xia Z., Ni T. et al. // J. Catal. 2018. V. 359. P. 101.
Redina E.A., Vikanova K.V., Shesterkina A.A., Kustov L.M. // Russ. J. Phys. Chem. A. 2018. V. 92. P. 2143.
Vikanova K.V., Redina E.A., Kapustin G.I. et al. // Ibid. 2019. V. 93. P. 231.
Vikanova K.V., Redina E.A. // Ibid. 2018. V. 92. P. 2355.
Kirichenko O., Nissenbaum V., Kapustin G. et al. // J. Therm. Anal. Calorim. 2019. V. 138. P. 2205.
Miller J.T., Kropf A.J., Zha Y. et al. // J. Catal. 2006. V. 240. P. 222.
Oosthuizen R.S., Nyamori V.O. // Platinum Metals Rev. 2011. V. 55. P. 154.
Duca D., Ferrante F., La Manna G. // J. Phys. Chem. C. 2007. V. 111. P. 5402.
Su D.S., Perathoner S., Centi G. // Chem. Rev. 2013. V. 113. P. 5782.
Zhu J., Holmen A., Chen D. // ChemCatChem. 2013. V. 5. P. 378.
Perathoner S., Ampelli C., Shimming C. et al. // J. Energy Chem. 2017. V. 26. P. 207.
Xia W. // Catal. Sci. Technol. 2016. V. 6. P. 630.
Zheng Y., Jiao Y., Zhu Y. et al. // Nature Commun. 2014. V. 5. P. 3783.
Ito Y., Cong W., Fujita T. et al. // Angew. Chem. Int. Ed. 2015. V. 54. P. 2131.
Loh K.P., Bao Q., Eda G., Chhowalla M. // Nature Chem. 2010. V. 2. P. 1015.
Rao R.G., Blume R., Hansen T.W. et al. // Nature Commun. 2017. V. 8. Article number: 340.
Zhao Z., Huang X., Li M. et al. // J. Am. Chem. Soc. 2015. V. 137. P. 15672.
Arrigo R., Schuster M.E., Wrabetz S. et al. // ACS Catal. 2016. V. 6. P. 6959.
Lin Y.-J., Zeng J.-J. // Appl. Phys. Lett. 2013. V. 102. P. 183120.
Kumar P.V., Bernardi M., Grossman J.C. // ACS Nano. 2013. V. 7. P. 1638.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии