Журнал физической химии, 2020, T. 94, № 11, стр. 1608-1615
Железо, диспергированное на углеродном носителе на основе древесины кустарника ирги (AMENANCHIER). Карбидирование промотированных висмутом Fe-содержащих катализаторов процесса гидрирования СО
Г. В. Панкина a, *, П. А. Чернавский a, А. Н. Харланов a, А. В. Малков b, В. В. Лунин a
a Московский государственный университет имени Ломоносова, Химический факультет
119992 Москва, Россия
b Российская академия наук, Федеральный исследовательский центр комплексного изучения Арктики
им. Н.П. Лаверова
Архангельск, Россия
* E-mail: pankina5151@inbox.ru
Поступила в редакцию 12.02.2020
После доработки 12.02.2020
Принята к публикации 17.03.2020
Аннотация
Углеродный материал (УМ), приготовленный на основе древесины кустарника ирги САm (AMENANCHIER) и смесь САm + АМШ, где АМШ – алюмо-магниевая шпинель, применены в качестве носителя промотированного Bi (0.6 мас. %) Fe-содержащего катализатора процесса гидрирования СО. Изучена динамика образования карбидов железа в процессе активации оксидов железа, нанесенных на УМ и смесь алюмо-магниевой шпинели с УМ и влияние висмута на этот процесс. Установлено, что уже на стадии приготовления катализаторов они имеют не нулевую намагниченность. Показано, что в случае Fe/CАm в среде CO/H2 (1 : 1) образуется только карбид Хэгга, а в случае Fe/(CАm + АМШ) образуется смесь карбидов Хэгга и ε'-Fe2.2C. Причем, промотирование висмутом катализатора Fe/(CAm + АМШ) существенно увеличивает количество образовавшегося карбида Хэгга и незначительно влияет на количество ε'-Fe2.2C.
Синтезу и применению углеродных материалов (УМ), получаемых на основе возобновляемых источников растительного происхождения, таких как древесина разнообразных пород деревьев, рисовая шелуха, отходы кофейных производств или биомассы, в последнее десятилетие посвящено значительное число публикаций [1–3].
Известно, что производство УМ из природных возобновляемых источников исключает использование достаточно дорогостоящих реактивов, а также решает экологически актуальную проблему утилизации древесных отходов. При этом затраты на получение УМ из природного сырья и их стоимость относительно невелики. Углеродные материалы в качестве носителей Fe- и Co-содержащих катализаторов востребованы при селективном получении С2–С4-алкенов, С5+-углеводородов и жидких парафинов в процессе гидрирования СО или синтезе Фишера–Тропша (СФТ), в котором синтез-газ Н2/СО получают из биомассы, угля, природного и сланцевого газов.
При выборе носителя металлсодержащих катализаторов важно учитывать, чтобы отсутствовало оксид-оксидное взаимодействие между пористой подложкой и активным компонентом, приводящее на стадии приготовления катализаторов к образованию трудно-восстанавливаемых промежуточных соединений, например, шпинельных структур, при заданных температурах практически не поддающихся восстановлению [4]. К таким носителям, по-видимому, относятся алюмо-магниевые шпинели различного стехиометрического состава. УМ, как правило, не взаимодействуют с активным компонентом.
Оксиды железа, нанесенные на углеродную матрицу или алюмо-магниевую шпинель – это композиты, как правило, с высокой удельной поверхностью и развитой пористой структурой, эффективно адсорбирующие газы и химические соединения, растворенные в жидкости [5]. Такие наноматериалы характеризуются большой долей поверхностных атомов и метастабильной морфологией с локальным минимумом свободной энергии.
На сегодняшний день считается, что в процессе гидрирования СО роль активных центров выполняют карбиды металлов (железо, кобальт) различного стехиометрического состава [6–8]. В случае железосодержащих катализаторов – это цементит Fe2C и карбид Хэгга χ-Fe5C2 [6–9]. Нимантсвердит и сотр. подтвердили гипотезу, что карбид Хэгга χ-Fe5C2 активно включается в реакцию СФТ [10]. Экспериментальные данные Ходакова и сотр. показали, что при использовании углеродного носителя в железосодержащем катализаторе высокая активность достигается благодаря значительной реакционной способности и быстрой регенеративности карбида Хэгга [9]. При этом углерод носителя активно включается в рост углеродной цепи. Установлено, что при активации катализатора Fe/CNT в токе СО при 350°С образуется достаточно стабильный магнетит. Благодаря тесному контакту магнетита с углеродом носителя в реакции каталитического гидрирования СО наблюдается положительный эффект [9].
При изучении динамики процесса карбидирования при активации катализаторов Fe/MgAl2O4 в синтез-газе, отмечено, что образуется только карбид Хэгга [11]. Примечательно, что при выборе алюмо-магниевых шпинелей, отличающихся друг от друга величиной удельной поверхности почти на порядок (23 и 185 м2/г), количество образованного карбида Хэгга для шпинели с меньшей удельной поверхностью оказалось существенно выше [11].
В зависимости от разновидности древесины и типа почв элементный состав углей может различаться как качественно, так и количественно. В незначительных количествах в состав углей в качестве примесей часто входят металлы (1–3 мас. %), которые используются как промоторы каталитической реакции гидрирования СО. Наиболее распространенными и часто используемыми промоторами железосодержащих катализаторов СФТ являются калий и медь. Так, показано, что в УМ на основе древесины кустарника облепихи изначально содержание калия составило порядка 2 мас. % [12]. Известно, что калий оказывает влияние на адсорбцию молекул CO и Н2 в катализаторах, содержащих железо, тем самым обуславливая рост прочности связи Fe–C и ослабление связи Fe–H [13]. Калий ускоряет образование карбида железа, увеличивает его концентрацию и существенно влияет на активность и селективность в СФТ [14, 15].
Ходаковым и сотр. [16] показано, что после активации железосодержащих углеродных нанотрубок, промотируемых Bi и Pb, достигается высокая степень восстанавления катализатора и повышается карбидизация наночастиц железа. В процессе активации катализатора наблюдалась сильная миграция висмута и свинца, а после активации, отмечено, что наночастицы карбида железа декорированы промотирующими элементами. Во время активации катализатора благодаря низким температурам плавления и высокой подвижности металлических промоторов обеспечивался тесный контакт между Fe и промоторами [16].
В настоящей работе изучена динамика процесса карбидирования Fe-содержащих, промотированных висмутом катализаторов на основе углеродного материала СAm, полученного из растительной биомассы – древесины кустарника ирги – и механической смеси СAm + АМШ, (где АМШ – алюмо-магниевая шпинель) в реакции гидрирования СО (СО/Н2).
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Приготовление катализаторов
В качестве носителей Fe-содержащих катализаторов выбран УМ (СAm) на основе растительной биомассы – древесины кустарника ирги и смесь УМ с алюмо-магниевой шпинелью. Древесину ирги измельчали до порошкообразного состояния размером 0.1–0.25 мм, сушили при 110°С до постоянного веса и в токе воздуха проводили пиролиз при 400°С. Полученный уголь химически активировали в растворе К2СО3 для формирования анизотропных соединений углерода с неодинаковыми физическими свойствами в продольных и поперечных слоях структуры, многократно промывали горячей дистиллированной водой от ионов калия и с последующей сушкой при 90°С на воздухе в течение 5 ч. Прокаливание проводили при 450°С в программированном режиме в течение 3 ч в атмосфере азота (скорость потока газа-азота 10 мл/с). Перед использованием носители тщательно измельчали в агатовой ступке и отбирали фракцию d < 0.08 мм. Алюмо-магниевую стехиометрическую шпинель формулы AlxMgyOz фирмы “SASOL Germany GmbH”, марки Puralox MG 30 Spinel с Sуд = 23 м2/г использовали той же фракции <0.08 мм.
Технические характеристики шпинели AlxMgyOz приведены в работе [17].
Смесь СAm + АМШ готовили тщательным перемешиванием составляющих в весовом соотношении 1 : 1 на лабораторной вибромельнице и тщательным перетиранием в агатовой ступке, а затем кальцинировали при 450°С в программированном режиме в атмосфере азота в течение 3 ч. Катализаторы готовили следующим образом: нитраты железа (Fe(NO3)3 · 9H2O) и висмута (Bi(NO3)3 · 5H2O) методом пропитки наносили на предварительно приготовленные носители из расчета 15 мас. % железа и 0.6 мас. % висмута в образце, а затем прокаливали при 450°С в программированном режиме в атмосфере азота в течение 3 ч с целью разложения нитратов металлов. Катализаторы обозначали следующим образом: Fe/СAm, FeBi/СAm, Fe/(СAm + АМШ), FeBi/(СAm + + АМШ).
Ранее в статье [17] подробно представлены данные физико-химических исследований всех образцов катализаторов методами сканирующей электронной микроскопии (СЭМ), энерго-дисперсионного анализа (ЭДС), низкотемпературной адсорбции азота, ИК-спектроскопии и дифференциально-термического анализа (ДTA/TГA).
РФА-спектры
Образцы катализаторов дополнительно проанализированы на рентгеновском дифрактометре Shimadzu XRD-7000 S в виде слоя порошка толщиной 1 мм и диаметром около 20 мм. Использован неотражающий держатель со скоростью вращения 30 об./мин. Оптическая схема гониометра – θ–θ, детектор сцинтилляционный с монохроматором. Параметры работы рентгеновской трубки: ускоряющее напряжение 40 кВ, ток 30 мА, материал мишени – Cu. Диапазон сканирования по углу 2θ – от 10 до 95°, скорость сканирования 1 град/мин, шаг 0.02°. Выполнен поиск соответствия дифрактограмм в базе данных PDF-2 (Powder Diffraction File™ PDF-2 Release 2010, International Centre for Diffraction Data).
In situ магнитометрический метод
Магнитометрический метод включает в себя комплекс методов: температурно-программируемое восстановление (ТПВ) с одновременной регистрацией намагниченности (in situ), термомагнитную кривую (ТМК) и магнитную гранулометрию (полевые зависимости).
Температурно-программируемое восстановление с одновременной регистрацией намагниченности образцов проводили на оригинальном вибрационном магнитометре (лабораторная установка) в режиме in situ с целью измерения намагниченности ферромагнитных компонентов, образующихся в ходе химической реакции [18]. Железо, магнетит и карбиды обладают значительными магнитными моментами, что и обуславливает намагниченность образцов. В ходе протекающих процессов при изменении температуры во времени намагниченность (J) изменяется, что позволяет следить за динамикой процесса восстановления во времени J(t), причем намагниченность пропорциональна массе магнетика [19]. Магнитометрические измерения in situ позволяют в ходе химических превращений достаточно точно определять состав образующихся крайне неустойчивых карбидов железа.
Катализаторы массой 10–15 мг восстанавливали в токе синтез-газа состава СО : Н2 = 1 : 1 при нагреве до температуры 600°С и скорости нагрева 10 К/мин в измерительной ячейке вибрационного магнитометра. Ячейка вибрационного магнитометра представляла собой проточный кварцевый микрореактор объемом 0.3 см3, позволяющий изучать топохимические превращения в условиях in situ [19]. Газы предварительно пропускали через колонку с γ-Al2O3, нагретую до 300°С, для очистки от карбонилов железа. Исследуемый образец неподвижно фиксировали между двумя мембранами из пористого кварца. При нагреве непрерывно с частотой 1 Гц регистрировали изменение намагниченности. По достижении заданной температуры 600°С катализатор выдерживали в изотермическом режиме до постоянного значения намагниченности, свидетельствующей об окончании процесса восстановления.
Термомагнитную кривую получали следующим образом. Восстановленные в синтез-газе образцы охлаждали в токе газа-восстановителя СО/Н2 со скоростью 10°/мин, затем его заменяли на поток аргона и измеряли удельную намагниченность в зависимости от температуры. Найденные термомагнитные зависимости позволили с достаточно высокой точностью определить температуру Кюри образующейся фазы. Температуру Кюри находили как точку пересечения прямой, касательной к точке максимальной скорости падения намагниченности, с осью абсцисс. Наличие перегибов на термомагнитной кривой свидетельствует о присутствии нескольких магнитных фаз. В этом случае по положению перегиба на кривой по температуре Кюри можно определить тип магнитной фазы. Анализ термомагнитных кривых при наличии двух магнитных фаз позволяет определять количественный состав магнитных фаз в образце [19].
Метод гранулометрии применен для определения магнитных характеристик систем. Определение магнитных характеристик, проводили из зависимости намагниченности J от величины магнитного поля Н (зависимость J–Н, где J – удельная намагниченность в отн. ед., отнесенная к грамму образца, Н – величина магнитного поля в кЭ – полевые зависимости или петли гистерезиса). В табл. 1 приведены магнитные характеристики исходных образцов при Ткомн. до активации после активации при 600°С в атмосфере синтез-газа.
Таблица 1.
Магнитные характеристики катализаторов
| Образец | Js | Jr | Hc | Fe3O4, мас. % | Js | Jr | Hc | χ-Fe5C2/ε'-Fe2.2C, мас. % |
|---|---|---|---|---|---|---|---|---|
| до активации в CO/H2 | после активации в CO/H2 | |||||||
| Fe/СAm | 130.0 | 6.4 | 48.0 | 14.0 | 286.0 | 56.0 | 404.0 | 20.0 |
| FeBi/СAm | 172.0 | 12.0 | 54.0 | 19.0 | 260.0 | 85.0 | 617.0 | 18.0 |
| Fe/(СAm + АМШ) | 92.0 | 15.0 | 76.0 | 20.0 | 58.0 | 29.0 | 626.0 | 6.6/1.4 |
| FeBi/(СAm + АМШ) | 134.0 | 14.0 | 82.0 | 27.0 | 213.0 | 64.0 | 423.0 | 25.4/1.6 |
Примечание. Размерность: Js, Jr – Г·см2/г, Нс – кЭ. Расчет мас. % продукта: m Fe3O4 = Js/J° Fe3O4, где J° Fe3O4 = 90 Г·см2/г, m Fe5C2 = Js/J° Fe5C2, где J° Fe5С2 = 144 Г·см2/г и J° ε'-Fe2.2С = 160 Г см2/г; Js – намагниченность насыщения, Jr – остаточная намагниченность, Нс – величина магнитного поля.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
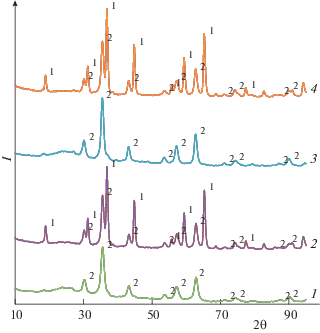
На рис. 1 представлены дифрактограммы образцов Fe/СAm, FeBi/СAm и Fe/(СAm + АМШ), FeBi/(СAm + АМШ). Полученные дифрактограммы сопоставлены друг с другом и анализ спектров показал, что основным кристаллическим компонентом образцов Fe/СAm, FeBi/СAm является магнетит Fe3O4 и маггемит как наиболее подходящая модификация оксида железа Fe2O3. Для Fe/(СAm + + АМШ), FeBi/(СAm + АМШ) основные кристаллические компоненты – модификации магнетита Fe3O4: это обычная модификация с параметром кристаллической решетки a = 8.396 Å и модификация, существующая при высоком давлении с параметром кристаллической решетки a = 8.0903 Å. Каких-либо фаз, содержащих Bi, идентифицировать по базе данных не удалось, очевидно, вследствие малого содержания висмута (0.6 мас. %). Присутствие магнетита обеспечивает наличие намагниченности в исходных образцах.
Рис. 1.
Результаты рентгенофазового анализа образцов: 1 – Fe/СAm, 2 – FeBi/СAm, 3 – Fe/(СAm + АМШ), 4 – FeBi/(СAm + АМШ); 1 – магнетит, образующийся при высоком давлении (High Pressure Magnetite, 00-026-1136), 2 – магнетит (Common Magnetite, 00-019-0629).
Магнитометрические измерения in situ
Магнитометрическим методом in situ восстанавливали образцы катализаторов в смеси СО/Н2 до 600°С до постоянного значения намагниченности, затем охлаждали до комнатной Т и снимали термомагнитную кривую с целью определения состава полученных продуктов.
Температурно-программируемое восстановление in situ
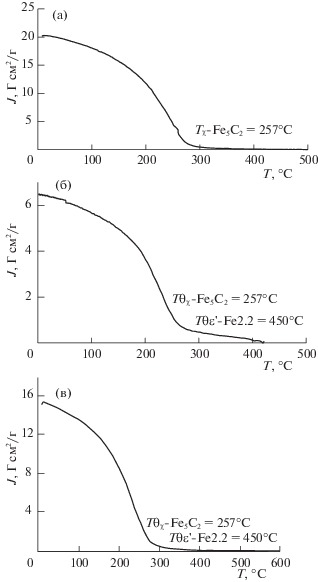
На рис. 2а, 2б приведены зависимости намагниченности от температуры при восстановлении Fe/CАm, FeBi/CАm, Fe/(CАm + АМШ) и FeBi/(CАm + + АМШ) в среде синтез-газа CO/H2 (1 : 1). Отмечено, что железо-содержащие катализаторы на основе активированного угля, высушенные и прокаленные, содержат в своем составе магнетит уже при 350°С [9]. Действительно, как следует из данных РФА (рис. 1), исходные катализаторы обладают ненулевой (начальной) намагниченностью при Ткомн, обусловленной присутствием магнетика – магнетита. Из рис. 2а, 2б видно, что количество магнетита в промотированных висмутом образцах выше на 25%, чем в отсутствии висмута. При нагреве наблюдается сначала некоторое падение намагниченности, которое может быть связано с образованием не магнитного термодинамически неустойчивого вюстита, а затем рост намагниченности от Т = 130°С, который заканчивается при Т = 200–230°С. Затем намагниченность падает до нуля при Т = 430–500°С. Ранее нами показано, что рост намагниченности обусловлен образованием магнетита по реакции: Fe2О3 → Fe3О4 [19]. Последующее падение намагниченности вызвано образованием карбида Хэгга χ-Fe5С2 с температурой Кюри Тθ = = 257°С, как будет показано ниже. Дополнительный пик на рис. 2а при восстановлении Fe/CАm связан, возможно, с довосстановлением достаточно мелких частиц гематита в магнетит.
Рис. 2.
Зависимости намагниченности от температуры при восстановлении в среде синтез-газа CO/H2 (1 : 1): а) 1 – Fe/CАm, 2 – FeBi/CАm, б) 1 – Fe/(CАm + АМШ),2 – FeBi/(CАm + АМШ).

При Т ≥ 257°С возможно одновременное протекание двух процессов, один из которых ответственен за рост, а второй – за падение намагниченности. Из рис. 2 следует, что как в случае Fe/CАm, так и Fe/(CАm + АМШ) промотирование висмутом понижает температуру начала восстановления гематита до магнетита, а также температуру образования карбида. В последнем случае такое понижение выражено сильнее.
Термомагнитные кривые
После охлаждения восстановленных при 600°С в синтез-газе исследуемых образцов наблюдается рост намагниченности (рис. 3a, 3б). Полученные зависимости намагниченности от температуры в среде инертного газа представляют собой термомагнитные кривые, которые являются характеристикой состава магнитных фаз.
На рис. 3а, 3б приведены термомагнитные кривые Fe/CАm, FeBi/CАm, Fe/(CАm + АМШ) и FeBi/(CАm + АМШ). Восстановленные в синтез-газе и охлажденные до комнатной температуры образцы (рис. 3) обладали начальной намагниченностью, обусловленной присутствием магнитной фазы.
Как следует из рис. 3а, после активации катализаторов Fe/CАm и FeBi/CАm в синтез-газе образуется карбид Хэгга χ-Fe5C2 с температурой Кюри Тθ = 257°С. Температуру Кюри определяли графически по пересечению касательной к точке перегиба термомагнитной кривой с осью Х. Заметно, что на ТМК для систем Fe/(CАm + АМШ) (рис. 3б) и FeBi/(CАm + АМШ) (рис. 3в) отчетливо виден перегиб, разделяющий кривую на две неравные части, отвечающую различным температурам Кюри. Так, общее значение намагниченности Jобщ = ${{J}_{{\chi {\text{ - F}}{{{\text{e}}}_{{\text{5}}}}{{{\text{C}}}_{{\text{2}}}}}}}$ + ${{J}_{{\varepsilon {\text{' - F}}{{{\text{e}}}_{{{\text{2}}{\text{.2}}}}}{\text{C}}}}}$, где температура Кюри карбида Хэгга Тθ = 257°С и ε'–Fe2.2C Тθ = 450°С [20]. Количества образовавшихся карбидов после активации катализаторов рассчитывали с учетом значений удельных намагниченностей: ${{J}_{{0\,\chi {\text{ - F}}{{{\text{e}}}_{{\text{5}}}}{{{\text{C}}}_{{\text{2}}}}}}}$ = = 144 Гсм2/г, ${{J}_{{0\,\varepsilon {\text{' - F}}{{{\text{e}}}_{{{\text{2}}{\text{.2}}}}}{\text{C}}}}}$ = 160 Гсм2/г [21]. Аналогично, рассчитывали содержание в исходных образцах магнетита – с учетом ${{J}_{{{\text{0}}\,{\text{F}}{{{\text{e}}}_{{\text{3}}}}{{{\text{О}}}_{{\text{4}}}}}}}$ = 90 Гсм2/г [20].
В табл. 1 представлены магнитные характеристики образцов Fe/СAm, Fe/(СAm + АМШ), FeBi/СAm и FeBi/(СAm + АМШ), где Hc – коэрцитивная сила, Js – намагниченность насыщения и Jr – остаточная намагниченность.
Магнитная гранулометрия
Применение метода магнитной гранулометрии позволило определить количества образовавшихся продуктов: m = Is/I°, где I° – удельное значение намагниченности магнетита и карбида Хэгга, соответственно.
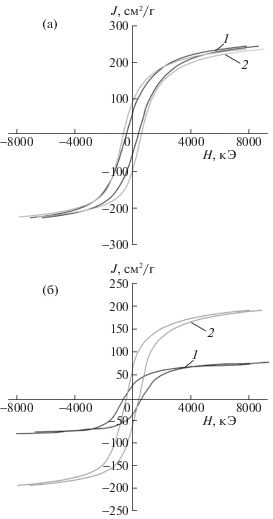
На рис. 4а, 4б изображены полевые зависимости или петли гистерезиса для систем: а) Fe/СAm, FeBi/СAm и б) Fe/(СAm + АМШ), и FeBi/(СAm + + АМШ), на основании которых вычислены величины Hc, Js и Jr. Из рис. 4б следует, что намагниченность насыщения образца FeBi/(СAm + АМШ) в 3.5 раза выше, чем не промотированного висмутом катализатора, что свидетельствует о высокой степени восстановления и карбидирования FeBi/(СAm + АМШ), обусловленной промотирующим эффектом висмута (табл. 1).
Рис. 4.
Полевые зависимости (петли гистерезиса): а) 1 – Fe/СAm, 2 – FeBi/СAm, б) 1 –Fe/(СAm + АМШ), 2 – FeBi/(СAm + АМШ).
Приведенные в табл. 1 данные свидетельствуют, что до активации в синтез-газе промотирование висмутом как Fe/CАm, так Fe/(CАm + АМШ) увеличивает количество магнетита в образце.
Как следует из рис. 3а, 3б и данных табл. 1, при активации в синтез-газе катализатора Fe/СAm образуется только карбид Хэгга, а промотирование висмутом катализатора Fe/СAm не влияет на количество образованного карбида Хэгга. При активации в синтез-газе катализатора Fe/(СAm + АМШ) наряду с χ-Fe5C2 образуется ε'-Fe2.2C. Однако промотирование висмутом катализатора Fe/(СAm + АМШ) повышает количество карбида Хэгга χ-Fe5C2 почти в 4 раза (6.6 и 25.4 мас. %) и незначительно влияет на количество ε'-Fe2.2C (1.4 и 1.6 мас. %) в образцах.
Чтобы выяснить, сколько железа при приготовлении перешло в магнетит, а в процессе активации – в карбиды, использована формула:
где С – расчетное содержание Fe в магнетите, χ-Fe5C2 или ε'-Fe2.2C по данным гранулометрии (мас. %), с – содержание магнетита, χ-Fe5C2 или ε'-Fe2.2C (мас. %) в образце по данным табл. 1, АFe – содержание Fe в магнетите, χ-Fe5C2 или ε'-Fe2.2C в 1 моле (168, 280 и 112 соответственно), М – молекулярный вес магнетита, χ-Fe5C2 или ε'-Fe2.2C.Результаты расчетного содержания Fe в магнетите, χ-Fe5C2 и ε'-Fe2.2C (мас. %) в образцах приведены на рис. 5. Анализ рис. 5 и сравнение расчетного значения С и содержания железа в исходном образце на стадии приготовления показало, что в катализаторах Fe/CАm и FeBi/CАm присутствует 60–70% магнетита, а остальное – гематит. Показательно, что катализаторы Fe/(CАm + АМШ) и FeBi/(CАm + АМШ) полностью состоят из магнетита.
Рис. 5.
Содержание Fe (мас. %): (слева направо) в исходном образце по данным ЭДС и СЭМ, расчетное – в Fe3O4 по данным гранулометрии, расчетное – в χ-Fe5C2 и ε'-Fe2.2C по данным гранулометрии для образцов: 1 – Fe/CАm, 2 – FeBi/CАm, 3 – Fe/(CАm + АМШ), 4 – FeBi/(CАm + АМШ).

Однако, если для катализатора FeBi/(CАm + + АМШ) по расчету происходит 100%-е превращение в карбиды, то для Fe/(CАm + АМШ) – лишь наполовину. Причины такого результата следующие. Что касается значения концентраций железа в исходных образцах (рис. 5), то оно может отличаться от расчетных значений, поскольку метод энерго-дисперсионного анализа относится к поверхностному методу анализа. Кроме того, как показано в нашей предыдущей работе [17] структура образцов Fe/(CАm + АМШ) и FeBi/(CАm + + АМШ) губчатая, и железо может частично проваливаться в структуру поверхности катализаторов. Однако, присутствие висмута стимулирует образование карбидов, и по-видимому, способствует их локализации на поверхности, делая их доступными для количественного обнаружения. На рис. 5 (гистограмма) представлены результаты расчета содержания Fe образцов Fe/CАm, FeBi/CАm, Fe/(CАm + АМШ) и FeBi/(CАm + АМШ).
Анализ представленных результатов позволяет сделать вывод о промотирующей роли висмута как при приготовлении, так и при карбидировании Fe/CAm и Fe/(CAm + АМШ) катализаторов в процессе активации в синтез-газе. При приготовлении Fe/CAm промотирование висмутом приводит к росту содержания магнетита на 32%, а Fe/(CAm + АМШ) – на 28%, присутствие которого в дальнейшем облегчает процесс восстановления катализаторов до карбидов. Как следует из приведенных в табл. 1 данных, после активации образца Fe/CAm в смеси синтез-газа образуется исключительно карбид Хэгга χ-Fe5С2 (20 мас. %) и промотирование висмутом практически не влияет на количество образовавшегося карбида Хэгга (18 мас. %). Напротив, в случае Fe/(CAm + АМШ) добавка висмута существенно увеличивает количество образовавшегося карбида Хэгга (в 4 раза) и незначительно влияет на количество ε'-Fe2.2C-карбида. Показательно, как следует из рис. 2а, 2б, процесс восстановления FeBi/CАm и FeBi/(CАm + + АМШ) в карбиды заканчивается при 420–440°С, в то время как в отсутствии промотора висмута восстановление продолжается вплоть до 500°С и выше.
Стоит отметить, что при выбранных условиях экспериментов возможность образования феррита висмута BiFeО3 маловероятна, поскольку при 600°С наночастицы феррита только начинают формироваться [22]. Скорее всего, присутствие висмута, локализованного на поверхности носителя, упрочняет связь Fe–C, а связь Fe–Н при этом ослабивает, что положительно сказывается на формировании карбидов. С помощью метода ИК-спектроскопии показано, что на поверхности образца FeBi/CAm после активации в атмосфере СО наблюдаются суб-карбонильные и мостиковые формы адсорбции, что существенно облегчает процесс восстановления оксидов железа [17]. Также не маловажным явдяется тот уже известный факт, что при использовании в качестве носителя Fe-содержащего катализатора шпинели AlxMgyOz с удельной поверхностью на порядок меньшей (23 м2/г) по сравнению с алюмо-магниевой шпинелью с удельной поверхностью 185 м2/г (фирма “Sasol”), при активации в синтез-газе образуется существенно большее количество карбида Хэгга [11].
Список литературы
Marquez-Montesinos F., Cordero T., Rodriguez-Mirasol J., Rodriguez J.J. // Sep. Sci. Technol. 2001. V. 36. P. 3191.
Faug B. // Microporous and Mesoporous Materials. 2013. V. 182. P. 1.
Castro C.S., Guerreiro M.C., Oliveira L.C.A. et al. // Appl. Catalysis A. General. 2009. V. 367. P. 53.
Чернавский П.А., Лунин В.В. // Журн. физ. химии. 1994. Т. 34. № 3. С. 531.
Bandosz T.J. Activated Carbon Surfaces in Environmental Remediation. New York: Elsevier, 2006.
Davis B.H. // Catal. Today. 2009. V. 141. P. 25.
Jiang F., Zhang M., Liu B. et al. // Catal. Sci. Technol. 2017. V. 7. P. 1245.
Dry M.E. In Studies in Surface Science and Catalysis: Steynberg A.P., Dry M.E. Eds.: 152. Elsevier: Amsterdam, 2004. P. 533.
Ordomsky V.V., Legras B., Cheng K. et al. // Cat. Sci. Tech. 2015. V. 5. P. 1433.
Gracia J.M., Prinsloo F.F., Niemantsverdriet J.W. // Catt. Lett. 2009. V. 133. P. 257.
Панкина Г.В., Шумянцев А.В., Черняк С.А., Лунин В.В. // Кинетика и катализ. 2019. Т. 60. № 5. С. 672.
Панкина Г.В., Чернавский П.А., Лунин В.В. // Журн. физ. химии. 2016. Т. 90. № 9. С. 1325.
Penduala V.R.R., Graham U.M., Jacobs G. et al. // Catal. Lett. 2014. V. 144. P. 1704.
Wan H., Wu B., Zhang C., Xiang H., Li Y. // J. Mol. Catal. 2008. V. 283. P. 33.
Chernavskii P.A., Kazak V.O., Pankina G.V. et al. // Кинетика и катализ. 2018. V. 59. № 2. P. 251.
Gua B., Ordomsky V.V., Bahri M. et al. // Applied Catalysis B: Environmental. 2018. V. 234. P. 153.
Панкина Г.В., Чернавский П.А., Лунин В.В. // Журн. физ. химии. 2020. В печати.
Chernavskii P.A., Lunin B.S., Zakharyan R.A. et al. // Inst. Exp Tech. 2014. V. 57. P. 78.
Chernavskii P.A., Pankina G.V., Lynin V.V. // Russ. Chem. Rev. 2011. V. 80. P. 579.
Cелвуд П. Магнетохимия. М.: Иностранная литература. 1954. С. 458.
Zhang G.L., Lin Y.C., Chen X., Goo N.Y. // J. Hazard, Mater. 2007. V. 148. P. 671.
Wang X., Yang C., Zhou D. et al. // Chemical Physics Letters. 2018. V. 713. P. 185.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии