Журнал физической химии, 2020, T. 94, № 11, стр. 1604-1607
Описание реакции гидрокарбоксилирования 1-гексена, катализируемой Co2(CO)8, в кинетике Марселина–де Донде
Ю. Т. Виграненко a, А. В. де Векки a, *, Т. Е. Крылова b, Е. В. Колужникова a
a Санкт-Петербургский государственный лесотехнический университет имени С.М. Кирова
Санкт-Петербург, Россия
b Санкт-Петербургский государственный университет аэрокосмического приборостроения
Санкт-Петербург, Россия
* E-mail: gertsog5000@yandex.ru
Поступила в редакцию 26.01.2020
После доработки 26.01.2020
Принята к публикации 11.02.2020
Аннотация
Выведено уравнение для расчета коэффициента скорости реакции гидрокарбоксилирования 1-гексена в кинетике Марселина–де Донде, которое корректно описывает экспериментальные данные в области концентраций ненасыщенного субстрата, где традиционная кинетика Вант-Гоффа–Аррениуса малоприменима.
При решении многих задач нефтепереработки и нефтехимии, связанных с расчетом реакторов и оптимизацией технологических процессов, важное место занимают расчеты времени пребывания сырья в реакторах (или объемной скорости его подачи в реактор), которое зависит от порядка реакции и величины ее константы скорости. Эти понятия тесно связаны с законом действующих масс в кинетике Вант-Гоффа–Аррениуса, который, как известно, строго выполняется только для сильноразбавленных растворов и идеальных газов, а также в изотермических условиях. Невыполнение закона действующих масс создает дополнительные трудности, связанные с расчетами времени пребывания сырья в реакторах. Так, возрастает погрешность в его определении, если имеет место переменный порядок реакции по какому-либо реагенту. Поэтому с целью их устранения целесообразно использовать кинетику более общего вида, сохраняющую основные свойства кинетики Вант-Гоффа–Аррениуса.
Так, реакция гидрокарбоксилирования алкенов имеет важное практическое значение как эффективный способ синтеза карбоновых кислот из нефтехимического сырья:
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали 1-гексен марки “х.ч.” и ацетон марки “ч” в качестве растворителя. Оксид углерода чистоты 99.60 об. %, примеси 0.06 об. % N2, кислород отсутствовал.
Исследование реакции гидрокарбоксилирования проводили в реакторе идеального смешения объемом 0.5 л, снабженным электропечью, рубашкой водяного охлаждения и отсекаемой емкостью высокого давления объемом 0.01 л для отбора проб жидкой фазы [3]. В состав установки входили также буферные емкости высокого давления для водорода, оксида углерода и синтез-газа CO–H2, а также загрузочная установка для ненасыщенных субстратов. Высокая скорость перемешивания (2800 об./мин) обеспечивала протекания реакции гидрокарбоксилирования в кинетической области.
Дикобальтоктакарбонил Co2(CO)8 получали в качающемся автоклаве из ацетата кобальта и уксусного ангидрида по методике, описанной в [4]. В реактор, продутый аргоном, заливали Co2(CO)8 и воду, подавали оксид углерода до давления 8.0 МПа, включали нагрев и перемешивание. В загрузочную емкость заливали 1-гексен. По достижении рабочей температуры 1-гексен передавливали оксидом углерода из загрузочной емкости в реактор, доводя давление в нем до 20.0 МПа. Момент передавливания 1-гексена считался началом реакции. В ходе опытов производили отбор проб жидкой и газовой фаз, которые после дросселирования растворенных газов взвешивали, затем направляли на химический и газохроматографический анализ. Концентрацию кобальта в пробах жидкой фазы определяли спектрофотометрически [5].
Газохроматографический анализ продуктов гидрокарбоксилирования 1-гексена выполняли на хроматографе ЛХМ-72; детектор – пламенно-ионизационный; неподвижная фаза ПЭГ-40М, нанесенная на твердый носитель – хроматон N-AW-DMCS (15% от его массы). Колонка из нержавеющей стали 3 м на 3 мм. Начальная температура колонки 100°C, конечная температура колонки 220°C, скорость подъема температуры 3 K/мин. Газ-носитель – аргон, скорость подачи водорода 60 мл/мин, скорость подачи воздуха 85 мл/мин, температура детектора 170°C, температура испарителя 150°C.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
К настоящему моменту времени разработан класс простых кинетик. Согласно Фейнбергу [6], кинетика называется простой, если она удовлетворяет следующим условиям: общая масса и энергия системы постоянны; концентрация всех компонентов, участвующих в химической реакции, не может быть величиной отрицательной; функция полной скорости для сложной многостадийной реакции имеет вид
(где Wj(C) – скорость j-й стадии, νj – стехиометрический коэффициент), т.е. обладает свойством аддитивности; существует так называемый псевдопотенциал $\tilde {\mu }$(C) = μ(C)/RT, где μ(C) – химический потенциал, для которого скалярное произведение μ(C) · W(C) ≤ 0, т.е. неположительно.Наиболее известной простой кинетикой является кинетика Марселина–де Донде. В ней каждой элементарной стадии сложной реакции, состоящей из Q стадий:
Можно показать, что широко используемая кинетика Вант-Гоффа–Аррениуса является частным случаем кинетики Марселина–де Донде [7]. В ней для необратимой химической реакции:
Анализ уравнения показывает, что для расчета коэффициента скорости реакции необходимо знать летучести и стандартные химические потенциалы исходных веществ [8]. В литературе отсутствуют работы по расчету коэффициентов скорости необратимых каталитических реакций по экспериментальным данным в гетерофазных системах жидкость–газ. Поэтому нами был выполнен расчет коэффициента скорости реакции гидрокарбоксилирования 1-гексена. Исходные данные для расчета коэффициента скорости реакции гидрокарбоксилирования 1-гексена в кинетике Марселина–де Донде представлены в табл. 1.
Таблица 1.
Скорость и состав продуктов реакции гидрокарбоксилирования 1-гексена
| Конверсия C6H12, % | W, моль/(л мин) | Состав жидкой фазы, мол. % | ||||||
|---|---|---|---|---|---|---|---|---|
| 1-гексен | этановые кислоты | метилэтилкетон | энантовые альдегиды | вода | ацетон | CO | ||
| 0 | 0.0324 | 6.4 | – | – | – | 35.5 | 39.6 | 18.5 |
| 7 | 0.0291 | 6.0 | 0.5 | – | – | 35.7 | 40.6 | 17.2 |
| 15 | 0.0263 | 5.2 | 0.9 | – | – | 35.4 | 42.1 | 16.4 |
| 22 | 0.0237 | 5.0 | 1.4 | 0.1 | 0.1 | 35.1 | 43.4 | 15.3 |
| 33 | 0.0208 | 4.6 | 2.1 | 0.1 | 0.1 | 34.7 | 44.9 | 13.5 |
| 44 | 0.0181 | 4.2 | 2.5 | 0.2 | 0.2 | 34.2 | 46.1 | 12.6 |
Анализ данных табл. 1 показывает, что растворимость CO в жидких продуктах уменьшается от 18.5 до 12.6 мол. % при повышении конверсии 1-гексена от 0 до 44% вследствие изменения состава жидкой фазы.
Летучесть оксида углерода рассчитывали по уравнению Кричевского–Казарновского [8]:
Зависимость ln W от $\ln \left( {{{f}_{{{{{\text{C}}}_{{\text{6}}}}{{{\text{H}}}_{{{\text{12}}}}}}}} \cdot {{f}_{{{{{\text{H}}}_{{\text{2}}}}{\text{O}}}}} \cdot {{f}_{{{\text{CO}}}}}} \right)$ хорошо линеаризуется (рис. 2).
Рис. 2.
Зависимость логарифма скорости реакции гидрокарбоксилирования 1-гексена от логарифма произведения летучестей исходных веществ.
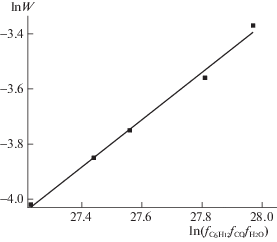
Отсюда был рассчитан коэффициент скорости реакции гидрокарбоксилирования 1-гексена k = 1.89 × 1045 моль/(л мин). За величины стандартных химических потенциалов $\mu _{{{{{\text{H}}}_{2}}{\text{O}}}}^{{\text{0}}}$, $\mu _{{{\text{CO}}}}^{{\text{0}}}$, $\mu {{_{{{{{\text{C}}}_{6}}{\text{H}}}}^{{\text{0}}}}_{{_{{12}}}}}$ принимали стандартные энергии Гиббса воды, оксида углерода и 1-гексена, взятые из работы [12]. Найденное значение коэффициента скорости может быть использовано при решении кинетических задач и расчета реакторов.
Список литературы
Falbe J. New Synthesis with Carbon Monoxide. Berlin: Springer, 1980. 465 p.
Виграненко Ю.Т., Сухов С.Ю., Рыбаков В.А. // Журн. прикл. химии. 1999. Т. 72. № 12. С. 238.
Вишневский Н.Е., Глуханов Н.П., Ковалев И.С. Машины и аппараты высокого давления с герметичным электроприводом. Л.: Машиностроение, 1977. 255 с.
Szabo P., Marko L., Bor G. // Chem. Rechn. 1961. V. 13. № 9. P. 549.
Фритц Дж., Шенк Г. Количественный анализ. М.: Мир, 1978. 558 с.
Feinberg M. // Arch. Rat. Met. Anal. 1972. V. 46. № 1. P. 1.
Димитров В.И. Простая кинетика. Наука: Новосибирск, 1982. 381 с.
Карапетьянц М.Х. Химическая термодинамика. М.: Химия, 1975. 384 с.
Тывина Т.Н., Харченко А.А., Пряникова Р.О. // Журн. прикл. химии. 1977. Т. 50. № 1. С. 186.
Уэйлес С.М. Фазовые равновесия в химической технологии. М.: Мир, 1989. 309 с.
Рид Р., Праузниц Дж., Шервуд Т. Свойства газов и жидкостей. Л.: Химия, 1982. 592 с.
Бенсон С. Термохимическая кинетика. М.: Мир, 1971. 308 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии



