Журнал физической химии, 2020, T. 94, № 11, стр. 1716-1722
Хемилюминесценция при автоокислении люминола в диметилсульфоксиде. Кинетические эффекты щелочей, тушение нитросиним тетразолием и снятие тушения пероксидом водорода
Ю. Б. Цаплев a, *, А. В. Трофимов a, b, **
a Российская академия наук, Институт биохимической физики им. Н.М. Эммануэля
119334 Москва, Россия
b Московский физико-технический институт
141701 Долгопрудный, Московской области, Россия
* E-mail: tsap_04@mail.ru
** E-mail: avt_2003@mail.ru
Поступила в редакцию 28.02.2020
После доработки 28.02.2020
Принята к публикации 17.03.2020
Аннотация
Определены условия и способы замедления (ингибирования), тушения и последующего разжигания хемилюминесценции люминола в щелочном аэрированном диметилсульфоксиде. Получены данные, свидетельствующие о ключевой роли переноса электрона с дианиона люминола на кислород в автоокислении и хемилюминесценции люминола в этих условиях.
Многие хемилюминесцентные реакции в жидкой фазе идут при автоокислении, когда их инициирование и протекание обусловлено растворенным кислородом. Однако молекула кислорода в триплетном состоянии очень медленно взаимодействует с субстратом в синглетном состоянии (например, бимолекулярная константа скорости взаимодействия O2 c анионом люминола равна 10–8 М–1 с–1 [1]).
С началом использования в органической химии диметилсульфоксида (ДМСО) было обнаружено, что процессы автоокисления протекают в щелочном ДМСО значительно быстрее, чем в воде (см. [2] и ссылки там). Щелочной ДМСО использовали в качестве тестовой окислительной системы при поиске хемилюминесценции у многих органических соединений, например, у индолов [3]. Тем не менее, причина быстрого автоокисления (и хемилюминесценции) осталась нераскрыта по сей день.
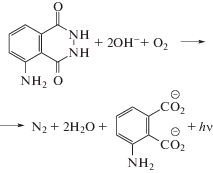
Свечение люминола в щелочном ДМСО было описано Эмилем Уайтом в [4]. Исследованию этой реакции, которую для краткости будем далее называть реакцией Уайта, посвящены работы [5–12]. Они выполнены четырьмя группами исследователей. В работе [5] замечено, что хемилюминесценция наблюдается только из растворов люминола, которые содержат чуть более одного моля основания на моль люминола. На окисление одного моля люминола расходуется моль кислорода и два моля щелочи, а продуктами реакции являются азот, вода и 3-аминофталат. Было доказано, что два атома кислорода в молекуле аминофталата берутся от растворенного кислорода. Формально реакция Уайта записывается следующим образом:
Независимое варьирование начальной концентрации люминола, щелочи и кислорода выявило первый порядок реакции по каждому из реагентов [5]. Это не было подтверждено (ни в [5], ни в последующих публикациях) фактическими данными. Но была предложена кинетическая схема реакций (схема 1 ), в соответствии с которой, при k–1[H2O] $ \gg $ $ \gg $ k2[O2], интенсивность ХЛ пропорциональна в квазистационарном приближении концентрациям аниона люминола, щелочи и кислорода.схема 1
где LH–, L2–, AP2– – моно и дважды депротонированные формы люминола и 3-аминофталевой кислоты,
В [6] было предположено, что эмиттером реакции является 3-аминофталат, испускающий свет из электронно-возбужденного синглетного состояния. В работах Ли и Селигера [7–9] был определен квантовый выход и получены спектры хемилюминесценции для нескольких реакций, в том числе для реакции Уайта, для которой он равен 0.012 Эйнштейн/моль. Было установлено, что эмиттером служит 3-аминофталат.
В работе [9] была получена зависимость квантового выхода хемилюминесценции (Φхл) люминола от концентрации воды в щелочном ДМСО. Оказалось, что Φхл увеличивается по мере снижения концентрации воды, достигает максимума при концентрации 0.63 моль/л, ниже которой вода не влияет на Φхл. Однако вода влияет на кинетику хемилюминесценции, например, при увеличении концентрации воды от 0 до 0.14 моль/л максимальная интенсивность хемилюминесценции снижается в 3 раза [10, 11].
Авторы [12], исследуя влияние концентрации кислорода на интенсивность хемилюминесценции в смеси ДМСО/EtOH, показали, что вместо линейной зависимости, ожидаемой на основе схемы 1 , имеет место зависимость с насыщением. И они предположили, что стадия взаимодействия дианиона люминола с кислородом – равновесное образование аддукта (L2– O2):
Для реакции Уайта не было найдено ингибиторов или тушителей хемилюминесценции. Известно лишь, что тушители триплетов, включая кислород, дифенилкетон, ацетофенон, диацетил, пирен, антрацен и иодид, а также перехватчики свободных радикалов, не влияют на хемилюминесценцию в концентрации до 1 мМ [9]. Реакция Уайта, будучи наиболее простой и доступной хемилюминесцентной реакцией, пока не нашла практических применений, причина этого, вероятно, в отсутствии “инструментов” влияния на нее. Их поиск – задача данной работы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Использовали следующие реактивы: диметилсульфоксид квалификации “для спектроскопии”, LiOH, NaOH, KOH, люминол, пероксид водорода (30%) – “х.ч.”, хлорид нитросинего тетразолия – “ч.д.а.”.
Кинетику хемилюминесценции исследовали на двухканальном хемилюминометре, собранном на основе двух фотоприемных модулей H7360-1 и H7360-2 (Hamamatsu, Япония), счетчика CNT-202 (Спецприбор, Беларусь) и компьютера. Хемилюминометр регистрировал свет в двух спектральных интервалах: 430–490 и 480–560 нм. Схема хемилюминометра описана в [13].
В качестве реакционных сосудов использовали полипропиленовые микропробирки объемом 2 мл, в которых смешивали растворы реагентов. Обычно к 600 мкл ДМСО со щелочью (LiOH, NaOH или KOH) в концентрации 1–5 мМ и (по условиям опыта) пероксидом водорода добавляли посредством светоизолированного инжектора 50 мкл раствора люминола или люминола с нитросиним тетразолием в ДМСО. Реакционная смесь в микропробирке имела небольшую площадь контакта с воздухом и сравнительно большой объем, что затрудняло нейтрализацию щелочи углекислым газом из воздуха и обеспечивало стабильность концентрации щелочи в течение 10–20 мин.
При регистрации выхода света в реакции люминола с раствором LiOH реагенты смешивали вне кюветного отделения, после чего реакционный сосуд закрывали пробкой и помещали в кюветное отделение хемилюминометра.
Электронные спектры поглощения измеряли на спектрофотометре Lambda 25 (“Perkin-Elmer”, США). При работе с растворами в щелочном ДМСО использовали литую кварцевую кювету с длиной оптического пути 1 см, кювету герметично закрывали притертой пробкой.
Концентрации реагентов далее указаны как начальные концентрации в реакционной смеси.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Щелочной ДМСО и люминол
Анионы с локализованным зарядом (HO–, t‑BuO–) в воде дают прочные водородные связи, а в биполярных апротонных растворителях они не стабилизированы водородными связями и энергично вступают в реакции нуклеофильного замещения, присоединения и депротонирования [14]. Депротонирование люминола – важная стадия в рассматриваемой хемилюминесцентной реакции. Первая константа ионизации люминола (pKa1) равна 6.7, и в большинство хемилюминесцентных реакций в водных средах люминол входит в виде моноаниона. Вторая константа ионизации люминола pKa2 = 15.1 (при ионной силе 5 [15]), и для перевода люминола в дважды депротонированную форму требуется суперосновная среда, например, щелочной ДМСО.
Химическая активность щелочей в ДМСО зависит от гидратации присутствующей в растворе водой и от ассоциации в ионные пары, которая определяется катионом щелочного металла. Константы ассоциации аниона HO– с ионами K+, Na+ и Li+ в ДМСО равны соответственно 1400, 50 000 и 790 000 M–1 [14], вследствие чего эффект образования ионных пар проявляется даже для разбавленных растворов.
Сравним эффективность возбуждения хемилюминесценции люминола в ДМСО в зависимости от вида щелочи. На рис. 1 в полулогарифмическом масштабе представлены кинетические кривые свечения при добавлении порции раствора люминола к ДМСО, содержащему KOH, NaOH или LiOH. Видим, что наиболее быстро реакция происходит в присутствии KOH, заметно медленнее в присутствии NaOH и совсем медленно с LiOH. В присутствии KOH почти весь свет излучается за 100 с, а в присутствии NaOH – за 500 с. Для регистрации выхода света в присутствии LiOH потребовалось более 24 ч. При этом квантовый выход хемилюминесценции люминола в присутствии LiOH составил ∼40% от квантового выхода в присутствии KOH и NaOH, где он был одинаков. Из этого следует, что различия эффективности возбуждения хемилюминесценции люминола в ДМСО в присутствии KOH и NaOH отсутствуют, а в присутствии LiOH они не столь значительны, как это можно было бы ожидать. Однако имеются явные различия в кинетике выхода света даже для реакций, проводимых в растворах KOH и NaOH. Эти различия могут быть связаны с различием в константах ассоциации аниона HO– с катионами.
Рис. 1.
Кинетика хемилюминесценции люминола в щелочном ДМСО. Условия: концентрация KOH (1) и NaOH (2) – 4.6 мМ, LiOH (3) – 7.7 мМ, концентрация люминола 0.77 (1), 7.7 (2) и 77 (3) нмоль/л.

Образование ионной пары из аниона HO– и катиона M+ описывается равновесием: HO– + M+ ↔ ↔ HO–M+. Концентрацию “свободного” гидроксид-иона11 ([HO–]f) легко найти, зная константу ассоциации K и общую концентрацию гидроксида в растворе (B):
(1)
${{[{\text{H}}{{{\text{O}}}^{--}}]}_{{\text{f}}}} = 0.5[--{{K}^{{--1}}} + {{({{K}^{{--2}}} + 4B{{K}^{{--1}}})}^{{0.5}}}].$(2)
$\begin{gathered} {{[{\text{H}}{{{\text{O}}}^{--}}]}_{{\text{f}}}} = 0.5\{ --({{K}^{{--1}}} + S) + \\ + \;{{[{{({{K}^{{--1}}} + S)}^{2}} + 4B{{K}^{{--1}}}]}^{{0.5}}}\} . \\ \end{gathered} $В соответствии с (1), концентрация [HO–]f при B = 4.6 мМ в растворах KOH и NaOH равна 1.5 и 0.3 мМ соответственно, и, следовательно, скорость депротонирования люминола в КОН в 5 раз выше, чем в NaOH.
Влияние добавок NaI и KI к растворам NaOH и KOH на кинетику хемилюминесценции показано на рис. 2. Видим, что увеличение концентрации NaI в растворе NaOH и концентрации KI в растворе KOH сопровождается замедлением реакции и снижением максимальной интенсивности хемилюминесценции. Но NaI и KI играют роль не тушителей, а ингибиторов, поскольку интенсивность излучения в реакции остается практически постоянной. На кинетических кривых видно, что интенсивность хемилюминесценции после перехода через максимум экспоненциально снижается. В качестве измеряемого параметра была взята константа спада кинетических кривых (kd).
Рис. 2.
Ингибирование хемилюминесценции люминола в присутствии KOH добавками KI (а) и в присутствии NaOH добавками NaI (б). Начальная концентрация люминола 0.77 нМ в растворе KOH и 7.7 нМ в растворе NaOH. Концентрации щелочи 3 мМ. Концентрация KI: 0 (1), 1.5 (2), 3 (3), 6 (4), 12 (5) и 24 (6) мМ. Концентрация NaI: 0 (1), 0.38 (2), 0.77 (3), 1.5 (4), 3.1 (5) и 6.2 (6) мМ. Концентрация H2O в ДМСО – 0.17 М.

Варьирование концентрации KI в KOH и NaI в NaOH приводит к симбатному изменению kd и концентрации [HO–]f, вычисленной по (2). На графике (рис. 3) точки 1, полученные при варьировании концентрации NaI в NaOH, и точки 2, полученные при варьировании концентрации KI в KOH, ложатся на одну прямую, и, следовательно, величина kd пропорциональна концентрации [HO–]f. Формально это соответствует схеме 1 . Значение kd не зависит от типа щелочи, а определяется величиной [HO–]f. Как легко видеть из (1), первый порядок реакции по концентрации щелочи, который был декларирован в [5], возможен лишь при 4BK $ \ll $ 1.
Рис. 3.
Зависимость kd от концентрации “свободного” гидроксид-иона; 1 – точки, полученные при варьировании концентрации NaI в NaOH, 2 – при варьировании концентрации KI в KOH.

Выше описано влияние солей, содержащих тот же катион, что и щелочь. Но и добавление солей лития к щелочному ДМСО, содержащему, например, KOH, приводит к замедлению реакции и снижению максимальной интенсивности хемилюминесценции. Такой эффект может быть использован для определения лития в неводных растворах.
Нитросиний тетразолий и люминол
Нитросиний тетразолий (NBT2+) – хорошо известный хромогенный реагент на супероксид-анион [16, 17]. Cтруктурные формулы NBT и стабильных продуктов его восстановления: моноформазана (MF) и диформазана (DF2–) показаны ниже:
В работе [18] предложен способ спектрофотометрического определения супероксида с использованием раствора NBT в ДМСО. NBT переходит в MF при концентрации супероксида, меньшей или равной удвоенной концентрации NBT, максимум поглощения MF в ДМСО расположен около 680 нм. При концентрации супероксида, превышающей учетверенную концентрацию NBT, весь NBT превращается в DF2–, максимум поглощения которого – около 730 нм.
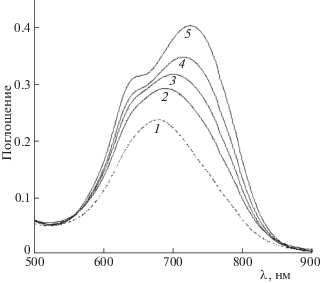
Известно, однако, что нитросиний тетразолий в ДМСО в присутствии NaOH или KOH превращается в моноформазан, но не в диформазан [19, 20]. На рис. 4 показан спектр NBT в щелочном ДМСО и спектры, полученные при добавлении к щелочному ДМСО раствора, содержащего NBT и люминол. Видна эволюция спектров: от спектра, характерного для MF в отсутствие люминола, к спектру, характерному для DF по мере увеличения отношения концентраций люминола и NBT. Образование диформазана в присутствии люминола свидетельствует о том, что в аддукте дианион люминол – кислород (L2– O2), постулированном Беком и Иу, происходит перенос электрона на кислород с образованием супероксид-аниона и анион-радикала люминола (${{{\text{L}}}^{{-- \bullet }}}$).
Рис. 4.
Спектр NBT в щелочном ДМСО в отсутствие (1) и в присутствии (2–4) люминола. Концентрация NBT 4 мкМ, отношение концентраций люминол/NBT: 0.5 (2), 1 (3), 2 (4) и 4 (5), концентрация NaOH 1 мМ.
Взаимодействие между ${{{\text{L}}}^{{-- \bullet }}}$ и ${\text{O}}_{2}^{{ - \bullet }}$ изучено ранее [1, 21], оно характеризуется бимолекулярной константой скорости, равной 2.3 × 108 М–1 с–1, и приводит к образованию пероксида (LO2H–, ${\text{LO}}_{2}^{{2 - }}$), играющего главную роль в хемилюминесценции люминола. Можно предположить, что удаление супероксид-аниона посредством NBT, должно приводить к тушению хемилюминесценции в реакции Уайта. И это действительно так. На рис. 5 в координатах Штерна–Фольмера показана зависимость выхода света в реакции от концентрации NBT. Видно, что NBT является эффективным тушителем, который оказывает заметное действие уже в концентрации менее 1 мкМ, и это единственный (известный сейчас) тушитель в реакции Уайта, действующий в такой концентрации.
Рис. 5.
Эффект тушения хемилюминесценции люминола в щелочном ДМСО от концентрации NBT; SS0/SS – отношение выхода света в реакции в отсутствие и в присутствии NBT. Начальная концентрация люминола – 7.7 (1) и 31 нМ (2). Концентрация NaOH в ДМСО – 3 мМ.

Когда супероксид удаляется из реакции (в данном случае посредством NBT), маршрут расходования люминола изменяется. Анион-радикал люминола быстро диспропорционирует на диазахинон (L) и L2– [21]. Далее диазахинон “гибнет” в реакции с гидроксид-ионом [21]. Вернуть диазахинон на световой путь превращений можно с помощью пероксида водорода, в реакции с которым вновь получается пероксид LO2H–, LO$_{2}^{{2 - }}$. Указанные реакции с константами скоростей представлены ниже [21]:
Схема реакций
Схема реакций, которая включает уточнение, сделанное Беком и Иу, и свидетельство образования супероксид аниона и анион-радикала люминола, полученное в данной работе, может быть представлена следующим образом:
(3)
${\text{L}}{{{\text{H}}}^{--}} + {\text{HO}}_{{\text{f}}}^{ - } \leftrightarrow {{{\text{L}}}^{{2--}}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}},$(4)
${{{\text{L}}}^{{2--}}} + {{{\text{O}}}_{2}} \leftrightarrow ({{{\text{L}}}^{{2--}}}{{{\text{O}}}_{2}}),$(5)
$({{{\text{L}}}^{{2--}}}{{{\text{O}}}_{2}}) \leftrightarrow ({{{\text{L}}}^{{-- \bullet }}}{\text{O}}_{2}^{{-- \bullet }}),$ЗАКЛЮЧЕНИЕ
Таким образом, на основании приведенных данных можно сделать следующие выводы.
1. За депротонирование люминола в щелочном ДМСО отвечает сильноосновный гидроксид-анион. Катионы щелочных металлов образуют с гидроксид-анионом ионные пары и играют роль ингибиторов хемилюминесценции в реакции Уайта. Кинетика хемилюминесценции в реакции определяется концентрацией гидроксид-аниона, не входящего в ионную пару.
2. Взаимодействие дианиона люминола с растворенным кислородом приводит к аддукту, в котором происходит перенос электрона на кислород с образованием анион-радикала люминола и супероксид анион-радикала. Супероксид анион-радикал обнаружен по реакции с нитросиним тетразолием. Хемилюминесценция в реакции Уайта эффективно тушится нитросиним тетразолием.
3. Тушение хемилюминесценции, вызванное нитросиним тетразолием, снимается пероксидом водорода, что подтверждает вывод об образовании анион-радикала люминола, поскольку последний диспропорционирует в диазахинон, который хемилюминесцирует в реакции с пероксидом водорода.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (код проекта № 19-53-18019 Болг_а).
Список литературы
Merényi G., Lind J., Shen X., Eriksen T.E. // J. Phys. Chem. 1990. V. 94. № 2. P. 748.
Паркер А. Применение полярных апротонных растворителей в органической химии. В кн. Успехи органической химии. Т. 5. М.: Мир, 1968. С. 5–50. / Пер. с англ. Advances in Organic Chemistry. Methods and results. V. 5. Ed-s: Raphael R.A., Taylor E.C., Wynberg H. N.Y.; London; Sydney: Intersci. Publ., 1965.
Васильев Р.Ф., Трофимов А.В., Цаплев Ю.Б. // Успехи химии. 2010. Т. 79. № 2. С. 91. https://doi.org/10.1070/RC2010v079n02ABEH004064
White E.H. // J. Chem. Education. 1957. V. 34. № 6. P. 275.
White E.H., Zafiriou O., Kagi H., Hill J. // J. Amer. Chem. Soc. 1964. V. 86. № 5. P. 940.
White E.H., Burcey M.M. // Ibid. 1964. V. 86. № 5. P. 941.
Lee J., Seliger H.H. // Photochem. Photobiol. 1965. V. 4. № 6. P. 1015.
Lee J., Seliger H.H. // Ibid. 1970. V.11. № 4. P. 247.
Lee J., Seliger H.H. // Ibid. 1972. V. 15. № 2. P. 227.
Gorsuch J.D. Studies of the Chemiluminescence of Luminol / MIT Ph.D. Thesis (1969). https://dspace.mit.edu/handle/1721.1/52931
Gorsuch J.D., Hercules D.M. // Photochem. Photobiol. 1972. V. 15. № 6. P. 567.
Beck M.T., Joó F. // Ibid. 1972. V. 16. № 6. P. 491.
Цаплев Ю.Б., Васильев Р.Ф., Трофимов А.В. // Хим. физика. 2020. Т. 39. № 6. С. 7.
Трофимов Б.А., Васильцов А.М., Амосова С.В. // Изв. АН СССР. Сер. хим. 1986. № 4. С. 751.
Haapakka K.E., Kankare J.J., Linke J.A. // Anal. Chim. Acta. 1982. V. 139. P. 379.
Auclair C., Voisin E. // Handbook of methods for oxygen radical research. Ed. by R.F. Greenwald. Boca Raton: CRC Press, 1985. P. 123–132.
Hayyan M., Hashim M.A., AlNashef I.M. // Chem. Rev. 2016. V. 116. № 5. P. 3029.
Liu R.H., Fu S.Y., Zhan H.Y., Lucia L.A. // Ind. Eng. Chem. Res. 2009. V. 48. № 20. P. 9331.
Umemoto K., Okamura N. // Bull. Chem. Soc. Jpn. 1986. V. 59. № 10. P. 3047.
Umemoto K., Nagase Y., Sasaki Y. // Bull. Chem. Soc. Jpn. 1994. V. 67. № 12. P. 3245.
Merényi G., Lind J., Eriksen T.E. // J. Biolum. Chemilum. 1990. V. 5. № 1. P. 53.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии