Журнал физической химии, 2020, T. 94, № 12, стр. 1865-1870
Термодинамика взаимодействия с водой редкосшитых гидрогелей акриловой и метакриловой кислот
Л. В. Адамова a, *, А. П. Сафронов a, b
a Уральский федеральный университет им. первого Президента России Б.Н.Ельцина
620002 Екатеринбург, Россия
b Российская академия наук, Уральское отделение, Институт электрофизики
Екатеринбург, Россия
* E-mail: Lidia.adamova@urfu.ru
Поступила в редакцию 03.03.2020
После доработки 25.03.2020
Принята к публикации 14.04.2020
Аннотация
Методами равновесной изотермической сорбции и микрокалориметрии изучено влияние соотношения звеньев различной природы в макромолекулярной сетке гидрогелей сополимеров акриловой (АК) и метакриловой (МАК) кислот на термодинамические параметры взаимодействия с водой. Экспериментально измерены изотермы сорбции паров воды на высушенных гидрогелях и концентрационные зависимости энтальпии набухания частично набухших гидрогелей в избытке воды. Рассчитаны значения эффективного интегрального параметра Флори–Хаггинса χ, а также его энтальпийной χH и энтропийной χS составляющих. Величины параметра Флори–Хаггинса закономерно возрастают с увеличением содержания звеньев МАК в сополимерах, что означает ухудшение взаимодействия с водой и согласуется с уменьшением их степени набухания. Значения χH, напротив, уменьшаются с ростом содержания звеньев МАК в сополимерах. Это свидетельствует о том, что вода энергетически более сильно взаимодействует с сеткой ПМАК, чем с ПАК, несмотря на более гидрофильный характер последней. Величины χS положительны для всех систем, что отвечает отрицательной некомбинаторной энтропии набухания гелей. Результаты обсуждены с точки зрения баланса гидрофильной и гидрофобной гидратации в гелях на основе АК и МАК.
Гидрофильные гели слабосшитых полимеров в последние годы являются объектами пристального интереса исследователей. Особое внимание привлекают гели полиэлектролитной природы, полимерная сетка которых содержит ионогенные группы, способные диссоциировать в воде. Одним из ярких проявлений полиэлектролитной природы гелей является способность поглощать и удерживать огромные количества растворителя и обратимо изменять свой объем под влиянием внешних факторов. Благодаря этим свойствам полиэлектролитные гели находят применение в медицине в качестве биосовместимых полимеров, в фармакологии для доставки лекарственных средств с контролируемым высвобождением, в хроматографии, при решении экологических проблем, для иммобилизации воды [1–6]. Для этих целей широко используются гели на основе полиакриловой кислоты, которые часто модифицируют с помощью синтетических или природных полимеров, в том числе с помощью сополимеризации [7–11]. Одним из способов такой модификации может служить получение гидрогелей сополимеров акриловой CH2=CH–COOH (АК) и метакриловой CH2=C(CH3)–COOH (МАК) кислот [1, 3, 12, 13].
Полимерные кислоты – полиакриловая (ПАК) и полиметакриловая (ПМАК) имеют достаточно линейное строение цепи, каждое звено которой содержит гидрофильную карбоксильную группу, которая обеспечивает взаимодействие с водой посредством образования водородных связей. Единственным различием в химическом строении звеньев ПАК и ПМАК является наличие гидрофобной метильной группы, присутствующей в звене последней. Однако это приводит к существенной разнице в термодинамических характеристиках взаимодействия этих полимеров с водой, которая обусловлена двумя причинами: Во-первых – это сильная ассоциация цепей ПАК, не характерная для ПМАК, во-вторых – существенная роль гидрофобной гидратации в растворах ПМАК, под которой понимают структурирование молекул воды вокруг неполярных групп растворенного вещества [12, 14, 15]. Эти особенности проявляются не только в растворах линейных полимеров ПАК и ПМАК, но и в слабосшитых гидрогелях на их основе. В частности, они обусловливают объемные эффекты набухания и сжатия гидрогелей.
Объемная степень набухания геля определяется суммой нескольких вкладов различной физической природы, важнейшим из которых является взаимодействие сетки геля с растворителем [2]. Представляет интерес проследить, как взаимодействие с водой (гидратация) полимерной сетки гидрогелей сополимеров ПАК и ПМАК зависит от соотношения звеньев АК и МАК в составе сополимера.
Для термодинамического описания процесса взаимодействия редкосшитого полиэлектролитного геля с растворителем могут быть использованы известные теоретические подходы, сформулированные для растворов линейных полимеров [16–18]. Важную роль для характеристики межмолекулярного взаимодействия геля с растворителем играет параметр Флори–Хаггинса χ [16], представляющий собой свободную энергию взаимообмена парных контактов звеньев полимера и молекул растворителя, нормированную к энергии теплового движения. В соответствии с теорией Флори–Хаггинса параметр χ связан с изменением химического потенциала растворителя уравнением
где φ – объемная доля полимера в растворе.В настоящее время этот параметр рассматривается как сумма энтальпийного χH и энтропийного χS вкладов [18]
Одним из прямых термодинамических методов определения параметра Флори–Хаггинса является сорбционное измерение величины относительного давления пара (P1/P$_{1}^{0}$) над системой полимер–низкомолекулярная жидкость в широкой области концентраций
(3)
$\frac{{\Delta {{\mu }_{1}}}}{{RT}} = \ln \frac{{{{P}_{1}}}}{{P_{1}^{0}}} = \ln (1 - \varphi ) + \varphi + \chi {{\varphi }^{2}}.$ПАК, ПМАК и их сополимеры находятся при комнатной температуре в стеклообразном состоянии, которое существенным образом сказывается на термодинамических функциях растворения, и вследствие этого на изотермах сорбции. Для таких систем величина χ, рассчитываемая по уравнению (3), является эффективным параметром, включающим наряду со вкладом бинарного взаимодействия полимера с растворителем также и вклад релаксации стеклообразного состояния полимера.
Для нахождения величины эффективного интегрального параметра χ был использован метод изотермической сорбции паров воды, энтальпийный вклад χH определяли методом изотермической калориметрии. По уравнению (2) рассчитывали энтропийный вклад в параметр взаимодействия χS. Ниже будут представлены закономерности измерения этих величин в зависимости от соотношения гидрофобных и гидрофильных звеньев в гидрогелях сополимеров АК и МАК.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами исследования служили сшитые гидрогели полиакриловой кислоты (ПАК), полиметакриловой кислоты (ПМАК) и их сополимеров с различным соотношением мономеров. Синтез гелей проводили методом радикальной полимеризации в водном растворе с концентрацией мономера 1.6 М. Инициатором служил персульфат аммония (NH4)2S2O8. Сшивающий агент метилендиакриламид (МДАА) CH2(NHCOCHCH2)2 брали в молярном отношении 1 : 100 к мономеру. Полимеризацию проводили при температуре 70°С в течение 2 ч. После этого гели промывали в дистиллированной воде в течение двух недель при ежедневной смене воды до достижения в ней постоянного значения рН 6.2. Ниже гели сополимеров АК и МАК будут маркированы СП (АКnnМАКmm), где nn, mm обозначают мольный процент АК и МАК в мономерной смеси при синтезе.
Равновесную степень набухания гелей в воде (содержание воды в структуре гидрогеля, отнесенное к массе полимерной сетки) определяли гравиметрическим методом, высушивая до постоянной массы образцы отмытых гелей.
Для калориметричеких и сорбционных измерений гели высушивали: сначала при 70°С на воздухе, затем при остаточном давлении 103 Па до постоянной массы.
Сорбцию паров воды высушенными образцами гелей изучали при 25°С двумя методами: весовым и объемным. Объемный метод реализовали с помощью автоматического анализатора площади поверхности и пористости ASAP 2020 (Micromeritics) c приставкой для сорбции паров. Принцип метода заключается в определении количества сорбированного вещества по уменьшению давления пара сорбата, находящегося в парообразной фазе и занимающего определенный заранее прокалиброванный объем. При использовании весового варианта сорбционного метода количество сорбированных паров измеряли с помощью кварцевых спиральных весов Мак-Бэна чувствительностью 0.3 мм/мг. Равновесное давление пара воды определяли оптическим манометром ОМ-2. Количество поглощенных паров воды определяли с точностью 3%. Погрешность в определении давления пара не превышала 1%. Результаты двух независимых методов хорошо согласуются друг с другом.
Измерения энтальпии набухания гелей в воде при 25°С проводили с использованием микрокалориметра Кальве лабораторной конструкции с объемом ячеек 10 см3. Предварительно были приготовлены образцы гелей, содержащие разное количество воды. Для этого к точным навескам высушенного геля добавляли воду, так чтобы получить частично набухшие гели, содержание полимера в которых варьировалось от 10 до 100%. Затем в калориметрической ячейке к образцам частично набухших гелей добавляли избыток воды и измеряли зависимость энтальпии набухания до равновесия от содержания полимера в частично набухшем геле. Абсолютная погрешность калориметрических измерений, по данным электрической калибровки прибора, составляла ±0.02 Дж. Измеряемые тепловые эффекты составляли не менее 0.4 Дж, относительная погрешность измерений не превышала 5%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В табл. 1 приведены значения равновесной степени набухания гидрогелей сополимеров АК и МАК в воде при 25°С. Видно, что степень набухания закономерно уменьшается при переходе от ПАК к ПМАК с увеличением доли метакриловой кислоты в составе сополимера. Это связано с более гидрофильной природой звеньев ПАК по сравнению с ПМАК, звенья которой содержат гидрофобную метильную группу.
Таблица 1.
Степени набухания в воде (α) и параметры взаимодействия в водных растворах сополимеров АК/МАК разного состава
| [АК]/[МАК] | α, г/г | χ | χH | χS |
|---|---|---|---|---|
| 100/0 | 132 | 0.61 | 0.18 | 0.42 |
| 80/20 | 107 | 0.74 | 0.15 | 0.59 |
| 60/40 | 31 | 0.81 | 0.02 | 0.79 |
| 40/60 | 17 | 0.82 | –0.03 | 0.85 |
| 20/80 | 16 | 0.92 | –0.03 | 0.95 |
| 0/100 | 14 | 0.98 | –0.04 | 1.02 |
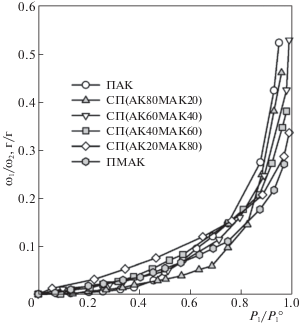
Более сложным образом состав сополимера влияет на поглощение паров воды. На рис. 1 представлены изотермы сорбции паров воды гелями ПАК, ПМАК и сополимеров АК/МАК разного состава в координатах: отношение массовых долей воды и полимера (ω1/ω2) – относительное давление пара воды (P1/P$_{1}^{0}$). Видно, что изотермы имеют небольшой S-образный участок в области малых относительных давлений пара, характерный для стеклообразных рыхлоупакованных полимеров и обусловленный одновременно протекающими процессами адсорбции и набухания [18–20]. Сорбционная способность гелей немонотонно изменяется с составом сополимера и изотермы пересекаются друг с дугом. В области малых значений P1/P$_{1}^{0}$ большей сорбционной способностью обладает ПМАК и сополимеры, обогащенные ею, в области высоких относительных давлений сорбционная способность больше у ПАК и сополимеров с большим содержанием последней. Поведение в области малых относительных давлений связано с уменьшением плотности упаковки цепей ПМАК по сравнению с ПАК, обусловленной наличием метильных групп, приводящей к уменьшению их ассоциации в растворе и большей доступности полярных групп полимеров для молекул воды [21]. В области высоких значений P1/P$_{1}^{0}$ основную роль играет термодинамическое сродство полимеров к воде, которое у ПАК выше, чем у ПМАК [13].
На основании изотерм сорбции при Т = 298 K рассчитывали зависимость разности удельных химических потенциалов воды от содержания воды в структуре геля на разных стадиях процесса сорбции:
(4)
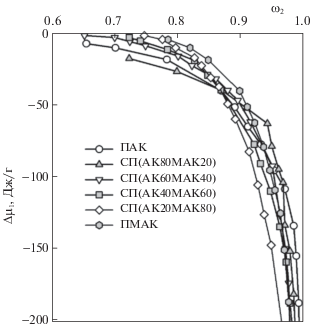
$\Delta {{\mu }_{1}} = \left( {\frac{{RT}}{{{{M}_{1}}}}} \right)\ln \left( {\frac{{{{P}_{1}}}}{{P_{1}^{0}}}} \right),$Как следует из рис. 2, зависимости величин Δμ1 от содержания воды в гидрогеле лежат в области отрицательных значений и коррелируют с изотермами сорбции: чем выше сорбционная способность ксерогеля, тем более отрицательны изменения химического потенциала.
Рис. 2.
Зависимости разности химического потенциала воды Δμ1 при 25°С от весовой доли полимера в набухших гелях ПАК, ПМАК и сополимеров АК/МАК.
Из этих данных по уравнению (3) рассчитывали значения эффективного параметра Флори–Хаггинса для сополимеров разного состава в зависимости от количества сорбированной воды. Значения χ резко зависели от концентрации раствора при большом содержании полимера. Это связано с тем, что при малом содержании сорбированной воды структура полимерной сетки отвечает рыхлой стеклообразной упаковке, для которой характерен неравновесный свободный объем [22, 23]. При увеличении количества сорбированной воды значения χ стремились к постоянной величине при отношении массовых долей воды и полимера (ω1/ω2) близких к 0.5, что отвечало максимальной величине адсорбции на изотерме при P1/P$_{1}^{0}$ = 0.95. Данные предельные значения χ использовали для характеристики термодинамического сродства полимера к воде, они представлены в табл. 1. Вместе с тем, следует отметить, что приведенные в табл. 1 значения χ носят эффективный характер, поскольку при их расчете использовали уравнение (3), не учитывающее особенностей стеклообразного состояния полимера. В литературе представлены [22, 23] теоретические модели, позволяющие учесть вклад релаксации стеклообразного состояния в термодинамические функции смешения полимера с растворителем. Одна из таких моделей была, в частности, использована в работе [13] для определения параметра χ ионизированных редкосшитых ПАК и ПМАК. Сопоставление значений параметра χ, представленных в табл. 1 для ПАК и ПМАК с литературными данными показывает, что значения параметра Флори–Хаггинса, обусловленные бинарным взаимодействием полимера с водой приблизительно на 30% ниже эффективного параметра χ.
Как следует из табл. 1, значения эффективного параметра Флори–Хаггинса закономерно возрастают с увеличением содержания ПМАК в сополимерах, что означает ухудшение взаимодействия гелей с водой и согласуется с уменьшением их степени набухания.
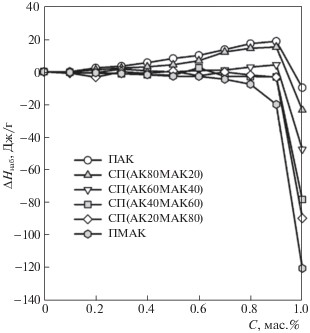
На рис. 3 представлены зависимости энтальпии набухания в избытке воды для предварительно набухших гелей ПАК, ПМАК и сополимеров АК/МАК разного состава в координатах: энтальпия набухания в расчете на 1 г полимерной сетки – весовая доля полимера в частично набухшем геле. Эти зависимости для всех систем носят знакопеременный характер и имеют вид, описанный в литературе для систем стеклообразный полимер – низкомолекулярная жидкость [24–26]. В этом случае участок в диапазоне концентраций от 0 до 90% характеризует качество растворителя, а участок в диапазоне от 90 до 100% отвечает экзотермическому вкладу стеклообразной структуры полимера в энтальпию смешения. По мере увеличения содержания звеньев МАК в составе сополимера наблюдается смещение зависимостей в область более отрицательных значений. Точки пересечения зависимостей с осью ω2 = 1 отвечают энтальпиям набухания полностью высушенных гелей с содержанием полимера 100%.
Рис. 3.
Энтальпия набухания частично набухших гелей ПАК, ПМАК и сополимеров АК/МАК в избытке воды в зависимости от массовой доли (С) полимера в частично набухшем геле.
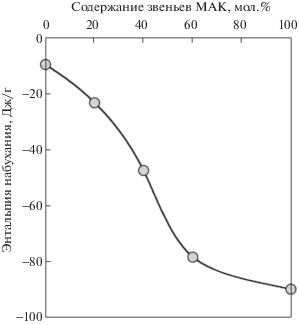
На рис. 4 представлена зависимость энтальпии набухания полностью высушенных гелей (100% полимера) от содержания звеньев МАК. Виден линейный рост отрицательных значений энтальпии набухания с увеличением содержания звеньев МАК в сополимере. Это связано с более рыхлой упаковкой макромолекул ПМАК в стеклообразной структуре по сравнению с ПАК [15, 21] и закономерным уменьшением плотности упаковки макромолекул сополимеров АК/МАК при увеличении содержания звеньев МАК в их составе. В литературе показано [22, 23], что в структуре стеклообразного полимера имеются неравновесные вакансии, которые заполняются растворителем, обусловливая, таким образом, большой дополнительный экзотермический вклад в энтальпию набухания. Поэтому энтальпийный параметр Флори–Хаггинса χH, характеризующий энергию взаимообмена парных контактов звеньев полимера и молекул растворителя, определяли по участку концентрационной зависимости энтальпии набухания в области содержания полимера менее 80%, в которой структура системы имеет равновесный характер.
Рис. 4.
Зависимость интегральной энтальпии набухания высушенных гелей ПАК, ПМАК и сополимеров АК/МАК в избытке воды от содержания звеньев МАК в полимерной сетке.
Начальный участок зависимости энтальпии набухания (рис. 3), обусловленный равновесным процессом гидратации полимерной сетки геля, связан с энтальпийным параметром взаимодействия Флори–Хаггинса χH уравнением [15]:
где φ – объемная доля полимера в частично набухшем геле, соответствующая абсциссам точек на рис. 3, φ равн – объемная доля полимера в геле, набухшем до равновесия в избытке воды.Согласно уравнению (5) зависимость энтальпии набухания гелей от объемной доли полимера в области содержания полимера менее 80% должна иметь вид прямой, тангенс угла наклона которой позволяет рассчитать значения энтальпийного параметра χH. В табл. 1 представлены результаты расчета величины χH гелей.
Можно видеть, что значения χH положительны для гелей ПАК, отрицательны для гелей ПМАК и закономерно уменьшаются от положительных значений к отрицательным с ростом содержания звеньев МАК в сополимерах АК/МАК. Положительные значения χH отвечают эндотермическому процессу, а отрицательные – экзотермическому. Это свидетельствует о том, что вода энергетически более сильно взаимодействует с сеткой ПМАК, чем с ПАК, несмотря на более гидрофильный характер последней. Этот эффект, отмеченный и ранее [12], обусловлен энергетически выгодным процессом образования сетки водородных связей между молекулами воды вокруг неполярных групп полимера, что является проявлением гидрофобной гидратации, наиболее выраженной в гелях, обогащенных звеньями МАК.
По уравнению (2) были рассчитаны энтропийные вклады в параметр взаимодействия полимер – растворитель χS. Они положительны как для гелей ПАК и ПМАК, так и для гелей сополимеров АК/МАК. Положительные значения χS отвечают отрицательным значениям некомбинаторной энтропии набухания гелей. Из табл. 1 видно, что положительные значения χS (соответственно и отрицательные значения некомбинаторной энтропии набухания) возрастают с увеличением содержания звеньев МАК в сополимерах, что свидетельствует о более сильном структурировании в гелях, обогащенных звеньями МАК.
Вероятно, что эффект структурного упорядочения в гидрогелях сополимеров АК/МАК при возрастании содержания звеньев МАК связан с преобладающей ролью гидрофобной гидратации молекул воды вокруг неполярных метильных групп. Такой вклад в энтропию неблагоприятен для сродства компонентов, вследствие чего интегральный параметр взаимодействия для гелей, обогащенных ПМАК, принимает большие положительные значения, т.е. термодинамическое качество растворителя ухудшается, несмотря на уменьшение энтальпийного параметра χH.
Таким образом, проведенное методами изотермической сорбции и микрокалориметрии исследование процесса гидратации гидрогелей сополимеров АК и МАК в зависимости от соотношения звеньев АК и МАК в сополимере позволило определить эффективный параметр Флори–Хаггинса χ, а также его энтальпийную и энтропийную составляющие. Показано, что параметр Флори–Хаггинса увеличивается по мере возрастания доли звеньев МАК в полимерной сетке гидрогелей сополимеров АК/МАК. Это свидетельствует об ухудшении термодинамического качества растворителя (воды) по отношению к гелю. В то же время энергетическое взаимодействие полимерной сетки с водой, характеризуемое энтальпийным параметром Флори–Хаггинса, напротив, усиливается при увеличении содержания звеньев МАК. Такой антибатный характер изменения связанных друг с другом термодинамических параметров обусловлен проявлением гидрофобной гидратации неполярных участков макромолекулярной сетки гелей. Гидрофобная гидратация метильных групп в звеньях МАК приводит к упрочнению структуры воды, что сопровождается экзотермическим эффектом, в то же время дополнительное структурирование обусловливает отрицательные значения некомбинаторной энтропии. Баланс энтальпийного и энтропийного вкладов смещен в пользу последнего, что и приводит к ухудшению термодинамического сродства при увеличении содержания звеньев МАК в гелях сополимеров.
Работа выполнена при финансовой поддержке Российского научного фонда (грант РНФ 18-19-00090).
Список литературы
Bronsted H., Kopecek J. In Polyelertrolyte Gels. Properties, Preparation and Application. Eds. Harland R.S., Prudhomme R.K. Amer. Chem. Soc. Washington D.C. 1990. P. 285.
Филиппова О.Е. // Высокомолек. соед. С. 2000. Т. 42. № 12. С. 2328.
Валуев Л.И., Валуева Т.А., Валуев И.Л., Платэ Н.А. // Успехи биологической химии. 2003. Т. 43. С. 307.
Curatolo V., Nardinocci P., Teresi L. // J. Mechanics and Physics of Solids. 2020. V. 135. https://doi.org/10.1016/j.jmps.2019.103807
Peppas N.A., Hilt J.Z., Khademhosseini A., Langer R. // Adv Mater. 2006. V. 18. № 11. P. 1345.
Будтова Т.В., Сулейменов И.Е., Френкель С.Я. // Журн. прикл. химии. 1997. Т. 70. № 4. С. 529.
Li W., Zhao H., Teasdale P.R. et al. // React. Funct. Polymers. 2002. V. 52. № 1. P. 31.
Oniku J., Hoshi M., Okabe H. et al. // J. Controlled Release. 2005. V. 108. Issue 2–3. P. 331.
Baek S.H., Kim B.S., Kim B.K. // Progress Org. Coating. 2004. V. 49. № 4. P. 353.
Devini D.M., Devery S.M., Lyons J.D. et al. // Int. J Pharmaceutics. 2006. V. 326. Issue 1–2. P. 50.
Huang Y., Yu H., Xiao C. // Carbohydrate Polymers. 2007. V. 69. № 4. P. 774.
Safronov A.P., Smirnova Ye.A., Pollack G.H., Blyakhman F.A. // Macromol. Chem. Phys. 2004. V. 205. № 1. P. 143.
Сафронов А.П., Адамова Л.В., Блохина А.С. и др. // Высокомолек. соед. А. 2015. Т. 57. № 1. С. 36.
Белоусов В.П., Панов М.Ю. Термодинамика водных растворов неэлектролитов. Л.: Химия, 1983.
Вшивков С.А., Адамова Л.В., Сафронов А.П. Термодинамика полимерных систем. Екатеринбург: Изд-во АМБ, 2011. 475 с.
Flory P.J. Principles of Polymer Chemistry. Ithaca: Cornel Univ. Press, 1953. 672 p.
Кленин В.И. Термодинамика систем с гибкоцепными полимерами. Саратов: Изд-во Саратовского ун-та, 1995. 733 с.
Тагер А.А. Физикохимия полимеров. М.: Научный мир, 2007. 574 с.
Герасимов В.К., Чалых А.А., Чалых А.Е. и др. Высокомолек. соед. А. 2001. Т. 43. № 12. С. 2141.
Кулагина Г.С., Чалых А.Е., Герасимов В.К. и др. // Высокомолек. соед. А. 2007. Т. 49. № 4. С. 654.
Сафронов А.П., Тагер А.А., Клюжин Е.С., Адамова Л.В. // Там же. 1993. Т. 35. № 6. С. 700.
Safronov A.P., Adamova L.V. // Polymer. 2002. V. 43. № 9. P. 265
Сафронов А.П., Адамова Л.В. // Высокомолек. соед. А. 2002. Т. 44. № 3. С. 408.
Сафронов А.П., Тагер А.А. // Там же. 1991. Т. 33. № 10. С. 2198.
Адамова Л.А., Сафронов А.П., Терзиян Т.В. // Там же. 2018. Т. 60. № 2. С. 146. https://doi.org/10.7868/S2308112018020086
Сафронов А.П., Адамова Л.В., Курляндская Г.В. // Там же. 2019 Т. 61. № 1. С. 33. https://doi.org/10.1134/S2308112019010152
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии