Журнал физической химии, 2020, T. 94, № 12, стр. 1849-1856
Фазовые равновесия и структура сложных оксидов в системе 1/2Nd2O3–CaO–CoO при 1373 K на воздухе
Т. В. Аксенова a, *, А. С. Урусова a, В. А. Черепанов a
a Уральский федеральный университет им. первого Президента России Б.Н.Ельцина
620000 Екатеринбург, Россия
* E-mail: TV.Aksenova@urfu.ru
Поступила в редакцию 03.03.2020
После доработки 25.03.2020
Принята к публикации 14.04.2020
Аннотация
Методом рентгеновской порошковой дифракции и полнопрофильного анализа Ритвелда установлены области гомогенности и кристаллическая структура твердых растворов Nd2 – zCazO3 – z/2 (0.0 ≤ ≤ z ≤ 0.1, пр. гр. P-3m1) и Nd2 – yCayCoO4 – δ (0.7 ≤ y ≤ 1.0, пр. гр. I4/mmm). Получены зависимости параметров элементарных ячеек от состава твердого раствора Nd2 – yCayCoO4 – δ. Показано, что все кобальтиты Nd2 – yCayCoO4 – δ в температурном интервале 298–1373 K на воздухе обладают практически стехиометрическим составов. Рассчитаны средние значения коэффициентов термического расширения Nd2 – yCayCoO4 – δ (y = 0.8; 0.9). Построен изобарно-изотермический разрез диаграммы состояния системы 1/2Nd2O3–CaO–CoO при 1373 K на воздухе.
В системе Nd2O3–CoO известно о существовании трех бинарных оксидов NdCoO3, Nd2CoO4 и Nd4Co3O10 [1–12]. При 1373 K на воздухе устойчивым является только NdCoO3. Кобальтит неодима NdCoO3 может быть получен по реакции твердофазного синтеза [1–3], разложением растворов нитратов [4], золь–гель-методом [5] или по цитратно-нитратной технологии [6]. В зависимости от условий термической обработки NdCoO3 кристаллизуется в кубической (a = 3.76 Å) [2, 3, 7], орторомбической (a = 5.33 Å, b = 5.35 Å, с = 7.54 Å) или тетрагональной ячейке (a = 3.83 Å, с = 3.91 Å) [8]. Кислородная нестехиометрия в NdCoO3 – δ при 1373 K на воздухе не превышает 0.003 [13]. Бинарный оксид Nd2CoO4 может быть получен по реакции твердофазного синтеза при 1023–1173 K в атмосфере очищенного азота [9]. Nd2CoO4 имеет тетрагональную решетку типа K2NiF4 с параметрами: a = 3.85 Å, с = 12.64 Å. Другой член гомологического ряда Раддлсдена–Поппера An + 1BnO3n + 1 (n = 3) Nd4Co3O10, с орторомбически искаженной перовскитоподобной ячейкой (a = = 5.364 Å, b = 5.452 Å и с = 7.23 Å), образуется в температурном интервале 1373–1473 K при понижении давления кислорода до 10–3 атм. [1, 10–12].
В системе CaO–CoO известно о существовании следующих бинарных оксидов: CaCo2O4, Ca2Co2O5, Ca3Co2O6, Ca3Co4O9 [14–22]. Кобальтит состава CaCo2O4 был получен при 873 K на воздухе золь–гель-методом [14] или при 973 K в атмосфере азота через соосаждение карбонатов [15]. CaCo2O4 кристаллизуется в моноклинной ячейке с параметрами a = 11.490 Å, b = 5.772 Å, c = = 4.737 Å, β = 106.8° [14, 15]. Синтез Ca2Co2O5 проводили по цитратно-нитратной технологии [14], разложением карбонатов [15] или золь–гель-методом [16]. Ca2Co2O5 имеет орторомбически искаженную ячейку с параметрами: a = 11.12 Å, b = 10.74 Å и c = 7.48 Å [15, 17]. Кристаллическая структура оксидов Ca3Co4O9 и Ca3Co2O6, полученных по цитратно-нитратной технологии, была описана в рамках моноклинной (a = 4.832 Å, b = = 36.467 Å, c = 10.819 Å, β = 98.05°, пр. гр. P21/m) [19] и ромбоэдрической (a = 9.079 Å, с = 10.381 Å, пр. гр. R-3c) ячеек, соответственно [19, 20]. При повышении температуры до 1373–1400 K на воздухе перечисленные выше сложные оксиды разлагаются [22], и в системе наблюдается лишь ограниченная растворимость простых оксидов друг в друге: растворимость CaO в CoO составляет 14–17 мол. %, а растворимость CoO в CaO – 7–10 мол. % [21, 22].
Фазовые равновесия в квазитройной системе 1/2Nd2O3–CaO–CoOz исследованы при 1158 K на воздухе [23]. В этих условиях существует три типа твердых растворов: Nd1 – xCaxCoO3 – z (0.0 ≤ x ≤ ≤ 0.25), Ca3 – xNdxCo4O9 – z (0.0 ≤ x ≤ 0.5), Nd2 ‒ xCaxO3 – z (0.0 ≤ x ≤ 0.4) и сложный оксид состава NdCaCoO4 – z. Систематического изучения фазовых равновесий при 1373 K на воздухе ранее не предпринималось, однако были синтезированы твердые растворы Ca1 – xNd1 + xCoO4 – δ, с тетрагональной структурой типа K2NiF4 в интервале составов 0.0 ≤ x ≤ 0.2 [24–27]. Оксиды Ca1 ‒ xNd1 + xCoO4 – δ (0.0 ≤ x ≤ 0.2) проявляют полупроводниковый характер проводимости n-типа и являются парамагнетиками при температуре выше 80 K [24].
Настоящая работа посвящена изучению фазовых равновесий, кристаллической структуры и свойств индивидуальных фаз, образующихся в квазитройной системе 1/2Nd2O3–CaO–CoO при 1373 K на воздухе.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Для приготовления образцов в качестве исходных компонентов использовали оксид Nd2O3 (НО-Л), карбонат CaCO3 (“ч.д.а.”), предварительно прокаленные для удаления адсорбированной влаги и газов, и металлический кобальт. Металлический Co получали восстановлением Co3O4 при 673–973 K в потоке водорода. Синтез сложных оксидов осуществляли по глицерин-нитратной технологии, ранее описанной в [28]. Заключительный отжиг проводили при 1373 K на воздухе в течение 100–120 ч с промежуточными перетираниями. Образцы закаливали на воздухе с 1373 K на комнатную температуру (скорость ~400–500 град/мин).
Определение фазового состава исследуемых образцов проводили на дифрактометрах Inel Equinox 3000 в Fe-излучении (λ = 1.93609 Å) и Shimadzu XRD 7000 в Cu-излучении (λ = 1.5418 Å) с применением монохроматора из пиролитического графита. Съемку проводили в интервале углов 20° ≤ 2$\Theta $ ≤ 90° по 0.02 градуса с выдержкой в точке 2 с.
Параметры элементарных ячеек однофазных образцов были рассчитаны в программе “Сelref” и уточнены методом полнопрофильного анализа Ритвелда в программе “Fullprof”.
Содержание кислорода в оксидах было определено в пяти параллелях методом йодометрического титрования, описанном [29] и в двух параллелях методом полного восстановления образцов в токе водорода при 1373 K в термогравиметрической установке (STA 409 PC, Netzsch GmbH) до простых оксидов Nd2O3, CaO и металлического кобальта Co по реакции:
Измерения относительного расширения керамических брусков при изменении температуры проводили на дилатометре DIL 402 C (Netzsch GmbH) на воздухе в температурном интервале 298–1273 K со скоростью нагрева и охлаждения 5 K/мин.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для изучения фазовых равновесий в системе 1/2Nd2O3–CaO–CoO при 1373 K на воздухе по глицерин-нитратной технологии было приготовлено 40 образцов с различным соотношением металлических компонентов.
Система Nd2O3–CaO
Для определения границы замещения неодима на кальций при 1373 K на воздухе были синтезированы образцы состава Nd2 – zCazO3 – z/2 с z = = 0.05, 0.075, 0.1, 0.125 и 0.15. По результатам РФА установлено, что образцы, соответствующие формуле Nd2 – zCazO3 – z/2 в интервале составов 0.0 ≤ z ≤ 0.1, были однофазны. На рентгенограммах образцов с z = 0.125 и 0.15 помимо основной фазы – твердого раствора граничного состава, присутствовали рефлексы, относящиеся к оксиду кальция CaO. Следовательно, состав граничного твердого раствора Nd2 – z'Caz'O3 – z'/2 лежит в интервале 0.1 < z' < 0.125. Так как более точного определения граничного состава не проводили, при дальнейшем описании фазовых равновесий для упрощения в качестве граничного будем полагать Nd1.9Ca0.1O2.95. Подобно крайнему члену ряда, твердые растворы Nd2 – zCazO3 – z/2 имеют гексагональную структуру и кристаллизуются в пространственной группе P-3m1. В табл. 1 приведены параметры элементарных ячеек Nd2 ‒ zCazO3 – z/2 (0.0 ≤ z ≤ 0.1), уточненные бесструктурным методом Ле-Бейла.
Таблица 1.
Параметры элементарных ячеек твердых растворов Nd2 – zCazO3 – z/2, закаленных с 1373 K на воздухе (пр. гр. P-3m1)
| z | a, Å | c, Å | V, (Å)3 | RBr, % | Rf, % | Rp, % |
|---|---|---|---|---|---|---|
| 0.0 | 3.828(1) | 5.995(1) | 76.16(1) | 1.08 | 1.04 | 11.5 |
| 0.05 | 3.828(1) | 6.002(1) | 76.20(1) | 0.873 | 1.08 | 10.1 |
| 0.075 | 3.828(1) | 6.000(1) | 76.16(1) | 0.757 | 0.822 | 11.8 |
| 0.1 | 3.829(1) | 6.002(1) | 76.19(1) | 1.22 | 1.89 | 11.2 |
Система NdCoO3 – δ–“CaCoO3”
Для установления возможности образования твердых растворов на основе кобальтита неодима Nd1 – xCaxCoO3 – δ были приготовлены соответствующие образцы с x = 0.05, 0.1, 0.2, 0.3 и 0.5. По результатам РФА установлено, что при 1373 K на воздухе замещение неодима на кальций с образованием твердого раствора не происходит, либо не превышает х = 0.05. Образцы номинального состава Nd1 – xCaxCoO3 – δ с 0.0 < x ≤ 0.5 содержали в равновесии три фазы: NdCoO3, CoO и оксид со структурой типа K2NiF4 соответствующий NdCaCoO4 – δ. Аналогичное существенное сужение области гомогенности Ln1 – xCaxCoO3 – δ было обнаружена в системе 1/2Sm2O3–CaO–CoO [30] при 1373 K на воздухе. Твердые растворы Ln1 ‒ xCaxCoO3 – δ полученные для Ln = Nd (0.0 ≤ ≤ x ≤ 0.25) [23] и Ln = Sm (0.0 ≤ x ≤ 0.22) [31] образуются на воздухе при более низкой температуре 1158 K. Уменьшение области гомогенности Ln1 ‒ xCaxCoO3 – δ при повышении температуры можно объяснить тем, что в более жестких восстановительных условиях ионы кобальта будут стремиться понизить среднюю степень окисления, а при незначительном увеличении кислородной нестехиометрии это возможно лишь только за счет уменьшения содержания гетеровалентного допанта – ионов кальция. Таким образом, увеличение температуры заметно уменьшает область гомогенности твердых растворов Ln1 ‒ xCaxCoO3 – δ (Ln = Nd, Sm).
Твердые растворы Nd2 – yCayCoO4 – δ
Для уточнения области гомогенности и кристаллической структуры твердых растворов на основе кобальтита неодима Nd2 – yCayCoO4 – δ при 1373 K на воздухе были приготовлены образцы с y = 0.6, 0.7, 0.8, 0.9, 1.0 и 1.1.
На воздухе бинарный оксид Nd2CoO4 термодинамически нестабилен. Однако, замещение ионов Nd3+ на ионы Ca2+ в Nd2CoO4 повышает среднюю степень окисления кобальта, стабилизируя фазу со структурой типа K2NiF4. По результатам РФА, установлено, что область гомогенности Nd2 – yCayCoO4 – δ, закаленных с 1373 K на воздухе, простирается от y = 0.7 до y = 1.0. Поскольку образцы вне этого интервала были неоднофазны, а более точного определения границ не проводили, как и ранее для простоты будем считать значения y = 0.7 и y = 1.0 границами области гомогенности. Образец номинального состава Nd1.4Ca0.6CoO4 – δ (y = 0.6) в равновесии содержал три фазы: NdCoO3 и два граничных твердых раствора Nd1.3Ca0.7CoO4 – δ и Nd1.9Ca0.1O2.95. На рентгенограмме образца Nd0.9Ca1.1CoO4 – δ (y = 1.1) помимо основной фазы, твердого раствора граничного состава NdCaCoO4 – δ, присутствовали рефлексы оксидов Co0.86Ca0.14O и Ca0.93Co0.07O.
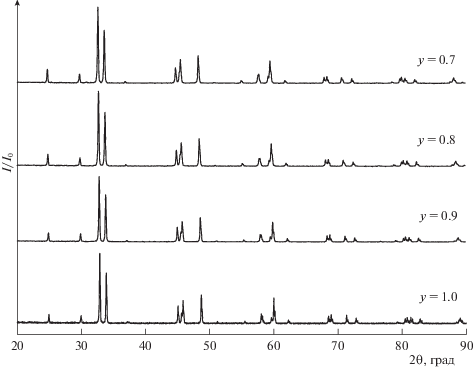
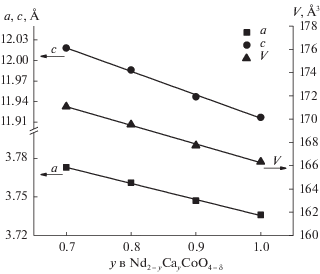
Граничные составы твердых растворов в системе CaO–CoO взяты из работы [21]. Рентгенограммы однофазных оксидов Nd2 – yCayCoO4 – δ с 0.7 ≤ y ≤ 1.0 представлены на рис. 1. Кристаллическая структура оксидов Nd2 – yCayCoO4 – δ (0.7 ≤ ≤ y ≤ 1.0) была описана в тетрагональной симметрии (пр. гр. I4/mmm), что хорошо согласуется с данными [24, 25, 27]. В качестве примера, на рис. 2 представлена дифрактограмма NdCaCoO4 – δ, обработанная по методу полнопрофильного анализа Ритвелда. В табл. 2 приведены уточненные методом Ритвелда параметры элементарных ячеек оксидов Nd2 – yCayCoO4 – δ (0.7 ≤ y ≤ 1.0), закаленных с 1373 K на воздухе и содержание кислорода, определенное методом восстановления образцов водородом и йодометрическим титрованием. Радиусы ионов кальция и неодима (${{r}_{{{\text{C}}{{{\text{a}}}^{{{\text{2 + }}}}}}}}$ = 1.32 Å, ${{r}_{{{\text{N}}{{{\text{d}}}^{{{\text{3 + }}}}}}}}$ = 1.303 Å, к.ч. = 9) [32] отличаются незначительно, однако внутри области гомогенности увеличение концентрации кальция в Nd2 ‒ yCayCoO4 – δ, приводит к монотонному уменьшению параметров и объема элементарных ячеек (рис. 3). По результатам термогравиметрических измерений и йодометрического титрования установлено, что содержание кислорода в оксидах Nd2 – yCayCoO4 – δ остается в пределах ошибки эксперимента практически неизменным при изменении состава и температуры (см. табл. 2). Это означает, что увеличение содержания кальция приводит к возрастанию средней степени окисления кобальта в Nd2 – yCayCoO4 – δ от +2.76 для y = 0.7 до 2.98 для y = 1.0, и, следовательно, доля ионов Co3+ увеличивается. Радиус Co3+(HS) = = 0.75 Å меньше радиуса Co2+(HS) = 0.885 Å [32], что и приводит к уменьшению параметров элементарных ячеек оксидов Nd2 – yCayCoO4 – δ (0.7 ≤ y ≤ 1.0) внутри области гомогенности при увеличении содержания кальция.
Рис. 2.
Рентгенографические данные для NdCaCoO4 – δ, обработанные по методу Ритвелда. Точки – данные эксперимента, 1 – теоретический спектр, 2 – местоположение максимумов с разрешенным набором индексов Миллера (hkl), 3 – разница между экспериментальными данными и теоретической кривой.
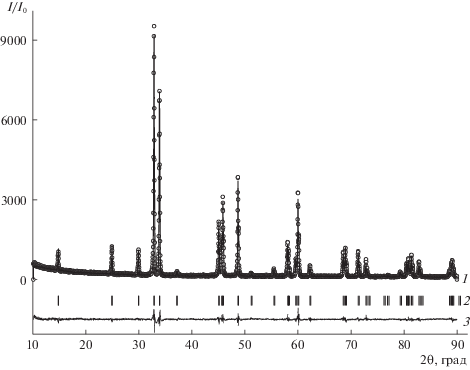
Таблица 2.
Структурные параметры элементарных ячеек твердых растворов Nd2 – yCayCoO4 – δ, закаленных с 1373 K на воздухе (пр. гр. I4/mmm)
| пр. гр. I4/mmm: Ca/Nd (0; 0; z), Co (0; 0; 0), O1 (0; 0.5; 0), O2 (0; 0; z) | ||||
|---|---|---|---|---|
| y | 0.7 | 0.8 | 0.9 | 1.0 |
| a, Å | 3.769(1) | 3.757(1) | 3.744(1) | 3.734(1) |
| c, Å | 12.001(5) | 11.972(1) | 11.937(1) | 11.911(1) |
| V, (Å)3 | 170.52(1) | 169.03(1) | 167.38(1) | 166.07(1) |
| z(Ca/Nd) | 0.361(3) | 0.361(5) | 0.361(4) | 0.360(7) |
| z(O2) | 0.171(1) | 0.170(1) | 0.167(4) | 0.169(5) |
| c/a, Å | 3.184 | 3.187 | 3.188 | 3.190 |
| 4 – δ | 4.03 ± 0.04* | 3.98 ± 0.04* | 3.97 ± 0.04* | 3.99 ± 0.04* |
| 3.95 ± 0.01** | ||||
| α | +2.76 | +2.76 | +2.84 | +2.98 |
| RBr, % | 3.49 | 3.17 | 3.78 | 3.5 |
| Rf, % | 2.56 | 2.16 | 2.42 | 2.58 |
| Rp, % | 15.3 | 14.1 | 14.1 | 14.7 |
Рис. 3.
Концентрационные зависимости параметров и объема элементарных ячеек твердых растворов Nd2 – yCayCoO4 – δ (0.7 ≤ y ≤ 1.0).
Для определения коэффициентов линейного термического расширения (ЛКТР) методом высокотемпературной дилатометрии порошки оксидов Nd2 – yCayCoO4 – δ (y = 0.8, 0.9) были спрессованы в бруски размером 4 × 4 × 25 мм и спечены при 1523 K на воздухе в течение 24 ч, с последующим медленным охлаждением до комнатной температуры со скоростью 100 K/ч. Относительная плотность спеченных оксидов Nd2 ‒ yCayCoO4 – δ составила не менее 85% от теоретического значения, рассчитанного из рентгенографических данных. Форма зависимостей относительного линейного расширения керамических образцов Nd2 – yCayCoO4 – δ (y = 0.8, 0.9) от температуры в интервале 298–1273 K на воздухе заметно отличается от линейной (рис. 4). Полученные зависимости ΔL/L0 = ƒ(T) описаны уравнениями полиномов 3-й степени (табл. 3), а значения ЛКТР могут быть рассчитаны по уравнению:
(1)
${{\alpha }_{P}} = \frac{1}{{{{L}_{0}}}}\left( {\frac{{d\Delta L}}{{dT}}} \right) = {{b}_{1}} + 2{{b}_{2}}T + 3{{b}_{3}}{{T}^{2}}.$(2)
${\text{O}}_{{\text{O}}}^{ \times } + {\text{V}}_{i}^{ \times } \leftrightarrow {\text{O}}_{i}^{{{\text{''}}}} + {\text{V}}_{{\text{O}}}^{{..}}.$Рис. 4.
Зависимости относительного линейного расширения Nd2 – yCayCoO4 – δ (y = 0.8 (1), 0.9 (2)) от температуры на воздухе.
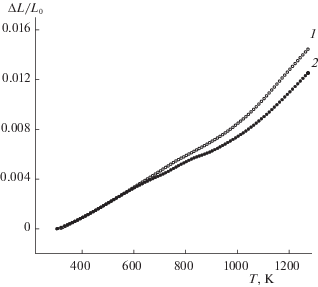
Таблица 3.
Коэффициенты уравнений, описывающих изобарические зависимости $\frac{{\Delta L}}{{{{L}_{0}}}} = a + {{b}_{1}}T$ $ + \;{{b}_{2}}{{T}^{2}} + {{b}_{3}}{{T}^{3}}$ и значения средних ЛКТР для Nd2 ‒ yCayCoO4 – δ (y = = 0.8, 0.9) на воздухе
| Коэффициенты | y | |
|---|---|---|
| 0.8 | 0.9 | |
| a | –0.00683 | –0.00662 |
| b1 | 2.85413 × 10–5 | 2.65162 × 10–5 |
| b2 | –2.77526 × 10–8 | –2.42073 × 10-8 |
| b3 | 1.35545 × 10–11 | 1.29043 × 10–11 |
| R2 | 0.99922 | 0.9992 |
| αp × 106, K–1 (T = 298–1273 K) |
14.4 | 15.5 |
| αp × 106, K–1 (T = 298–900 K) |
10.87 | 12.3 |
| αp × 106, K–1 (T = 900–1273 K) |
17.84 | 20.54 |
Диаграмма состояния системы 1/2Nd2O3–CaO–CoO
Для изображения диаграммы состояния четырехкомпонентной системы Nd–Ca–Co–O в плоскости в изобарно-изотермических условиях удобно использовать треугольник, состав в котором выражен через мольную долю по металлическим компонентам, а вершины треугольника соответствуют равновесно существующим в этих условиях простым оксидам 1/2Nd2O3, CaO и CoO. Содержание кислорода при этом не определяется из диаграммы, а приписывается равным соответствующему термодинамически равновесному. Информация о фазовых равновесиях на стороне CaO–CoO при 1373 K на воздухе взята из [21]. На основании установленных областей гомогенности твердых растворов Nd2 – zCazO3 – z/2 (0.0 ≤ z ≤ ≤ 0.1), Nd2 – yCayCoO4 – δ (0.7 ≤ y ≤ 1.0) и фазового состава других образцов диаграмма состояния системы 1/2Nd2O3–CaO–CoO при 1373 K на воздухе была разделена на 9 фазовых полей (рис. 5). Состав фазовых полей представлен в табл. 4.
Рис. 5.
Изобарно-изотермический разрез диаграммы состояния системы 1/2Nd2O3–CaO–CoO при 1373 K на воздухе.
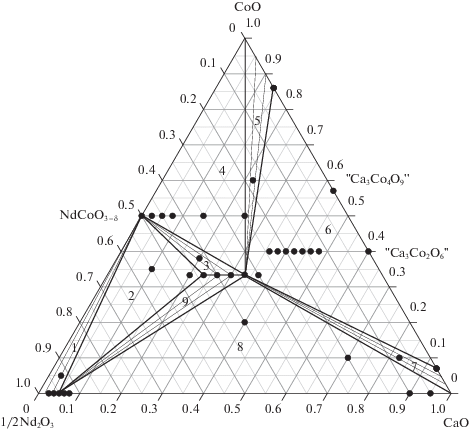
Таблица 4.
Состав фазовых полей диаграммы состояния системы 1/2Nd2O3–CaO–CoO при 1373 K на воздухе
| № обла-сти на диаг-рамме | Фазовый состав полей |
|---|---|
| 1 | NdCoO3 и Nd2 – zCazO3 – z/2 (0.0 ≤ z ≤ 0.1) |
| 2 | Nd0.9Ca0.1O2.95, NdCoO3 и Nd1.3Ca0.7CoO4 – δ |
| 3 | NdCoO3 и Nd2 – yCayCoO4 – δ (0.7 ≤ y ≤ 1.0) |
| 4 | NdCoO3, CoO и NdCaCoO4 – δ |
| 5 | Co1 – mCamO (0 ≤ m ≤ 0.14) и NdCaCoO4 – δ |
| 6 | NdCaCoO4 – δ, Co0.86Ca0.14O и Ca0.93Co0.07O |
| 7 | Ca1 – nConO (0.0 ≤ n ≤ 0.07) и NdCaCoO4 – δ |
| 8 | CaO, NdCaCoO4 – δ и Nd1.9Ca0.1O2.95 |
| 9 | Nd1.9Ca0.1O2.95 и Nd2 – yCayCoO4-δ (0.7 ≤ y ≤ 1.0) |
Таким образом, в квазитройной системе 1/2Nd2O3–CaO–CoO при 1373 K на воздухе установлены границы областей существования и структура твердых растворов: Nd2 – zCazO3 – z/2 с 0.0 ≤ z ≤ 0.1 (пр. гр. P-3m1) и Nd2 – yCayCoO4 – δ с 0.7 ≤ y ≤ 1.0 (пр. гр. I4/mmm). Изменение параметров элементарных ячеек Nd2 – yCayCoO4 – δ (0.7 ≤ ≤ y ≤ 1.0) при изменении содержания кальция в большей степени связано с изменением степени окисления ионов кобальта. В температурном интервале 298–1373 K на воздухе кобальтиты Nd2 ‒ yCayCoO4 – δ (0.7 ≤ y ≤ 1.0) являются практически стехиометричными по кислороду (δ ≈ 0). Рассчитанные средние коэффициенты термического расширения Nd2 – yCayCoO4 – δ возрастают с увеличением содержания кальция. Диаграмма состояния системы 1/2Nd2O3–CaO–CoO, построенная при 1373 K на воздухе, разделена на девять фазовых полей.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ (проект № FEUZ-2020-0052), и по постановлению № 211 Правительства Российской Федерации, контракт № 02.A03.21.0006.
Список литературы
Petrov A.N., Cherepanov V.A., Zuyev A.Yu. et al. // J. Solid State Chem. 1988. V. 77. № 1. P. 1.
Hashimoto H., Kusunose T., Sekino T. // J. Alloys and Compd. 2009. V. 484. P. 246.
Tealdi C., Islam M.S., Fisher C.A.J. et al. // Progr. Solid State Chem. 2007. V. 35. P. 491.
Choudhary V.R., Mondal K.C. // Applied Energy. 2006. V. 83. P. 1024.
Malavasi L., Teadi C., Flor G. et al. // Sens. and Actuat. 2005. V. 105. P. 407.
Patil A., Parida S.C., Dash S. et al. // Thermochim. Acta. 2007. V. 465. P. 25.
Ali Z., Ahmad I., Amin B. et al. // Physica B. 2011. V. 406. P. 3800.
Bose M., Ghoshray A., Basu A. // Phys. Rev. B. 1982. V. 26. P. 4871.
Книга М.В., Выговский И.И., Климентович Е.Е. // Журн. неорган. химии. 1979. Т. 24. С. 1171.
Kitayama K. // J. Solid State Chem. 1998. V. 137. P. 255.
Kitayama K. // Ibid. 1988. V. 76. № 2. P. 241.
Olafser A., Fjellvag H., Hauback B.C. // Ibid. 2000. V. 151. № 1. P. 46.
Петров А.Н., Черепанов В.А., Зуев А.Ю. // Журн. физ. химии. 1987. Т. 61. № 3. С. 630.
Tran H., Mehta T., Zeller M. et al. // Mat. Res. Bull. 2013. V. 48. P. 2450.
Vidyasagar K., Gopalakrishnan J., Rao C.N.R. // Inorg. Chem. 1984. V. 23. P. 1206.
Agilandeswari K., Ruban Kumar A. // Adv. Powder Technol. 2014. V. 25. № 3. P. 904.
Pei J., Chen G., Li X. et al. // Mat. Lett. 2009. V. 63. P. 1459.
Sotelo A., Rasekh Sh., Torres M.A. et al. // J. Solid State Chem. 2015. V. 221. P. 247.
Hervoches C.H., Fjellva H., Kjekshus A. et al. // Ibid. 2007. V. 180. P. 628.
Iwasaki K., Yamane H., Kubota S. et al. // J. Alloys and Compd. 2003. V. 358. P. 210.
Woermann E., Muan A. // J. Inorg. Nucl. Chem. 1970. V. 32. P. 1455.
Jacob K.T., Gupta P. // J. Solid State Chem. 2015. V. 221. P. 57.
Wong-Ng W., Laws W., Talley K.R. et al. // J. Solid State Chem. 2014. V. 215. P. 128.
Taguchi H., Kido H., Tabata K. // Physica B. 2004. V. 344. P. 271.
Shlyakhtin O.A., Mazo G.N., Kaluzhskikh M.S. et al. // Mat. Lett. 2012. V. 75. P. 20.
Shlyakhtin O.A., Mazo G.N., Malyshev S.A. et al. // Mat. Res. Bull. 2013. V. 48. № 2. P. 245.
Thorogood G.J., Orain P., Ouvry M. et al. // Solid State Scien. 2011. V. 13. P. 22113.
Аксенова Т.В., Элкалаши Ш.И., Урусова А.С., Черепанов В.А. // Журн. неорган. химии. 2017. Т. 62. № 8. С. 1092.
Urusova A.S., Cherepanov V.A., Aksenova T.V. et al. // J. Solid State Chem. 2013. V. 202. P. 207.
Galayda A.P., Volkova N.E., Gavrilova L.Ya. et al. // J. Alloys and Compd. 2017. V. 718. P. 288.
Wong-Ng W., Laws W., Lapidus S.H. et al. // Solid State Scien. 2015. V. 48. P. 31.
Shannon R.D // Acta. Cryst. 1976. V. 32. P. 751.
Liu X., Prewitt C.T. // J. Phys. Chem. Solids. 1991. V. 52. P. 441.
Gilev A.R., Kiselev E.A., Cherepanov V.A. // RSC Advances. 2016. V. 6. P. 72905.
Gilev A.R., Kiselev E.A., Zakharov D.M. et al. // Solid State Sci. 2017. V. 72. P. 134.
Gilev A.R., Kiselev E.A., Zakharov D.M. et al. // J. Alloys and Compd. 2018. V. 753. P. 491.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии