Журнал физической химии, 2020, T. 94, № 12, стр. 1767-1775
Ионный обмен как метод направленного синтеза твердых растворов халькогенидов металлов
Н. А. Чуфарова a, *, Л. Н. Маскаева a, В. Ф. Марков a
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
620002 Екатеринбург, Россия
* E-mail: natal-ku8@yandex.ru
Поступила в редакцию 03.03.2020
После доработки 25.03.2020
Принята к публикации 14.04.2020
Аннотация
Раскрыто понятие ионообменной трансформации в гетерогенных системах “тонкая пленка–водный раствор металла-заместителя” как перспективного метода синтеза многокомпонентных соединений на основе халькогенидов металлов. На основании данных, полученных на кафедре физической и коллоидной химии УрФУ с использованием тонкопленочных твердых растворов SnxPb1 ‒ xSe, CdxPb1 – xS, AgxPb1 – xS, HgxPb1 – xSe, SnxPb1 – xS различного состава, показаны характерные особенности этого процесса и выявлен ряд его физико-химических закономерностей. Рассмотрена организация процесса ионообменного синтеза, начиная от предварительного расчета и заканчивая интерпретацией полученных результатов. Описано влияние на глубину протекания процесса морфологии и кристаллической структуры исходной пленки, состава водного раствора, металла-заместителя, температуры. Приведены данные по твердофазной диффузии ионов свинца в пленке CdS.
Современная история ионного обмена, насчитывающая более 100 лет, в течение которых ионообменные процессы, представляющие стехиометрическое замещение разноименных ионов между двумя контактирующими фазами, нашли широкое практическое применение во многих отраслях науки и техники. Особое внимание уделялось ионообменным материалам на основе сульфидов, в частности, для извлечения тяжелых металлов, например, меди из водных растворов [1], благородных металлов пленками Cu2S [2], серебра тонкослойным сульфидом никеля [3], токсичных и радиоактивных металлов из сточных вод и отработанных растворов металлосульфидными сорбентами [4–6]. Метод ионного обмена используется для получения соединений, прямой синтез которых затруднен либо неэффективен, например, синтез сульфида серебра путем полной трансформации тонких пленок SnS2 посредством их выдержки в водном растворе нитрата серебра(I) [7]. В работе [8] авторам удалось внедрить медь в состав химически осажденной тонкой пленки ZnSe путем ее выдержки в водном растворе хлорида меди CuCl2.
Ионный обмен на границе “твердая фаза (сульфид или гидроксид металла)–раствор соли металла-заместителя” изучался Вольхиным с сотр. [9, 10]. В исследовании [11] рассмотрена сорбция ионов кадмия Cd2+ осадком сульфида никеля в нейтральной и кислой средах. Путем трансформации тонкой пленки CdS выдерживанием в электролите, содержащем ионы теллура Те2−, в [12] была успешно решена задача создания гетеростуруктуры CdS/CdTe для гелиоэнергетики. Для получения гетеропереходов CdS/Cu2S в пленочных солнечных элементах использовалось замещение ионов Cd2+ в пленках CdS на ионы меди Cu+ за счет погружения их в водный раствор CuCl [13]. Выдержка пленок CdS в водном растворе одновалентной меди использовалась также в [14] для улучшения их функциональных свойств.
Считается, что применение химических методов модифицирования электронной и кристаллической структуры полупроводников А2В6 может оказаться достаточно результативным. Подтверждением служат публикации [15, 16], в которых для разработки электронных устройств, в частности, полевых транзисторов, использована технология ионообменного замещения путем погружения пленки CdS в раствор CuCl2. Дисперсионной рентгеновской спектроскопией доказана возможность замещения до 10% атомов кадмия в CdS ионами меди [15]. В [16] проведена оценка ионообменного замещения с привлечением оптических исследований, сканирующей растровой микроскопии и рентгеновской фотоэлектронной спектроскопии. Авторы [16] обнаружили, что обмен кадмия на ионы меди способствует изменению ширины запрещенной зоны и образованию гексагональной кристаллической структуры. Ранее [17] было установлено увеличение доли гексагональной фазы CdS после контакта тонкопленочного сульфида кадмия с тиосульфатным комплексом серебра(I).
По мнению ряда исследователей [18, 19], достаточно часто процессы, сопровождающиеся ионообменными реакциями, приводят к возникновению новых фаз, представляющих собой твердые растворы замещения на основе халькогенидов металлов. Так, в работе [18] показано формирование твердого раствора Cd1 – xHgхTe на поверхности монокристаллов CdTe при контакте с раствором HgCl2 в глицерине при 160°C, а при ионообменном диффузионном легировании монокристаллов ZnSe ионами Cd2+ из расплавов солей были получены твердые растворы Zn1 ‒ xCdхSe [19].
Исследования процесса ионообменного замещения для направленного синтеза твердых растворов замещения на основе халькогенидов металлов на кафедре физической и коллоидной химии Уральского федерального университета проводятся уже более десяти лет. Интерес к ним возник после успешных экспериментов по целенаправленному синтезу твердых растворов Pb1 ‒ xSnxSe путем выдерживания тонкой пленки PbSe в растворе соли SnCl2 [20–22]. При дальнейших исследованиях удалось получить твердые растворы в системе PbSe–SnSe с аномально высоким уровнем замещения до 31.6 ат. % [23]. Эти результаты послужили отправной точкой для формирования и развития научного направления, впоследствии названного методом ионообменной трансформации или ионообменного замещения. Метод успешно апробирован при получении твердых растворов Pb1 – xHgxSe [24], AgxPb1 – xS [25], SnxPb1 – xS [26] в реакционных системах PbSe(тв.)/Hg2+(р-р), PbS(тв.)//Ag+(р-р), PbS(тв.)/ /Sn2+(р-р), а также Pb1 – xCdxS при использовании реакционных систем CdS(тв.)//Pb2+(р-р) [27–33] и PbS(тв.)//Cd2+(р-р) [34, 35].
Получение твердых растворов замещения халькогенидов металлов методом ионообменной трансформации можно считать сложившимся универсальным приемом. Важнейшими достоинствами и преимуществами метода, открывающими широкие перспективы эффективного его использования, является проведение процесса при относительно низких температурах и атмосферном давлении, простота технологической операции и низкая стоимость оборудования, обеспечивающих в итоге возможность синтеза перспективных материалов для наноэлектроники, сенсорики и солнечной энергетики. Кроме того, данный материаловедческий прием может дать важную научную информацию как эффективный метод исследования свойств материалов, в частности, коэффициента диффузии обменивающихся ионов, а также применен в приложении к новым объектам современной электроники от тонких пленок до квантовых точек.
Цель настоящей работы – анализ особенностей и физико-химических закономерностей процесса ионообменной трансформации, происходящего при межфазном взаимодействии на границе “твердофазная пленка халькогенида металла–водный раствор соли металла заместителя”.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Процедура ионообменной трансформации заключалась в выдерживании химически осажденной тонкой пленки сульфида или селенида металла в водном растворе соли металла-заместителя. Продолжительность контакта пленки халькогенида металла с раствором, его состав и температура процесса определялись, исходя из конкретной реакционной системы. Процесс ионообменной трансформации проводился в герметичных бюксах объемом 50 мл в термостате марки “ТЖ-ТБ-01” с точностью поддержания температуры ±0.1 K.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
В общем виде процесс ионного обмена на межфазной границе “твердая фаза сорбента на основе халькогенида металла–водный раствор соли металла заместителя” можно описать уравнением:
(1)
$\begin{gathered} q{{{\text{A}}}_{2}}{{{\text{X}}}_{{n{\text{\;}}}}}({\text{тв}}.){\text{/}} + 2n{\text{B}}_{{}}^{{q + }}({\text{р - р}}){\text{\;}} = \hfill \\ = n{{{\text{B}}}_{2}}{{{\text{X}}}_{{q{\text{\;}}}}}({\text{тв}}.) + 2q{\text{A}}_{{}}^{{n + }}({\text{р - р}}), \hfill \\ \end{gathered} $С целью организации управления процессом синтеза твердых растворов замещения с применением ионообменной трансформации важно сформировать представление о нем, а также о механизме его протекания на межфазной поверхности. Согласно работам [36–39], посвященным изучению массообмена (преимущественно для кристаллических сорбентов), существуют три основных механизма формирования новой фазы в процессе ионного обмена [36]:
– механизм “растворение–осаждение” в объеме раствора, когда ионы X2− и Bq+ взаимодействуют в жидкой фазе после растворения сорбента A2Xn(тв.) с образованием новой фазы B2Xq(тв.), осаждающейся в объеме раствора (рис. 1а);
Рис. 1.
Схемы массопереноса при ионообменных процессах: механизм “растворение–осаждение” в объеме раствора (а), механизм “растворение–осаждение” на поверхности (б), топохимический механизм (в); A2Xn – исходная твердая фаза, B2Xq – конечная твердая фаза продукта.
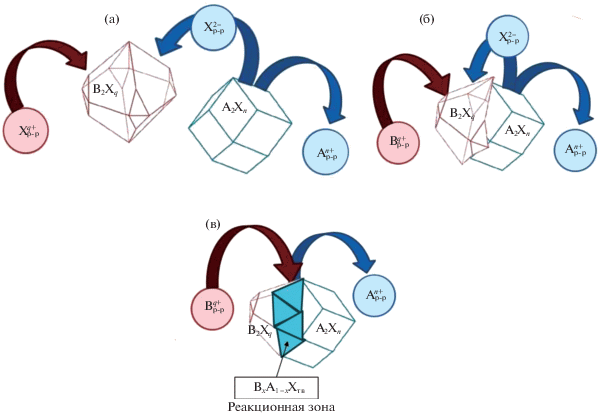
– механизм “растворение–осаждение” на поверхности, при котором осаждение нового труднорастворимого соединения фазы B2Xq(тв.) протекает на поверхности исходного сорбента в виде закономерным образом ориентированного слоя, а массоперенос осуществляется через жидкую фазу (рис. 1б);
– топохимический механизм, при реализации которого ионообменная реакция протекает непосредственно в твердой фазе A2Xn(тв.) на межфазной границе раздела “исходное вещество–конечный продукт”, в результате чего происходит массоперенос (рис. 1в).
Поскольку топохимический характер ионообменных реакций в металлосульфидах был ранее описан в работах [37–39] (рис. 1в), с учетом его основных положений можно предложить механизм протекания процесса ионного обмена на поверхности тонкой пленки. Вначале на отдельных наиболее реакционно-активных точках ее поверхности возникают первичные зародыши новой фазы B2Xq(тв.), после чего происходит их рост с соответствующим увеличением площади поверхности, сопровождающейся возрастанием скорости топохимического процесса. Дальнейшее повышения его скорости до максимальных значений может быть обусловлено увеличением площади реакционной поверхности за счет срастания частиц новой фазы. После полного заполнения реакционной поверхности исходной пленки скорость процесса падает практически до нуля. Приведенный механизм протекания ионообменных процессов на границе “твердая фаза–водный раствор металла-заместителя” отражается в специфическом виде кинетических кривых.
Кинетические кривые, полученные посредством рентгено-флуоресцентного анализа на примере тонкопленочных образцов сульфида свинца после его ионообменной модификации, использовались в работах Р.А. Юсупова с сотр. [40–43] для выделения отдельных стадий процесса ионного обмена на поверхности пленочного сорбента. В отличие от осадков тонкие пленки представляют собой плотный поликристаллический слой из зерен, которые находятся в тесном соприкосновении друг с другом, ограничивая тем самым площадь поверхности, контактирующей с раствором соли металла-заместителя. С учетом данных [40], процесс диффузии ионов металла из раствора в структуру тонкопленочного сорбента можно представить посредством трех последовательных этапов, скорость протекания каждого из которых определяется морфологическими и структурными особенностями исходной пленки, а также составом взаимодействующего с ней раствора и внешними условиями процесса:
− накопление иона металла из контактирующего водного раствора поверхностным слоем тонкой пленки, его насыщение;
− диффузия по границам зерен (кристаллов) твердого тела;
− внутрикристаллитное перемещение примеси, собственно топохимическая реакция.
Как уже указывалось, важным фактором, влияющим на скорость протекания ионного обмена, является состав раствора, контактирующего с пленкой, в частности, его лигандный фон. Это объясняется координирующей способностью иона металла-заместителя, т.е. при образовании прочных комплексов иона металла с лигандами, имеющими разветвленное строение, его подвижность существенно снижается, соответственно скорость протекания первой сорбционной стадии падает. Аналогично действуют и введенные в состав раствора различного рода ПАВ, повышающие вязкость среды и препятствующие движению ионов в растворе. Интересный эффект отмечен в [20], где наблюдалось уменьшение доли замещения олова в составе твердого раствора Pb1 ‒ xSnxSe при увеличении длительности выдержки пленки PbSe в цитратном растворе соли олова Sn2+ свыше 3 ч. Это могло быть связано с обратным процессом растворения образовавшейся фазы под влиянием комплексообразования олова с цитрат-ионами в водном растворе.
Введение лигандов в состав раствора соли металла-заместителя может использоваться и для “вытягивания” ионов металла из исходной пленки в раствор для ускорения обменного процесса. Так, в работе [44] демонстрируется интенсификация ионообменного процесса на границе PbSe(тв.)/Sn2+(р-р) при введении в раствор соли хлорида олова(II) ацетат-ионов, образующих достаточно прочные комплексы с ионами свинца (рk1 = 2.68, 4.08, 6.48 и 8.58 [45]). При этом уровень замещения свинца на олово(II) составил 31.6 ат. % [44] против полученных ранее 15 ат. % [20].
Таким образом, для организации синтеза твердого раствора посредством ионообменной трансформации, важно a priori выбрать наиболее благоприятные условия протекания процесса.
Теоретические представления об оценке вероятности ионообменных трансформаций в первых работах кафедры, посвященных ионному обмену, ограничивались сопоставлением произведений растворимости ПР0 или изменения свободной энергии Гиббса $\Delta G_{T}^{0}$, определяемой их разностью [20, 24, 25, 27]:
(2)
$\Delta G_{T}^{0} = - RT\ln \frac{{{\text{ПР}}_{{{{{\text{A}}}_{2}}{{{\text{X}}}_{n}}}}^{0}}}{{{\text{ПР}}_{{{{{\text{B}}}_{2}}{{{\text{X}}}_{q}}}}^{0}}},$Интерпретация результатов расчетов базируется на том, что, согласно рассуждениям авторов [9], для протекания ионного обмена в системе “тонкая пленка A2Xn – водный раствор соли металла заместителя Bq+” необходимо создать такие условия в реакционной смеси, при которых ${\text{ПР}}_{{{{{\text{B}}}_{2}}{{{\text{X}}}_{q}}}}^{0}$ < ${\text{ПР}}_{{{{{\text{A}}}_{2}}{{{\text{X}}}_{n}}}}^{0}$, т.е. ионы металла твердой фазы приобретают способность переходить в фазу водного раствора. Содержащиеся в растворе ионы Bq+, в свою очередь, взаимодействуя с ионами X2–, смогут образовывать собственную фазу B2Xq. В ходе подобного перехода и происходит образование промежуточных кристаллических фаз – твердых растворов замещения BxA1 – xX. Однако использование для предварительного расчета только справочных термодинамических констант не учитывает реально созданные в реакционной смеси условия.
В работе [21] для оценки возможности образования твердых растворов замещения предложено сопоставлять величины эффективных произведений растворимости халькогенидов металлов, позволяющие учесть при расчетах не только термодинамические параметры (температуру, давление), но и ионную силу раствора, лигандный фон и протекание побочных реакций:
(3)
${\text{ПР}}_{{{{{\text{M}}}_{m}}{{{\text{X}}}_{n}}}}^{{\text{'}}} = \frac{{{\text{ПР}}_{{{{{\text{M}}}_{m}}{{{\text{X}}}_{n}}}}^{0}}}{{\alpha _{{{{{\text{M}}}^{{{{z}_{1}} + }}}}}^{m}\alpha _{{{{{\text{X}}}^{{{{z}_{2}} - }}}}}^{n}{{f}_{{{{{\text{M}}}^{{{{z}_{1}} + }}}}}}{{f}_{{{{X}^{{{{z}_{2}} - }}}}}}}},$Подобный подход успешно использовался для прогнозирования возможности протекания ионообменного замещения в системах CdS–PbS, PbSe–SnSe, PbS–SnS. Однако при сравнении способности к формированию осадков халькогенидов металлов с различным стехиометрическим содержанием катионов и анионов, таких как Ag2S [25], выявилось несовершенство такого расчета. Впоследствии авторами [46] был предложен универсальный метод оценки способности халькогенидов металлов к взаимным ионообменным трансформациям в водных растворах с учетом комплексообразования. Суть метода заключалась в сопоставлении полноты протекания реакций растворения различных твердых фаз, рассчитанных по формуле:
(4)
$S = \sqrt[{m + n}]{{\frac{{{\text{ПР}}_{{{{{\text{M}}}_{m}}{{{\text{X}}}_{n}}}}^{{\text{'}}}}}{{{{m}^{m}}{{n}^{n}}}}}}.$Апробация такого подхода приведена в [46], где демонстрируется согласованность результатов расчетов с ранее полученными экспериментальными данными для исследуемых нами систем, согласно которым, были синтезированы пленки твердых растворов Pb1 – xHgxSe (0 < х < 0.4) [24], Pb1 – xCdxS (0 < х < 0.022) [34] и AgxPb1 – xS (0 < х < 0.24) [25]. Получено также высокое соответствие результатов расчетов с экспериментальными данными для системы PbSe–SnSe.
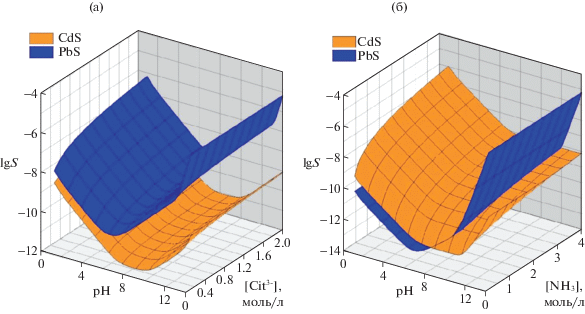
В качестве примера на рис. 2 показана рассчитанная по предложенной в [46] методике зависимость растворимости сульфидов кадмия и свинца lg SCdS и lg SPbS от равновесных значений рН и концентрации лигандов в растворе для ионообменного процесса в присутствии Na3C6H5O7 (рис. 2а) и NH4OH (рис. 2б). Как видно из рисунка, введение в раствор соли металла цитрата натрия независимо от pH раствора не приводит к интенсификации процесса на межфазной границе CdS(тв.)/Pb2+(р-р): плоскость растворимости сульфида свинца лежит выше плоскости растворимости сульфида кадмия [47]. Это свидетельствует о том, что ионы свинца, находясь в растворе преимущественно в виде Pb(OH)Cit2− (pkн = = 13.7) [45] закомплексованы сильнее, чем ионы кадмия Cd(OH)Cit2– (pkн = 9.3) [45]. Кроме того, цитрат натрия, повышая вязкость среды, затрудняет процесс диффузии ионов Pb2+ к поверхности пленки CdS, препятствуя, тем самым, формированию твердой фазы индивидуального сульфида свинца. В свою очередь присутствие в растворе аммиака связывает кадмий в многочисленные аммиачные комплексы. Растворимость CdS при этом начинает превышать растворимость PbS, что в целом благоприятствует протеканию ионообменного процесса. Однако, несмотря на пересечение плоскостей растворимости сульфидов свинца и кадмия, аммиак не является эффективной добавкой для проведения ионного обмена в рассматриваемом случае. По результатам проведенного анализа с целью подбора условий протекания ионообменного процесса в системе CdS–PbS предпочтение было отдано индивидуальному раствору соли свинца [27–33].
Рис. 2.
Зависимости логарифма растворимости lg SCdS и lg SPbS от равновесных значений рН и концентрации комплексующих добавок при введении в реакционную смесь цитрата натрия Na3C6H5O7 (а) и гидроксида аммония (NH4OH) (б).
Увеличение температуры процесса способствует накоплению ионов металла-заместителя на поверхности тонкопленочного сорбента. Повышение при этом возможности преодоления ими активационного барьера зернограничной диффузии и внутрикристаллитной топохимической реакции повышает вероятность образования твердого раствора. Так, в работах [31, 33] показано, что рост температуры с 353 до 368 K увеличивает содержание свинца в составе пленки CdS при контакте ее с водным раствором Pb(CH3COO)2 в 1.4 раза (с 27 до 38 ат. %). Подобный подход использовался и при выборе условий протекания ионообменного синтеза в системе PbS–SnS [26], где максимальное содержание олова 33.3 ат. %. было достигнуто при температуре 368 K и продолжительности контакта, равного 9 ч.
Для осуществления процесса ионообменной трансформации, в котором участвуют халькогениды металлов со значительной разницей в произведениях растворимости, например, PbS и Ag2S, PbSe и HgSe, повышения температуры, как правило, не требуется. Величины произведений растворимости сульфида свинца (ПР0 = 2.5 × 10–27 [45]) и сульфида серебра (ПР0 = 6.3 × 10–50 [45]) обеспечивают эффективную трансформацию пленки PbS в твердый раствор замещения AgxPb1 – xS с 0 ≤ x ≤ 0.24 при комнатной температуре [25]. Повышение температуры с 298 до 333 K на межфазной границе PbSe(тв.)/Hg2+(р-р) при проведении ионообменного процесса с участием PbSe (ПР0 = 1.0 × 10−38 [45]) и HgSe (ПР0 = 1.0 × × 10–58 [45]) приводит даже к снижению доли cвинца x в твердом растворе HgxPb1 – xSe с 0.40 до 0.26, что может быть обусловлено термодинамической выгодностью образования самостоятельной фазы HgSe [24].
Сорбционная способность тонкопленочного слоя, выступающего в качестве матрицы для ионного обмена, зависит от степени развитости ее поверхности и морфологии. Использование метода гидрохимического осаждения для синтеза тонкопленочных образцов обеспечивает возможность управлять скоростью ионообменного процесса за счет создания необходимой геометрии и морфологии слоя, варьируя условия синтеза (температуру, лигандный фон, pH) [47, 48]. Рассчитанные по методике, приведенной в [47], значения удельной площади поверхности пленки CdS, способной к ионному обмену, в присутствии в качестве лиганда этилендиамина (68.3 м2/г) свидетельствуют о менее развитой ее поверхности, чем в случае использования цитрат-ионов в присутствии гидроксида аммония (154.4 м2/г). АСМ-изображения обсуждаемых пленок приведены на рис. 3.
Рис. 3.
АСМ-изображения поверхности тонкой пленки CdS, полученной из реакционной смеси, содержащей в качестве лиганда для ионов Cd2+ этилендиамин (а) и цитрат-ион в присутствии гидроксида аммония (б).
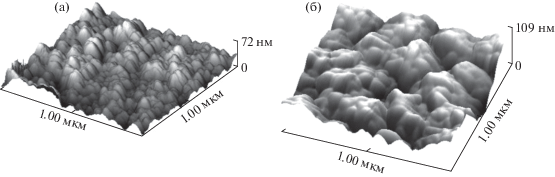
Оценка составов твердых растворов CdxPb1 – xS, выполненная методом рентгеновской дифракции, показала, что более эффективной добавкой для ионообменной трансформации пленки CdS при контакте ее с водным раствором соли свинца, являются цитрат-ионы (x = 0.38), а не этилендиамин (x = 0.06).
Отметим также такую выявленную особенность ионообменной трансформации как изменение микроструктуры и архитектуры тонкопленочной матрицы в зависимости от продолжительности ее контакта с водным раствором соли. Так, например, довольно неожиданными оказались превращения аморфных микроглобул, специфичных по своей форме для индивидуальной пленки CdS, после ее контакта с раствором соли свинца в достаточно ограненные кристаллиты, отвечающие кубической структуре B1, характерной для индивидуальной пленки PbS, но имеющие меньшие размеры [27–33] (см. рис. 4). Как видно из рисунка, характерные изменения происходят и с пленкой сульфида свинца при ее обработке в растворе соли кадмия. Установлены также определенные морфологические различия при использовании для синтеза пленок CdS, синтезированных из различных по составу реакционных смесей. Существенное изменение микроструктуры отмечалось и для ионообменной матрицы на основе пленки сульфида свинца после ее контакта с раствором соли нитрата серебра [25].
Рис. 4.
Электронно-микроскопические изображения индивидуальных пленок СdS (а), PbS (б), а также пленки PbS, выдержанной в течение 9 ч в 0.1 моль/л растворе хлорида кадмия при 368 K (в), и пленки СdS, выдержанной в 0.04 М растворе соли Pb(CH3COO)2 в течение 540 мин при 368 K (г).

Для понимания протекающих при ионообменной трансформации процессов важное значение имеют параметры твердофазной диффузии ионов металлов, поскольку они позволяют судить о глубине процесса и дефектах кристаллической решетки ионообменной матрицы. Известно, что диффузия в твердых телах характеризуется рядом особенностей, затрудняющих ее количественное описание. Во-первых, поликристаллические пленки сформированы из зерен, наличие которых обусловливает протекание диффузии как минимум в две стадии [40]. При этом кристаллы, формирующие слой, обычно неоднородны по размерам. Во-вторых, коэффициент взаимной диффузии обменивающихся ионов по мере протекания процесса меняется при варьировании соотношения мольных долей участвующих в обмене катионов. В-третьих, возможно изменение условий диффузии в твердофазной матрице по мере трансформации ее структуры в ходе обмена. В-четвертых, возможно изменение размера частиц ионообменной матрицы в процессе ее трансформации.
Для определения глубины проникновения ионов свинца в пленку CdS при ее контакте с водным раствором ацетатной соли и определения его коэффициента диффузии в матрицу, нами был применен метод рентгеновской фотоэлектронной спектроскопии с послойным ионным травлением аргоновым пучком [33]. Обработка полученных данных показала, что свинец проникает в пленку CdS на всю ее толщину (∼200 нм) с образованием твердых растворов замещения CdxPb1 – xS переменного состава. На глубине до ∼40 нм формируется твердый раствор на основе PbS, слой на глубине 40–70 нм – переходный к новому качественному составу твердого раствора, а на глубине от 70 до 200 нм формируется твердый раствор на основе сульфида кадмия. На основе концентрационного профиля распределения свинца в тонкой пленке CdS рассчитан коэффициент его диффузии при 368 K: (3.6 ± 0.4) × 10–15 см2/с, что сопоставимо с литературными данными для пленочных систем на основе халькогенидов металлов.
Таким образом, на основе экспериментальных и расчетных результатов по получению путем ионообменной трансформации в гетерогенных системах “тонкая пленка – водный раствор металла-заместителя” тонкопленочных твердых растворов SnxPb1 – xSe, CdxPb1 – xS, AgxPb1 – xS, HgxPb1 – xSe, SnxPb1 – xS различного состава показаны характерные особенности этого процесса и выявлен ряд его физико-химических закономерностей. С целью управления составом твердого раствора продемонстрировано влияние на процесс ионообменного замещения морфологии исходной пленки, природы лигандного фона водного раствора металла-заместителя, температуры, также других условий. Представленные результаты исследований показывают перспективность разработанного метода целенаправленного синтеза многокомпонентных соединений на основе халькогенидов металлов.
Работа выполнена при финансовой поддержке программы 211 Правительства Российской Федерации № 02.А03.21.0006 и гранта РФФИ № 20-48-660041.
Список литературы
Бобылев А.Е., Марков В.Ф., Козлова М.М. и др. // Журн. прикл. химии. 2018. Т. 91. № 10. С. 99.
Сулейманова Н.А., Бетенеков Н.Д., Китаев Г.А. // Радиохимия.1981. Т. 23. № 1. С. 30.
Поляков Е.В. // Там же. 1993. Т. 35. № 1. С. 90.
Бетенеков Н.Д., Губанова А.Н., Чубурков Ю.Т. // Там же. 1981. Т. 23. № 1. С. 21.
Бетенеков Н.Д., Ипатова Е.Г., Егоров Ю.В. // Там же. 1982. Т. 24. № 3. С. 363.
Бетенеков Н.Д., Кафтайлов В.В., Денисов Е.И и др. // Там же. 1986. Т. 28. № 5. С. 599.
Lokhande C.D., Bhad V.V., Dhumure S.S. // J. Phys. D: Appl. Phys. 1992. V. 25. Iss. 2. P. 315.
Estrada C.A., Zingaro R.A., Meyers E.A. // Thin Solid Films. 1994. V. 247. P. 208. https://doi.org/10.1016/0040-6090(94)90261-5
Вольхин В.В., Львович Б.И. // Кинетика и катализ. 1970. Т. 11. С. 1337.
Вольхин В.В., Львович Б.И. // Журн. физ. химии. 1975. Т. 49. № 6. С. 1512.
Вольхин В.В., Львович Б.И. // Журн. неорган. химии. 1968. № 8. С. 1992.
Гусейналиев М. // Естественные и математические науки в современном мире. 2015. № 9 (33). С. 44.
Pfisterer F. // Thin Solid Films. 2003. V. 431–432. P. 470. https://doi.org/10.1016/S0040-6090(03)00166-4
Taur V.S., Joshi R.A., Ghule A.V. et al. // Renewable Energy. 2012. V. 38. P. 219. https://doi.org/10.1016/j.renene.2011.07.024
Flores-Garcı’a E., Herna’ndez-Landaverde M.A., Gonza’lez-Garcı’a P. et al. // J. Spectroscopy. 2018. P. 1. https://doi.org/10.1155/2018/1095204
Diaz-Grijalva O.I., Berman-Mendoza D., Flores-Pacheco A. et al. // J. Mater. Sci. Mater. Electron. 2020. V. 31. P. 1722. https://doi.org/10.1007/s10854-019-02690-2
Ristova M., Ristov M., Tosev P. et al. // Thin Solid Films. 1998. V. 315. P. 301 https://doi.org/10.1016/S0040-6090(97)00476-8
Алексанян А.О., Ганьшин В.А., Коркишко Ю.Н. // Журн. техн. физики. 1989. Т. 59. № 2. С. 174.
Алексанян А.О., Ганьшин В.А., Коркишко Ю.Н. и др. // Неорган. материалы. 1991. Т. 27. № 9. С. 1798.
Смирнова З.И., Маскаева Л.Н., Воронин В.И. и др. // Бутлеровские сообщения. 2010. Т. 21. № 7. С. 29.
Смирнова З.И., Маскаева Л.Н., Воронин В.И. и др. // Там же. 2013. Т. 33. № 2. С. 99.
Смирнова З.И., Маскаева Л.Н., Воронин В.И. // Конденсированные среды и межфазные границы. 2012. Т. 14. № 2. С. 250.
Smirnova Z.I., Maskaeva L.N., Markov V.F. et al. // J. Mater. Sci. Technol. 2015. V. 31. Iss. 8. P. 790. https://doi.org/10.1016/j.jmst.2015.06.003
Маскаева Л.Н., Дубинина Е.А., Мухамедзянов Х.Н. и др. // Бутлеровские сообщения. 2011. Т. 27. № 15. С. 65.
Маскаева Л.Н., Марков В.Ф., Москалева А.А. // Там же. 2011. Т.26. № 10. С. 36.
Сарыева Р.Х., Маскаева Л.Н., Марков В.Ф. и др. // Там же. 2013. Т. 33. № 2. С. 99.
Марков В.Ф., Форостяная Н.А., Ермаков А.Н. и др. // Там же. 2011. Т. 27. № 16. С. 56.
Форостяная Н.А., Пермяков Н.В., Полепишина А.О. и др. // Хим. физика и мезоскопия. 2014. Т. 16. № 2. С. 274.
Форостяная Н.А., Маскаева Л.Н., Марков В.Ф. и др. // Фундаментальные проблемы современного материаловедения. 2014. Т. 11. № 4. С. 453.
Форостяная Н.А., Полепишина А.О., Марков В.Ф. и др. // Chemica Techno Acta. 2014. Т. 1. № 3. С. 98.
Маскаева Л.Н., Форостяная Н.А., Марков В.Ф. и др. // Журн. неорган. химии. 2015. Т. 60. № 5. С. 618.
Форостяная Н.А., Маскаева Л.Н., Бахтеев С.А. и др. // Журн. физ химии. 2017. Т. 91. № 8. С. 1374.
Forostyanaya N.A., Maskaeva L.N., Smirnova Z.I. et al. // Thin Solid Films. 2018. V. 657. P. 101. https://doi.org/10.1016/j.tsf.2018.04.031
Маскаева Л.Н., Смирнова З.И., Воронин В.И. и др. // Фундаментальные проблемы современного материаловедения. 2011. Т. 8. № 3. С. 55.
Котлованова Н.Е., Форостяная Н.А., Смирнова З.И. и др. // Бутлеровские сообщения. 2014. Т. 38. № 6. С. 88.
Зильберман М.В., Вольхин В.В., Калинин Н.Ф. // Коллоидн. журн. 1978. Т. 40. № 5. С. 982.
Глистенко Н.И. // Тр. хим. факультета Воронеж. ун-та. 1953. Т. 32. С. 79.
Вольхин В.В., Львович Б.И. // Кинетика и катализ. 1970. Т. 11. С. 1337.
Вольхин В.В., Львович Б.И. // Журн. физ химии. 1975. Т. 49. № 6. С. 1512.
Юсупов Р.А., Михайлов О.В. Глубокий ионный обмен в металлосульфидных имплантантах. Казань: Фэн, 2004. 220 с.
Юсупов Р.А., Цивунин В.С., Умарова Н.Н. и др. // Журн. физ химии. 1997. Т. 71. № 3. С. 539.
Умарова Н.Н., Мовчан Н.И., Юсупов Р.А. и др. // Там же. 2002. Т. 76. № 8. С. 1485.
Юсупов Р.А., Цивунин В.С., Умарова Н.Н. и др. // Там же. 1990. Т. 64. № 12. С. 3312.
Смирнова З.И. Физико-химические закономерности получения пленок твердых растворов Pb1 – xSnxSe методом ионообменного синтеза: Автореф. дис. … канд. хим. наук. Екатеринбург: УрФУ, 2013. 24 с.
Лурье Ю.Ю. Справочник по аналитической химии. 6-е изд., перераб. и доп. М.: Химия, 1989. 448 с.
Маскаева Л.Н., Смирнова З.И., Марков В.Ф. // Изв. АН. Сер. хим. 2014. № 7. С. 1515. https://doi.org/10.1007/s11172-014-0629-0
Форостяная Н.А., Маскаева Л.Н., Марков В.Ф. // Журн. общ. химии. 2015. Т. 85. Вып. 11. С. 1769.
Смирнова З.И., Баканов В.М., Маскаева Л.Н. и др. // ФТТ. 2014. Т. 56. Вып. 12. С. 2468.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


