Журнал физической химии, 2020, T. 94, № 12, стр. 1805-1813
Кинетика окислительной деструкции катионита КУ-2×8 с использованием пероксида водорода
М. М. Козлова a, *, В. Ф. Марков a, b, Л. Н. Маскаева a, b, М. И. Смольников b, С. Д. Савиных a
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
b Уральский институт ГПС МЧС России
Екатеринбург, Россия
* E-mail: marina.kozlova2014@mail.ru
Поступила в редакцию 03.03.2020
После доработки 25.03.2020
Принята к публикации 14.04.2020
Аннотация
Изучена кинетика окислительной деструкции сильнокислотного универсального катионита КУ‑2×8 с использованием пероксида водорода. Оценена роль природы и концентрации каталитических добавок на процесс окисления в виде солей меди(II) и железа(II). С повышением температуры в диапазоне 348–368 K при безкаталитической деструкции выявлен рост эффективной константы скорости с 0.24 × 10–3 до 7.54 × 10–3 г1/3 мин–1. Установлено, что полученные значения энергии активации при безкаталитическом окислении катионита пероксидом водорода характерны для процесса, протекающего в кинетической области, и составляют 132.46–141.96 кДж/моль. Показано, что введение каталитических добавок способствует уменьшению Ea процесса до 40.90 кДж/моль и снижению температуры деструкции на 15–25 K. Выявлен характер изменения морфологии поверхности гранул катионита в процессе окислительного разложения. Методом газовой хроматографии–масс-спектрометрии идентифицирован ориентировочный состав продуктов разложения катионита.
Эксплуатация атомных электростанций (АЭС) сопровождается образованием отработанных ионообменных смол, объемы которых в настоящее время стремительно увеличиваются. Используемые отечественные иониты и их аналоги (КУ-2×8, АВ-17×8 и др.) представляют собой, как правило, гранулированную форму полимеров на основе поперечно сшитого полистирола, матрица которых отличается высокой пористостью. После отработки они являются гетерогенными отходами с низким уровнем активности [1]. Такие смолы не могут быть регенерированы, и поэтому их необходимо перерабатывать с целью уменьшения негативного воздействия на окружающую среду.
В настоящее время для переработки отработанных ионообменных смол предлагаются либо технологии иммобилизации (цементирование, остекловывание) [2–4] либо пиролиз [5–7]. Однако традиционные технологии утилизации относительно дорогостоящи и в ряде случаев сопровождаются образованием взрывоопасных продуктов, связанных с радиолизом органических веществ и воды. Эффективным способом утилизации отработанных смол может быть окислительная деструкция, в результате которой резко уменьшаются их объем и концентрация органических веществ. К перспективному окислительному методу можно отнести процесс Фентона, который может быть использован для деструкции органических соединений с помощью пероксида водорода.
Стандартный электрохимический потенциал системы, в которой Н2О2 служит окислителем, равен 1.77 В. Исходя из этого, пероксид водорода, являясь, по сути, экологически чистым окислителем, способен разлагать большинство органических веществ [8]. Основной механизм классического процесса Фентона можно представить в виде окислительно-восстановительной реакции с участием ионов Fe2+, в ходе которой происходит генерирование свободных гидроксильных радикалов ${\text{Н}}{{{\text{О}}}^{ \bullet }}$ [8]:
(1)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to {\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{Н}}{{{\text{О}}}^{ \bullet }} + {\text{O}}{{{\text{H}}}^{--}}.$(2)
${\text{Н}}{{{\text{О}}}^{ \bullet }} + {{{\text{H}}}_{{\text{2}}}}{{{\text{O}}}_{{\text{2}}}} \to {\text{HO}}{{{\text{O}}}^{ \bullet }} + {{{\text{Н}}}_{{\text{2}}}}{\text{О}},$(3)
${\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{HO}}{{{\text{O}}}^{ \bullet }} \to {\text{F}}{{{\text{e}}}^{{2 + }}} + {{{\text{Н}}}^{ + }} + {{{\text{O}}}_{2}},$(4)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{HO}}{{{\text{О}}}^{ \bullet }} \to {\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{HO}}{{{\text{О}}}^{--}},$(5)
${\text{F}}{{{\text{e}}}^{{2 + }}} + {\text{Н}}{{{\text{О}}}^{ \bullet }} \to {\text{F}}{{{\text{e}}}^{{3 + }}} + {\text{O}}{{{\text{H}}}^{--}},$(6)
${\text{Н}}{{{\text{О}}}^{ \bullet }} + {\text{RH}} \to {{{\text{R}}}^{ \bullet }} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}.$В классическом процессе Фентона в качестве каталитической добавки используют соли железа(II). В общем случае катализаторами могут быть соли других переходных металлов, в частности меди(II). Процесс Фентона характеризуется высокой реакционной способностью, глубокой степенью окисления и достаточно мягкими условиями проведения. На эффективность реакции влияют такие факторы как температура, рН среды, концентрация пероксида водорода и катализатора [8, 9].
Авторами [10–16] изучено окисление пероксидом водорода сульфокислотных катионитов, а также сильноосновных анионитов с третичными триметиламмониевыми группами в присутствии каталитических добавок солей переходных металлов. Так, в работе [10] рассмотрено разложение универсального катионита КУ-2×8 водным раствором Н2О2. В результате воздействия 30%-го раствора пероксида водорода с добавлением в него соли железа(II) в диапазоне температур 363–373 K было достигнуто полное растворение навесок твердой фазы ионита за относительно короткий промежуток времени. Исследования [11–16] направлены на выбор оптимальных условий окислительной деструкции ионообменных смол некоторых зарубежных марок. В приведенных работах изучены отдельные стороны влияния концентрации окислителя, температуры раствора, а также концентрации каталитических добавок на используемый для этой цели процесс Фентона.
Однако проведенный анализ научной литературы показал, что в настоящее время отсутствуют сведения о комплексных кинетических исследованиях окислительной деструкции ионообменных смол на основе органополимеров с использованием процесса Фентона с получением при этом количественных кинетических характеристик процесса. В связи с этим настоящая работа посвящена изучению кинетики безкаталитической и каталитической окислительной деструкции с использованием процесса Фентона на примере отечественного универсального катионита КУ-2×8.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В качестве объекта исследования использовали сульфокислотный катионит КУ-2×8 в Na-форме (ГОСТ 20298-74), матрица которого представляет собой пространственно сшитый сополимер стирола и дивинилбензола с относительно высокой удельной поверхностью. Интервал размеров частиц смолы сферической формы составлял 350–1250 мкм, содержание рабочей фракции не менее 96%, коэффициент однородности 1.8, удельный объем 2.1 ± 0.2 см3/г. Для деструкции катионита КУ-2×8 применяли экологически чистый окислитель – пероксид водорода H2O2 марки “ч.”, концентрацию которого определяли методом перманганатометрии [17]. Приготовление 0.1 М растворов катализаторов проводили с использованием солей сульфата меди(II) CuSO4 · · 5H2O и сульфата железа(II) FeSO4 · 7H2O.
Во всех экспериментах количество ионообменной смолы было постоянным и составляло 0.5 г в пересчете на воздушно-сухую массу. Для проведения безкаталитической деструкции в реакторы вносили навеску катионита КУ-2×8 и добавляли 10 мл раствора пероксида водорода с концентрацией H2O2 5–25 об. %. Для исследования каталитического окисления в серию реакторов с навеской катионита КУ-2×8 добавляли 20 об. % раствор H2O2, затем вводили определенное количество каталитической добавки – CuSO4 (0.001–0.009 ммоль/л) или FeSO4 (0.001–0.005 ммоль/л).
Реакторы помещали в термостат марки LOIP LT-105a. Процесс проводили в интервале температур 323–368 K. Каждый реактор извлекали из термостата по истечении определенного промежутка времени. Находящийся в реакторах остаток катионита КУ-2×8 тщательно промывали, фильтровали, высушивали на воздухе в течение недели при комнатных условиях, затем нагревали в электропечи ПМ-1.0-7 в течение 2.5 ч при температуре 377 ± 1 K. После этого его взвешивали на аналитических весах VIBRA HTR-220CE с точностью ±0.0001 г.
Для исследования морфологии поверхности гранул катионита КУ-2×8 использовали метод растровой электронной микроскопии с применением микроскопа JEOL JSM-6390 LA. Состав продуктов окисления катионообменной смолы оценивали методом газовой хроматографии–масс-спектрометрии (ГХ-МС) с применением хромато-масс-спектрометра GCMS-QP2010 Ultra.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Кинетику безкаталитической окислительной деструкции катионита КУ-2×8 исследовали с использованием 5–25 об. %. пероксида водорода. Зависимости относительной потери массы катионита КУ-2×8 от продолжительности выдержки в 20 об. % водном растворе H2O2 при различных температурах представлены на рис. 1а. Независимо от температуры процесса уменьшение массы смолы незначительно на начальном этапе разложения вследствие замедленной диффузии раствора пероксида водорода внутрь гранул сорбента. Процесс окисления катионита КУ-2×8 при температуре 368 K протекает более ускоренно и заканчивается к 140 мин. При снижении температуры раствора до 363 и 358 K полное растворение сорбента наблюдается к 228 и 245 мин соответственно. Уменьшение массы катионообменной смолы наполовину происходит при 353 K в течение 230 мин. При 348 K для разложения 50% катионита необходимо в ∼2 раза больше времени (∼430 мин).
Рис. 1.
Кинетические кривые потери массы катионита КУ-2×8 в 20 об. % водном растворе H2O2 в процессе безкаталитической деструкции (а) и с добавлением 0.003 ммоль/л CuSO4 (б) и FeSO4 (в) при различных температурах: 1 – 368, 2 – 363, 3 – 358, 4 – 353, 5 – 348, 6 –343, 7 – 333, 8 – 323 K.
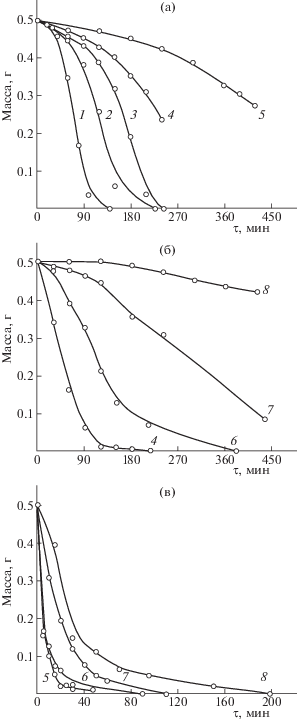
Каталитическое окисление катионита КУ-2×8 проводили с добавлением в реактор 0.001–0.009 ммоль/л сульфата меди(II) и 0.001–0.005 ммоль/л сульфата железа(II). Зависимости относительной потери массы катионообменной смолы от продолжительности выдержки в 20 об. % водном растворе H2O2 с введением 0.003 ммоль/л CuSO4 при различных температурах представлены на рис. 1б. Добавление сульфата меди(II) при 353 K обеспечивает наиболее интенсивное разложение катионита КУ-2×8 в течение первых 215 мин. Понижение температуры до 343 K приводит к значительному уменьшению скорости реакции, полное растворение смолы происходит в течение 380 мин. При 333 K вначале наблюдается замедление процесса деструкции катионита, затем реакция ускоряется и к 435 мин убыль массы катионообменной смолы составляет ∼83%. С уменьшением температуры реакции до 323 K возникает длительный индукционный период, а процесс окислительной деструкции протекает относительно медленно. Так, в течение 420 мин растворяется всего ∼16% ионита.
С использованием в качестве каталитической добавки сульфата железа(II) (рис. 1в) в исследуемом температурном диапазоне достигается полное разложение катионита КУ-2×8. При 348 K растворение катионита происходит очень интенсивно и заканчивается за ∼48 мин. Понижение рабочей температуры раствора до 343 и 333 K способствует полному разложению сорбента к 90 и 110 мин соответственно. При 323 K время растворения катионита увеличивается до 198 мин. Однако для указанной температуры это намного эффективнее по сравнению с безкаталитической деструкцией при более высокой температуре (348 K), когда за 7 ч растворяется не более половины взятой навески ионита и существенно быстрее при использовании в качестве добавки соли меди(II).
Анализ кинетических кривых относительной потери массы исследуемого катионита при его взаимодействии с пероксидом водорода в присутствии каталитических добавок позволяет сделать вывод, что наибольшее влияние на процесс окисления ионообменной смолы оказывает температура процесса. Увеличение концентрации окислителя или катализатора в определенных пределах при заданной температуре существенно не повышает скорость процесса деструкции.
Что касается механизма влияния каталитических добавок, то, согласно [14–16], это связано с повышением концентрации активного кислорода при разложении пероксида водорода, способствующим более активному окислению катионита. В указанных работах сравнивается также активность каталитических добавок в системах Fe2+/H2O2 и Cu2+/H2O2 и делается вывод, что ионы железа(II) обладают более сильным катализирующим действием по сравнению с ионами меди(II). Оценка влияния природы солей CuSO4 и FeSO4 на скорость окислительной деструкции КУ-2×8 по данным кинетических исследований подтверждает этот вывод. Отметим, что электроотрицательность и энергия ионизации железа ниже, чем у меди, и, следовательно, железо, обладая более сильными металлическими свойствами, легче отдает валентные электроны.
При определении скорости гетерогенного процесса в системе “катионит–раствор” необходимо принимать во внимание площадь межфазной поверхности, изменяющуюся в процессе окислительной деструкции, и геометрию реагирующих частиц. По своей геометрии гранулы катионообменной смолы КУ-2×8 имеют практически идеальную форму шара. При этом скорость реакции (потерю массы катионита) можно записать согласно уравнению:
где m – масса гранулы катионита КУ-2×8 в момент времени τ, F – площадь ее поверхности, С – концентрация Н2О2, k – константа скорости реакции окисления.С учетом площади поверхности шара F = 4πr2 масса гранул катионита выражается как m = = (4/3)πr2ρ, где r – радиус гранул, а ρ – их плотность. Отсюда радиус может быть найден как $r = {{\left( {\frac{3}{{4\pi }}\frac{m}{\rho }} \right)}^{{1/3}}}$. Тогда площадь поверхности шара равна $F = 4\pi {{\left( {\frac{3}{{4\pi \rho }}} \right)}^{{2/3}}}{{m}^{{2/3}}}$ [18]. Подставив эти выражения в уравнение (7), получим [18]
(8)
$ - \frac{{dm}}{{d\tau }} = 4k\pi {{\left( {\frac{3}{{4\pi \rho }}} \right)}^{{2/3}}}{{m}^{{2/3}}}C,$(10)
$ - \mathop \smallint \limits_{{{m}_{0}}}^m \frac{{dm}}{{{{m}^{{2/3}}}}} = k{\kern 1pt} '\mathop \smallint \limits_0^\tau \,d\tau ,$Следовательно, зависимости $(m_{0}^{{1/3}} - {{m}^{{1/3}}})$ от τ или m1/3 от τ должны быть прямолинейными.
Таким образом, проведя преобразования уравнения (7), можно получить зависимость изменения массы гранулы катионита от продолжительности процесса ее разложения “m1/3 – τ”. В соответствии с уравнениями (7) и (9), реакция имеет первый порядок по площади поверхности гранул и дробный порядок “2/3” по массе катионита. Обработка экспериментальных результатов, проведенная в координатах “m1/3 – τ”, позволяет учесть гетерогенную природу реакции окисления и шарообразную геометрию гранул катионита КУ-2×8. В качестве примера на рис. 2 представлена линеаризация экспериментальных данных в координатах “m1/3 – τ”.
Рис. 2.
Линеаризация экспериментальных данных. Безкаталитическое окисление при 348 K и различных концентрациях пероксида водорода: 1 – 25, 2 – 20, 3 – 15, 4 – 10, 5 – 5 об. %.

Эффективную константу скорости процесса k определяли по тангенсу угла наклона полученной прямой в координатах “m1/3 – τ” к оси абсцисс. В табл. 1 приведены вычисленные значения эффективных констант скорости процесса окислительной деструкции исследуемого катионита в зависимости от температуры, концентраций пероксида водорода и каталитических добавок CuSO4 и FeSO4. Как следует из полученных данных (табл. 1), в процессе безкаталитического окисления катионита КУ-2×8 с повышением температуры от 348 до 368 K наблюдается закономерное увеличение эффективной константы скорости в ∼18 раз при использовании 20 об. % H2O2. При остальных концентрациях окислителя константа скорости возрастает до 12 раз. Повышение концентрации пероксида водорода от 5 до 25 об. % обеспечивает ее рост в 2.5–2.6 раза.
Таблица 1.
Эффективная константа скорости процесса (k × 103, г1/3 мин–1) окислительной деструкции катионита КУ-2×8 в зависимости от температуры, концентрации пероксида водорода при безкаталитическом окислении и от содержания каталитических добавок при использовании 20 об. % пероксида водорода
| T, K | [H2O2], об. % | [CuSO4], ммоль/л | [FeSO4], ммоль/л | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 5 | 10 | 15 | 20 | 25 | 0.001 | 0.003 | 0.005 | 0.007 | 0.009 | 0.001 | 0.002 | 0.003 | 0.004 | 0.005 | |
| 323 | – | – | – | – | – | 0.13 | 0.18 | 0.13 | 0.15 | 0.26 | 5.51 | 4.69 | 3.17 | 4.35 | 6.24 |
| 333 | – | – | – | – | – | 0.71 | 0.75 | 0.72 | 0.84 | 0.98 | 7.79 | 7.22 | 7.57 | 8.50 | 9.08 |
| 343 | – | – | – | – | – | 2.25 | 2.22 | 2.44 | 2.17 | 2.30 | 10.65 | 10.66 | 10.61 | 11.52 | 16.31 |
| 348 | 0.24 | 0.28 | 0.30 | 0.31 | 0.63 | – | – | – | – | – | 16.45 | 18.71 | 19.10 | 20.52 | 20.13 |
| 353 | 0.50 | 0.56 | 0.56 | 0.62 | – | 4.80 | 5.38 | 4.30 | 3.12 | 4.39 | – | – | – | – | – |
| 358 | 1.01 | 0.95 | 0.88 | 1.23 | 0.90 | – | – | – | – | – | – | – | – | – | – |
| 363 | 1.81 | 1.90 | 4.13 | 2.14 | 4.54 | – | – | – | – | – | – | – | – | – | – |
| 368 | 2.96 | 3.24 | 3.87 | 5.46 | 7.54 | – | – | – | – | – | – | – | – | – | – |
Из рассчитанных значений констант скорости процесса окислительной деструкции катионита в 20 об. % пероксиде водорода в присутствии добавки CuSO4 следует, что повышение температуры процесса от 323 до 353 K приводит к росту константы в ∼37 раз с добавлением 0.001 ммоль/л CuSO4 (табл. 1). При концентрациях катализатора 0.003 и 0.005 ммоль/л константа возрастает до 30 раз. С увеличением содержания катализатора CuSO4 в пероксиде водорода от 0.001 до 0.009 ммоль/л рост константы скорости процесса замедляется, возрастая не более, чем в 1.4–2.0 раза.
Согласно полученным значениям эффективной константы скорости процесса, в 20 об. % пероксиде водорода с добавлением сульфата железа повышение температуры процесса от 323 до 348 K способствует увеличению константы скорости в ∼6 раз при введении в реакционную смесь 0.003 ммоль/л катализатора (табл. 1). При 0.002 и 0.004 ммоль/л FeSO4 наблюдается возрастание эффективной константы скорости деструкции в ∼4–5 раз. С увеличением каталитической добавки до 0.001 и 0.005 ммоль/л рост константы несколько ниже. Повышение содержания FeSO4 от 0.001 до 0.009 ммоль/л увеличивает константу только в 1.2–2.0 раза.
С учетом вычисленных значений эффективных констант скоростей, представленных в табл. 1, рассчитаны ошибки определения и среднеквадратичное отклонение (табл. 2). При этом коэффициент детерминации находится в пределах от 0.8211 до 0.9964. Энергия активации Eа процесса окислительной деструкции катионита КУ-2×8 определялась путем графического решения уравнения Аррениуса в координатах “ln k – 103/T”. Как следует из табл. 3, значение Eа при безкаталитическом окислении смолы 5–25%-ным раствором пероксида водорода находится в пределах от 141.96 ± 1 до 132.46 ± 1 кДж/моль, что свидетельствует о протекании процесса в кинетической области. Согласно приведенным в табл. 3 данным, величины энергии активации окислительной деструкции при добавлении CuSO4 и FeSO4 в целом также характерны для процессов, протекающих в кинетической области.
Таблица 2.
Значения среднеквадратичного отклонения (σk) и ошибки определения (∆k) эффективной константы скорости безкаталитического и каталитического разложения катионита КУ-2×8
| T, K | Безкаталитическое окисление | Каталитическое окисление с добавлением CuSO4 | Каталитическое окисление с добавлением FeSO4 | |||
|---|---|---|---|---|---|---|
| σk × 103 | ∆k × 103 | σk × 103 | ∆k × 103 | σk × 103 | ∆k × 103 | |
| 323 | – | – | 0.03 | 0.10 | 0.67 | 2.14 |
| 333 | – | – | 0.06 | 0.21 | 0.43 | 1.38 |
| 343 | – | – | 0.06 | 0.19 | 1.42 | 4.53 |
| 348 | 0.07 | 0.19 | – | – | 0.92 | 2.93 |
| 353 | 0.02 | 0.07 | 0.63 | 2.01 | – | – |
| 358 | 0.06 | 0.17 | – | – | – | – |
| 363 | 0.59 | 1.64 | – | – | – | – |
| 368 | 0.85 | 2.36 | – | – | – | – |
Таблица 3.
Энергия активации процесса безкаталитической окислительной деструкции катионита КУ-2×8 и в 20% пероксиде водорода при различной концентрации (с) катализаторов CuSO4 и FeSO4
| Безкаталитическое окисление | Каталитическое окисление | |||
|---|---|---|---|---|
| [H2O2], об. % | Eа ± 1 кДж/моль | с, ммоль/л | Eа ± 1 кДж/моль | |
| CuSO4 | FeSO4 | |||
| 5 | 141.96 | 0.001 | 115.2 | 40.9 |
| 10 | 141.66 | 0.002 | – | 51.7 |
| 15 | 136.34 | 0.003 | 107.5 | 67.1 |
| 20 | 134.83 | 0.004 | – | 58.0 |
| 25 | 132.86 | 0.005 | 109.6 | 43.8 |
| – | – | 0.007 | 95.3 | – |
| – | – | 0.009 | 89.7 | – |
В присутствии исследуемых каталитических добавок энергия активации снижается и особенно заметно при введении соли железа(II), составляя в этом случае 40.9–67.1 кДж/моль. Обращает на себя внимание сложный характер зависимости каталитической активности сульфата железа от концентрации, что, вероятно, является следствием неоднозначного влияния его содержания на скорость цепной реакции и вероятность обрыва реакционной цепи в результате взаимодействия компонентов соли с активными частицами.
Для установления характера изменений гранул в процессе окислительной деструкции было проведено исследование их морфологии. Для сравнения на рис. 3а представлено микроизображение гранул катионита до окисления пероксидом водорода. Можно наблюдать, что их поверхность в исходном состоянии относительно гладкая и практически недеформированная. На рис. 3б показано микроизображение после трех часов контакта смолы с 20 об. % водным раствором пероксида водорода при температуре 358 K, что соответствует потере 60% ее массы. На рис. 3в приведены электронно-микроскопические изображения гранул катионита КУ-2×8 после воздействия 20 об. % водного раствора H2O2, содержащего 0.005 ммоль/л CuSO4. В результате контакта в течение 1 ч при температуре 353 K потеря массы катионита составила 60%. На рис. 3г показаны микроизображения катионита КУ-2×8 после 5 мин контакта при температуре 353 K с 20 об. % водным раствором H2O2, содержащим 0.005 ммоль/л FeSO4, что соответствует потере 90% его массы. При этом на рис. 3б–3г можно отметить, что изменения на поверхности смолы носят преимущественно локальный характер, большая часть поверхности гранулы не претерпела значительных изменений. В то же время сама гранула сорбента изменила свою форму, объем, а ее поверхность покрылась трещинами, что может свидетельствовать о разрушении поперечных связей катионита КУ-2×8 в процессе окислительной деструкции, и как следствие уменьшение его механической прочности.
Рис. 3.
Электронно-микроскопические изображения поверхности катионита КУ-2×8 до окисления (а), после воздействия 20 об. % раствором H2O2 (б) и с добавлением 0.005 ммоль/л CuSO4 (в) и FeSO4 (г).

Анализ продуктов окислительной деструкции катионита КУ-2×8 проводили с использованием метода газовой хроматографии-масс-спектрометрии (ГХ-МС). Для идентификации соединений исследовали раствор, образующийся в процессе как безкаталитического, так и каталитического окисления катионообменной смолы при растворении ее в 10%-ном водном растворе пероксида водорода. На рис. 4 представлены полученные масс-хроматограммы продуктов окисления, а в табл. 4 указаны интенсивности пиков выявленных при этом соединений и время их выхода.
Рис. 4.
Масс-хроматограммы продуктов окислительной деструкции катионита КУ-2×8 в процессе окисления 10 об. % раствором H2O2 (а) и при разложении 5 об. % раствором H2O2 с добавлением катализатора FeSO4 (б).

Таблица 4.
Состав продуктов окислительной деструкции катионита КУ-2×8 в процессе окисления 10 об. % раствором H2O2 и при разложении 5 об. % раствором H2O2 с добавлением катализатора FeSO4 (τ – время выхода)
| № пика | τ, мин | Формула | Название | τ, мин | Формула | Название |
|---|---|---|---|---|---|---|
| Безкаталитическое окисление | Каталитическое окисление с добавлением FeSO4 | |||||
| 1 | 19.887 | C19H40 | Нонадекан | 18.885 | C19H40 | Нонадекан |
| 2 | 21.512 | C20H42 | Эйкозан | 19.886 | C19H40 | Нонадекан |
| 3 | 22.840 | C20H42 | Эйкозан | 21.512 | C20H42 | Эйкозан |
| 4 | 24.234 | C16H22O4 | Дибутилфталат | 24.237 | C16H22O4 | Дибутилфталат |
| 5 | 27.087 | C21H44 | Генэйкозан | 26.746 | C25H52 | Пентакозан |
| 6 | 28.541 | C22H46 | Докозан | 27.089 | C21H44 | Генэйкозан |
| 7 | 29.139 | C20H42 | Эйкозан | 27.533 | C27H56 | Гептакозан |
| 8 | 30.279 | C21H44 | Генэйкозан | 28.545 | C21H44 | Генэйкозан |
| 9 | 32.430 | C24H50 | Тетракозан | 30.281 | C21H44 | Генэйкозан |
| 10 | 32.799 | C23H32O2 | 2,2-Метилен-бис(4-метил-6-трет-бутилфенол) | 31.371 | C18H24N2 | N-(1,3-Диметилбутил)-N'-фенил-1,4-бензолдиамин |
| 11 | 34.016 | C21H44 | Генэйкозан | 32.434 | C21H44 | Генэйкозан |
| 12 | 34.853 | C24H38O4 | 7-кето-литохолевая кислота | 34.016 | C21H44 | Генэйкозан |
| 13 | 35.837 | C36H74 | Гексатриаконтан | 34.855 | C24H38O4 | 7-кето-литохолевая кислота |
| 14 | 38.050 | C36H74 | Гексатриаконтан | 35.840 | C21H44 | Генэйкозан |
| 15 | 39.522 | C44H90 | Тетратетраконтан | 38.043 | C21H44 | Генэйкозан |
| 16 | 40.854 | C36H74 | Гексатриаконтан | 39.524 | C21H44 | Генэйкозан |
| 17 | 42.371 | C36H74 | Гексатриаконтан | 40.856 | C21H44 | Генэйкозан |
| 18 | 44.141 | C40H82 | Тетраконтан | 42.373 | C44H90 | Тетратетраконтан |
| 19 | 46.273 | C40H82 | Тетраконтан | 44.150 | C44H90 | Тетратетраконтан |
| 20 | 48.892 | C44H90 | Тетратетраконтан | 46.282 | C44H90 | Тетратетраконтан |
| 21 | 51.286 | C44H90 | Тетратетраконтан | 48.890 | C44H90 | Тетратетраконтан |
| 22 | 54.005 | C40H82 | Тетраконтан | 51.287 | C44H90 | Тетратетраконтан |
| 23 | 57.223 | C25H52 | Пентакозан | 54.013 | C40H82 | Тетраконтан |
| 24 | – | – | – | 57.242 | C25H52 | Пентакозан |
Как следует из табл. 4, по результатам ГХ-МС в водно-органическом растворе, полученном в результате безкаталитического разложения катионита, были идентифицированы следующие соединения с вероятностью подобия более 90%: нонадекан C19H40, эйкозан C20H42, дибутилфталат C16H22O4, генейкозан C21H44, докозан C22H46, тетракозан C24H50, 2,2-метилен-бис(4-метил-6-трет-бутилфенол) C23H32O2, 7-кето-литохолевая кислота C21H44, гексатриаконтан C36H74, тетратетраконтан C44H90, тетраконтан C40H82, пентакозан C25H52. При этом сразу три пика соответствуют таким соединениям как генейкозан (27.087, 30.270, 34.016 мин), тетратетраконтан (39.522, 48.892, 51.286 мин) и тетраконтан (44.141, 46.273, 54.005 мин).
При добавлении в реакционную систему соли FeSO4 среди продуктов окисления с вероятностью подобия более 90% установлено присутствие большинства приведенных выше соединений: нонадекана, эйкозана, дибутилфталата, генейкозана, 7-кето-литохолевой кислоты, тетратетраконтана, тетраконтана, пентакозана. Однако интенсивность пиков первых пяти из них со временем выхода 19.886, 24.237, 27.089, 30.281 и 34.854 мин по сравнению с безкаталическим разложением несколько снижается при заметном повышении интенсивности пиков высокомолекулярных соединений, таких как тетратетраконтан C44H90 и тетраконтан C40H82. Одновременно при этом со временем выхода 28.541 мин было обнаружено присутствие гептакозана C27H56. Отметим также, что из всех зафиксированных пиков для этого раствора девять относятся к генейкозану, а пять соответствует тетратетраконтану.
Таким образом, из результатов проведенных кинетических исследований процесса безкаталитического окислительного разложения катионита КУ-2×8 в 5–25%-ных водных растворах пероксида водорода следует, что в 25%-ном растворе H2O2 константа процесса деструкции увеличивается в диапазоне 348–368 K с 0.63 × 10–3 до 7.54 × 10–3 г1/3 мин–1, возрастая в ∼12 раз.
Введение каталитических добавок сульфатов меди(II) и железа(II) в пределах 0.001–0.009 ммоль/л существенно повышает интенсивность процесса окисления даже при более низких (на 15–25 K) рабочих температурах, что, вероятно, связано с повышением концентрации активного кислорода в процессе разложения H2O2, способствующем более активному окислению катионита. Установлено, что в присутствии 0.001 ммоль/л каталитических добавок в 20%-ном водном растворе пероксида водорода в диапазоне 323–348 K наблюдается рост константы скорости процесса окислительного разложения катионита по сравнению с безкаталитическим процессом в 7.7 раза при использовании сульфата меди(II) при 353 K, а при добавке сульфата железа(II) при рабочей температуре 348 K – в 53 раза. Однако пятикратное повышение концентрации катализатора в последнем случае увеличивает константу процесса не более, чем вдвое.
Введение катализаторов снижает установленные значения энергии активации окислительного разложения катионита КУ-2×8 с 132.46–141.96 кДж/моль для безкаталитического процесса до 89.7–115.2 и 40.9–67.1 кДж/моль в присутствии сульфата меди(II) и сульфата железа(II) соответственно.
По результатам масс-хроматографического анализа продуктов окислительного разложения катионита КУ-2×8 установлено, что как при безкаталитическом окислении, так и в присутствии FeSO4 преобладают соединения класса алканов. Однако в продуктах, полученных в процессе безкаталитического окисления, обнаружены также соединения класса фенолов, при добавлении же катализаторов заметно повышается интенсивность пиков высокомолекулярных соединений, таких как тетратетраконтан C44H90 и тетраконтан C40H82. Полученные результаты в перспективе могут быть использованы для создания экономически эффективной технологии утилизации отработанных ионообменных смол с целью уменьшения их объема и содержания органической фазы.
Список литературы
Смольников М.И., Марков В.Ф., Маскаева Л.Н. и др. // Бутлер. сообщения. 2017. Т. 49. № 3. С. 119. ROI: jbc-01/17-49-3-119.
Wang J., Wan Z. // Prog. Nucl. Energy. 2015. V. 78. P. 47. https://doi.org/10.1016/j.pnucene.2014.08.003
Lee W.H., Cheng T.W., Ding Y.C. et al. // J. Environ. Manage. 2019. V. 235. P. 19. https://doi.org/10.1016/j.jenvman.2019.01.027
McGann O.J., Bingham P.A., Hyatt N.C. // Ceram. Trans. 2013. V. 241. P. 69.
Yang H.C., Lee S.Y., Choi Y.C. et al. // J. Therm. Anal. Calorim. 2017. V. 127. № 1. P. 587. https://doi.org/10.1007/s10973-016-5817-8
Luca V., Bianchi H.L., Allevatto F. et al. // J. Environ. Chem. Eng. 2017. V. 5. № 4. P. 4165. https://doi.org/10.1016/j.jece.2017.07.064
Castro H.A., Luca V., Bianchi H.L. // Environ. Sci. Pollut. Res. 2018. V. 25. № 22. P. 21403. https://doi.org/10.1007/s11356-017-8766-2
Babuponnusami A., Muthukumar K. // J. Environmental Chem. Eng. 2014. V. 2. № 1. P. 557. https://doi.org/10.1016/j.jece.2013.10.011
Bokare A.D., Choi W. // J. Hazard. Mater. 2014. V. 275. P. 121. https://doi.org/10.1016/j.jhazmat.2014.04.054
Кузнецов А.Е., Князев О.В., Мараев И.Ю., Манаков М.Н. // Биотехнология. 2000. Т. 16. № 1. С. 66.
Liang Z.R., Wu Y.S., Liu X.J. // J. Nucl. Radiochem. 2007. V. 29. № 2. P. 71.
Zahorodna M., Bogoczek R., Oliveros E., Braun A.M. // Catal. Today. 2007. V. 129. № 1–2. P. 200. https://doi.org/10.1016/j.cattod.2007.08.014
Gunale T.L., Mahajani V.V., Wattal P.K., Srinivas C. // Chem. Eng. J. 2009. V. 148. № 2–3. P. 371. https://doi.org/10.1016/j.cej.2008.09.018
Wan Z., Xu L., Wang J. // Nucl. Eng. Des. 2015. V. 291. P. 101. https://doi.org/10.1016/j.nucengdes.2015.05.009
Wan Z., Xu L., Wang J. // Chem. Eng. J. 2016. V. 284. P. 733. https://doi.org/10.1016/j.cej.2015.09.004
Xu L., Meng X., Li M. et al. // Chem. Eng. J. 2019. V. 361. P. 1511. https://doi.org/10.1016/j.cej.2018.09.169
Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. М.: Химия, 1990. 480 с.
Дьяченко А.Н., Шагалов В.В. Химическая кинетика гетерогенных процессов. Томск: Томский политехнический университет, 2014. 102 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


