Журнал физической химии, 2020, T. 94, № 12, стр. 1814-1820
Моделирование гетерогенной системы Cu(II)–H2O–OH––NH3 по данным pH-метрии
В. Ф. Марков a, *, Р. А. Юсупов b, С. А. Бахтеев b, Е. А. Ситникова b, А. Т. Сулейманов b, К. А. Карпов a
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
b Казанский национальный исследовательский технологический университет
Татарстан, Казань, Россия
* E-mail: v.f.markov@urfu.ru
Поступила в редакцию 03.03.2020
После доработки 25.03.2020
Принята к публикации 14.04.2020
Аннотация
С использованием экспериментальных данных, полученных путем анализа остаточной концентрации и рН-метрии, разработана математическая модель системы Cu(II)–H2O–OH––NH3, определяющая условия образования соединений меди в растворе и в виде осадков. Для расчета областей образования твердой фазы в модели, наряду с правилами произведения растворимости и молекулярной растворимости, использованы растворимость по интермедиату и правило выбора приоритетного осадка. С помощью предложенной модели рассчитаны значения эффективных констант равновесия гомогенных и гетерогенных процессов для 40 образующихся в системе соединений, состав которых в ряде случаев подтвержден методами рентгенофлуоресцентного, рентгенофазового и дифференциального термографического анализов. Установлено, что с учетом новых теоретических положений модель создает возможность оптимизации условий гидрохимического синтеза различных целевых соединений, а также обеспечивает более эффективное создание базы данных на основе полученных экспериментальных результатов.
Системы соль металла–вода–комплексообразующие агенты–халькогенизатор (например, тио- или селеномочевина) широко применяются для синтеза сульфидов и селенидов металлов в виде тонких пленок и нанокристаллов. Условия синтеза и конечные свойства этих материалов, в том числе возможность внедрения примесей, определяются, в первую очередь, гетерофазными равновесиями, для управления которыми необходимо использование моделирования множественных равновесий в реакционной системе. В работе [1] нами были предложены методологические основы создания подобной модели, основанные на применении следующих четырех правил растворимости: правила произведения растворимости, молекулярной растворимости (в молекулярной недиссоциированной форме), растворимости по интермедиату (соединению, концентрация которого постоянна над осадком, но отличающемуся от состава осадка), выбора приоритетной твердой фазы.
Выбор приоритетной твердой фазы – необходимое условие для создания модели гетерофазных равновесий в случае пересыщения в системе по нескольким твердым фазам. Использование данного условия особенно важно при синтезе тонких пленок, когда в системе одновременно образуется твердая фаза, как в виде осадка, так и в виде пленки на подложке, и в случае отличий осадков по составу для расчета точки его изменения в зависимости, например, от рН раствора.
Преимущество применения молекулярной растворимости для расчета областей образования гидроксидов металлов ранее показано в работе [2]. Использование растворимости по интермедиату впервые было описано в [3]. Отметим, что интермедиат по своей сути является стабильным соединением, которое определяет возможность выпадения некоторых осадков (например, оксидов), и которое отличается по своему составу от состава осадка. Так, образование в изучаемой системе CuOS будет определяться наличием в системе гидроксокомплекса Cu(OH)$_{3}^{ - }$, являющегося в данном случае интермедиатом.
Учет влияния кинетических ограничений, в частности, эффекта “памяти” и разнонаправленных колебаний значений рН в реакционной системе проведен в работе [4]. Понятие эффекта “памяти”, предложенное в работах Уральского федерального университета, связано с тем, что процедура сливания прекурсоров для получения реакционных систем для синтеза тонких пленок может сильно влиять на поведение этой системы. Математическое описание экспериментально установленных колебаний рН дано в работах [5, 6] с учетом протекания процесса гидролиза во взаимно перекрывающихся зонах областей образования твердых фаз полиядерных соединений.
Для оптимизации расчетов констант равновесия протекающих в системе процессов наилучшие результаты обеспечивает комбинация ручного и автоматического режимов обработки данных. В ручном режиме массивы экспериментальных данных сегментируются до четырехразмерной задачи, далее производится расчет в автоматическом режиме с визуальным отображением пространства решений для предотвращения получения локальных решений. В программных продуктах, применяемых большинством исследователей, таких, например, как PHREEQC, MINEQL+4.1 [7, 8], в алгоритмах расчетов используется лишь правило произведения растворимости. Между тем такие явления как образование оксидов одинаковой стехиометрии, но с разными путями протекания реакций, образование тонких пленок халькогенидов металлов не описываются моделями, базирующимися лишь на правиле произведения растворимости [2, 3, 9, 10]. В работе [11] проведен обзор используемых программных продуктов и показаны их основные недостатки, ограничивающие применение при моделировании гетерогенных систем. В литературе константы равновесия полиядерных, гетеролигандных, гетероядерных комплексов представлены в недостаточной мере вследствие избегания многими исследователями систем, содержащих твердофазные образования. При этом нередко они являются недостоверными из-за упрощенного подхода при обработке экспериментальных данных.
При расчете областей образования нескольких фаз в виде осадков, золей, тонких пленок вначале, как правило, производится определение условий образования первой из них, образующейся в системе, при увеличении концентрации соли металла в системе. Далее при расчете областей образования других фаз необходимо одновременно использовать еще одно условие – правило образования приоритетного осадка. С ростом исходной концентрации металла в системе и с образованием твердых фаз возрастает вероятность отклонения системы от состояния равновесия. В связи с этим при моделировании подобных систем необходимо наличие программного продукта, включающего в обязательном порядке: блок экспериментальных данных; блок фундаментальных параметров таких как константы равновесия, правила растворимости и необходимые условия; блок численного решения задач с размерностью до ста в ручном и автоматическом режимах с визуальным отображением пространств решений; блок уравнений материального баланса (УМБ) и определения числа частиц в системе; блок учета неравновесных состояний и влияния используемых методов исследования; блок учета ионной силы и вязкости раствора. Отметим, что в условиях образования твердой фазы ионная сила оказывает малое влияние на область ее существования, а вязкость раствора необходимо учитывать при рН > 13.
Приведенные выше условия для моделирования фазообразования в водных растворах изложены в [9]. Предложенный подход успешно апробирован нами для определения констант равновесия в системе Pb(II)–H2О–ОН––тиомочевина, используемой на практике для синтеза важных целевых соединений [10]; для расчета констант равновесия и условий образования твердых фаз в системах Sn(II)–H2O–OH–, ZnCl2–H2O–NaOH, Ga(NO3)3–H2O–NаOH [11–13].
Большое значение для материаловедческой практики имеет моделирование систем, содержащих соли меди в присутствии различных лигандов. Тонкие пленки сульфида и селенида меди, твердые растворы с их участием широко используются для синтеза материалов солнечной энергетики с целью создания эффективных фотопреобразователей. В этой связи очень важен целенаправленный синтез этих соединений требуемого состава. Ранее нами методом потенциометрического титрования изучены фазообразование и равновесные состояния в системах CuCl2–H2O–NaOH” [14] и CuSO4–H2O–KOH, NaOH, NH3 [15]. Однако введение в раствор такого сильного комплексообразующего агента для меди как аммиак существенно изменяет характер фазообразования в системе. Эту задачу в работе [16] предложено было решить путем построения комплексной термодинамической модели, объединяющей уравнения состояния Хелгесона–Киркхема–Флауэрса (HKF) для стандартных термодинамических свойств. В указанной работе сделан важный вывод, что путем построения подобных диаграмм можно получить больше количественной информации о реальной медьсодержащей системе по сравнению с традиционными диаграммами состояния. Однако такой подход, отличаясь достаточной сложностью, является полностью расчетным и не позволяет учесть все возможные равновесные состояния и образования фаз, для которых отсутствуют термодинамические данные.
Цель настоящей работы – построение модели гетерогенной системы с использованием предложенных теоретических положений о растворимости по интермедиату и выборе приоритетной твердой фазы при образовании в ней осадков на примере системы Cu(II)–H2O–OH––NH3.
МЕТОДИКА РАСЧЕТОВ
Постепенное накопление большого массива экспериментальных результатов при изучении гетерогенных систем обеспечило возможность создания базы данных на основе программного продукта, в основе которого лежит математическая модель с новыми теоретическими положениями. Ее использование расширяет возможности более точного расчета областей образования таких субстанций, как осадки, тонкие пленки, золи. Для построения модели равновесий использованы полученные нами экспериментальные данные [14, 15, 17, 18], а также ранее описанные [7, 8, 16] сведения о составе соединений и равновесиях с их участием. Подробное описание методик эксперимента при использовании методов рН-метрии и остаточных концентраций для исследования подобных гетерогенных систем приведено в [14, 17, 18].
В работе [14] нами представлены зависимости функции образования n от рН растворов CuCl2, n – мольная доля, соответствующая отношению молярной концентрации соединения к молярной концентрации исходной соли металла (практически является эквивалентом моляльной концентрации). Экспериментальные данные получены нами для диапазона концентраций соли 10–4–1.00 моль/л и концентрации аммиака в системе 0.0–2.00 моль/л.
При описании данных по остаточной концентрации были заимствованы результаты работы [17], в которой представлены экспериментальные зависимости остаточной концентрации Cu(II) и Zn(II) от рН раствора. Авторами [17] был сделан значительный задел в исследовании равновесий данных систем и подробно изложена методика эксперимента. Необходимо отметить, что в данной работе при анализе кривых остаточных концентраций в присутствии аммиака был сделан вывод, что смещение кривой в кислую область рН объясняется образованием гетеролигадных комплексов металла.
При моделировании гетерогенных систем Cu(II)–H2O–OH– и Cu(II)–H2O–OH––NH3 на начальном этапе в исходные уравнения материального баланса было включено 65 соединений, находящихся в растворе, и 35 соединений в виде труднорастворимых фаз. После расчета числа частиц в системе осталось 40 соединений. Алгоритм расчета числа частиц включал использование экспериментальных данных по равновесным состояниям, полученным различными методами, определение минимума расхождений экспериментальных и расчетных кривых и выделение соединений со значимыми мольными долями, например, более 0.001. В табл. 1 приведены вычисленные из данных потенциометрии (ПТ) и остаточной концентрации соли меди (ОК) константы равновесия без учета активных концентраций. В методе ОК растворы выдерживались не менее двух недель. По результатам расчетов с учетом ионной силы (по методу Дебая–Хюккеля) и без ее учета в исследуемых нами системах не установлено существенного различия между величинами найденных в работе констант. Основной вклад, приводящий к недостоверным результатам, вносит неправильный подбор уравнений материального баланса.
Таблица 1.
Значения эффективных констант равновесия в зависимости от метода исследования при различных температурах раствора
| Соединение | lg Ki [15] | 25°C | 30°C | 45°C | 60°C | 65°C | ||||
|---|---|---|---|---|---|---|---|---|---|---|
| ОК | ПТ [15] | Г | ГН | [19] | ОК | ОК | ОК | ОК | ||
| Гидроксиды | lg K1 | 9.9 | 6.1 | 6.1 | 6.1 | 6.1 | 9.9 | 9.7 | ||
| lg K2 | 7.2 | 4.7 | 4.7 | 4.7 | 4.7 | 6.6 | 6.0 | |||
| lg K2S | –5.5 | –5.5 | –5.5 | –5.3 | –5.2 | |||||
| lg K3 | 3.1 | 3.5 | 3.5 | 3.0 | 3 | |||||
| lg K4 | 3.4 | 3.3 | 2.2 | 3.0 | 3.0 | |||||
| lg K5 | 2.1 | 3.2 | 0.1 | 0.1 | ||||||
| lg K6 | 0.2 | 2.9 | –1 | –1 | ||||||
| NH4OH | lg KT | 4.75 | 4.75 | 4.75 | ||||||
| ${\text{HSO}}_{4}^{ - }$ | lg KD | 1.94 | 1.94 | 1.94 | ||||||
| Полиядерные комплексы | lg KKPB0XB1 | 3.2 | –3.0 | 0.1 | 3.1 | 2.3 | ||||
| lg KKPB0XB1S | –9.3 | –9.0 | –9.0 | –8.0 | ||||||
| lg KKP2B0XB1 | –6.0 | 0.5 | ||||||||
| lg KKPB1XB1 | 5.1 | 3.5 | ||||||||
| Гетеролигандн. комплексы | lg KKTB0XT | 3.6 | 4.0 | 3.9 | 3.9 | 3.4 | ||||
| lg KKTB1XT | 3.2 | 6.0 | 7.4 ± 0.4 | 3.2 | 3.2 | 2.2 | ||||
| lg KKTB2XT | 3.1 | 7.1 | 3.0 | 3.0 | 2.5 | |||||
| lg KKTB3XT | 6.1 | 11.4 | 6 | 5.5 | ||||||
| lg KKTB4XT | 6.4 | 10 | 6 | 7 | ||||||
| Оксиды | lg KKB2DW | 3.1 | 3.1 | 3.1 | ||||||
| lg KKB2DWS | –7.8 | –7.8 | –7.8 | |||||||
Обозначения: ОК – остаточная концентрация, ПТ – потенциометрическое титрование, Г – исследование системы + + (NH4)2SO4; ГН – измерение рН [17].
С целью упрощения работы с программным продуктом нами использована специальная индексации полученных констант. Первые шесть из них имеют классическое обозначение. Далее буква в начале присвоенного индекса означает: Т – гетеролигандное соединение, Р – полиядерное соединение, О – оксид или оксогидроксид; буква S в конце индекса – соединение в виде осадка. Примеры индексов констант представлены в табл. 1. Жирным шрифтом выделены константы, значения которых отсутствуют в литературе или имеют большой разброс у различных представивших их авторов, что обычно связано с неполным включением соединений в УМБ или отсутствием учета влияния метода исследования.
В случае использования в качестве исходной соли CuSO4 вместо CuCl2 следует учитывать, кроме взаимодействия соединений Cu(II) с водой (гидролиз), также гидролиз кислоты средней силы НSO$_{4}^{ - }$.
Соединения, которые остаются в значимых мольных долях при стремлении исходной концентрации соли металла к нулю (при рСCu(II) ≈ 9) нами названы базисными. Для изучаемой системы это Cu2+ – 0, Cu(OH)+ – 1, Cu(OH)2 – 2, Cu(OH)$_{3}^{ - }$ – 3, Cu(OH)$_{4}^{{2 - }}$ – 4, Cu(OH)$_{5}^{{3 - }}$ – 5, Cu(OH)$_{6}^{{4 - }}$ – 6, H2O – W, NH3 – Т. Буквы в середине индекса этих соединений означают: Х – присоединение, D – удаление, а арабская цифра – число базисных частиц.
Цель приведенной выше индексации – необходимость быстрого распознавания типа соединения и способа его образования из базисных частиц, что существенно упрощает работу с программным продуктом, созданным на основе предложенной нами математической модели. В случае образования твердой фазы в уравнение материального баланса включаются также соединения из раствора с низкими значениями мольных долей, но определяющие условия насыщения раствора. При расчете областей существования нескольких осадков, а также областей образования пленок на первом этапе производится расчет области образования первого из осадков. Следует учесть, что массовая доля образующихся на межфазных поверхностях пленок не превышает 1% по сравнению с массовой долей осадка с одинаковой стехиометрией, поскольку индукционный период для их формирования может быть достаточно длительным. На рис. 1 представлены экспериментальные данные [5], которые демонстрируют области образования осадков S1 – Сu6(OH)2(SO4)5S, S9 – Сu4(OH)6SO4S в системе.
Рис. 1.
Экспериментальная (точки) и расчетная кривые остаточной концентрации раствора СuSO4; ${{С}_{{{\text{СuS}}{{{\text{O}}}_{{\text{4}}}}}}}$ = = 0.01 моль/л, ${{С}_{{{\text{N}}{{{\text{H}}}_{{\text{3}}}}}}}$ = 0.017 моль/л. Экспериментальные данные заимствованы из работы [15]. Состав соединений: 0 – Сu2+, Р4 – Сu3(OH)5+, Р5 – Сu2(OH)3+, PG1 – Сu4(OH)6(NH3)$_{6}^{{2 + }}$, PG2 – Сu4(OH)7(NH3)$_{6}^{ + }$, G2 – Сu(OH)2(NH3), G10 – Сu(OH)6(NH3)4–, G6 – Сu4(OH)3(NH3)5+, G8 – Сu4(OH)4(NH3)4+, G9 – Сu(OH)5(NH3)3–, S1 – Сu6(OH)2(SO4)5S, S9 – Сu4(OH)6SO4S.
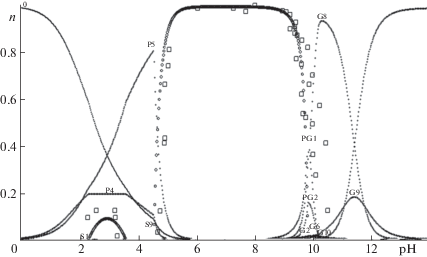
После решения задачи составления УМБ и оценки значений констант равновесия можно учитывать вторичные параметры, влияющие на поведение системы, например, ионную силу или вязкость раствора. Если при получении экспериментальных данных в первую очередь поддерживать ионную силу раствора добавлением “инертного” электролита, возникают проблемы образования в системе примесных и побочных соединений. Это в конечном итоге приводит к усложнению расчетов и повышению вероятности получения менее достоверных результатов. С учетом указанного, а также присутствия относительно разбавленных растворов над фазой осадка в широком диапазоне рН, в связи с чем коэффициенты активностей принимались близкими единице, найденные константы равновесия следует считать эффективными.
Наличие математической модели равновесных состояний и возможность учета отклонений от равновесного состояния в присутствии твердых фаз позволяет обеспечивать анализ достоверности результатов и сделанных выводов. В частности, возможно проведение оценки соответствия концентраций исходных реагентов и сходимости повторных экспериментов.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
С использованием указанных выше условий растворимости, составленных уравнений материального баланса, вычисленных эффективных констант был проведен расчет теоретических мольных долей соединений, остаточной концентрации (ОК) и кривых потенциометрического титрования (ПТ) с учетом образования более одного осадка в системе, а также с учетом их областей перекрывания. Результаты расчетов представлены на рис. 1–3.
Рис. 2.
Экспериментальная зависимость функции образования n от рН раствора СuCl2 при наличии осадков, ${{С}_{{{\text{СuC}}{{{\text{l}}}_{{\text{2}}}}}}}$ = = 1.01 моль/л, СNaOH = 10.25 моль/л [14]. Отмеченные участки на кривой характеризуются фазовыми изменениями. Пояснения в тексте.
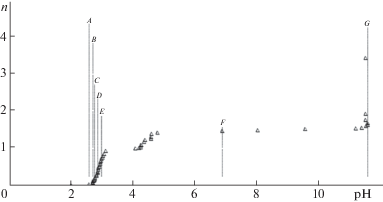
Рис. 3.
Экспериментальные [18] и расчетные зависимости функции образования n от рН растворов; ${{С}_{{{\text{СuS}}{{{\text{O}}}_{{\text{4}}}}}}}$ = = 0.050 моль/л; ${{С}_{{{\text{NH}}_{4}^{ + }}}}$ = 0.040 (1), 0.160 (2); 0.200 (3), 0.800 (4); 1.20 (5), 1.60 (6), 1.80 (7) моль/л.
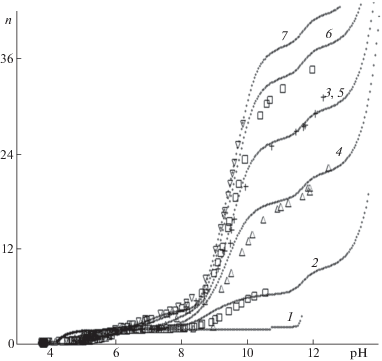
Как видно из рисунков, имеет место хорошее совпадение экспериментальных и теоретических кривых. Сужение области образования осадков в области рН > 9 в присутствии NH3 объясняется образованием в основном гетеролигандных комплексов с ростом рН раствора: Cu(OH)2NH3, [Cu4(OH)6(NH3)6]2+, [Cu(OH)4NH3]2–, Cu(OH)3NH$_{3}^{ - }$, [Cu4(OH)7(NH3)6]+, [Cu4(OH)7]+, [Cu(OH)5NH3]3– и [Cu(OH)6NH3]4–. Растворение осадка CuOS определяется образованием комплексов [Cu4(OH)7]+, [Cu(OH)6]4–, а также гетеролигандных комплексных форм. При введении в систему иона аммония происходят резкое увеличение числа частиц в системе и изменение областей существования осадков. При этом существенно изменяется ход кривых ПТ (см. рис. 3).
Модель равновесных состояний в присутствии гетерогенных фаз полезно использовать для изучения изменений в системе в зависимости от величины рН. Так представленный на рис. 2 пример экспериментальной зависимости функции образования n от рН раствора наглядно демонстрирует образование в системе труднорастворимых фаз и их эволюцию. Отмеченные участки на кривой характеризуют происходящие фазовые изменения с возрастанием величины рН: A – выпадение хлопьевидного осадка ярко-синей окраски (при рН 2.56); B – изменение окраски раствора на бирюзовую с образованием хлопьев (рН 2.70), далее в узком диапазоне рН происходит растворение осадка; С – незначительное потемнение окраски раствора и увеличение его вязкости (рН 2.74); D – раствор приобретает светло-зеленую окраску с образованием синих хлопьев (рН 2.84); E – образование суспензии светло-зеленого цвета (рН 2.98); F – увеличение вязкости суспензии вплоть до pH ≈ 6.88; G – суспензия приобретает темно-зеленую окраску с образованием густой гелеобразной массы (рН ∼ 11.60). Визуальная оценка образования осадков (см. рис. 2) позволяет быстро и экономично проверять достоверность расчетов, а при необходимости проводить дополнительные эксперименты для установления химического состава или структуры соединений.
Таким образом, предлагаемая математическая модель гетерогенной системы позволяет по экспериментальным данным, полученным различными методами и при большом интервале значений исходных параметров вычислять число частиц в системе, значения эффективных констант равновесия, предсказывать стехиометрию соединений, как в растворе, так и в виде осадков. При этом, как видно из сравнительных данных, модель системы позволяет достоверно описать эксперимент при исходной концентрации CuCl2 1.01 моль/л. Отметим, что и при значительно меньших концентрациях CuCl2, вплоть до концентраций исходной соли менее 10–7 моль/л, модель достаточно хорошо описывает экспериментальные данные.
Для более полного описания экспериментальных данных, как уже отмечалось, необходимо учитывать эффект “памяти” раствора, который заключается в присутствии в системе сравнительно медленно образующихся соединений. Такие соединения можно выявить при сравнении данных, полученных методами ПТ и ОК. При расчете теоретических кривых потенциометрического титрования медленно образующиеся соединения в итоге завышают константу устойчивости соединения и занижают константу их растворимости. В свою очередь очень быстро образующиеся соединения дают обратный эффект. Например, соединение Cu3(OH)5+ при ПТ не проявляется, и его константа устойчивости сильно занижена по сравнению с рассчитанной по данным ОК. То же самое относится к Cu2(OH)3+ и в меньшей степени к Cu4(OH)$_{7}^{ + }$ и Cu4(OH)$_{6}^{{2 + }}$.
Интересно сравнить полученные нами данные с результатами работы [16], согласно которым, в системе CuCl2–H2O–NH4Cl–NaOH существуют соединения Cu2+, CuCl+, CuNH$_{3}^{{2 + }}$, CuNH3Cl$_{3}^{ - }$, Cu(NH3)$_{2}^{{2 + }}$, Cu(NH3)$_{3}^{{2 + }}$, Cu(NH3)$_{4}^{{2 + }}$, Cu(NH3)$_{5}^{{2 + }}$, Cu(NH3)(OH)+, Cu(NH3)3OH+. В тоже время, как следует из наших расчетов при СCu(II) = 0.0800–0.0008 моль/л в системе образуются осадки Cu4(OH)6SO4S, Cu8(OH)14SO4S, CuOS. При СCu(II) = = 0.0008 моль/л сохраняется только осадок CuOS, причем образования осадка Cu(OH)2S вообще не установлено. В литературе иногда приводится ошибочная информация об образовании твердой фазы Cu(OH)2S в этих условиях. Данная ситуация служит примером рассмотрения упрощенной модели системы. Как следует из наших расчетов, при СCu(II) = 0.0800–0.200 моль/л в присутствии избытка NH3 осадки практически не образуются. Как видно из рис. 2, при большом избытке NH3 по сравнению с исходной концентрацией Cu(II) доля комплексов Cu(NH3)2+, Cu(NH3)$_{2}^{{2 + }}$, Cu(NH3)$_{3}^{{2 + }}$, Cu(NH3)$_{4}^{{2 + }}$, Cu(NH3)$_{5}^{{2 + }}$ относительно невелика, и лишь в области рН 8.5–10.0 она возрастает (особенно это касается Cu(NH3)$_{5}^{{2 + }}$). В других областях, в частности, при рН < 8 преобладают комплексы состава Cu4(OH)х(NH3)$_{y}^{{Z + }}$, а при рН > 8 гетеролигандные комплексы состава Cu(OH)х(NH3)$_{y}^{{Z - }}$.
В работе [18] методами рентгенофлуоресцентного и термогравиметрического анализа определен состав осадков в системах Cu(II)–H2O–KOH (NaOH) – система I и Cu(II)–H2O–NaOH–NH3 – система II. Так, в системе II подтвержден состав осадков Cu4(OH)6SO4S при рН 2.0–4.5, Cu(OH)2S при рН 4.5–11.5. В системе I установлено образование осадков Cu4(OH)6SO4S при рН 2.0–4.5 и CuOS при рН 13.0–14.5. Области насыщения раствора по отношению к определенному осадку сильно зависят от исходной концентрации соли металла, особенно в случае Cu(OH)2S, который образуется лишь при концентрации Cu(II) менее 10–4 моль/л. Ситуация осложняется в присутствии дополнительных реагентов, например, NH3. Часто при высоких исходных концентрациях соли металла система пересыщена по нескольким труднорастворимым фазам, и для расчета их областей образования приходится применять все три указанных выше условия насыщения раствора и условие образования приоритетного осадка.
Таким образом, с использованием разработанной модели гетерогенных равновесий, основанной на применении правил: произведения растворимости, молекулярной растворимости, растворимости по интермедиату и выбора приоритетной твердой фазы, проведено моделирование системы Cu(II)–H2O–OH––NH3 с учетом образования осадков. Показано хорошее соответствие расчетных данных и результатов эксперимента. Рассчитаны имеющие справочный характер эффективные константы равновесия для 40 образующихся в системе соединений. Методами рентгенофазового и дифференциального термографического анализов в исследуемой системе подтвержден состав образующихся осадков следующих составов: (Cu4OH)6(SO4)4S при рН 2.0–4.5, Cu(OH)2S при рН 4.5–11.5, Cu4(OH)6SO4S при рН 2.0–4.5 и CuOS.
Работа выполнена при финансовой поддержке программы 211 Правительства Российской Федерации № 02.А03.21.0006.
Список литературы
Khalilova A.A., Mal’tsev A.S., Bakhteev S.A. et al. // Russ. J. Phys. Chem. A. 2019. V. 93. P. 845. https://doi.org/10.1134/S0036024419050182
Yusupov R.A., Bakhteev S.A. // Ibid. 2009. V. 83. № 12. P. 2188. https://doi.org/10.1134/S0036024409120346
Yusupov R.A., Bakhteev S.A., Smerdova S.G. // Ibid. 2010. V. 84. № 7. P. 1263. https://doi.org/10.1134/S0036024410070320
Динь З.Т., Бахтеев С.А., Юсупов Р.А. // Вестн. Технолог. ун-та. 2015. Т. 18. № 1. С. 53.
Динь З.Т., Бахтеев С.А., Юсупов Р.А. // Тез. докл. VIII Международной научной конф. “Кинетика и механизм кристаллизации. Кристаллизация как форма самоорганизации вещества”. Иваново: Изд-во ОАО “Иваново”, 2014. С. 72.
Динь З.Т., Бахтеев С.А., Юсупов Р.А. // Бутлеровские сообщения. 2014. Т. 38. № 6. С. 164.
Parkhurst, D.L. // D.L. Parkhurst and C.A.J Appelo: U.S. Geological Survey Techniques and Methods, 2013. Book 6. Ch. A43. 497 p.
William D., Schecher et al. // MINEQL+4.1 Chemical Equilibrium Program for Personal Computers, 2008.
Yusupov R.A., Dinh Z.T., Bakhteev S.A. // J. Appl. Sol. Chem. and Modeling. 2015. № 4. P. 185. https://doi.org/10.6000/1929-5030.2015.04.04.4
Юсупов Р.А., Динь З.Т., Бахтеев С.А. Оптимизация гидрохимического синтеза тонких пленок PbS. Расчет констант равновесий в системе Pb(II)–H2О–ОН––тиомочевина для синтеза целевых соединений. LAP LAMBERT Academic Publishing, 2014. 42 с.
Dinh Z.T., Bakhteev S.A., Yusupov R.A. // Russ. J. Phys. Chem. A. 2014. V. 88. № 6. P. 927–931. https://doi.org/10.1134/S0036024414060107
Fedorova E.A., Maskaeva L.N., Markov V.F. et al. // Ibid. 2018. V. 92. P. 2575. https://doi.org/10.1134/S0036024418120117
Fedorova E.A., Bakhteev S.A., Maskaeva L.N. et al. // Ibid. 2016. V. 90. P. 1274. https://doi.org/10.1134/S0036024416060078
Fedorova E.A., Maskaeva L.N., Markov V.F. et al. // Ibid. 2019. V. 93. P. 970. https://doi.org/10.1134/S0036024419050091
Бахтеев С.А., Динь З.Т., Юсупов Р.А. // Вестн. Kазанск. технолог. ун-та. 2014. Т. 17. № 22. С. 16.
Xi Wang, Qi-Yuan Chen, Zhou-Lan Yin et al. // J. Cent. South Univ. Technol. 2011. V. 18. P. 48−55. https://doi.org/10.1007/s11771-011-0657-y
Юсупов Р.А., Гафаров М.Р., Нурисламов Э.Р., Михайлов О.В. // Бутлеровские сообщения. 2002. Т. 3. № 9. С. 37. ROI: jbc-01/2-2-9-37
Бахтеев С.А., Юсупов Р.А. // Вестн. Kазанск. технолог. ун-та. 2009. № 6. С. 62.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1989. 448 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


