Журнал физической химии, 2020, T. 94, № 12, стр. 1904-1908
Стандартные энтальпии образования пиколиновой кислоты и продуктов ее диссоциации в водном растворе
А. И. Лыткин a, В. В. Черников a, О. Н. Крутова a, *, Е. Д. Крутова a
a Ивановский государственный химико-технологический университет
153000 Иваново, Россия
* E-mail: kdvkonkpd@yandex.ru
Поступила в редакцию 28.10.2019
После доработки 22.05.2020
Принята к публикации 25.05.2020
Аннотация
Измерены теплоты растворения кристаллической пиколиновой кислоты в воде и в растворах гидроксида калия при 298.15 K прямым калориметрическим методом. Рассчитаны стандартные энтальпии образования кислоты и продуктов ее диссоциации в водном растворе.
Пиридинмонокарбоновые кислоты (пиколиновая (в), никотиновая (б) и изоникотиновая кислоты (а)):
обладающие весьма интересными фармацевтическими свойствами образуют важную группу антигельминтных препаратов и витаминов [1]. Эти соединения полезны для организма человека и участвуют в ряде важных биохимических процессов [2]. Например, никотиновая кислота превращается в никотинамидадениннуклеотид, который служит промежуточным продуктом в процессах двухэлектронного переноса в организме [3]. Пиридинкарбоновые кислоты могут взаимодействовать с ионами ряда металлов, присутствующих в организме человека [2]. Биологическое значение пиколиновой, никотиновой и изоникотиновой кислот, и в особенности, их комплексов описано в [4–9]. Очевидна биохимическая значимость протолитических равновесий, особенно при изучении транспортных функций никотиновой кислоты. Проникновение витамина РР через липопротеидную мембрану осуществляется в основном по диффузионному механизму при наличии градиента концентраций молекулярной формы никотиновой кислоты, превращающейся в никотинат-ион при рН внутриклеточной среды [10].В литературе имеются надежные данные по константам ионизации кислоты [11–22]. Эти работы выполнены при различных значениях ионной силы раствора, на фоне отличающихся по своей природе поддерживающих электролитов. Для того, чтобы можно было сравнивать значения констант ступенчатой диссоциации кислоты, полученные разными авторами, мы пересчитали величины рK1 и рK2 на нулевую ионную силу.
Пересчет констант диссоциации кислоты на нулевую ионную силу был выполнен по уравнению Дэвис [23] (для I < 0.5):
(1)
${\text{р}}{{K}^{0}} = {\text{р}}{{K}^{{\text{c}}}} + A\Delta {{Z}^{2}}[{{I}^{{1/2}}}{\text{/}}(1 + {{I}^{{1/2}}})--0.2I],$(2)
${\text{р}}{{K}^{0}}\, = \,{\text{р}}{{K}^{{\text{c}}}}\, + \,A\Delta {{Z}^{2}}[{{I}^{{1/2}}}{\text{/}}(1\, + \,1.6{{I}^{{1/2}}})\,--\,0.05I]\,--\,\delta I,$(3)
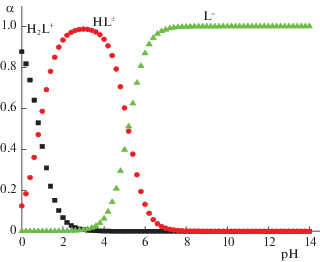
${\text{p}}{{K}^{{\text{c}}}} = {\text{p}}{{K}^{0}} - \Delta {{Z}^{2}}A\frac{{\sqrt I }}{{{\text{1}} + {\text{1}}{\text{.6}}\sqrt I }} + \delta I.$После обработки литературных данных – констант ступенчатой диссоциации в качестве наиболее вероятных значений термодинамических констант диссоциации можно принять при 298.15 K: рK$_{1}^{0}$ = 0.85 ± 0.03. рK$_{2}^{0}$ = 5.18 ± 0.05. На рис. 1 представлена диаграмма равновесий в водном растворе пиколиновой кислоты, построенная на основании расчетов равновесного состава растворов кислоты при различных значениях рН с использованием программы КЕV [25].
Цель настоящей работы – определение стандартных энтальпий образования пиколиновой кислоты и продуктов ее диссоциации в водном растворе по тепловым эффектам растворения кислоты в воде и в водных растворах КОН при 298.15 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали пиколиновую кислоту, приобретенную в SIGMA-ALDRICH (содержание основного вещества 99.0%) без дальнейшей очистки. Растворы кислоты готовили растворением навесок препарата в свежеприготовленном бидистилляте непосредственно перед проведением опыта. Бескарбонатный раствор КOH и растворы HNO3 приготавливали из реактивов марки “х.ч.” по обычной методике [26]. Работу калориметрической установки [27] проверяли по общепринятому калориметрическому стандарту – теплоте растворения кристаллического хлорида калия в воде. Препарат KCl очищали двукратной перекристаллизацией реактива марки “x.ч.” из бидистиллята. Перед взятием навесок хлорид калия высушивали в сушильном шкафу при 393.15 K до постоянной массы. Согласование экспериментально полученных теплот растворения КСl(кр.) в воде ΔsolН(∞Н2О) = 17.25 ± 0.06 кДж/моль с наиболее надежными литературными данными [28] свидетельствует об отсутствии заметной систематической погрешности в работе калориметрической установки.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Протонирование анионной формы кислоты (L–) осуществляется по двум ступеням:
(5)
${\text{Н}}{{{\text{L}}}^{ \pm }} + {{{\text{Н}}}^{ + }} \leftrightarrow {{{\text{Н}}}_{{\text{2}}}}{{{\text{L}}}^{ + }},$Стандартные энтальпии образования раствора пиколиновой кислоты при различных разведениях рассчитывали по уравнению:
(6)
$\begin{gathered} {{\Delta }_{{\text{f}}}}Н^\circ ({\text{H}}{{{\text{L}}}^{ \pm }},\;{\text{р - р}},\;n{{{\text{Н}}}_{{\text{2}}}}{\text{О}},\;298.15\;{\text{K}}) = \\ = {{\Delta }_{{\text{f}}}}Н^\circ ({\text{H}}{{{\text{L}}}^{ \pm }},\;{\text{кр}}{\text{.}},\;298.15\;{\text{К}}) + \\ + \;{{\Delta }_{{{\text{sol}}}}}H({\text{H}}{{{\text{L}}}^{ \pm }},\;{\text{кр}}{\text{.}},\;298.15\;{\text{K}}), \\ \end{gathered} $Таблица 1.
Энтальпии растворения пиколиновой кислоты в воде при 298.15 K (кДж/моль)
| Масса навески, г | m × 103, моль HL±/1000 г Н2О | N, моль Н2О/моль HL± | ΔsolH | –ΔfН°(HL±, р-р, nН2О, 298.15 K) | –ΔfH° (HL±, р-р, nН2О, гип., недисс. 298.15 K) |
|---|---|---|---|---|---|
| 0.0064 | 0.6600 | 44 985 | 16.02 ± 0.25* | 359.82 | 360.1 |
| 0.0072 | 0.7425 | 39 986 | 16.01 | 359.81 | 360.1 |
| 0.0085 | 0.8765 | 33 871 | 16.03 | 359.83 | 360.1 |
| 0.0115 | 1.1859 | 25 035 | 16.02 | 359.82 | 360.1 |
| 0.0169 | 1.7428 | 17 036 | 16.11 | 359.91 | 360.2 |
| 0.0203 | 2.0935 | 14 182 | 16.18 | 359.98 | 360.2 |
| 0.0335 | 3.4548 | 8594 | 16.21 | 360.01 | 360.3 |
| 0.0437 | 4.5067 | 6588 | 16.23 | 360.03 | 360.3 |
| 0.0539 | 5.5586 | 5341 | 16.32 | 360.13 | 360.4 |
| 0.0605 | 6.2392 | 4759 | 16.40 | 360.20 | 360.5 |
| 0.0705 | 7.2705 | 4084 | 16.53 | 360.33 | 360.6 |
| 0.0805 | 8.3018 | 3576 | 16.55 | 360.35 | 360.6 |
| 0.0912 | 9.4053 | 3157 | 16.65 | 360.45 | 360.7 |
| 0.0963 | 9.9312 | 2990 | 16.68 | 360.48 | 360.7 |
Энтальпии образования кислоты в водном растворе в исследуемом интервале концентраций практически не зависит от величины разведения, что неудивительно для столь больших разбавлений.
Стандартную энтальпию образования гипотетически недиссоциированной молекулы кислоты при конечных разведениях в водном растворе находили по уравнению:
(7)
$\begin{gathered} {{\Delta }_{{\text{f}}}}H^\circ ({\text{H}}{{{\text{L}}}^{ \pm }},\;{\text{р - р}},\;n{{{\text{Н}}}_{{\text{2}}}}{\text{О}},\;{\text{гип}}{\text{.}},\;{\text{недисс}}{\text{.}},\;298.15\;{\text{K}}) = \\ = {{\Delta }_{{\text{f}}}}Н^\circ ({\text{H}}{{{\text{L}}}^{ \pm }},{\text{р - р}},\;n{{{\text{Н}}}_{{\text{2}}}}{\text{О}},\;298.15\;{\text{K}}) + \\ + \;{{\alpha }_{1}}{{\Delta }_{{{\text{dis}}}}}H_{1}^{ \circ }--{{\alpha }_{2}}{{\Delta }_{{{\text{dis}}}}}H_{2}^{ \circ }, \\ \end{gathered} $Стандартную энтальпию образования кислоты в гипотетическом недиссоциированном состоянии при бесконечном разведении находили экстраполяцией величин, полученных по уравнению (7) на нулевое значение моляльности раствора m. Точки в координатах –∆fН°(H2L, р-р, nН2О. гип. недисс. 298.15 K) – m удовлетворительно укладывались на прямую.
В результате по МНК найдена величина:
Стандартные энтальпии образования частиц (H2L+, L–) в водном растворе определяли, используя данные о стандартных энтальпиях образования кислоты в гипотетическом недиссоциированном состоянии и значения ступенчатых энтальпий диссоциации кислоты.
Для независимого определения стандартной энтальпии образования частицы L– и других продуктов диссоциации пиколиновой кислоты в водном растворе использовали следующую методику. Была проведена серия опытов по определению энтальпий растворения кислоты в растворах щелочи при соотношении эквивалентов не менее 1 : 2.
Процесс растворения в растворе КОН можно представить схемой:
(8)
$\begin{gathered} {\text{H}}{{{\text{L}}}^{ \pm }}({\text{кр}}.) + {\text{О}}{{{\text{Н}}}^{--}}({\text{р - р}},\;n{{{\text{H}}}_{{\text{2}}}}{\text{O}}) = \\ = {{{\text{L}}}^{--}}({\text{р - р}},\;n{{{\text{Н}}}_{{\text{2}}}}{\text{О}}) + {{{\text{Н}}}_{{\text{2}}}}{\text{О}}({\text{ж}}). \\ \end{gathered} $Таблица 2.
Энтальпии растворения пиколиновой кислоты в растворе КОН при различных концентрациях и Т = 298.15 K (кДж/моль)
| Масса навески, г | ${{c}_{{{\text{KOH}}}}}^\circ $, моль/л | ΔsolH |
|---|---|---|
| 0.0212 0.0213 0.0212 |
0.007535 | 116.13 ± 0.27 116.21 ± 0.25 116.05 ± 0.28 |
| 0.0412 0.0412 0.0414 |
0.01507 | 118.07 ± 0.25 117.99 ± 0.26 118.02 ± 0.25 |
| 0.0601 0.0600 0.0602 |
0.02260 | 119.95 ± 0.25 119.89 ± 0.27 119.98 ± 0.26 |
Поскольку в реакции (8) разность квадратов зарядов продуктов реакции и исходных компонентов ∆Z 2 = 0, тепловые эффекты растворения кислоты при нулевой ионной силе рассчитывали по уравнению [24]:
где ∆rH(8) и ${{\Delta }_{{\text{r}}}}H_{{(8)}}^{^\circ }$ – тепловые эффекты процесса (8) при конечном и нулевом значениях ионной силы; i – эмпирический коэффициент; I – ионная сила раствора.Используя полученные величины ${{\Delta }_{{\text{r}}}}H_{{(8)}}^{^\circ }$ и значения ∆fH°(OH–, р-р Н2О, 298.15 K), ∆fH°(H2O, ж, 298.15 K), рекомендованные справочником [31], рассчитали стандартную энтальпию образования депротонированного аниона кислоты:
(10)
$\begin{gathered} {{\Delta }_{{\text{f}}}}Н^\circ ({{{\text{L}}}^{ - }},\;{\text{р - р}},\;{{{\text{Н}}}_{{\text{2}}}}{\text{О}},\;298.15\;{\text{K}}) = \\ = {{\Delta }_{{\text{f}}}}Н^\circ ({\text{H}}{{{\text{L}}}^{ \pm }},\;{\text{кр}}{\text{.}},\;298.15\;{\text{K}}) + \\ + \;{{\Delta }_{{\text{f}}}}H^\circ ({\text{O}}{{{\text{H}}}^{--}},\;{\text{р - р}}\;{{{\text{Н}}}_{{\text{2}}}}{\text{О}},\;298.15\;{\text{K}}) + \\ + \;{{\Delta }_{{\text{r}}}}H^\circ --{{\Delta }_{{\text{f}}}}H^\circ ({{{\text{H}}}_{{\text{2}}}}{\text{O}},\;{\text{ж}},\;298.15\;{\text{K}}). \\ \end{gathered} $(11)
$\begin{gathered} {{\Delta }_{{\text{f}}}}H^\circ ({\text{H}}{{{\text{L}}}^{ + }},\;{\text{р - р}},\;{{{\text{Н}}}_{{\text{2}}}}{\text{О,}}\;{\text{гип}}{\text{.}}\;{\text{недисс}}{\text{.}},\;298.15\;{\text{K}}) = \\ = {{\Delta }_{{\text{f}}}}H^\circ ({{{\text{L}}}^{--}},\;{\text{р - р}},\;{{{\text{Н}}}_{{\text{2}}}}{\text{О}},\;298.15\;{\text{K}})-- \\ - \;{{\Delta }_{{{\text{dis}}}}}H^\circ ({\text{H}}{{{\text{L}}}^{ \pm }},\;298.15\;{\text{K}}). \\ \end{gathered} $(12)
$\begin{gathered} {{\Delta }_{{\text{f}}}}H^\circ ({{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ + }},\;{\text{р - р,}}\;{{{\text{H}}}_{{\text{2}}}}{\text{O}},\;{\text{гип}}{\text{.}}\;{\text{недисс}}{\text{.}},\;298.15\;{\text{K}}) = \\ = {{\Delta }_{{\text{f}}}}H^\circ ({\text{H}}{{{\text{L}}}^{ \pm }},\;{\text{р - р}},\;{{{\text{Н}}}_{{\text{2}}}}{\text{О}},\;{\text{гип}}{\text{.}}\;{\text{недисс}}{\text{.}},\; \\ 298.15\;{\text{K}})--{{\Delta }_{{{\text{dis}}}}}H^\circ ({{{\text{H}}}_{{\text{2}}}}{{{\text{L}}}^{ + }},\;298.15\;{\text{K}}). \\ \end{gathered} $Значения стандартных энтальпий образования пиколиновой кислоты и продуктов ее диссоциации в водном растворе являются ключевыми величинами в термохимии этих соединений, открывают возможности проведения строгих термодинамических расчетов в системах, содержащих данные соединения (табл. 3).
Таблица 3.
Стандартные энтальпии образования пиколиновой кислоты продуктов ее диссоциации в водных растворах (кДж/моль)
| Частицы | Состояние | –ΔfН°(298.15 K) ± 1.8 |
|---|---|---|
| HL± | крист. | 343.8 |
| HL± | р-р, Н2О, гип. недисс. | 362.1 |
| H2L+ | р-р, Н2О, гип. недисс. | 360.1 |
| L– | р-р, Н2О | 346.5 |
Работа выполнена в НИИ Термодинамики и кинетики химических процессов Ивановского государственного химико-технологического университета в рамках Государственного задания (базовая часть) проект № FZZW-2020-0009.
Список литературы
Vargova Z., Zeleoak V., Cisaova I., Gyoryova K. // Thermochim. Acta. 2004. V. 423. P. 149.
Textbook of Biochemistry with Clinical Correlations. J.L. York in: Delvin T.M. (Ed.). New York: Wiley, 1992. P. 135.
Kiec-Kononowicz K., Szymaska E. // II Farmaco. 2003. V. 57. P. 909.
Wang W., Basinger A., Shane B. et al. // Am. J. Physiol. Endocrinol. Metab. 2001. V. 280. P. 540.
Berg I., Potter B.V.L., Mayr G.W., Guse A.H. // J. Cell Biol. 2000. V. 150. P. 581.
Sulanç M., Emre I. // J. Appl. Entomol. 2000. V. 124. P. 151.
Ahrén B. // Acta. Physiol. Scand. 2001. V. 171. P. 161.
Koczo P., Dobrowolski J.Cz., Lewandowski W., Mazurek A.P. // J. Mol. Struct. 2003. V. 655. P. 89.
Jakusch T., Gajda-Schrantz K., Kiss T. // J. Inorg. Biochem. 2006. V. 100. P. 1521.
Спиричев В.Б. Обогащение пищевых продуктов витаминами и минеральными веществами. Наука и технология. Новосибирск: Изд-во Сиб. ун-та, 2005.
Paula M., Meier M., Szpoqanicz B. // J. Coord. Chem. 1999.V. 46. P. 491.
Halle J.-C., Lelievre J., Nerrier F. // Can. J. Chem. 1996. V. 74. P. 613.
Asuero A., Navas M., Recamales A., Herrador M. // Microchim Acta. 1986. P. 395.
Chiacchieriuni E. // Ann. Chim. (Rome). 1977. V. 67. P. 547.
Lubes V. // J. Sol. Chem. 2005. V. 34. P. 899.
Kiss E., Petrohan K ., Sanna D., Garriba E. // Polyhedron. 2000. V. 19. P. 55.
Loring J., Karlsson M., Fawcett W., Casey W. // Geochim. Cosmo. Acta. 2000. V. 64. P. 4115.
Gelb R., Alper J. // J. Chem. Eng. Data. 1998. V. 43. P. 383.
Ignaczak M., Andrijewski G. // Pol. J. Chem. 1995. V. 69. P. 716.
Jons O., Johansen E. // Inorg. Chim. Acta. 1988. V. 151. P. 129.
Seleim M., Idriss K. // Analyst. 1987. V. 112. P.1685.
Куранова Н.Н., Душина С.В., Шарнин В.А. // Журн. физ. химии. 2010. Т. 84. № 5. С. 892.
Davies C. // J. Chem. Soc. 1938. P. 2093.
Васильев В.П. Термодинамические свойства растворов электролитов. М.: Высшая школа, 1982. С. 200, 313.
Meshkov A.N., Gamov G.A. // Talanta. 2019. V. 198. P. 200.
Коростелев П.П. Приготовление растворов для химико-аналитических работ. М.: Изд-во АН СССР, 1962. С. 398.
Лыткин А.И., Черников В.В., Крутова О.Н., Смирнова Д.К. // Журн. общ. химии. 2018. Т. 88. Вып. 5. С. 811.
Archer D.G. // J. Phys. Chem. Ref. Data. 1999. V. 28. № 1. P. 1.
Губарева А.И., Бухтоярова И.А., Герасимов П.А., Гаджиев С.Н. // Журн. прикл. химии. 1990. Т. 63. С. 448.
Рибейру да Силва // J. Chem. Thermodyn. 1998. V. 30. № 7. Р. 869. https://doi.org/10.1006/jcht.1998.0353
Термические константы веществ. Вып. III / Под ред. В.П. Глушко и др. М.: ВИНИТИ, 1965–1971.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии