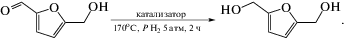Журнал физической химии, 2020, T. 94, № 12, стр. 1899-1903
Монометаллические медные катализаторы гидрирования 5-гидроксиметилфурфурола
Е. А. Редина a, *, К. В. Виканова a, Г. И. Капустин a
a Российская академия наук, Институт органической химии им. Н.Д. Зелинского
119991 Москва, Россия
* E-mail: redinalena@yandex.ru
Поступила в редакцию 29.01.2019
После доработки 29.01.2019
Принята к публикации 11.02.2020
Аннотация
Разработана каталитическая система 3%Cu/CeO2–ZrO2, которая позволяет проводить селективное гидрирование 5-гидроксиметилфурфурола до 2,5-бис(гидроксиметил)фурана с конверсией 70% и селективностью 100% за 2 ч при 170°С и давлении водорода 10 атм. Исследовано влияние количества нанесенной меди, фазового состава катализатора и методики нанесения меди на активность полученных образцов.
5-Гидроксиметилфурфурол (5-HMF) является биодоступным соединением, которое легко получается путем кислотного гидролиза сахаров [1]. Благодаря наличию в молекуле трех типов активных центров (фурановое кольцо, группы –С=О и –С–ОН), данное соединение обладает широким спектром применения в органическом синтезе, тем самым заменяя существующие процессы получения фурановых соединений более экологичными и экономически выгодными технологиями, реализующими принципы “зеленой” химии. Из 5-HMF можно получать широкий спектр различных химических соединений, которые применяются как в синтезе полимерных материалов, в получении высокооктановых добавок к топливам или альтернативного топлива, растворителей, лекарственных препаратов, вследствие чего данное соединение получило название “спящий гигант” [1–4]. В частности, интерес исследователей привлекает процесс селективного гидрирования 5-HMF с получением соответствующего диола 2,5-бис(гидроксиметил)фурана (2,5-BHMF), имеющего огромный потенциал в создании полимерных материалов нового поколения [1–3].
Наиболее активными катализаторами гидрирования альдегидов являются системы на основе благородных металлов (Pd, Pt, Ru, Au), однако не всегда удается добиться высокой селективности процесса [5–9]. Так, использование Pd и Ru-содержащих систем может приводить к нежелательному гидрированию фуранового кольца [9, 10], вплоть до его раскрытия. Кроме того, благородные металлы не подходят в случае создания более экономически выгодных процессов. В настоящее время идет поиск более доступных каталитических систем на базе неблагородных металлов (Cu, Ni, Co) [11–15]. Особый интерес для реакций гидрирования представляют медьсодержащие катализаторы [11, 14–17]. Основное преимущество таких катализаторов состоит в том, что наночастицы меди способны активировать водород, но при этом более селективны в реакциях гидрирования альдегидной группы, чем, например, катализаторы на основе никеля, которые катализируют нежелательный процесс гидрогенолиза молекулы [18]. На активность Cu-содержащих катализаторов оказывают влияние такие факторы, как фазовое состояние меди, размер наночастиц, природа подложки [12, 17, 19]. Катализаторы, нанесенные на наноразмерные оксиды переходных металлов, обладают более высокой активностью в гидрировании 5-HMF [17].
В настоящей работе была синтезирована серия катализаторов, нанесенных на смешанный церий-циркониевый оксид CuOx/CeO2–ZrO2. Нами было исследовано влияние содержания меди, а также метода синтеза каталитических систем на их активность в реакции селективного гидрирования 5-HMF до 2,5-BHMF.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Синтез катализаторов
Синтез смешанных оксидных носителей CeO2–ZrO2 осуществлялся методом соосаждения прекурсоров металлов из рабочих растворов [20]. В качестве исходных материалов использовали ZrO(NO3)2 · 8H2O (99.5%; до 4% Hf; Acros) как прекурсор оксида циркония и (NH4)2Ce(NO3)6 (98+%, Alfa Aesar) в качестве прекурсора оксида церия.
Нанесение меди осуществляли по методике осаждения мочевиной (DPU). В реактор приливали необходимый объем водного раствора Cu(NO3)2 (С = 0.174 М), а также необходимый объем дистиллированной воды. Далее в полученный раствор вносили навеску CeO2–ZrO2 в виде тонкого порошка и проводили перемешивание в течение 15 мин на магнитной мешалке. По истечении 15 мин к полученной суспензии добавляли навеску мочевины (nмочевины/nCu = 6 : 1 в методе DPU-1 и nмочевины/nCu = 10 : 1 в случае методики DPU-2) и проводили нагрев системы до 92°С. Далее суспензию термостатировали при постоянном перемешивании при 92°С в течение 5 ч. Затем полученный осадок отделяли от маточного раствора центрифугированием и промывали дистиллированной водой (50 мл, 3 раза). Полученные образцы сушили под вакуумом на роторном испарителе при 40°С и давлении 60 мбар в течение 2 ч, а затем в сушильном шкафу при 110°С в течение 4 ч. Сухие образцы прокаливали в муфельной печи при 300°С в течение 4 ч. Содержание меди в катализаторе составляло 1, 3 и 5 мас. % Катализатор с содержанием Cu 3 мас. % был получен по двум методикам: DPU-1 и DPU-2.
Каталитические испытания
Реакцию жидкофазного гидрирования 5-HMF проводили в пальчиковом автоклаве объемом 15 мл при исходном давлении водорода 10 атм. и температуре 170°С в течение 2 ч. В качестве растворителя использовали этанол (2 мл) без дополнительной очистки. Катализатор (50 мг) помещали в стеклянный вкладыш, затем приливали реакционную смесь. Затем вкладыш помещали в автоклав, систему герметизировали, затем напускали водород (10 атм) и медленно продували систему. Продувку проводили двукратно. Затем в реактор вновь напускали водород (10 атм), помещали реактор на масляную баню, предварительно нагретую до 170°С. Реакцию проводили в течение 2 ч при интенсивном перемешивании (900 об./мин). По завершении эксперимента автоклав охлаждали на ледяной бане и медленно сбрасывали давление. Жидкую фазу отделяли от катализатора центрифугированием и отбирали пробу для проведения анализа продуктов реакции.
Жидкие продукты реакции анализировали на газожидкостном хроматографе Хроматек Кристалл 5000.2 с ПИД и капиллярной колонкой CR-5 (30 м × 2.5 мм) при ступенчатом нагреве колонки 80–190°С. Строение получаемых соединений подтверждали методами спектроскопии 1H и 13С ЯМР.
Исследование катализаторов физико-химическими методами
Исследования катализаторов методом термопрограммируемого восстановления водородом (ТПВ-Н2) проводили в лабораторной проточной системе с водяной ловушкой, охлажденной до –100°C. Детектор (ДТП) калибровали восстановлением CuO (Aldrich-Chemie GmbH, 99%), предварительно обработанным в токе Ar (30 мл/мин при 300°C). Катализаторы CuOx/CeO2–ZrO2 массой 140–170 мг предварительно обрабатывали в токе аргона с кислородной ловушкой при 250°С в течение 90 мин. Перед ТПВ-экспериментом образец охлаждали в токе Ar до комнатной температуры (20°С). Нагрев от 20 до 300°C проводили со скоростью 10 K/мин в газовой смеси 4.6% H2–Ar, также очищенной с помощью кислородной ловушки, со скоростью потока 30 мл/мин. Образец выдерживали при требуемой температуре (300°С) до тех пор, пока не прекращалось поглощение водорода. Эксперименты повторяли несколько раз для каждого образца.
Фазовый состав материалов и размер частиц были исследованы методом рентгенофазового анализа. Рентгенограммы регистрировали с использованием дифрактометра ARL X’TRA (Thermo Fisher Scientific) с CuKα-излучением (40 кВ, 40 мА) со скоростью сканирования 1.2° в минуту в диапазоне сканирования 20 < 2θ < 70°. Данные ICCD были использованы для идентификации фаз.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
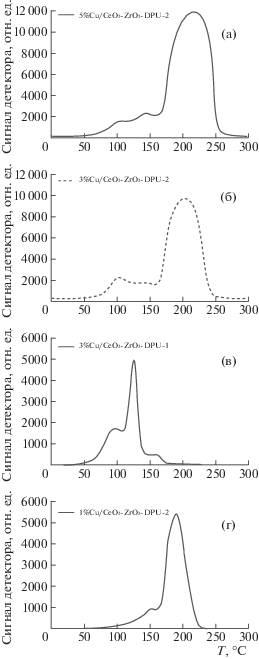
На кривых ТПВ катализаторов, полученных по методике DPU-2, наблюдаются две области поглощения водорода (рис. 1). Первая область поглощения Н2, наблюдаемая в интервале температур 20–160°С, имеет сложную форму, и может быть отнесена к восстановлению дисперсных частиц CuO [16, 21]. Удельное поглощение водорода в интервале температур 20–160°С образцами с содержанием Cu 1 и 3 мас. % близко к 1 (табл. 1). Для образца 5%Cu/CeO2–ZrO2 удельное поглощение водорода несколько занижено, что может быть следствием наличия более крупных частиц CuO в образце с высоким содержанием меди (табл. 1). Вторая область поглощения водорода наблюдается в интервале температур 160–300°С, при этом пик поглощения водорода смещается в область более высоких температур по мере увеличения содержания меди в образце (рис. 1). Поглощение водорода в этой области может быть связано с восстановлением крупных частиц CuO, сопряженное с восстановлением наночастиц носителя. Совершенно иная картина наблюдается для образца 3%Cu/CeO2–ZrO2, полученного по методике DPU-1 (рис. 1). Основное поглощение водорода происходит в области 20–150°С (с небольшим плечом на кривой ТПВ в интервале температур 150–175°С), при этом поглощение водорода при 20–150°C в 2 раза превышает стехиометрическое значение (табл. 1). Вероятно, в этом образце восстановление оксидной фазы меди протекает одновременно с восстановлением носителя уже в области низких температур (до 150°С) [21].
Таблица 1.
Данные исследования ТПВ-Н2 полученных катализаторов
| Катализатор | T, °C | H2/Cu, моль/моль |
|---|---|---|
| 1%Cu/CeO2–ZrO2–DPU-2 | 0–150 | 0.98 |
| 150–300 | 6.04 | |
| 3%Cu/CeO2–ZrO2–DPU-1 | 0–150 | 2.01 |
| 150–300 | 0.35 | |
| 3%Cu/CeO2–ZrO2–DPU-2 | 0–160 | 1.32 |
| 160–300 | 6.12 | |
| 5%Cu/CeO2–ZrO2–DPU-2 | 0–160 | 0.84 |
| 160–300 | 5.61 |
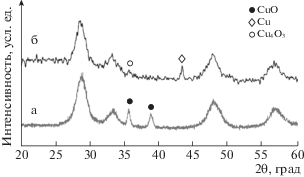
Изучение фазового состава катализаторов 3%Cu/CeO2–ZrO2, полученных по методикам DPU-1 и DPU-2, показало, что использование разного количества осадителя (мочевины) ведет к заметному изменению фазового состава образцов (рис. 2). Так, в образце, полученном по методике с использованием меньшего количества осадителя, наблюдается формирование фаз металлической меди и фазы парамелоконита Cu4O3, в котором медь находится в состоянии Cu+ и Cu2+, с размером ОКР 13 нм. Увеличение количества осадителя ведет к образованию фазы тенорита (CuO) с размером ОКР 22 нм. Можно предположить, что добавление мочевины в 10-кратном избытке в методике DPU-2 приводит к быстрому росту зародышей оксо-гидроксо соединений меди с непрореагировавшей мочевиной, а также продуктами ее разложения, и, частично, к образованию крупных частиц CuO уже на стадии синтеза, как ранее отмечалось в работе Wang и др. [22]. Последующее прокаливание приводит к дополнительному росту частиц CuO, размер которых превышает 20 нм. Уменьшение количества осадителя, вероятно, ведет к более полному гидролизу мочевины с образованием, по всей видимости, другого типа промежуточных соединений меди с продуктами гидролиза мочевины, прокаливание которых позволяет получить дисперсную фазу редкого вида оксида меди Cu3O4 и наночастиц Cu0. Наличие металлической меди в образце 3%Cu/CeO2–ZrO2–DPU-1 способствует активации водорода и переносу его на носитель с последующим его восстановлением [23], что объясняет завышенное поглощение водорода в низкотемпературной области, по данным ТПВ. В образцах, полученных по методике DPU-2, требуется первоначально восстановление крупных наночастиц CuO до металлической меди, а только потом происходит спилловер водорода с восстановлением носителя.
Исследование активности катализаторов в реакции гидрирования 5-HMF до 2,5-BHMF, полученных по методике DPU-2, показало, что увеличение содержания меди приводит к падению активности полученных образцов
Это может быть связано с увеличением размера частиц CuO. Однако все три образца обладают низкой активностью в гидрировании 5-HMF: конверсия субстрата не превышала 20%. С другой стороны, образец 3%Cu/CeO2–ZrO2, полученный по методике DPU-1, показал высокую активность и позволил добиться конверсии 5-HMF 70%. Можно предположить, что наличие наночастиц Cu0 уже в исходном катализаторе 3%Cu/CeO2–ZrO2-DPU-1 позволяет сразу в условиях реакции активировать водород для последующего гидрирования молекулы 5-HMF до 2,5-BHMF, что согласуется с результатами Feng и др. [11]. Вероятно, для образцов, полученных по методике DPU-2, реакция гидрирования протекает ступенчато: в первую очередь должна образоваться фаза металлической меди с последующей активацией водорода на ее поверхности и гидрированием субстрата. Следовательно, за то же время реакции на катализаторах DPU-2 субстрат не успевает превращаться в целевой продукт (2,5-BHMF), в отличие от образца, который изначально характеризуется наличием наночастиц металлической меди (табл. 2).
Таблица 2.
Гидрирование 5-HMF до 2,5-BHMF на Cu-содержащих катализаторах
| Катализатор | X, % | S, % | TOF, ч–1 |
|---|---|---|---|
| 1%Cu/CeO2–ZrO2–DPU-2 | 20 | 100 | 3.96 |
| 3%Cu/CeO2–ZrO2–DPU-1 | 70 | 100 | 4.62 |
| 3%Cu/CeO2–ZrO2–DPU-2 | 10 | 100 | 0.66 |
| 5%Cu/CeO2–ZrO2–DPU-2 | 15 | 100 | 0.59 |
Следует отметить, что активность полученного медного катализатора 3%Cu/CeO2–ZrO2–DPU-1 сопоставима с активностью каталитических, содержащих благородные металлы. Так, например, конверсия 5-HMF на катализаторе Ru(OH)x/ZrO2 достигает 60%, а селективность по 2,5-BHMF составляет 45% после 2 часов реакции при температуре 120°С и давлении водорода 15 атм [8]. На катализаторе Pt/CMK-3 конверсия 5-HMF не превышает 65% при селективности по 2,5-BHMF всего 25% в схожих условиях проведения процесса (120°С, Р (Н2) 8 атм) [6].
Таким образом, в настоящей работе была получена активная каталитическая система на базе неблагородного металла, Cu/CeO2–ZrO2, для селективного гидрирования 5-гидроксиметилфурфурола до 2,5-бис(гидроксиметил)фурана. Изучение физико-химических свойств полученной серии катализаторов с различным содержание меди показало, что даже небольшие изменения в методике нанесения Cu на оксидную подложку может оказывать существенное влияние на фазовый состав полученных образцов, что в свою очередь, определяет их каталитические свойства. Наличие фазы парамелоконита и металлической меди в катализаторе 3%Cu/CeO2–ZrO2–DPU-1, обуславливает его высокую активность в гидрировании 5-HMF, сопоставимую с активностью каталитических систем на базе благородных металлов.
Работа выполнена при финансовой поддержке гранта Президента Российской Федерации для государственной поддержки молодых российских ученых – кандидатов наук МК-3811.2019.3. Авторы благодарят д.х.н., проф. И.В. Мишина за проведение исследований катализаторов методом РФА.
Список литературы
Kucherov F.A., Romashov L.V., Galkin K.I. et al. // ACS Sustain. Chem. Eng. 2018. V. 6. P. 8064–8092.
Hu L., Lin L., Wu Z. et al. // Renew. Sustain. Energy Rev. 2017. V. 74. P. 230–257.
Tang X., Wei J., Ding N. et al. // Renew. Sustain. Energy Rev. 2017. V. 77. P. 287–296.
Galkin K.I., Ananikov V.P. // ChemSusChem. 2019. V. 12. P. 2976–2982.
Chatterjee M., Ishizaka T., Kawanami H. // Green Chem. 2014. V. 16. P. 4734–4739.
Ledesma B., Juárez J., Mazarío J. et al. // Catal. Today. 2019. https://doi.org/10.1016/j.cattod.2019.06.037
Wang T., Zhang J., Xie W. et al. // Catalysts. 2017. V. 7. P. 92.
Han J., Kim Y.-H., Jang H.-S., Hwang S.-Y. et al. // RSC Adv. 2016. V. 6. P. 93394–93397.
Cadu A., Sekine K., Mormul J. et al. // Green Chem. 2018. V. 20. P. 3386–3393.
Li C., Xu G., Liu X. et al. // Ind. Eng. Chem. Res. 2017. V. 56. P. 8843–8849.
Feng Y., Yan G., Wang T. et al. // Green Chem. 2019. V. 21. P. 4319–4323.
Sun K., Shao Y., Li Q. et al. // Mol. Catal. 2019. V. 474. P. 110407.
Zhang L., Zhang F., Michel F.C. // ChemElectroChem. 2019. V. 6. P. 4739–4749.
Li Z.-X., Wei X.-Y., Yang Z. et al. // Catal. Commun. 2019. V. 129. P. 105679.
Ren B., Zhao C., Yang L. et al. // Appl. Surf. Sci. 2020. V. 504. P. 144364.
Hu D., Hu H., Zhou H. et al. // Catal. Sci. Technol. 2018. V. 8. P. 6091–6099.
Wang Q., Feng J., Zheng L. et al. // ACS Catal. 2020. V. 10. P. 1353–1365.
Nakagawa Y., Nakazawa H., Watanabe H. et al. // ChemCatChem. 2012. V. 4. P. 1791–1797.
Zhu Y., Zhu Y., Ding G. et al. // Appl. Catal. Gen. 2013. V. 468. P. 296–304.
Redina E.A., Vikanova K.V., Kapustin G.I. et al. // Eur. J. Org. Chem. 2019. V. 2019. P. 4159–4170.
Kaminski P., Ziolek M., van Bokhoven J.A. // RSC Adv. 2017. V. 7. P. 7801–7819.
Wang Z., Brouri D., Casale S. et al. // J. Catal. 2016. V. 340. P. 95–106.
Witoon T., Numpilai T., Phongamwong T. et al. // Chem. Eng. J. 2018. V. 334. P. 1781–1791.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии