Журнал физической химии, 2020, T. 94, № 12, стр. 1790-1796
Кинетика и механизм образования твердой фазы при осаждении пленок PbSe в присутствии ингибиторов окисления селеномочевины
В. М. Юрк a, Л. Н. Маскаева a, b, *, В. Ф. Марков a, b, А. В. Бельцева a, А. А. Урицкая a
a Уральский федеральный университет имени первого Президента России Б.Н. Ельцина
Екатеринбург, Россия
b Уральский институт ГПС МЧС России
Екатеринбург, Россия
* E-mail: mln@ural.ru
Поступила в редакцию 03.03.2020
После доработки 25.03.2020
Принята к публикации 14.04.2020
Аннотация
Систематизированы и критически проанализированы данные о кинетике и механизме образования твердой фазы при гидрохимическом осаждении пленок селенида свинца в присутствии ингибиторов окисления селеномочевины (сульфита натрия, аскорбиновой кислоты, хлорида олова). Показано, что эффективные константы скорости превращения соли свинца в селенид и толщина пленок PbSe зависят от природы и концентрации ингибирующих добавок. Методом динамического рассеяния света изучено влияние природы ингибиторов на механизм зародышеобразования. Обосновано более значительное ингибирующее действие на процесс окисления селеномочевины одновременного присутствия в реакционной смеси сульфита натрия и аскорбиновой кислоты.
Тонкопленочный селенид свинца PbSe, обладая комплексом уникальных полупроводниковых, оптических и электрофизических свойств, является одним из востребованных функциональных материалов современной инфракрасной техники. Он – один из наиболее чувствительных материалов для среднего инфракрасного диапазона спектра (3–5 мкм) обеспечивает создание эффективных фотоприемных устройств для тепловидения, приборов контроля технологических процессов в металлургии, металлообработке и машиностроении [1–3]. Большие потенциальные возможности этого материала при создании преобразователей солнечного излучения [4, 5], квантовых точек [6], термоэлементов [7]. Этому способствует метод гидрохимического осаждения – технологически простой и менее энергоемкий с возможностью эффективного контроля состава, морфологии пленок и гибкого регулирования их электрофизических свойств [8, 9]. В основе гидрохимического осаждения пленок PbSe лежит химическая реакция между солью металла и халькогенизатором – веществом, способным при своем разложении поставлять в раствор селенсодержащие ионы. В качестве халькогенизатора наиболее широко используют селеномочевину (селеноамид угольной кислоты N2H4CSe) [10, 11]. Процесс осаждения селенида металла, по данным многочисленных исследований [10, 12–14], реализуется через коллоидно-химическую стадию и представляет собой совокупность топохимических автокаталитических реакций, механизм которых не до конца ясен. Представления о механизме взаимодействия селеномочевины с солью свинца на начальной стадии процесса, по мнению различных авторов, можно свести к следующим утверждениям:
− пленка PbSe образуется в результате непосредственного взаимодействия ионов металла с селенид-ионами;
− при взаимодействии халькогенизатора с образовавшимся на подложке гидроксидом свинца;
− разложение промежуточного реакционного комплекса селеномочевины со свинцом [10, 12, 14].
Дальнейшее формирование твердой фазы на подложке происходит, как в результате непосредственного взаимодействия ионных и молекулярных форм свинца и селена, так и путем адсорбции первичных частиц твердой фазы из объема реакционной смеси [10, 11, 14, 15]. Однако бесспорные доказательства в пользу той или иной гипотезы в настоящее время отсутствуют.
В работах, выполненных сотрудниками Уральского федерального университета ранее, была рассмотрена кинетическая сторона протекающих при гидрохимическом синтезе PbSe процессов [16, 17]. Так, было показано, что процесс идет в кинетической области, а реакция имеет первый порядок по селеномочевине и гидроксид-иону. При синтезе PbSe в цитратно-аммиачной системе [17] установленные отрицательные частные порядки по цитрату и сульфиту натрия демонстрируют в целом ингибирующее действие этих реагентов на процесс.
Особенность селеномочевины – ее высокая склонность к окислению кислородом воздуха в водных растворах с выделением высокодисперсного золя элементарного селена, который оказывает влияние не только на зарождение и кинетику осаждения селенида свинца, но на воспроизводимость электрофизических свойств пленки за счет неконтролируемого внедрения в нее селена. В связи с этим возникает острая необходимость в антиокислительной стабилизации селеномочевины. В литературе сведения по этому вопросу практически отсутствуют.
Наиболее широко в качестве ингибитора окисления селеномочевины применяется сульфит натрия [2, 15, 18, 19]. Ранее [19] нами при сравнительных спектрофотометрических исследованиях была изучена устойчивость водных растворов селеномочевины к окислению кислородом воздуха при введении в реакционную смесь таких ингибиторов процесса как сульфит натрия, аскорбиновая кислота, хлорид олова (II). Методом атомно-силовой микроскопии было показано влияние аскорбиновой кислоты на механизм роста тонких пленок PbSe [19], установлено повышение фотоотклика осажденных пленок PbSe при снижении температуры их отжига при термосенсибилизации [20].
Однако, несмотря на проведенные исследования, остается открытым вопрос о механизме зародышеобразования и кинетике формирования твердой фазы селенида свинца в присутствии как широко используемых, так и новых перспективных антиоксидантов. В связи с этим целью работы были изучение и анализ кинетических особенностей и механизма зарождения твердой фазы при гидрохимическом осаждении селеномочевиной пленок PbSe в присутствии ингибиторов ее окисления различной природы.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектом исследования гидрохимического осаждения твердой фазы PbSe служила реакционная смесь, содержащая ацетат свинца Pb(СН3СОО)2 (0.085 моль/л), этилендиамин H2NCH2CH2NH2 (0.19 моль/л), ацетат аммония NH4СН3СОО (1.72 моль/л), селеномочевину N2H4CSe (0.05 моль/л) [20], а также добавки от 0.0001 до 0.005 моль/л ингибиторов (сульфита натрия Na2SO3, аскорбиновой кислоты С6Н8О6, хлорида олова SnCl2, смеси Na2SO3 + С6Н8О6). Концентрацию соли свинца в реакционной смеси контролировали методом обратного трилонометрического титрования [21].
Осаждение пленок PbSe проводили на предварительно обезжиренные ситалловые пластины марки СТ-50-1 размером 30 × 24 мм. Подложки до обезжиривания кратковременно (5 с) обрабатывали в разбавленном растворе (1 : 20) фтороводородной кислоты. Реакторы помещали в термостат марки “ТС-ТБ-10”, точность поддержания температуры в котором составляла ±0.1 K.
Размер коллоидных частиц селенида свинца в растворе в процессе синтеза определяли методом динамического рассеяния света при помощи анализатора Photocor Compact. Обработку результатов измерений проводили с использованием программы DynaLS 2.8.3. Толщину осажденных пленок оценивали с использованием микроинтерферометра Линника МИИ-4М, точность измерения составляла ±10%. Исследование структурно-морфологических характеристик осаждаемых пленок PbSe проводили методом растровой электронной микроскопии с использованием микроскопа MIRA 3 LMU при ускоряющем напряжении электронного пучка 10 кВ.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Процесс образования селенида свинца при коллоидно-химическом осаждении включает ряд стадий: формирование и диссоциацию комплексного соединения металла PbL$_{x}^{{2 + }}$; гидролитическое разложение селеномочевины с образованием селенид-ионов Se2–, взаимодействие прекурсорных ионов Pb2+ и Se2–. Суммарный процесс можно описать реакцией:
(1)
$\begin{gathered} {\text{PbL}}_{x}^{{2 + }} + {{{\text{N}}}_{2}}{{{\text{H}}}_{4}}{\text{CSe}} + 4{\text{O}}{{{\text{H}}}^{ - }} = \\ = {\text{PbSe}}{\kern 1pt} \downarrow + \;x{\text{L}} + {\text{CN}}_{2}^{{2 - }} + 4{{{\text{H}}}_{2}}{\text{O}}.{\text{\;}} \\ \end{gathered} $Рис. 1.
Кинетические кривые превращения соли свинца в селенид в присутствии Na2SO3, моль/л: 0.0005 (1), 0.001 (2), 0.005 (3). Температура 308 K.
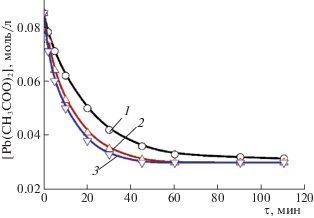
Образование твердой фазы PbSe в реакционной смеси происходило в условиях самопроизвольного зарождения и соответственно изменения во времени удельной поверхности. В связи с этим для обработки кинетических кривых было использовано уравнение для скорости реакции, в котором площадь поверхности твердой фазы селенида свинца была учтена (в предположении, что поверхность частиц изменяется пропорционально объему в степени 2/3 [23]).
Рассчитанные значения эффективных констант скоростей превращения соли свинца в селенид при 308 K в присутствии различных ингибиторов приведены в [24]. Анализ этих данных показывает, что эффективная константа скорости превращения k с повышением содержания Na2SO3 в реакторе от 0.0005 до 0.005 моль/л изменяется в пределах 2.56 × 10–3–4.24 × 10–3 с–1, а при введении тех же концентраций SnCl2 возрастает в ∼1.6 раза: от 1.55 × 10–3 до 2.46 × 10–3 с–1. В присутствии 0.0005–0.005 моль/л аскорбиновой кислоты константа слабо зависит от ее содержания в растворе и составляет 2.99 × 10–3–2.72 × 10–3 с–1. Добавление в реакционную смесь помимо 0.0001 моль/л С6Н8О6 еще и 0.001 моль/л Na2SO3 приводит к снижению эффективной константы скорости процесса до (1.50–1.17) × 10–3 с–1, т.е. в ∼2.0–2.3 раза.
Таким образом, для предотвращения окисления селеномочевины более эффективным, требующим более низких концентраций ингибитора, является одновременное присутствие в реакционной смеси аскорбиновой кислоты (0.0001 моль/л) и сульфита натрия (0.001 моль/л). Аналогичное ингибирование процесса обеспечивается также при более высоких концентрациях SnCl2 (до 0.005 моль/л).
На рис. 2 показана кинетика роста пленок PbSe в присутствии 0.001 моль/л исследуемых ингибиторов. Видно, что при введении Na2SO3 скорость наращивания слоя на начальной стадии процесса (до 20 мин) составляет ∼0.18 нм/с, для смеси Na2SO3 + С6Н8О6 ∼ 0.16 нм/с, для С6Н8О6 ∼ ∼ 0.12 нм/с и для SnCl2 ∼ 0.06 нм/с. Таким образом, наибольшей скоростью роста обладают слои, осаждаемые в присутствии Na2SO3 и смеси Na2SO3 + С6Н8О6. В результате гидролиза сульфита натрия в растворе появляются дополнительные OH–-ионы, участвующие в образовании коллоидных частиц Pb(OH)2, играющих роль первичных зародышей и центров нуклеации фазы PbSe как в объеме раствора, так и на поверхности ситалловой подложки [14]. При этом увеличение толщины пленки PbSe происходит за счет как селенизации адсорбированных на подложке частиц Pb(OH)2, так и кластерных структур, образующихся при взаимодействии частиц гидроксида свинца с селеномочевиной в объеме раствора. Более низкие скорости роста пленки селенида свинца в присутствии С6Н8О6 и SnCl2 связаны, как уже отмечалось выше, с понижением рН реакционной смеси.
Рис. 2.
Кинетика роста пленки PbSe в присутствии 0.001 моль/л Na2SO3 (1), смеси Na2SO3 + С6Н8О6 (2), С6Н8О6 (3) и SnCl2 (4).
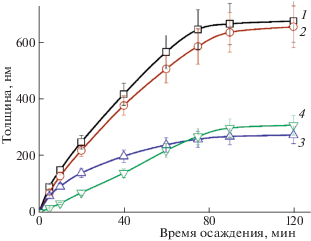
За 120 минут осаждения в присутствии Na2SO3 и смеси Na2SO3 + С6Н8О6 толщина пленки PbSe достигает ∼680 нм. Толщина слоев селенида свинца, осаждаемых в присутствии С6Н8О6 и SnCl2, не превышает соответственно 275 и 300 нм.
Электронно-микроскопические изображения пленок PbSe наглядно демонстрируют влияние природы ингибитора на их морфологию и размеры кристаллитов (рис. 3). Пленку PbSe, осажденную в присутствии аскорбиновой кислоты, формируют преимущественно кристаллиты размером от 100 до 300 нм (рис. 3а). Из зерен размером ∼80–200 нм, имеющих форму усеченных пирамидок, идет образование пленки PbSe из раствора с добавкой Na2SO3 (рис. 3б). При совместном присутствии в реакторе Na2SO3 и С6Н8О6 процесс формирования пленки замедляется, в результате усеченные пирамидки превращаются в близкие по размеру хорошо ограненные параллелепипеды (рис. 3в). Рыхлая структура пленки, сформированной из неоднородных зерен сфероподобной и эллипсоидной формы с размерами 300–400 нм, характерна для слоя PbSe, полученного в присутствии SnCl2 (рис. 3г). При этом наблюдаемые зерна при ближайшем рассмотрении состоят из множества более мелких наноразмерных частиц пластинчатой и шарообразной формы (≥60–90 нм). Формирование подобной микроструктуры связано, вероятно, с тем, что в щелочной среде олово(II) гидролизуется с образованием полиядерных гидроксокомплексов, обладающих разветвленной структурой и способствующей созданию множественных центров зародышеобразования.
Рис. 3.
Электронно-микроскопические изображения пленок PbSe, синтезированных при 308 K в присутствии 0.001 моль/л С6Н8О6 (а); 0.001 моль/л Na2SO3 (б); 0.001 моль/л и 0.0001 моль/л Na2SO3 + С6Н8О6 соответственно (в); 0.001 моль/л SnCl2 (г).

Важную информацию для выяснения особенностей зарождения и роста пленок PbSe в присутствии исследуемых ингибиторов дает оценка распределения коллоидных частиц в реакционной смеси по размерам и их концентрации. Определение размеров частиц PbSe и их количества на начальной стадии процесса синтеза проводили методом динамического рассеивания света. Полученные результаты в виде функции распределения частиц по размерам при осаждении PbSe в присутствии ингибитора окисления селеномочевины (на примере Na2SO3) через 15, 30, 60 с от начала процесса показаны на рис. 4. Установлено, что к 15-й секунде осаждения наблюдается уже достаточно широкий диапазон частиц по размерам (от 60 до 500 нм) при среднем их диаметре 192 нм. С 30-й секунды в растворе четко выделяются две преобладающие фракции: нанодисперсная со средним размером 6 нм и значительно более крупные агломераты размером от 50 до 800 нм. Присутствие наноразмерных частиц к 30-й и 60-й секундам синтеза (∼46 нм) свидетельствует о параллельно протекающих процессах зародышеобразования и роста фазы PbSe. Возможный механизм зародышеобразования селенида PbSe на подложке и в объеме реакционной смеси в присутствии Na2SO3 проиллюстрирован на рис. 4б.
Рис. 4.
Распределение коллоидных частиц в реакционной смеси при коллоидно-химическом осаждении PbSe спустя 15, 30 и 60 с от начала процесса в присутствии Na2SO3 (а), а также схема формирования пленки PbSe на поверхности ситалловой подложки (б).
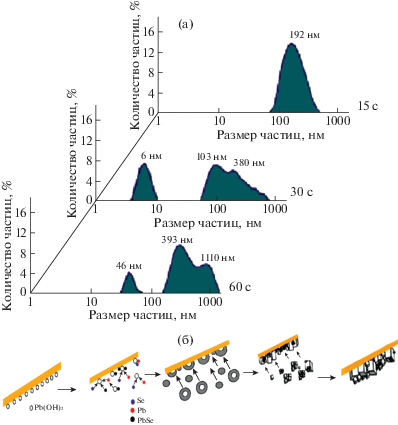
Основное отличие зародышеобразования PbSe в присутствии аскорбиновой кислоты – меньшее количество коллоидных частиц гидроксида металла в реакционной смеси, чем при добавке Na2SO3. В результате к 15-й секунде до 40% частиц имеют размеры 6–10 нм, к 30-й секунде их становится ∼1% при увеличении до 15% частиц со средним размером 130 нм. Спустя 60 с диапазон размеров частиц, находящихся в растворе, расширяется от 50 до 1000 нм.
При совместном применении двух антиоксидантов (0.001 моль/л Na2SO3 и 0.0001 моль/л С6Н8О6) за счет снижения скорости гидролитического разложения селеномочевины замедляется образование в реакционной смеси Se2–-ионов. В результате на начальном этапе процесса преобладают наночастицы размером ∼2 нм, т.е. используемая смесь ингибиторов повышает устойчивость коллоидного раствора. К 30 с размеры наночастиц увеличиваются до 200–550 нм. Описанная ситуация приводит к формированию пленки PbSe с достаточно однородной микроструктурой (рис. 3в).
При введении в реакционную ванну SnCl2 наблюдается увеличение индукционного периода до 30 с. К этому моменту отмечается образование наночастиц размером от 1 до 12 нм. К окончанию первой минуты процесса в растворе преобладают две фракции: наноразмерные частицы ∼7 нм (∼3%) и укрупненные до 120 нм агрегаты, доля которых составляет ∼20%. Толщина осажденных пленок PbSe в этом случае примерно вдвое меньше, что указывает на изменение механизма их формирования. В случае добавки в щелочную реакционную смесь соли олова(II) за счет интенсивного гидролиза последней происходит образование моно- и полиядерных гидроксокомплексов [25] и труднорастворимых основных солей типа SnOHCl [26, 27]. Кроме того, известно о возможности формирования труднорастворимого координационного соединения SnCl2-C(NH2)2Se [28, 29], сведения об устойчивости которого отсутствуют. В работе [30] при смешении водных растворов селеномочевины с хлоридом олова (II) состав образовавшегося желтого осадка был идентифицирован как SnCl2 · 2C(NH2)2Se. Гидроксо- и полиядерные комплексы, малорастворимые соединения олова, а также образующиеся частицы Sn(СМ)2(ОН)$_{n}^{{2 - n}}$ могут выступать активными центрами нуклеации, увеличивая концентрацию первичных частиц. В итоге, по данным динамического рассеивания света, в реакционной смеси на протяжении 60 с наблюдается присутствие двух основных разновидностей частиц: ∼10 и более 200 нм. За счет снижения пересыщения в системе концентрация наночастиц постепенно снижается, а крупные частицы, агрегируя и образуя блоки, формируют рыхлую и достаточно однородную структуру пленки PbSe.
Проведенные исследования показали, что основное влияние на процесс синтеза селенида свинца вводимые ингибиторы окисления селеномочевины оказывают на стадии зародышеобразования, преимущественно в течение первой минуты осаждения. На этом этапе определяется и преимущественная форма и ориентация частиц.
Таким образом, природа присутствующего в реакционном растворе ингибитора окисления селеномочевины оказывает существенное влияние как на кинетику процесса превращения соли свинца в селенид, так и на механизм формирования твердой фазы и как следствие на морфологию осаждаемого слоя PbSe. Связано это, в первую очередь, с различным поведением ингибитора по отношению к халькогенизатору, влияющего на скорость высвобождения Se2–-ионов. Вводимые в реакционную смесь добавки могут способствовать дополнительному образованию коллоидных частиц в системе преимущественно гидроксидной природы, способствующих зарождению твердой фазы селенида свинца, как в объеме реактора, так и на поверхности подложки. Результаты данной работы необходимо принимать во внимание при получении высокофункциональных слоев селенидов металлов с воспроизводимыми свойствами.
Работа выполнена при финансовой поддержке программы 211 Правительства Российской Федерации № 02.А03.21.0006 и Российского фонда фундаментальных исследований (код проекта № 20-48-660041).
Список литературы
Бараночников М.Л. Приемники и детекторы излучений. Справочник. М.: ДМК Пресс, 2017. 141 с.
Jang M.-H., Litwin P.M., Yoo S.-S. et al. // J. Appl. Phys. 2019. V. 126. P. 105701. https://doi.org/10.1063/1.5114923
Lee H., Oh C., Hahn J.W. // Infrared Phys. Technol. 2013. V. 57. P. 50. https://doi.org/10.1016/j.infrared.2012.12.015
Sun X., Gao K., Pang X., Yang H. et al. // Thin solid films. 2015. V. 592. P. 59. https://doi.org/10.1016/j.tsf.2015.09.009
Selvakumar D., Vasudevan R., Jayavel R. // Materials Today: Proceedings. 2018. V. 5. P. 14468. https://doi.org/10.1016/j.matpr.2018.03.033
Kershaw S.V., Susha A.S., Rogach A.L. // Chem. Soc. Rev. 2013. V. 42. P. 3033. https://doi.org/10.1039/C2CS35331H
Wei T.-R., Wu C.-F., Li F., Li J.-F. // J. Materiomics. 2018. V. 4. N 4. P. 304. https://doi.org/10.1016/j.jmat.2018.07.001
Dobson K.D., Hodes G., Mastai Y. // Sol. Energy Mater. Sol. Cells. 2003. V. 80. № 3. P. 283. doi.org/https://doi.org/10.1016/j.solmat.2003.06.007
Mane R.S., Lokhande C.D. // Mat. Chem. Phys. 2000. V. 65. № 1. P. 1. https://doi. org/https://doi.org/10.1016/s0254-0584(00)00217-0
Hodes G. // Phys. Chem. Chem. Phys. 2007. V. 9. P. 2181. https://doi.org/10.1039/b616684a
Катышева А.С., Марков В.Ф., Маскаева Л.Н. // Журн. неорган. химии. 2013. Т. 58. № 7. С. 940. https://doi.org/10.1134/S0036023613070127
Лундин А.Б., Китаев Г.А. // Неорган. материалы. 1965. Т. 1. № 12. С. 2102.
Китаев Г.А., Лундин А.Б., Мокрушин С.Г. // Изв. вузов СССР. Химия и хим. технология. 1966. № 4. С. 574.
Марков В.Ф., Маскаева Л.Н. // Изв. АН. Сер. хим. 2014. № 7. С. 1523. https://doi.org/10.1007/s11172-014-0630-7
Suh Y., Suh S.-H., Lee S.Y., Kim G.-H. // Thin Solid Films. 2017. V. 628. P. 148. https://doi.org/10.1016/j.tsf.2017.03.026
Лундин А.Б., Китаев Г.А. // Неорган. материалы. 1965. Т. 1. № 12. С. 2107.
Третьякова Н.А., Марков В.Ф., Маскаева Л.Н., Мухамедзянов Х.Н. // Конденсированные среды и межфазные границы. 2005. Т. 7. № 2. С. 189.
Smirnova Z.I., Maskaeva L.N., Markov V.F. et al. // J. Mater. Sci. & Technol. 2015. V. 31. P. 790. https://doi.org/10.1016/j.jmst.2015.06.003
Юрк В.М., Маскаева Л.Н., Марков В.Ф., Бамбуров В.Г. // Журн. прикл. химии. 2019. Т. 93. № 3. С. 128.
Маскаева Л.Н., Марков В.Ф., Смирнова З.И. и др. Способ получения фоточувствительных химически осажденных пленок селенида свинца: Патент РФ № 2617360. Бюл. № 29. 7 с. 19.10.2018
Шварценбах Г., Флашка Г. Комплексонометрическое титрование. М.: Химия. 1970. 360 с.
Дельмон Б. Кинетика гетерогенных реакций. М.: Мир, 1972. 554 с.
Туленин С.С., Маскаева Л.Н., Марков В.Ф. // Журн. общ. химии. 2016. Т. 86. № 8. С. 1252.
Юрк В.М. Гидрохимическое осаждение высокофункциональных пленок селенида свинца селеномочевиной с использованием различных антиоксидантов: Дис. … канд. хим. наук. Екатеринбург: ФГАОУ ВО “Уральский федеральный университет имени первого Президента России Б.Н. Ельцина”, 2019. 184 с.
Маскаева Л.Н., Федорова Е.А., Юсупов Р.А., Марков В.Ф. // Журн. физ. химии. 2018. Т. 92. № 5. С. 831.
Спиваковский В.Б. Аналитическая химия олова. М.: Наука, 1975. 252 с.
Pettine M., Cigala R.M., Crea F., De Stefano C. et al. // Cosmochimica Acta. 2012. V. 87. P. 1.
Федоров В.Е., Тырышкина О.Г., Хлыстунова Э.В // Изв. АН. Сер. хим. 1973. № 1. С. 262.
Varand V.L., Shul’man V.M., Khlystunova E.V. // Izvestiya Akademii Nauk SSSR, Seriya Khimicheskaya. 1971. V. 7. P. 1556.
Cheremisina I.M., Khlystunova E.V., Varand V.L. // Ibid. 1972. V. 12. P. 2672.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


