Журнал физической химии, 2020, T. 94, № 2, стр. 163-170
Теплоемкость твердых растворов LaLnZr2O7 (Ln = Sm, Gd, Dy) со структурой пирохлора в интервале температур 10–1400 K
В. Н. Гуськов a, *, П. Г. Гагарин a, А. В. Тюрин a, А. В. Хорошилов a, А. В. Гуськов a, К. С. Гавричев a
a Российская академия наук, Институт общей и неорганической химии им. Н.С. Курнакова
119991 Москва, Россия
* E-mail: guskov@igic.ras.ru
Поступила в редакцию 03.05.2019
После доработки 03.05.2019
Принята к публикации 14.05.2019
Аннотация
Методами адиабатической и дифференциальной сканирующей калориметрии измерена изобарная теплоемкость твердых растворов со структурой пирохлора LaLnZr2O7 (Ln = Sm, Gd, Dy) в интервале температур 10–1400 K и рассчитаны термодинамические функции – энтропия, приращение энтальпии и приведенная энергия Гиббса без учета магнитных превращений ниже 10 K.
Цирконаты легких лантаноидов общей формулой Ln2Zr2O7 (Ln = La–Gd) характеризуются максимальными температурами существования ~2300–2600 K, отсутствием структурных превращений, высокими химической, радиационной стойкостью и термической стабильностью, относительно низкой теплопроводностью и минимальным давлением паров [1, 2]. Эти качества определяют перспективу практического использования цирконатов лантаноидов как твердых электролитов [3], материалов атомной промышленности и катализаторов [4, 5], а также термобарьерных покрытий для энергетических установок [6, 7].
В ряду пирохлоров Ln2Zr2O7 (Ln = La–Gd) основные физико-химические параметры (параметры решетки, коэффициенты термического расширения, теплопроводность и т.д.) изменяются дискретно. Изучение взаимных твердых растворов пирохлоров лантаноидов позволит получать материалы с заданными физико-химическими характеристиками вариацией содержания компонентов для плавного регулирования целевых параметров [8–10]. Например, при нанесении пленок особое значение имеет кратное или полное совпадение параметров кристаллических решеток, а в случае высокотемпературного использования слоистых структур – совпадение коэффициентов термического расширения материала подложки и покрытия. Необходимо отметить также, что введение лантана в состав флюоритов Ln2O3 ⋅ 2ZrO2 (Ln = Dy–Lu) позволяет продолжить структурный ряд пирохлоров. Так, в [11] показано, что непрерывный ряд твердых растворов La2 –xLuxZr2O7 имеет структуру пирохлора при х = = 0.0–1.2.
Изучение термодинамических свойств этих веществ имеет первостепенное значение для прогнозирования их поведения при практическом использовании, особенно при высоких температурах и в контакте с материалами подложки и агрессивными жидкими и газовыми средами.
Цель настоящей работы – определение теплоемкости твердых растворов пирохлоров LaLnZr2O7 (Ln = Sm, Gd, Dy) в широком интервале температур (10–1400 K), расчет энтропии, приращения энтальпии и приведенной энергии Гиббса без учета низкотемпературных (<10 K) магнитных превращений.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Образцы цирконата лантана и твердых растворов двойных цирконатов лантаноидов LaLnZr2O7 (Ln = Sm, Gd, Dy) готовили методом “обратного” осаждения, подробно описанным в нашей работе [12]. Для этого оксиды лантаноидов Ln2O3 (99.99%) растворяли в соляной кислоте, а источником циркония служил оксохлорид циркония ZrOCl2 ⋅ 8H2O (99.9%). Исходные реагенты закупали в ООО “Ланхит”. Водные растворы компонентов, взятые в стехиометрических соотношениях, осаждали в водном растворе аммиака. Окончательный отжиг полученных осадков проводили при температуре 1500–1550°С в течение 4 ч для синтеза пирохлоров и образования кристаллов нормального размера (>100 нм), чтобы избежать влияния наноразмерности на термодинамические свойства. Условия отжига определены опытным путем в наших предыдущих работах [13–15]. Дифракционные исследования образцов проводили порошковым дифрактометром Bruker D 8 Advance (CuKα1-излучение, λ = 1.5406 Å, детектор LYNXEYE с Ni-фильтром). Дифрактограммы обрабатывали программой Bruker EVA с использованием базы данных ICDD PDF. Уточнение параметров элементарных ячеек было выполнено методом полного профильного анализа с применением программы TOPAS. Электронно-микроскопические исследования морфологии образцов и анализ рентгено-электронных спектров для подтверждения их химического состава осуществляли электронным микроскопом Cross Beam Zeiss NVision 40 и полевым эмиссионным растровым электронным микроскопом JSM-6700F с приставкой для энергодисперсионной спектрометрии JED-2300F фирмы JEOL (ЦКП “Материаловедение и металлургия” НИТУ МИСИС (Технологический университет)).
Теплоемкость в интервале 10–340 K измеряли автоматическим низкотемпературным калориметром БКТ-3. Более подробное описание прибора и условий измерений приведено в работе [12]. Масса измеряемых образцов составляла ~ 1–2 г. Молекулярные массы рассчитывали с использованием атомных масс [16]. Экспериментальные данные сглаживали полиномом высокой степени по алгоритму [17].
Получение температурных зависимостей теплоемкости в интервале ~ 330–1350 K осуществляли по стандартной методике на установке синхронного термического анализа STA 449 F1 Jupiter Netzsch. Измерения проводили как в динамическом режиме, так и в изотермических условиях при программируемом изменении температуры оболочки (нагревателя) в атмосфере аргона.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Для проведения калориметрических исследований синтезированы образцы цирконата лантана и двойных цирконатов LaLnZr2O7 (Ln = Sm, Gd, Dy), кристаллическая структура которых и отсутствие посторонних фаз подтверждены рентгенофазовым анализом (РФА). Соотношение металлов 1:1:2 в образцах подтверждено анализом рентгено-электронных спектров. Полученные образцы имели структурный тип пирохлора (Fd3m) и параметры кубических решеток, которые содержатся в табл. 1. В табл. 1 для сравнения приведены также параметры соответствующих простых цирконатов из базы ICDD и наших исследований [18]. Так как в базе ICDD отсутствуют данные для двойных цирконатов, для сравнения параметров кристаллических решеток в табл. 1 приведены полусуммы a = 1/2[a(La2Zr2O7) + + a(Ln2Zr2O7)] решеток цирконатов лантана и соответствующего простого лантаноида (Ln = Sm, Gd) [18–21], а для LaDyZr2O7 взят удвоенный параметр а флюоритной решетки (Fm3m) твердого раствора Dy2O3 ⋅ 2ZrO2 [22]. Как видно из табл. 1, в том случае, если структурный тип двойного и исходных простых цирконатов одинаков, то параметр а двойного цирконата практически соответствует полусумме параметров простых цирконатов. Заметные отличия появляются, если исходные структурные типы различны (пирохлор и флюорит), как это происходит в случае LaDyZr2O7.
Таблица 1.
Параметры кристаллических решеток синтезированных образцов и литературные данные (I)
Отсутствие примесей в полученных соединениях показано анализом рентгеноэлектронных спектров, а контроль размера частиц – сканирующей электронной микроскопией и обработкой по Шереру дифракционных рефлексов. Все образцы характеризуются размерами кристаллитов >100 нм, которые не влияют на величины термодинамических функций и пригодны для их измерений.
Теплоемкость охарактеризованных образцов измерена методами адиабатической (5–340 K) и дифференциальной сканирующей калориметрии (330–1400 K). Сглаженные значения низкотемпературной (10–340 K) теплоемкости и термодинамические функции пирохлоров LaLnZr2O7 приведены в табл. 2–5. Высокотемпературные (330–1400 K) значения теплоемкости представлены в виде уравнений Майера–Келли [23, 24], коэффициенты которых приведены в табл. 6. В табл. 7 содержатся стандартные термодинамические свойства при 298.15 K и расчетные значения теплоемкости по полусуммам теплоемкостей компонентов, взятых из работы [18]. Как и при сравнении параметров кристаллических решеток, наблюдается хорошее совпадение экспериментальной и расчетной теплоемкостей при 298.15 K в случае, если имеется совпадение структурных типов двойных и простых цирконатов. Температурные зависимости теплоемкостей всех соединений представляют собой гладкие S-образные кривые, что свидетельствует об отсутствии структурных превращений во всем температурном интервале.
Таблица 2.
Температурные зависимости изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для La2Zr2O7, М = 572.25474 г/моль [16]
| Т, K | $C_{{\text{p}}}^{^\circ }$(T) | S°(T) | Ф°(Т) | Н°(Т) – Н°(0) |
|---|---|---|---|---|
| Дж/(K моль) | Дж/моль | |||
| 10 | 0.3665 | 0.04319 | 0.01079 | 0.3240 |
| 15 | 1.705 | 0.3510 | 0.05890 | 4.382 |
| 20 | 4.490 | 1.196 | 0.2260 | 19.40 |
| 25 | 8.305 | 2.590 | 0.5505 | 51.00 |
| 30 | 12.96 | 4.505 | 1.043 | 103.9 |
| 35 | 18.27 | 6.894 | 1.703 | 181.7 |
| 40 | 24.05 | 9.708 | 2.524 | 287.4 |
| 45 | 30.12 | 12.89 | 3.495 | 422.7 |
| 50 | 36.29 | 16.38 | 4.607 | 588.7 |
| 60 | 48.76 | 24.10 | 7.200 | 1014 |
| 70 | 61.21 | 32.55 | 10.21 | 1564 |
| 80 | 73.42 | 41.52 | 13.56 | 2237 |
| 90 | 85.24 | 50.86 | 17.18 | 3031 |
| 100 | 96.61 | 60.43 | 21.03 | 3941 |
| 110 | 107.5 | 70.16 | 25.05 | 4962 |
| 120 | 117.9 | 79.96 | 29.22 | 6089 |
| 130 | 127.7 | 89.79 | 33.50 | 7318 |
| 140 | 137.0 | 99.60 | 37.87 | 8642 |
| 150 | 145.7 | 109.3 | 42.31 | 10 060 |
| 160 | 153.7 | 119.0 | 46.80 | 11 550 |
| 170 | 161.2 | 128.6 | 51.33 | 13 130 |
| 180 | 168.3 | 138.0 | 55.88 | 14 780 |
| 190 | 174.8 | 147.3 | 60.45 | 16 490 |
| 200 | 181.0 | 156.4 | 65.02 | 18 270 |
| 210 | 186.8 | 165.3 | 69.58 | 20 110 |
| 220 | 192.4 | 174.2 | 74.14 | 22 010 |
| 230 | 197.7 | 182.8 | 78.68 | 23 960 |
| 240 | 202.6 | 191.4 | 83.19 | 25 960 |
| 250 | 206.5 | 199.7 | 87.69 | 28 010 |
| 260 | 210.1 | 207.9 | 92.15 | 30 090 |
| 270 | 213.8 | 215.9 | 96.59 | 32 210 |
| 280 | 217.4 | 223.7 | 101.0 | 34 360 |
| 290 | 220.7 | 231.4 | 105.4 | 36 550 |
| 300 | 223.7 | 238.9 | 109.7 | 38 780 |
| 310 | 226.5 | 246.3 | 114.0 | 41 030 |
| 320 | 228.9 | 253.5 | 118.2 | 43 310 |
| 330 | 231.2 | 260.6 | 122.4 | 45 610 |
| 340 | 233.2 | 267.6 | 126.6 | 47 930 |
Таблица 3.
Температурные зависимости изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для LaSmZr2O7, М = 583.7093 г/моль [16]
| Т, K | $C_{{\text{p}}}^{^\circ }$(T) | S°(T) | Ф°(Т) | Н°(Т) – Н°(0) |
|---|---|---|---|---|
| Дж/(K моль) | Дж/моль | |||
| 10 | 0.5307 | 0.2423 | 0.07519 | 1.671 |
| 15 | 2.378 | 0.7505 | 0.2007 | 8.246 |
| 20 | 5.749 | 1.863 | 0.4638 | 27.99 |
| 25 | 10.35 | 3.620 | 0.9089 | 67.78 |
| 30 | 15.88 | 5.984 | 1.550 | 133.0 |
| 35 | 22.04 | 8.888 | 2.385 | 227.6 |
| 40 | 28.55 | 12.25 | 3.404 | 354.0 |
| 45 | 35.11 | 16.00 | 4.592 | 513.2 |
| 50 | 41.57 | 20.03 | 5.932 | 704.9 |
| 60 | 54.21 | 28.73 | 8.997 | 1184 |
| 70 | 66.43 | 38.01 | 12.47 | 1788 |
| 80 | 78.23 | 47.66 | 16.27 | 2511 |
| 90 | 89.59 | 57.53 | 20.30 | 3351 |
| 100 | 100.5 | 67.54 | 24.52 | 4302 |
| 110 | 111.1 | 77.62 | 28.89 | 5360 |
| 120 | 121.2 | 87.72 | 33.37 | 6522 |
| 130 | 130.8 | 97.80 | 37.94 | 7782 |
| 140 | 139.9 | 107.8 | 42.58 | 9136 |
| 150 | 148.4 | 117.8 | 47.26 | 10 580 |
| 160 | 156.3 | 127.6 | 51.97 | 12 100 |
| 170 | 163.6 | 137.3 | 56.71 | 13 700 |
| 180 | 170.4 | 146.8 | 61.45 | 15 370 |
| 190 | 176.7 | 156.2 | 66.19 | 17 110 |
| 200 | 182.5 | 165.4 | 70.93 | 18 900 |
| 210 | 188.0 | 174.5 | 75.64 | 20 760 |
| 220 | 193.1 | 183.3 | 80.34 | 22 660 |
| 230 | 197.9 | 192.0 | 85.01 | 24 620 |
| 240 | 202.5 | 200.6 | 89.64 | 26 620 |
| 250 | 206.7 | 208.9 | 94.25 | 28 670 |
| 260 | 210.8 | 217.1 | 98.82 | 30 750 |
| 270 | 214.6 | 225.1 | 103.3 | 32 880 |
| 280 | 218.3 | 233.0 | 107.8 | 35 050 |
| 290 | 221.8 | 240.7 | 112.3 | 37 250 |
| 300 | 225.2 | 248.3 | 116.7 | 39 480 |
| 310 | 228.5 | 255.7 | 121.1 | 41 750 |
| 320 | 231.8 | 263.0 | 125.4 | 44 050 |
| 330 | 234.9 | 270.2 | 129.7 | 46 390 |
| 340 | 238.1 | 277.3 | 133.9 | 48 750 |
Таблица 4.
Температурные зависимости изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для LaGdZr2O7, М = = 590.3464 г/моль [16]
| Т, K | $C_{{\text{p}}}^{^\circ }$(T) | S°(T) | Ф°(Т) | Н°(Т) – Н°(0) |
|---|---|---|---|---|
| Дж/(K моль) | Дж/моль | |||
| 10 | 1.668 | 0.5598 | 0.1400 | 4.198 |
| 15 | 3.353 | 1.513 | 0.4307 | 16.24 |
| 20 | 6.188 | 2.841 | 0.8582 | 39.65 |
| 25 | 9.993 | 4.614 | 1.424 | 79.73 |
| 30 | 14.59 | 6.832 | 2.135 | 140.9 |
| 35 | 19.81 | 9.466 | 2.989 | 226.7 |
| 40 | 25.46 | 12.48 | 3.983 | 339.7 |
| 45 | 31.38 | 15.82 | 5.110 | 481.8 |
| 50 | 37.38 | 19.43 | 6.359 | 653.7 |
| 60 | 49.27 | 27.30 | 9.184 | 1087 |
| 70 | 60.97 | 35.78 | 12.37 | 1639 |
| 80 | 72.47 | 44.67 | 15.85 | 2306 |
| 90 | 83.73 | 53.86 | 19.56 | 3087 |
| 100 | 94.73 | 63.26 | 23.46 | 3980 |
| 110 | 105.4 | 72.79 | 27.51 | 4980 |
| 120 | 115.6 | 82.40 | 31.68 | 6086 |
| 130 | 125.4 | 92.05 | 35.95 | 7292 |
| 140 | 134.7 | 101.7 | 40.31 | 8593 |
| 150 | 143.5 | 111.3 | 44.72 | 9985 |
| 160 | 151.6 | 120.8 | 49.18 | 11 460 |
| 170 | 159.1 | 130.2 | 53.67 | 13 010 |
| 180 | 166.0 | 139.5 | 58.18 | 14 640 |
| 190 | 172.5 | 148.7 | 62.70 | 16 330 |
| 200 | 178.5 | 157.7 | 67.22 | 18 090 |
| 210 | 184.1 | 166.5 | 71.74 | 19 900 |
| 220 | 189.4 | 175.2 | 76.25 | 21 770 |
| 230 | 194.4 | 183.7 | 80.74 | 23 690 |
| 240 | 199.1 | 192.1 | 85.20 | 25 660 |
| 250 | 203.6 | 200.3 | 89.64 | 27 670 |
| 260 | 207.9 | 208.4 | 94.06 | 29 730 |
| 270 | 211.9 | 216.3 | 98.44 | 31 830 |
| 280 | 215.7 | 224.1 | 102.8 | 33 970 |
| 290 | 219.3 | 231.7 | 107.1 | 36 140 |
| 300 | 222.7 | 239.2 | 111.4 | 38 350 |
| 310 | 225.9 | 246.6 | 115.6 | 40 590 |
| 320 | 228.9 | 253.8 | 119.8 | 42 870 |
| 330 | 231.7 | 260.9 | 124.0 | 45 170 |
| 340 | 234.3 | 267.8 | 128.1 | 47 500 |
Таблица 5.
Температурные зависимости изобарной теплоемкости, энтропии, приведенной энергии Гиббса и приращения энтальпии (10–340 K) для LaDyZr2O7, М = 595.8479 г/моль [16]
| Т, K | $C_{{\text{p}}}^{^\circ }$(T) | S°(T) | Ф°(Т) | Н°(Т) – Н°(0) |
|---|---|---|---|---|
| Дж/(K моль) | Дж/моль | |||
| 10 | 0.6874 | 0.2277 | 0.05693 | 1.708 |
| 15 | 2.508 | 0.8112 | 0.1974 | 9.207 |
| 20 | 5.432 | 1.908 | 0.4771 | 28.63 |
| 25 | 9.317 | 3.521 | 0.9162 | 65.13 |
| 30 | 14.02 | 5.625 | 1.519 | 123.2 |
| 35 | 19.41 | 8.183 | 2.283 | 206.5 |
| 40 | 25.33 | 11.16 | 3.202 | 318.2 |
| 45 | 31.65 | 14.50 | 4.269 | 460.5 |
| 50 | 38.23 | 18.18 | 5.473 | 635.1 |
| 60 | 51.43 | 26.32 | 8.256 | 1084 |
| 70 | 63.63 | 35.18 | 11.46 | 1660 |
| 80 | 75.08 | 44.43 | 15.00 | 2354 |
| 90 | 86.45 | 53.93 | 18.80 | 3162 |
| 100 | 97.72 | 63.62 | 22.79 | 4083 |
| 110 | 108.8 | 73.46 | 26.95 | 5115 |
| 120 | 119.6 | 83.39 | 31.24 | 6258 |
| 130 | 130.0 | 93.37 | 35.64 | 7506 |
| 140 | 139.9 | 103.4 | 40.12 | 8856 |
| 150 | 149.2 | 113.3 | 44.67 | 10 300 |
| 160 | 157.9 | 123.3 | 49.27 | 11 840 |
| 170 | 166.0 | 133.1 | 53.91 | 13 460 |
| 180 | 173.5 | 142.8 | 58.58 | 15 160 |
| 190 | 180.5 | 152.4 | 63.26 | 16 930 |
| 200 | 186.9 | 161.8 | 67.95 | 18 760 |
| 210 | 192.9 | 171.0 | 72.64 | 20 660 |
| 220 | 198.5 | 180.1 | 77.32 | 22 620 |
| 230 | 203.7 | 189.1 | 81.99 | 24 630 |
| 240 | 208.5 | 197.9 | 86.63 | 26 690 |
| 250 | 213.1 | 206.5 | 91.26 | 28 800 |
| 260 | 217.4 | 214.9 | 95.85 | 30 950 |
| 270 | 221.5 | 223.2 | 100.4 | 33 150 |
| 280 | 225.4 | 231.3 | 104.9 | 35 380 |
| 290 | 229.2 | 239.3 | 109.4 | 37 660 |
| 300 | 232.9 | 247.1 | 113.9 | 39 970 |
| 310 | 236.6 | 254.8 | 118.3 | 42 320 |
| 320 | 240.2 | 262.4 | 122.7 | 44 700 |
| 330 | 243.9 | 269.8 | 127.1 | 47 120 |
| 340 | 247.6 | 277.2 | 131.4 | 49 580 |
Таблица 6.
Коэффициенты уравнения Майера–Келли: $C_{{\text{p}}}^{^\circ }$ = a + bT + c/T 2 (330–1400 K, Р = 101.325 кПа)
| Формула | a | b | –c | R2 |
|---|---|---|---|---|
| La2Zr2O7 | 254.040 | 0.039840 | 3 893 980 | 0.99987 |
| LaSmZr2O7 | 275.161 | 0.012485 | 4 799 732 | 0.99980 |
| LaGdZr2O7 | 263.073 | 0.023592 | 4 313 576 | 0.99981 |
| LaDyZr2O7 | 250.508 | 0.035837 | 2 899 003 | 0.99996 |
Таблица 7.
Стандартные термодинамические свойства исследованных образцов, T = 298.15 K
| Формула | $C_{{\text{p}}}^{^\circ }$(T) | $C_{{\text{p}}}^{^\circ }$(T)* | S°(T) | Ф°(Т) | Н°(Т) – Н°(0) |
|---|---|---|---|---|---|
| Дж/(K моль) | Дж/моль | ||||
| La2Zr2O7 | 223.2 ± 0.4 | – | 237.6 ± 0.5 | 108.9 ± 0.2 | 38360 ± 80 |
| LaSmZr2O7 | 224.6 ± 0.4 | 224.0 | 246.9 ± 0.5 | 115.9 ± 0.2 | 39070 ± 80 |
| LaGdZr2O7 | 222.1 ± 0.4 | 222.4 | 237.8 ± 0.5 | 110.6 ± 0.2 | 37940 ± 80 |
| LaDyZr2O7 | 232.3 ± 0.5 | 226.6 | 245.7 ± 0.5 | 113.1 ± 0.2 | 39540 ± 80 |
* Расчет $C_{{\text{p}}}^{^\circ }$(T) = 1/2[$C_{{\text{p}}}^{^\circ }$(La2Zr2O7) + $C_{{\text{p}}}^{^\circ }$(Ln2Zr2O7)]; данные для $C_{{\text{p}}}^{^\circ }$(Ln2Zr2O7) Ln = Sm, Gd, Dy взяты из [18].
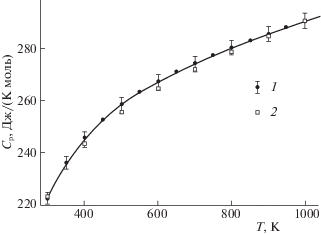
Цирконат лантана готовили и измеряли его теплоемкость для подтверждения соответствия результатов наших исследований ранее полученным данным в других лабораториях. Впервые теплоемкость пирохлора La2Zr2O7 была измерена методами адиабатической калориметрии при 4–380 K и калориметрии сброса в области 480–898 K в работе [25]. Эти данные с точностью до погрешностей измерений полностью совпадают с нашими результатами (табл. 2) при низкой температуре (0–340 K), и находятся в 1% доверительном интервале при высоких температурах (340–1000 K) – рис. 1. Уместно отметить, что суммарная погрешность сравниваемых методов дифференциальной сканирующей калориметрии (ДСК), используемой нами, и калориметрии сброса, примененной в [25], существенно больше указанного интервала сравнения, что подчеркивает достоверность наших экспериментальных процедур, включая синтез и подготовку образцов и, собственно, сами результаты измерения теплоемкости.
На рис. 2–4 приведены экспериментальные результаты измерения высокотемпературной теплоемкости LaSmZr2O7, LaGdZr2O7 и LaDyZr2O7 и расчетные кривые по Нейману–Коппу. Как видно, при комнатных температурах измеренные и расчетные значения для первых двух соединений с высокой точностью совпадают, а для LaDyZr2O7 экспериментальная величина выше расчетной на 5.3 Дж/(K моль) – табл. 7. Дальнейшее повышение температуры приводит к заметному отставанию величины экспериментальной теплоемкости от расчетных значений, и такие отличия достигают 3–5%, что сравнимо с погрешностями метода ДСК. Тем не менее, прослеживается общая тенденция понижения экспериментальной теплоемкости по сравнению со средней величиной для взаимных твердых растворов пирохлоров. Это же явление наблюдали при исследовании твердого раствора YbGdZr2O7 [26]. Необходимо отметить, что при уменьшении радиуса иона лантаноида за счет лантаноидного сжатия следовало бы ожидать и относительного снижения теплоемкости, однако взаимодействие f-электронов и кристаллического поля вносит дополнительный вклад в теплоемкость, известный как аномалия Шоттки [27 ] . Этот вклад не является монотонной функцией и индивидуален для каждого лантаноида и конкретной кристаллической структуры, поэтому общий вид зависимости теплоемкости от температуры имеет сложный характер.
Рис. 2.
Экспериментальная теплоемкость пирохлора LaSmZr2O7 (1) и ее оценка по правилу Неймана–Коппа (2).

Рис. 3.
Экспериментальная теплоемкость пирохлора LaGdZr2O7 (1) и ее оценка по правилу Неймана–Коппа (2).

Рис. 4.
Экспериментальная теплоемкость пирохлора LaDyZr2O7 (1) и оценка по правилу Неймана–Коппа (2).

Таким образом, измерена изобарная теплоемкость твердых растворов пирохлоров LaLnZr2O7 (Ln = Sm, Gd, Dy) в области 10–340 K методом адиабатической калориметрии и в интервале 330–1400 K – методом ДСК. Показано отсутствие структурных превращений во всем изученном температурном интервале. Рассчитанные термодинамические функции не учитывают вклады магнитных превращений ниже 10 K. Полученные данные могут быть использованы для термодинамических расчетов и оптимизации процессов получения и применения высокотемпературных теплозащитных материалов.
Работа выполнена в рамках государственного задания ИОНХ РАН в области фундаментальных научных исследований при финансовой поддержке РФФИ (код проекта № 15-03-04388) с использованием оборудования ЦКП ИОНХ РАН.
Список литературы
Арсеньев П.А., Глушкова В.Б., Евдокимов А.А. и др. Соединения редкоземельных элементов. Цирконаты, гафнаты, ниобаты, танталаты, антимонаты. М.: Наука, 1985. 261 с.
Andrievskaya E.R. // J. Europ. Ceram. Soc. 2008. V. 28. P. 2363. https://doi.org/10.1016/j.jeurceramsoc.2008.01.009
Шляхтина А.В., Щербакова Л.Г. // Электрохимия. 2012. Т. 48. С. 3.
Sohn J.M., Woo S.I. // Catalysis Letters. 2002. V. 79. P. 45. https://doi.org/10.1023/A:1015339821135
Nästren C., Jardin R., Somers J., Walter M. Brendebach B. // J. Solid State Chem. 2009. V. 182. P. 1. https://doi.org/10.1016/j.jssc.2008.09.017
Cao X.Q., Vassen R., Stoever D. // J. Europ. Ceram. Soc. 2004. V. 24. P. 1. https://doi.org/10.1016/S0955-2219(03)00129-8
Fergus J.W. // Metallurgical and Materials Transactions E. 2014. V. 1. P. 118. https://doi.org/10.1007/s40553-014-0012-y
Liu Z.G., Ouyang J.H., Zhou Y. // J. Alloys and Compd. 2009. V. 475. P. 21. https://doi.org/10.1016/j.jallcom.2008.07.089
Liu Z.G., Ouyang J.H., Zhou Y. // Bulletin of Materials Science. 2009. V. 32. P. 603. https://doi.org/10.1007/s12034-009-0092-y
Wang Z., Zhou G., Qin X., Yang Y. et al. // J. Europ. Ceram. Soc. 2013. V. 33. P. 643. https://doi.org/10.1016/j.jeurceramsoc.2012.09.026
Wang Z., Zhou G., Qin X. et al. // J. Europ. Ceram. Soc. 2014. V. 34. P. 3951. https://doi.org/10.1016/j.jeurceramsoc.2014.05.046
Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. // Неорган. материалы. 2017. Т. 53. С. 64−70. https://doi.org/10.7868/S0002337X17010067
Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. // Неорган. материалы. 2017. Т. 53. С. 632.https://doi.org/10.7868/S0002337X17010045
Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. // Неорган. материалы. 2017. Т. 53. № 9. С. 963. https://doi.org/10.7868/S0002337X17090093
Гагарин П.Г., Тюрин А.В., Гуськов В.Н. и др. // ЖНХ. 2018. Т. 63. С. 1458. https://doi.org/10.1134/S0044457X18110053
Wieser M.E. // Pure Appl. Chem. 2006. V. 78. P. 2051. https://doi.org/10.1351/pac200678112051
Gurevich V.M., Gorbunov V.E., Gavrichev K.S. et al. // Geochem. Int. 1999. V. 37. P. 367.
Гагарин П.Г. Термодинамические функции соединений и твердых растворов оксидов лантаноидов и диоксида циркония: Автореферат дис. … канд. хим. наук. М.: ИОНХ РАН, 2018. 19 с.
ICCD PDF 01-074-8764
ICCD PDF 01-075-8266
ICCD PDF 01-075-8269
ICCD PDF 01-078-1293
Maier C.G., Kelley K.K. // J. Am. Chem. Soc. 1932. V. 54. P. 3243. https://doi.org/10.1021/ja01347a029
Qiu L., White M.A. // J. Chem. Education. 2001. V. 78. P.1076. https://doi.org/10.1021/ed078p1076
Bolech M., Cordfunke E.H.P., van Genderen et al. // J. Phys. Chem. Solids. 1997. V. 58. P. 433. https://doi.org/10.1016/s0022-3697(06)00137-5
Liu Z.-G., Ouyang J.-H., Zhou Y. // Bull. Mater. Sci. 2009. V. 32. P 603. https://doi.org/10.1007/s12034-009-0092-y
Westrum E.F. // J. Thermal Anal. 1985. V. 30. P. 1209. https://doi.org/10.1007/bf01914288
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии