Журнал физической химии, 2020, T. 94, № 2, стр. 171-181
Термодинамические свойства силоксанового дендримера первой генерации с концевыми триметилсилильными группами
А. В. Маркин a, *, Ю. А. Сармини a, С. С. Сологубов a, Н. Н. Смирнова a, К. Л. Болдырев b, c, Е. А. Татаринова b, И. Б. Мешков b, А. М. Музафаров b, c
a Национальный исследовательский Нижегородский государственный университет им. Н.И. Лобачевского
Нижний Новгород, Россия
b Российская академия наук, Институт синтетических полимерных материалов им. Н.С. Ениколопова
Москва, Россия
c Российская академия наук, Институт элементоорганических соединений им. А.Н. Несмеянова
Москва, Россия
* E-mail: markin@calorimetry-center.ru
Поступила в редакцию 14.06.2019
После доработки 14.06.2019
Принята к публикации 18.06.2019
Аннотация
Впервые определена температурная зависимость теплоемкости силоксанового дендримера первой генерации с концевыми триметилсилильными группами методами высокоточной адиабатической вакуумной калориметрии в области температур 6–347 K и дифференциальной сканирующей калориметрии в температурном интервале 330–410 K. Обнаружено аномальное изменение теплоемкости в области T = 42–76 K, а также переход в интервале T = 137–153 K, связанный с расстеклованием дендримера. Методом термогравиметрического анализа исследована термическая стабильность соединения. Полученные экспериментальные данные использованы для расчета стандартных термодинамических функций дендримера для области от T → 0 до T = 400 K, а также стандартной энтропии его образования при T = 298.15 K.
Сверхразветвленные полимеры представляют собой трехмерные молекулы с древовидной структурой и высокой плотностью ветвления [1]. В последние годы особое внимание исследователей уделяется этому классу соединений благодаря их функциональности и уникальности физических и химических свойств [2, 3]. Среди полимеров, обладающих сверхразветвленной архитектурой, наиболее перспективны дендримеры – макромолекулярные нанообъекты регулярного строения, характеризующиеся монодисперсностью и функциональностью поверхностного слоя [4–6].
Благодаря структурной упорядоченности и многообразию по химической природе дендримеры используются для создания высокотехнологичных наноматериалов, обладающих магнитными, оптическими и другими свойствами [7]. Также в настоящее время дендримеры находят широкое применение в биомедицине в качестве носителей для контролируемой доставки противовирусных и противоопухолевых препаратов, в тканевой инженерии и диагностике [8–10].
Наиболее важные представители кремнийсодержащих дендримеров –карбосилановые (Si–C) и силоксановые (Si–O) дендримеры [11–13]. Они характеризуются хорошей растворимостью в органических растворителях, высокой термической стабильностью и низкими значениями температуры расстеклования по сравнению с линейными полимерами.
Определение комплекса стандартных термодинамических характеристик дендримеров методами прецизионной калориметрии в широком диапазоне температур позволило установить и проанализировать практически важные зависимости свойств от состава и структуры соединений [14–20]. Современный прогресс в области синтеза дендримеров позволил впервые получить серию представителей силоксановых дендримеров первой–четвертой генераций.
Данная работа посвящена калориметрическому изучению силоксанового дендримера с концевыми триметилсилильными группами G1[OSi(СH3)3]6 в температурной области 6–410 K, которое включает в себя определение теплоемкости дендримера в указанном интервале температур; выявление возможных физических превращений и определение их термодинамических характеристик; расчет стандартных термодинамических функций дендримера для области от T → 0 до T = 400 K, а также стандартной энтропии его образования из простых веществ при T = = 298.15 K.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Характеристики изученного образца. На рис. 1 приведена схема синтеза, а также структура исследуемого силоксанового дендримера G1[OSi(СH3)3]6, где G1 – номер генерации дендримера, [OSi(СH3)3] – фрагмент концевых групп дендримера. Образец был получен и охарактеризован в Институте синтетических полимерных материалов им. Н.С. Ениколопова РАН (Москва). Для подтверждения строения и состава дендримера использованы методы элементного анализа, 1Н, 13C и 29Si ЯМР-спектроскопии [21].
Рассчитано (%): C, 34.97; H, 8.80; O, 19.06; Si, 37.17.
Найдено (%): C, 35.14; H, 8.87; O, 19.08; Si, 36.91.
1H ЯМР (400 МГц, CDCl3, δ, м.д.): 0.05 (с, 9H, –(CH3SiO)(CH3)3SiO)2–Si–CH3); 0.09 (с, 3H, ‒(CH3SiO)3–Si–CH3); 0.10 (с, 54H, –O–Si–(CH3)3).
13C ЯМР (100 МГц, CDCl3, δ, м.д.): –2.40 (‒(CH3SiO)3–Si–CH3); –2.13 (–(CH3SiO)3–Si–CH3); 1.71 (–O–Si–(CH3)3).
29Si ЯМР (80 МГц, CDCl3, δ, м.д.): –69.10, ‒66.00 (Si–CH3); 7.48 (Si–(CH3)3).
$d_{4}^{{25}}$ = 0.9477 г/см3; $n_{{25}}^{{\text{D}}}$ = 1.4010.
При расчете молярной массы дендримера (M(C22H66O9Si10) = 755.56 г/моль) использована таблица стандартных атомных масс, рекомендованная ИЮПАК [22].
Аппаратура и методики измерений. Температурную зависимость теплоемкости силоксанового дендримера G1[OSi(СH3)3]6 в области температур 5.64–347.08 K определяли с использованием полностью автоматизированного адиабатического вакуумного калориметра БКТ-3 (АО “Термис”, Московская обл.). Подробное описание конструкции установки и методики измерений опубликовано в работах [23, 24]. Поверку калориметра проводили посредством измерения теплоемкости эталонных образцов синтетического сапфира и бензойной кислоты [25].
Перед измерением теплоемкости калориметрическую ампулу с веществом заполняли сухим гелием особой чистоты для улучшения теплопроводности системы до давления 5 кПа. В качестве хладагентов использовали жидкие гелий и азот в интервалах температур 5.64–86.32 K и 84.67–347.08 K соответственно. Для проведения калориметрического опыта в ампулу загружали 0.3001 г исследуемого дендримера G1[OSi(СH3)3]6. Образец взвешивали на аналитических весах Shimadzu AUX 220 (Япония); точность взвешивания составляла ±0.0001 г. Скорость нагревания ампулы с веществом составляла 0.2 K/мин. Установлено, что калориметр позволяет определить теплоемкость соединения с относительной стандартной неопределенностью ur($C_{p}^{{^{ \circ }}}$) = 0.02 в области температур 6–15 K, ur($C_{p}^{{^{ \circ }}}$) = 0.005 в интервале температур 15–40 K, ur($C_{p}^{{^{ \circ }}}$) = 0.002 в температурной области 40–350 K; стандартная неопределенность u(T) = 0.01 K.
Теплоемкость силоксанового дендримера G1[OSi(СH3)3]6 в области T = 330.5–410.5 K измеряли с помощью дифференциального сканирующего калориметра DSC 204 F1 Phoenix (NETZSCH-Gerätebau, Германия). Методика проведения эксперимента и устройство прибора детально изложены в работах [26, 27] и программном обеспечении NETZSCH Proteus Software. Калибровку ДСК осуществляли посредством определения характеристик плавления высокочистых образцов индия, висмута, цинка, олова, ртути, калия, хлорида цезия и бифенила. В результате было установлено, что калориметр позволяет определять температуры фазовых превращений со стандартной неопределенностью u(T) = 0.5 K.
Для определения $C_{p}^{{^{ \circ }}}$ дендримера выполняли три последовательных измерения: базовой линии, стандартного образца (корунда) и исследуемого образца. Эксперимент проводили в инертной атмосфере аргона со скоростью потока газа 25 мл/мин; скорость нагревания ампулы с веществом составляла 5 K/мин. Таким образом, калориметр позволяет определить теплоемкость вещества с относительной стандартной неопределенностью ur($C_{p}^{{^{ \circ }}}$) = 0.02 в температурной области 350–410 K.
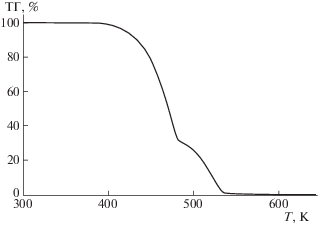
Термогравиметрический (ТГ) анализ силоксанового дендримера G1[OSi(СH3)3]6 проводили с помощью термомикровесов TG 209 F1 Iris (NETZSCH-Gerätebau, Германия) в температурном интервале 300–850 K в атмосфере аргона со скоростью потока газа 25 мл/мин. Скорость нагревания ампулы с веществом составляла 5 K/мин. Результаты анализа показали, что температура начала разложения исследуемого дендримера T = 405 K (потеря массы – 2%). Полученная ТГ-кривая дендримера G1[OSi(СH3)3]6 представлена на рис. 2.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Теплоемкость. Температурная зависимость теплоемкости силоксанового дендримера G1[OSi(СH3)3]6 представлена на рис. 3. Экспериментальные значения $C_{p}^{{^{ \circ }}}$ дендримера приведены в табл. 1 (серии 1–4 получены с использованием адиабатического вакуумного калориметра; серия 5 – с помощью ДСК).
Рис. 3.
Температурная зависимость теплоемкости силоксанового дендримера G1[OSi(СH3)3]6; AE – аморфное (стеклообразное) состояние, FG – аморфное (расстеклованное) состояние, BCD – кажущаяся теплоемкость в интервале аномалии, BD – нормальный (интерполяционный) ход теплоемкости в интервале аномалии, $T_{{\text{g}}}^{^\circ }$ – температура расстеклования.

Таблица 1.
Экспериментальные значения теплоемкости (Дж/(K моль)) силоксанового дендримера G1[OSi(СH3)3]6, M(C22H66O9Si10) = 755.56 г/моль, p° = 0.1 МПа
| Т, K | $C_{p}^{{^{ \circ }}}$ | Т, K | $C_{p}^{{^{ \circ }}}$ | Т, K | $C_{p}^{{^{ \circ }}}$ |
|---|---|---|---|---|---|
| Серия 1 | 12.14 | 46.9 | 73.63 | 457.8 | |
| 5.64 | 11.6 | 12.95 | 51.1 | 75.50 | 470.6 |
| 5.81 | 14.6 | 14.22 | 62.2 | 77.36 | 482.6 |
| 5.95 | 13.3 | 15.56 | 74.67 | 79.23 | 490.7 |
| 6.11 | 13.7 | 16.86 | 86.78 | 81.39 | 504.5 |
| 6.25 | 14.2 | 18.19 | 98.93 | 83.86 | 517.8 |
| 6.38 | 14.8 | 19.54 | 110.3 | 86.32 | 529.8 |
| 6.52 | 15.0 | 21.63 | 124.8 | Серия 2 | |
| 6.64 | 16.1 | 24.11 | 141.4 | 28.39 | 171.2 |
| 6.77 | 16.5 | 26.58 | 158.7 | 30.34 | 184.1 |
| 6.89 | 17.0 | 29.06 | 175.4 | 33.01 | 200.0 |
| 7.01 | 18.4 | 31.54 | 191.9 | 35.29 | 211.0 |
| 7.14 | 18.5 | 34.04 | 204.3 | 37.80 | 227.1 |
| 7.26 | 18.8 | 36.53 | 217.7 | 40.56 | 242.6 |
| 7.48 | 17.7 | 39.01 | 233.6 | 42.93 | 257.6 |
| 7.78 | 19.4 | 41.49 | 249.5 | 45.48 | 277.8 |
| 8.05 | 20.8 | 43.97 | 265.4 | 47.80 | 293.8 |
| 8.34 | 22.4 | 46.45 | 285.0 | 49.87 | 308.3 |
| 8.65 | 23.8 | 48.93 | 301.8 | 52.29 | 327.7 |
| 8.96 | 24.8 | 51.11 | 318.4 | 53.96 | 342.7 |
| 9.27 | 26.2 | 52.98 | 334.3 | 56.07 | 360.8 |
| 9.57 | 28.0 | 54.85 | 349.4 | 58.02 | 397.6 |
| 9.88 | 29.4 | 56.72 | 369.6 | 59.11 | 409.5 |
| 10.18 | 31.4 | 58.62 | 407.5 | 61.22 | 407.4 |
| 10.49 | 33.5 | 60.49 | 405.7 | 63.15 | 421.9 |
| 10.80 | 36.0 | 62.38 | 416.2 | 65.22 | 434.9 |
| 11.13 | 38.4 | 64.25 | 428.3 | 67.10 | 448.8 |
| 11.46 | 40.6 | 66.12 | 441.4 | 68.77 | 453.0 |
| 11.79 | 43.6 | 67.98 | 453.1 | 70.88 | 447.9 |
| 72.73 | 450.0 | 162.74 | 1078 | 266.49 | 1200 |
| 74.58 | 463.4 | 166.24 | 1081 | 269.92 | 1205 |
| 76.46 | 476.9 | 169.73 | 1085 | 273.36 | 1209 |
| 78.42 | 487.2 | 173.22 | 1089 | 276.79 | 1214 |
| 80.16 | 496.6 | 176.71 | 1092 | 280.21 | 1220 |
| 82.49 | 510.5 | 180.20 | 1095 | 283.64 | 1226 |
| 84.72 | 521.9 | 183.68 | 1099 | 287.06 | 1231 |
| Серия 3 | 187.15 | 1102 | 290.48 | 1236 | |
| 84.67 | 519.7 | 190.62 | 1105 | 293.89 | 1241 |
| 88.46 | 539.2 | 194.08 | 1109 | 297.69 | 1247 |
| 92.02 | 557.6 | 197.53 | 1112 | 300.68 | 1252 |
| 95.58 | 576.5 | 200.98 | 1116 | 304.60 | 1259 |
| 102.93 | 611.9 | 204.42 | 1121 | 307.44 | 1265 |
| 106.69 | 631.7 | 207.87 | 1123 | 310.82 | 1269 |
| 110.22 | 648.3 | 211.33 | 1127 | 314.20 | 1275 |
| 113.75 | 665.2 | 214.76 | 1130 | 317.58 | 1281 |
| 117.28 | 680.3 | 218.21 | 1135 | 320.95 | 1286 |
| 120.81 | 696.3 | 221.67 | 1141 | 323.92 | 1291 |
| 124.34 | 708.8 | 225.11 | 1146 | 327.52 | 1298 |
| 127.86 | 726.8 | 228.55 | 1152 | 330.66 | 1303 |
| 131.38 | 744.7 | 232.01 | 1157 | 334.03 | 1310 |
| 134.91 | 759.9 | 235.46 | 1162 | 337.23 | 1317 |
| 138.42 | 781.1 | 238.91 | 1166 | 340.37 | 1323 |
| 141.94 | 801.7 | 242.36 | 1170 | 343.73 | 1330 |
| 145.43 | 847.1 | 245.81 | 1175 | 347.08 | 1335 |
| 148.82 | 1047 | 249.25 | 1179 | Серия 4 | |
| 152.22 | 1068 | 252.70 | 1184 | 116.15 | 674.0 |
| 155.73 | 1072 | 256.15 | 1188 | 119.94 | 691.1 |
| 159.23 | 1074 | 259.60 | 1192 | 123.48 | 706.9 |
| 127.01 | 722.1 | 200.33 | 1114 | 357.5 | 1354 |
| 130.54 | 738.5 | 203.77 | 1118 | 360.5 | 1359 |
| 134.07 | 755.1 | 207.22 | 1122 | 363.5 | 1364 |
| 137.60 | 772.9 | 210.67 | 1124 | 366.5 | 1369 |
| 141.13 | 794.3 | 214.11 | 1129 | 369.5 | 1375 |
| 144.63 | 831.8 | 217.55 | 1133 | 372.5 | 1380 |
| 148.05 | 1012 | 220.99 | 1139 | 375.5 | 1385 |
| 151.46 | 1065 | 224.42 | 1145 | 378.5 | 1390 |
| 154.96 | 1070 | 227.81 | 1151 | 381.5 | 1396 |
| 158.48 | 1072 | 231.24 | 1156 | 384.5 | 1402 |
| 162.00 | 1075 | 234.68 | 1160 | 387.5 | 1407 |
| 165.51 | 1078 | Серия 5 | 390.5 | 1412 | |
| 169.01 | 1083 | 330.5 | 1303 | 393.5 | 1417 |
| 172.50 | 1087 | 333.5 | 1308 | 396.5 | 1423 |
| 176.00 | 1090 | 336.5 | 1316 | 399.5 | 1429 |
| 179.50 | 1094 | 339.5 | 1322 | 402.5 | 1434 |
| 182.98 | 1097 | 342.5 | 1329 | 405.5 | 1440 |
| 186.46 | 1100 | 345.5 | 1334 | 408.5 | 1445 |
| 189.94 | 1104 | 348.5 | 1338 | 410.5 | 1449 |
| 193.41 | 1107 | 351.5 | 1344 | ||
| 196.88 | 1111 | 354.5 | 1349 | ||
Примечание. Стандартные неопределенности u(p) = 10 кПа, u(T) = 0.01 K. Относительная стандартная неопределенность ur($C_{p}^{{^{ \circ }}}$) = 0.02 в области температур 5.64–14.22 K, ur($C_{p}^{{^{ \circ }}}$) = 0.005 в интервале температур 15.56–41.49 K, ur($C_{p}^{{^{ \circ }}}$) = 0.002 в области температур 40.56–347.08 K, ur($C_{p}^{{^{ \circ }}}$) = 0.02 в интервале температур 330.5–410.5 K. В серии 5 приведено каждое третье значение теплоемкости.
Исследуемый дендример охлаждали от комнатной температуры до температуры начала измерений (T = 5.64 K) со скоростью 0.02 K/с. В результате нагревания образца в интервале T = 42–76 K выявлено аномальное изменение его теплоемкости (рис. 3, участок BCD), выражающееся в положительном отклонении от нормального (интерполяционного) хода кривой. Аналогичные аномалии были обнаружены ранее у карбосилановых дендримеров низких генераций с различными концевыми группами в том же диапазоне температур. Установлено, что проявление подобных аномалий имеет системный характер и определяется номером генерации дендримера, а также практически не зависит от природы молекулярного скелета и концевых групп (рис. 4). Кроме того, при изучении дендримера третьей генерации с концевыми этиленоксидными группами методом ИК-спектроскопии было установлено, что низкотемпературные аномалии обусловлены тонкими структурными колебаниями (например, метильных фрагментов) [16]. По термодинамической классификации Веструма–МакКаллафа, аномалию можно отнести к равновесному релаксационному переходу типа порядок $ \rightleftarrows $ беспорядок.
Рис. 4.
Структуры кремнийорганических дендримеров первой генерации с различной природой ядра и поверхностного слоя.

При последующем нагревании дендримера в интервале T = 137–153 K наблюдается его расстеклование (рис. 3, участок EF). Выявленный переход воспроизводился при охлаждении и повторном нагревании образца в том же температурном интервале.
Стандартные термодинамические характеристики низкотемпературной аномалии теплоемкости. В температурной области 42–76 K была выявлена воспроизводимая низкотемпературная аномалия и определены ее термодинамические характеристики: температурный интервал ΔT, энтальпия ΔtrH° и энтропия ΔtrS°. Рассчитанные значения указанных величин приведены в табл. 2. Интервал ΔT определяли по температурной зависимости теплоемкости. За температуры начала (Tнач.) и конца (Tкон.) перехода принимали температуры начала и конца аномальной зависимости теплоемкости. Энтальпию ΔtrH° рассчитывали как разность интегралов по кривым кажущейся и нормальной теплоемкостей вещества $C_{p}^{{^{ \circ }}}$ = f(T) в интервале аномалии. Энтропию ΔtrS° вычисляли аналогичным способом по кривой $C_{p}^{{^{ \circ }}}$ = f(ln T).
Таблица 2.
Стандартные термодинамические характеристики низкотемпературных аномалий теплоемкостей дендримеров первой генерации, отличающихся молекулярным скелетом и концевыми группами
Стандартные термодинамические характеристики расстеклования и стеклообразного состояния. Термодинамическими характеристиками расстеклования и стеклообразного состояния дендримера являются температурный интервал расстеклования ΔT, температура расстеклования $T_{g}^{{^{ \circ }}}$, изменение (увеличение) теплоемкости при расстекловании $\Delta C_{p}^{{^{ \circ }}}(T_{g}^{{^{ \circ }}})$, конфигурационная энтропия $S_{{conf}}^{{^{ \circ }}}$ и остаточная энтропия S°(0). Полученные данные приведены в табл. 3. Температуру расстеклования $T_{g}^{{^{ \circ }}}$ определяли по перегибу графика температурной зависимости энтропии нагревания [28]. Интервал расстеклования ΔT и увеличение теплоемкости при расстекловании $\Delta C_{p}^{{^{ \circ }}}(T_{g}^{{^{ \circ }}})$ определяли графически. Конфигурационную энтропию $S_{{conf}}^{{^{ \circ }}}$ рассчитывали по уравнению, предложенному в работе [29]:
(1)
$S_{{conf}}^{{^{ \circ }}} = \Delta C_{p}^{{^{ \circ }}}(T_{g}^{{^{ \circ }}})\ln (T_{g}^{{^{ \circ }}}{\text{/}}{{T}_{K}}),$Таблица 3.
Стандартные термодинамические характеристики (Дж/(K моль)) расстеклования и стеклообразного состояния дендримеров первой генерации, отличающихся молекулярным скелетом и концевыми группами
Из сравнительного анализа данных, полученных в настоящей работе и ранее [14, 19, 20], можно сделать вывод, что температура расстеклования дендримеров зависит в большей степени от химической природы групп внешнего слоя (рис. 4). Наличие гибких силоксановых фрагментов в ядре и на поверхности дендримера G1[OSi(СH3)3]6 приводит к закономерному снижению его температуры стеклования за счет увеличения молекулярной подвижности. Из представленного ряда соединений изученный силоксановый дендример имеет наименьшую температуру расстеклования (табл. 3). Таким образом, изменение химической природы дендримеров является эффективным инструментом регулирования их термодинамических и теплофизических свойств.
Стандартные термодинамические функции. Кривую зависимости $C_{p}^{{^{ \circ }}}$ = f(T) сглаживали с помощью логарифмических полиномов, а затем экстраполировали от температуры начала измерений до T → 0 по функции теплоемкости Дебая [32]:
где D – функция Дебая, n = 3 и ΘD = 36.9 K – специально подобранные параметры. Уравнение (2) с указанными параметрами описывает экспериментальные значения $C_{{\text{p}}}^{^\circ }$ дендримера в интервале T = 6–9 K с погрешностью ±1.8%.По полученным значениям теплоемкости рассчитывали стандартные термодинамические функции изученного силоксанового дендримера G1[OSi(СH3)3]6 (табл. 4). При расчете функций принимали, что уравнение (2) воспроизводит значения при T ≤ 6 K с погрешностью ±1.8%. Расчет энтальпии [H°(T)–H°(0)] и энтропии [S°(T)–S°(0)] проводили численным интегрированием зависимостей $C_{{\text{p}}}^{^\circ }$ = f(T) и $C_{{\text{p}}}^{^\circ }$ = f(ln T) соответственно. Расчет энергии Гиббса [G°(T)–H°(0)] осуществляли по уравнению Гиббса–Гельмгольца:
(3)
$\begin{gathered} \text{[}G^\circ (T)--H^\circ (0)] = \\ = [H^\circ (T)--H^\circ (0)]--Т[S^\circ (T)--S^\circ (0)]. \\ \end{gathered} $Таблица 4.
Стандартные термодинамические функции силоксанового дендримера G1[OSi(СH3)3]6, M(C22H66O9Si10) = = 755.56 г/моль, p° = 0.1 МПа
| Т | $C_{p}^{{^{ \circ }}}(T)$ | [S°(T) – S°(0)] | [H°(T) – H°(0)] | –[G°(T) – H°(0)] |
|---|---|---|---|---|
| K | Дж/(K моль) | кДж/моль | ||
| Аморфное (стеклообразное) состояние | ||||
| 5 | 8.41 | 3.06 | 0.0114 | 0.00394 |
| 10 | 30.5 | 15.2 | 0.105 | 0.0472 |
| 15 | 69.71 | 34.49 | 0.3492 | 0.1682 |
| 20 | 112.5 | 60.53 | 0.8071 | 0.4035 |
| 25 | 148.2 | 89.55 | 1.461 | 0.7781 |
| 30 | 181.1 | 119.5 | 2.285 | 1.301 |
| 35 | 211.9 | 149.8 | 3.269 | 1.974 |
| 40 | 240.1 | 180.0 | 4.399 | 2.799 |
| 45 | 273.6 | 210.1 | 5.680 | 3.774 |
| 50 | 310.8 | 240.8 | 7.140 | 4.901 |
| 60 | 404.8 | 305.8 | 10.72 | 7.627 |
| 70 | 449.5 | 372.4 | 15.05 | 11.02 |
| 80 | 496.7 | 434.7 | 19.72 | 15.06 |
| 90 | 547.3 | 496.2 | 24.94 | 19.71 |
| 100 | 598.3 | 556.5 | 30.67 | 24.98 |
| 110 | 647.3 | 615.8 | 36.90 | 30.84 |
| 120 | 691.7 | 674.1 | 43.60 | 37.29 |
| 130 | 735.3 | 731.1 | 50.73 | 44.31 |
| 140 | 783.1 | 787.4 | 58.33 | 51.91 |
| 147 | 814.5 | 826.4 | 63.92 | 57.56 |
| Аморфное (расстеклованное) состояние | ||||
| 147 | 1060 | 826.4 | 63.92 | 57.56 |
| 150 | 1064 | 847.8 | 67.11 | 60.07 |
| 160 | 1075 | 916.8 | 77.80 | 68.89 |
| 170 | 1084 | 982.3 | 88.60 | 78.39 |
| 180 | 1094 | 1045 | 99.49 | 88.53 |
| 190 | 1104 | 1104 | 110.5 | 99.27 |
| 200 | 1115 | 1161 | 121.6 | 110.6 |
| 210 | 1127 | 1215 | 132.8 | 122.5 |
| 220 | 1139 | 1268 | 144.1 | 134.9 |
| 230 | 1152 | 1319 | 155.6 | 147.8 |
| 240 | 1165 | 1368 | 167.1 | 161.3 |
| 250 | 1179 | 1416 | 178.9 | 175.2 |
| 260 | 1192 | 1463 | 190.7 | 189.6 |
| 270 | 1206 | 1508 | 202.7 | 204.5 |
| 280 | 1221 | 1552 | 214.8 | 219.8 |
| 290 | 1236 | 1595 | 227.1 | 235.5 |
| 298.15 | 1249 | 1630 | 237.3 | 248.6 |
| 300 | 1252 | 1637 | 239.6 | 251.7 |
| 310 | 1268 | 1679 | 252.2 | 268.2 |
| 320 | 1286 | 1719 | 264.9 | 285.2 |
| 330 | 1303 | 1759 | 277.9 | 302.6 |
| 340 | 1321 | 1798 | 291.0 | 320.4 |
| 350 | 1340 | 1837 | 304.3 | 338.6 |
| 360 | 1358 | 1875 | 317.8 | 357.1 |
| 370 | 1377 | 1912 | 331.5 | 376.1 |
| 380 | 1394 | 1949 | 345.3 | 395.4 |
| 390 | 1411 | 1986 | 359.4 | 415.1 |
| 400 | 1427 | 2022 | 373.5 | 435.1 |
Примечание. Стандартные неопределенности u(p) = 10 кПа, u(T) = 0.01 K в температурной области 5–350 K, u(T) = 0.5 K в температурном интервале 350–400 K. Расширенные относительные неопределенности Ur($C_{{\text{p}}}^{^\circ }(T)$) = 0.02, 0.005, 0.002 и 0.02; Ur[H°(T) – H°(0)] = 0.022, 0.007, 0.005 и 0.022; Ur[S°(T) – S°(0)] = 0.023, 0.008, 0.006 и 0.023; Ur[G°(T) – H°(0)] = 0.03, 0.01, 0.009 и 0.03 в температурных интервалах 5–15 K, 15–40 K, 40–350 K и 350–400 K соответственно (уровень достоверности 0.95, k ≈ 2).
Подробная методика расчета стандартных термодинамических функций опубликована в работе [33].
По значениям [S°(T) – S°(0)] изученного дендримера при T = 298.15 K (табл. 4), его остаточной энтропии (табл. 3) и абсолютных энтропий простых веществ (С(гр), Si(кр), Н2(г), O2(г) [34]) вычисляли стандартную энтропию образования ΔfS° силоксанового дендримера в аморфном (расстеклованном) состоянии при той же температуре. Полученное значение ΔfS°(С22Н66O9Si10, 298.15) = –3980 ± 22 Дж/(K моль) соответствует уравнению реакции:
(4)
$\begin{gathered} 22{{{\text{C}}}_{{({\text{гр}})}}} + 33{{{\text{H}}}_{{2({\text{г}})}}} + 4.5{{{\text{О}}}_{{2({\text{г}})}}} + 10{\text{S}}{{{\text{i}}}_{{({\text{кp}})}}} \to \\ \to {{{\text{C}}}_{{22}}}{{{\text{Н}}}_{{66}}}{{{\text{O}}}_{9}}{\text{S}}{{{\text{i}}}_{{10({\text{p}})}}}, \\ \end{gathered} $Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проект № 19-03-00248) и Российского научного фонда (проект № 18-13-00411).
Список литературы
Hyperbranched Polymers: Synthesis, Properties, and Applications / Ed. by D. Yan, C. Gao, H. Frey. John Wiley & Sons, Inc.: Hoboken, New Jersey, USA, 2011. 481 p.
Muzafarov A.M., Tatarinova E.A., Vasilenko N.V. et al. // in Organosilicon Compounds: Experiment (Physico-Chemical Studies) and Applications (edited by V.Ya. Lee). Cambridge, Massachusetts, USA: Academic Press, 2017. P. 323.
Voit B.I., Lederer A. // Chem. Rev. 2009. V. 109. № 11. P. 5924.
Tomalia D.A. // Prog. Polym. Sci. 2005. V. 30. № 3–4. P. 294.
Newkome G.R., Shreiner C.D. // Polymer. 2008. V. 49. № 1. P. 1.
Muzafarov A.M., Rebrov E.A. // J. Polym. Sci. Part A: Polym. Chem. 2008. V. 46. № 15. P. 4935.
Astruc D., Boisselier E., Ornelas C. // Chem. Rev. 2010. V. 110. № 4. P. 1857.
Mintzer M.A., Grinstaff M.W. // Chem. Soc. Rev. 2011. V. 40. P. 173.
Yang J., Zhang Q., Chang H. et al. // Chem. Rev. 2015. V. 115. P. 5274.
Liko F., Hindré F., Fernandez-Megia E. // Biomacromolecules. 2016. V. 17. P. 3103.
Majoral J.-P., Caminade A.-M. // Chem. Rev. 1999. V. 99. № 3. P. 845.
Ребров Е.А., Музафаров А.М., Папков В.С. и др. // Докл. АН СССР. 1989. Т. 309. № 2. С. 376.
Музафаров A.M., Ребров E.A., Папков В.С. // Успехи химии. 1991. Т. 60. № 7. С. 1596.
Лебедев Б.В., Рябков М.В., Татаринова Е.А. и др. // Изв. АН. Сер. хим. 2003. № 3. С. 523.
Смирнова Н.Н., Степанова О.В., Быкова Т.А. и др. // Изв. АН. Сер. хим. 2007. № 10. С. 1924.
Markin A.V., Sologubov S.S., Smirnova N.N. et al. // Thermochim. Acta. 2015. V. 617. P. 144.
Sologubov S.S., Markin A.V., Smirnova N.N. et al. // J. Phys. Chem. B. 2015. V. 119. № 45. P. 14527.
Sologubov S.S., Markin A.V., Smirnova N.N. et al. // J. Therm. Anal. Calorim. 2016. V. 125. № 2. P. 595.
Смирнова Н.Н., Сологубов С.С., Сармини Ю.А. и др. // Журн. физ. химии. 2017. Т. 91. № 12. С. 2030.
Сологубов С.С., Маркин А.В., Смирнова Н.Н. и др. // Журн. физ. химии. 2018. Т. 92. № 2. С. 219.
Boldyrev K., Tatarinova E., Meshkov I. et al. // Polymer. 2019. V. 174. P. 159.
Meija J., Coplen T.B., Berglund M. et al. // Pure Appl. Chem. 2016. V. 88. № 3. P. 265.
Varushchenko R.M., Druzhinina A.I., Sorkin E.L. // J. Chem. Thermodyn. 1997. V. 29. № 6. P. 623.
Малышев В.М., Мильнер Г.А., Соркин Е.Л. и др. // Приб. техн. экспер. 1985. № 6. С. 195.
Sabbah R., Xu-wu A., Chickos J.S. et al. // Thermochim. Acta. 1999. V. 331. № 2. P. 93.
Höhne G.W.H., Hemminger W.F., Flammersheim H.-J. Differential Scanning Calorimetry. Berlin, Germany: Springer-Verlag Berlin Heidelberg, 2003. 310 p.
Drebushchak V.A. // J. Therm. Anal. Calorim. 2005. V. 79. № 1. P. 213.
Alford S., Dole M. // J. Am. Chem. Soc. 1955. V. 77. № 18. P. 4774.
Adam G., Gibbs J.H. // J. Chem. Phys. 1965. V. 43. P. 139.
Kauzmann W. // Chem. Rev. 1948. V. 43. № 2. P. 219.
Bestul A.B., Chang S.S. // J. Chem. Phys. 1964. V. 40. P. 3731.
Lebedev B.V. // Thermochim. Acta. 1997. V. 297. P. 143.
Experimental Thermodynamics, Volume I: Calorimetry of Non-reacting Systems / Ed. by J.P. McCullough, D.W. Scott. London, England: Butterworth & Co. Ltd., 1968. 626 p.
Chase M.W.Jr. // J. Phys. Chem. Ref. Data, Monograph No. 9. 1998. V. 1–2. P. 1.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии