Журнал физической химии, 2020, T. 94, № 3, стр. 411-417
Кинетика реакции оксиэтилирования метанола с учетом влияния ассоциации
Б. Я. Стуль *
ФГУП НИИ “Синтез”
109088 Москва, Россия
* E-mail: b.st@mail.ru
Поступила в редакцию 21.11.2018
После доработки 13.05.2019
Принята к публикации 03.09.2019
Аннотация
В условиях основного катализа при температурах 80–150°С и давлении 1.4 МПа на начальном участке в избытке спирта исследована кинетика реакции оксиэтилирования метилового спирта. Определены кинетические параметры и параметр ассоциации метанола. На основании полученных экспериментальных данных предположено, что жидкий метанол при 80–100°С существует в виде объемных гребнеобразных ассоциатов, при 115–150°С – в виде линейных цепочечных ассоциатов; 100–115°С – переходная область, наличие которой подтверждается известными из литературы изменениями трендов температурных зависимостей ряда физико-химических и спектральных свойств жидкого метанола.
Реакция оксиэтилирования спиртов в случае метанола может быть представлена следующей схемой:
Это – необратимая последовательная по спирту реакция, которая может иметь много стадий, но в данном случае рассматривается первая стадия реакции, характеризуемая константой скорости ${{k}_{{0,{\text{набл}}}}}$. Кинетика этой необратимой, последовательной по спирту реакции была исследована в ряде работ, результаты которых обобщены в [1]. В этой работе показано, что в условиях основного катализа на начальном участке в избытке спирта скорость реакции имеет первые порядки по концентрациям оксида этилена (ОЭ) и катализатора и имеет сложную зависимость от концентрации спирта. Предполагается [1], что отклонения от кинетики чистого первого порядка по концентрации спирта связаны с ассоциацией молекул спирта за счет образования водородных связей.
Ранее нами была изучена кинетика реакции оксиэтилирования первичных спиртов нормального строения состава С4–С7 [2] и С10 [3].
При этом было отмечено, что первый продукт реакции оказывает тормозящее влияние на скорость реакции. Исходя из этого было подобрано уравнение, которое описывает кинетику данной реакции:
(1)
$W = {\text{ }}(С_{0}^{{\text{o}}} - {{С}_{0}}){\text{/}}\tau {\text{ }} = {{k}_{{0,{\text{набл}}}}}{{С}_{{\text{к}}}}{{С}_{0}}(С_{{\text{c}}}^{{\text{o}}} - n{{С}_{1}}),$Для теоретического обоснования предлагаемого кинетического уравнения необходимо, чтобы выполнялись следующие условия [2, 3]:
1) молекулы спирта связаны за счет водородных связей в линейные цепочечные ассоциаты со средним числом молекул, равным n;
2) из всех молекул цепочечного ассоциата в реакцию вступает только одна из двух концевых молекул спирта (терминальная), атом водорода гидроксильной группы которой не участвует в образовании водородной связи;
3) образующаяся в результате реакции молекула моноэфира этиленгликоля остается в составе ассоциата в качестве концевой молекулы и, обладая более низкой реакционной способностью, как бы “запирает” этот ассоциат, т.е. превращает его в отдельную молекулу.
Подробное обоснование пунктов 1–3 дано в работах [2, 3]. Здесь можно лишь отметить, что ключевым из условий является пункт 3, в котором предполагается, что в реакцию вступает не мономерная молекула спирта, а линейный цепочечный ассоциат, состоящий в среднем из n молекул спирта. Остающиеся в составе ассоциата после реакции (n – 1) молекул спирта в заявленных условиях не принимают участия в дальнейшей реакции, т.е. ассоциация фактически меняет стехиометрию данной реакции. При этом получается, что скорость реакции имеет первый порядок не по брутто-концентрации спирта, а по концентрации спиртовых ассоциатов. Чтобы показать это, необходимо правую часть уравнения (1) поделить и умножить на n
(2)
$W = (С_{{\text{0}}}^{{\text{o}}} - {{С}_{0}}){\text{/}}\tau = {{k}_{{0,{\text{набл}}}}}n{{С}_{{\text{к}}}}{{С}_{0}}(С_{{\text{c}}}^{{\text{o}}}{\text{/}}n - {{С}_{1}}).$При подобной трактовке механизма реакции ключевое значение приобретает время жизни спиртового ассоциата. В работе [4] с использованием масс-спектрометрии экспериментально показано, что в газовой фазе ассоциаты метанола состава (СН3ОН)n, где n = 5–20 имеют время жизни порядка 10–4–10–5 с. При переходе к жидкой фазе вследствие клеточного эффекта время жизни ассоциата должно увеличиться на 1–2 порядка и быть не менее 10–3 с, что достаточно для протекания элементарного химического акта.
Выполнение пункта 3 также косвенно подтверждается тем, что, по данным ИК-спектроскопии [5], молекулы моноэфиров этиленгликоля, в отличие от спиртов, склонны к образованию не межмолекулярной, а внутримолекулярной водородной связи, когда атом водорода гидроксильной группы замыкается на эфирный атом кислорода той же самой молекулы. Вследствие этого в спиртовом растворе они могут образовывать только одну межмолекулярную водородную связь, т.е. не могут находиться внутри цепочки, а могут лишь замыкать ее.
В работах [2, 3] представлены результаты экспериментов по оксиэтилированию первичных спиртов нормального строения состава С4–С7 [2] и С10 [3] в интервале температур 80–180°С и результаты их обработки в соответствии с уравнением (1). При этом оказалось, что, найденные в соответствии с этой моделью, наряду с кинетическими параметрами, параметры ассоциации спиртов, представляют самостоятельный интерес.
В связи с этим целесообразно исследовать кинетику реакции оксиэтилирования метанола в ранее малоисследованном диапазоне температур 80–150°С, а также получить, в рамках используемой модели, информацию о параметре ассоциации метанола. Последнее представляет интерес еще в связи с тем, что с точки зрения ассоциации метанол – одно из наиболее исследованных соединений, в этом плане он, по-видимому, уступает только воде.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Кинетику реакции оксиэтилирования метанола исследовали в проточном реакторе смешения в интервале температур 80–150°С при давлении 1.4 МПа. Реактор представлял из себя полый цилиндрический аппарат объемом 15 см3, выполненный из титана, снабженный магнитной мешалкой, электрообогревом, карманом для термопары и трубками для ввода (внизу) и вывода (вверху) реакционной смеси. На выходе из реактора реакционная смесь охлаждалась с помощью водяного холодильника до комнатной температуры, после чего попадала в сборник, из которого могли отбираться пробы на анализ. Выход реактора на стационарный режим контролировался по анализу отбираемых проб, которые начинали отбирать при пропускании через него количества реакционной смеси, равного не менее шести объемам реактора. Как предварительно выполненные расчеты, так и проведенные эксперименты показали, что используемого давления было достаточно, чтобы практически предотвратить переход ОЭ из жидкой фазы в паровую, объем которой в установке был сведен к минимуму. Материальный баланс по ОЭ сводился в экспериментах с погрешностью не более ±5%. Погрешность в определении параметров ${{k}_{{0,{\text{набл}}}}}$ и n в большинстве случаев не превышала ±10% отн. Заданная температура в реакторе поддерживалась с точностью ±0.5 К. В экспериментах использовался коммерческий метанол с содержанием основного вещества не менее 99 мас. %, который дополнительно сушился над молекулярными ситами. В качестве катализатора использовался метилоксид натрия.
Анализ исходных смесей и продуктов реакции проводился методом ГЖХ на приборе “Цвет-100” с детектором по теплопроводности. Использовалась колонка длиной 1 м и диаметром 3 мм, заполненная полисорбом, на который было нанесено 5 мас. % ПЭГ-20М.
Поскольку во всех экспериментах реакция проводилась в большом избытке спирта, то изменением объема за счет протекания реакции пренебрегали. Мольные концентрации компонентов реакционной смеси рассчитывались с использованием коэффициентов объемного расширения для каждого компонента.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Результаты экспериментов показаны в табл. 1 и 2 и на рис. 1. В табл. 1 показаны первичные экспериментальные данные по оксиэтилированию метанола при различных температурах, а также для сравнения результаты их обработки по уравнению (1) при n = 1 (первый порядок по брутто-концентрации спирта) и при n ≠ 1 (первый порядок по концентрации спиртовых ассоциатов). Следует отметить, что в этих экспериментах выход второго продукта реакции не превышал 1% от выхода первого продукта реакции, что дает основания общую скорость реакции, определенную по убыли ОЭ, полностью относить к первой стадии этой реакции, характеризуемой константой скорости ${{k}_{{0,{\text{набл}}}}}$. В представленных в табл. 1 реакционных сериях варьировались концентрация катализатора, концентрация ОЭ и время пребывания. В некоторых экспериментах в исходную реакционную смесь добавлялось небольшое количество первого продукта реакции, поскольку такое добавление в случае спиртов С4–С7 и С10 всегда приводило к дополнительному торможению реакции. В случае n = 1 по уравнению (1) обрабатывался каждый эксперимент, при n ≠ 1 – сразу вся реакционная серия. Статистическая обработка экспериментальных данных при n ≠ 1 заключалась в том, что с использованием линейного метода наименьших квадратов подбиралось такое значение параметра n, при котором среднеквадратичный разброс значений константы скорости относительно среднего значения был минимальным, т.е. находился минимум функции F
(3)
$F = \mathop \sum \limits_{i = 1}^N \,{{({{k}_{{0,{\text{набл,}}i}}} - ~~{{k}_{{0,{\text{набл}}{\text{.cp}}}}})}^{2}},$Таблица 1.
Первичные экспериментальные данные по оксиэтилированию метанола
| τ, мин | Концентрация, моль/л | ${{k}_{{0,{\text{набл}}}}}$ × 103, л2/(моль2 с) | ||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| Ск × 103 | $C_{{\text{0}}}^{{\text{o}}}$ | Со | $C_{{\text{c}}}^{{\text{o}}}$ | Сс | $C_{1}^{{\text{o}}}$ | С1 | С2 | n = 1 | n | |
| 80оС | ||||||||||
| 9.4 | 4.7 | 0.967 | 0.910 | 21.733 | 21.670 | – | 0.057 | – | 1.09 | |
| 9.4 | 9.8 | 0.947 | 0.835 | 21.735 | 21.642 | – | 0.111 | – | 1.12 | |
| 9.4 | 14.6 | 0.876 | 0.733 | 21.824 | 21.681 | – | 0.142 | – | 1.09 | |
| 9.4 | 19.5 | 0.919 | 0.731 | 21.781 | 21.597 | – | 0.184 | – | 1.08 | |
| 9.4 | 9.8 | 0.835 | 0.745 | 20.409 | 20.325 | 0.453 | 0.534 | 0.004 | 1.07 | |
| 9.4 | 9.8 | 0.915 | 0.769 | 20.924 | 20.781 | 0.261 | 0.400 | 0.003 | 1.11 | |
| 100оС | ||||||||||
| 18.7 | 4.0 | 0.859 | 0.610 | 21.341 | 21.094 | – | 0.247 | – | 4.31 | |
| 10.4 | 4.0 | 0.832 | 0.675 | 21.367 | 21.212 | – | 0.155 | – | 4.39 | |
| 4.6 | 4.0 | 0.859 | 0.779 | 21.341 | 21.261 | – | 0.080 | – | 4.37 | |
| 9.2 | 4.0 | 0.866 | 0.715 | 21.334 | 21.181 | – | 0.149 | – | 4.52 | |
| 9.2 | 4.0 | 0.854 | 0.717 | 19.924 | 19.799 | 0.420 | 0.543 | 0.004 | 4.37 | |
| 11.5 | 4.0 | 0.688 | 0.552 | 20.660 | 20.524 | 0.215 | 0.347 | 0.002 | 4.35 | |
| 115оС | n = 19.2 | |||||||||
| 9.35 | 3.18 | 0.820 | 0.588 | 20.88 | 20.654 | – | 0.226 | 0.001 | 10.7 | 13.4 |
| 5.8 | 3.18 | 0.814 | 0.640 | 20.886 | 20.710 | – | 0.171 | 0.002 | 11.9 | 13.9 |
| 16.2 | 3.18 | 0.894 | 0.553 | 20.806 | 20.470 | – | 0.334 | 0.0017 | 9.75 | 13.9 |
| 28.4 | 3.18 | 0.859 | 0.449 | 20.841 | 20.430 | – | 0.401 | 0.002 | 8.2 | 12.9 |
| 125оС | n = 29.5 | |||||||||
| 9.3 | 3.7 | 0.42 | 0.248 | 21.18 | 21.00 | – | 0.177 | – | 16.0 | 21.0 |
| 5.6 | 3.7 | 0.462 | 0.311 | 21.14 | 21.00 | – | 0.145 | – | 18.6 | 23.2 |
| 3.9 | 3.7 | 0.454 | 0.343 | 21.15 | 21.04 | – | 0.108 | – | 17.8 | 20.8 |
| 15.5 | 3.7 | 0.462 | 0.214 | 21.14 | 20.896 | – | 0.244 | – | 16.1 | 24.2 |
| 28.0 | 3.7 | 0.458 | 0.175 | 21.142 | 20.857 | – | 0.281 | 0.001 | 12.5 | 20.2 |
| 137.5оС | n = 29.4 | |||||||||
| 8.8 | 5.3 | 0.861 | 0.367 | 20.240 | 19.753 | – | 0.483 | 0.004 | 24.4 | 79.6 |
| 8.8 | 3.5 | 0.860 | 0.425 | 20.242 | 19.805 | – | 0.435 | 0.003 | 28.0 | 74.3 |
| 8.8 | 2.0 | 0.865 | 0.502 | 20.238 | 19.872 | – | 0.360 | 0.0017 | 34.4 | 64.7 |
| 8.8 | 0.9 | 0.865 | 0.615 | 20.243 | 19.993 | – | 0.242 | 0.0008 | 42.8 | 65.2 |
| 8.8 | 1.2 | 0.870 | 0.640 | 19.730 | 19.510 | 0.210 | 0.410 | 0.0015 | 29.1 | 73.9 |
| 150оС | n = 33.2 | |||||||||
| 27.6 | 1.45 | 0.830 | 0.350 | 19.970 | 19.495 | – | 0.470 | 0.005 | 29.3 | 131 |
| 16 | 1.45 | 0.822 | 0.381 | 19.978 | 19.539 | – | 0.428 | 0.004 | 42.6 | 144 |
| 8.8 | 1.45 | 0.826 | 0.446 | 19.974 | 19.599 | – | 0.371 | 0.002 | 56.8 | 145 |
| 5.7 | 1.45 | 0.811 | 0.489 | 19.989 | 19.669 | – | 0.316 | 0.002 | 67.5 | 140 |
| 3.7 | 1.45 | 0.849 | 0.582 | 19.951 | 19.693 | – | 0.260 | 0.001 | 72.4 | 126 |
| 4.2 | 1.45 | 0.832 | 0.712 | 19.008 | 18.887 | 0.360 | 0.478 | 0.001 | 24.4 | 147 |
Таблица 2.
Константы скорости реакции оксиэтилирования и параметр ассоциации метанола в зависимости от температуры при Р = 1.4 МПа
| t, °С | 80 | 100 | 115 | 125 | 137.5 | 150 |
|---|---|---|---|---|---|---|
| ${{k}_{{0,{\text{набл}}}}}$ × 103, л2/(моль2 c) | 1.09 ± 0.02 | 4.38 ± 0.07 | 13.5 ± 0.5 | 21.9 ± 1.7 | 71.5 ± 6.4 | 139 ± 8.5 |
| n | 1 | 1 | 19.2 | 29.5 | 29.4 | 33.2 |
Как видно из табл. 1, при температурах 80 и 100°С скорость реакции описывается обычным кинетическим уравнением с первыми порядками по концентрациям компонентов и катализатора, т.е. уравнением (1) с n = 1. В каждой серии наблюдается постоянство константы скорости, причем добавление в исходную реакционную смесь небольших количеств первого продукта реакции не приводит к изменению константы скорости. Следует отметить, что первый порядок по брутто-концентрации спирта не наблюдался в случае спиртов С4–С7 и С10.
При 115–150°С наблюдается та же самая картина, что и в случае спиртов С4–С7 и С10: чем выше выход первого продукта реакции, тем ниже, при прочих равных условиях, константа скорости, рассчитанная по уравнению первого порядка с n = 1. Добавление в исходную реакционную смесь небольших количеств первого продукта реакции приводит к дополнительному торможению. В то же время удовлетворительное постоянство константы скорости реакции достигается при обработке экспериментальных данных по уравнению (1) с n ≠ 1, т.е. наблюдается такая же картина, как и в случае спиртов С4–С7 и С10.
Из полученных результатов следует,что при 115–150°С метанол, по-видимому, так же как и спирты С4–С7 и С10, существует в виде линейных цепочечных ассоциатов. Тогда, чтобы с ростом температуры наблюдалось падение числа ассоциации, необходимо предположить, что при 80–100°С метанол существует в виде объемных, например, гребнеобразных [6] ассоциатов. В этом случае наблюдаемый с ростом температуры рост числа ассоциации является лишь кажущимся. Это связано с тем, что данный метод позволяет определять число ассоциации лишь в линейных цепочечных ассоциатах, в которых каждая молекула спирта стремится, в среднем, быть связанной с двумя ближайшими молекулами и не определяет число ассоциации в объемных гребнеобразных ассоциатах, где большая часть молекул связана с тремя ближайшими соседями. Поэтому наблюдаемый некоторый рост числа ассоциации в линейных цепочечных ассоциатах может быть компенсирован соответствующим большим падением числа ассоциации в объемных ассоциатах. Такая избирательность метода, по-видимому, связана с тем, что в случае объемных ассоциатов образующаяся в результате реакции молекула монометилового эфира этиленгликоля, в силу стерических затруднений или по причинам энергетического порядка, выходит из состава ассоциата, т.е. не выполняется пункт 3 принятых допущений, и в результате наблюдается первый порядок по брутто-концентрации спирта.
Таким образом, с повышением температуры в гребнеобразном ассоциате боковые цепочки начинают отсоединяться от основной и в результате остается линейный цепочечный ассоциат. При этом доля молекул спирта, связанных с тремя соседними молекулами, уменьшается, что не фиксируется данным методом, а фиксируется лишь возрастающая доля двукратно связанных молекул спирта, что и приводит к кажущемуся росту числа ассоциации.
В общем здесь происходит то же самое, что часто происходит в случае кристаллов [7]. При низких температурах они имеют неплотную анизотропную упаковку, которая существует благодаря заметному вкладу нецентральных сил и трехчастичному взаимодействию. С повышением температуры вклад центрального парного взаимодействия возрастает, что приводит к появлению изотропных упаковок, имеющих более резкую зависимость плотности от температуры.
Полученные значения констант скорости и параметров ассоциации представлены в табл. 2 и в аррениусовских координатах на рис. 1.
Как видно из рис. 1, реакционная способность гидроксильных групп метанола не зависит от внутреннего строения метанольных ассоциатов, поскольку на зависимости ln ${{k}_{{0,{\text{набл}}}}}$ – 1/Т нет аномалий. Энергия активации реакции Еакт = 81 ± ± 5 кДж/моль. Отличие в реакционной способности объемных кластеров и цепочечных ассоциатов проявляется только благодаря разной стехиометрии их реакций с ОЭ.
Следует отметить, что в работе [8] методом молекулярной динамики показано, что в предкритическом метаноле при T = 485–506 K, n ≈ 15–20, что с учетом падения n с повышением температуры, коррелирует с нашим значением n ≈ 29–33 при T = 398–423 K. В то же время использование квазихимического подхода к моделированию надмолекулярной организации и диэлектрической проницаемости метанола при T = 398–423 K приводит к несколько меньшим значениям n ≈ ≈ 12–15 [9], т.е. можно считать, что данный способ определения параметра ассоциации в случае метанола, так же как и в случае спиртов С4–С7 и С10, дает результаты сопоставимые с литературными данными.
Можно также отметить, что классическая теория нуклеации для метанола приводит к значению n ≈ 24 [10]. Но независимо от проведенной идентификации структур жидкого метанола химическая кинетика указывает на структурную перестройку, которая происходит в жидком метаноле при 100–115°С. Если такая перестройка структуры действительно имеет место, то это должно отражаться на поведении некоторых физико-химических и спектральных свойств жидкого метанола в этом температурном интервале.
В работе [11] исследованы ИК-спектры жидкого метанола в области первых обертонов валентных колебаний ОН-групп, начиная от температуры плавления и до критической. При 80–105°С наиболее интенсивной в спектре является полоса с центром на частоте ν = 6849 см–1. При температурах выше 105оС наиболее интенсивной становится полоса с ν = 7092 см–1. Первую из этих полос относят к колебаниям энергетически ненасыщенных, разрыхленных ОН-связей. Вторая полоса отнесена к свободным ОН-группам в концевых молекулах ассоциатов и в мономерных молекулах спирта. В данном случае важно отметить, что температура, при которой наблюдаются резкие изменения в ИК-спектре (105°С) находится почти в середине интервала температур, в котором наблюдается изменение параметра ассоциации. Pабота [11] не только подтверждает существование перехода, но фактически дает ключ к идентификации структуры до и после перехода. До перехода энергетически ненасыщенные, разрыхленные ОН-связи – это объемные гребнеобразные ассоциаты (большой вклад нецентральных сил и трех частичное взаимодействие) и после перехода – линейные цепочечные структуры (центральное парное взаимодействие).
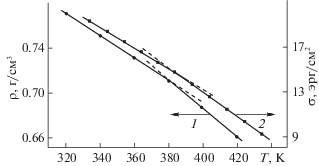
В работе [12] измерена плотность жидкого и сверхкритического метанола при давлениях до 200 МПа и температурах 320–420 К с интервалом 20 К. Как следует из этих данных, при давлениях до 100 МПа каждая из этих изобар может быть представлена в виде двух пересекающихся прямых с точкой пересечения около 380 К, что совпадает с серединой температурного интервала скачка параметра ассоциации, определенного кинетическим методом. На рис. 2 в качестве примера показана зависимость плотности жидкого метанола от температуры при давлении 5 МПа [12]. Таким образом, из данных [12] следует, что при умеренных давлениях тренд зависимости плотности жидкого метанола от температуры меняется при 380 К, в согласии с результатами кинетических исследований.
На рис. 2 представлены также справочные данные по поверхностному натяжению жидкого метанола в зависимости от температуры [13]. Видно, что эта зависимость очень похожа на указанную выше, и точка пересечения находится в той же самой области.
В работе [14] методом протонного магнитного резонанса измерена разность химических сдвигов протонов гидроксильных и метильных групп жидкого и сверхкритического метанола в зависимости от температуры при 297–392 К и давлениях до 103 МПа с интервалом около 20 МПа. Каждая из полученных изобар также представляет собой две пересекающиеся прямые с точкой пересечения, лежащей в интервале 105–110°С.
Таким образом, результаты работ [11–14] подтверждают наличие структурного перехода в жидком метаноле при 100–115°С. В подтверждение этого структурного перехода, по-видимому, можно привести еще один факт. В работе [15] измерена теплопроводность парообразного метанола в зависимости от температуры при атмосферном давлении. Эта зависимость показана на рис. 3 (кривая 1). Видно, что с понижением температуры при приближении к температуре конденсации происходит скачкообразный рост теплоемкости. Авторы объясняют этот рост ассоциацией. Резкий рост теплоемкости с понижением температуры очень похож на кривую перехода от линейной цепочечной структуры к объемным ассоциатам, происходящего в жидком метаноле, полученную в данной работе (рис. 3, кривая 2). Однотипность этих зависимостей приводит к выводу о том, что образующиеся с понижением температуры зародыши жидкой фазы имеют линейную цепочечную структуру, которая сразу превращается в объемные ассоциаты, внося дополнительный вклад в рост теплоемкости. Несовпадение температуры объясняется разностью давлений: теплоемкость измерялась при атмосферном давлении, а наша зависимость – при Р = 1.4 МПа, т.е. эта работа также, по-видимому, подтверждает наши результаты.
Рис. 3.
Зависимости от температуры теплоемкости парообразного метанола (1) по данным [15] и параметра n (2) по данным настоящей работы.

Таким образом, показано, что при температурах 80–100°С скорость реакции оксиэтилтитрования метанола имеет первый порядок по брутто-концентрации спирта. При 115–150°С скорость реакции имеет первый порядок по концентрации спиртовых ассоциатов. На основании полученных результатов по изменению кинетики и с учетом литературных данных предположено, что жидкий метанол при температурах 80–100°С существует в виде объемных гребнеобразных ассоциатов, при 115–150°С ассоциаты метанола имеют линейную цепочечную структуру. Интервал температур 100–115°С – переходная область. В этой области происходит структурная перестройка жидкого метанола, существование которой подтверждается известными из литературы изменениями трендов температурных зависимостей ряда физико-химических и спектральных свойств жидкого метанола.
Список литературы
Швец В.Ф., Цивинский Д.Н. // Кинетика и катализ. 1981. Т. 22. № 5. С. 1192.
Стуль Б.Я., Чесноков Б.Б. // Там же. 2002. Т. 43. № 5. С. 794.
Стуль Б.Я. // Журн. физ. химии. 2016. Т. 90. № 4. С. 532.
Lu W., Yang S. // Phys. Chem. A. 1998. V. 102. № 5. P. 825.
Смирнова Н.А. Молекулярные теории растворов. Л.: Химия, 1987. 336 с.
Дуров В.А. Растворы неэлектролитов в жидкостях. М.: Наука, 1989. С. 36.
Бражкин В.В., Волошин Р.Н., Ляпин А.Г., Попова С.В. // Успехи физ. наук. 1999. Т. 169. № 9. С. 1035.
Krishtal S., Kiselev M., Kolker A., Idrissi A. // Teor. Chem. Acc. 2007. V. 117. P. 297.
Дуров В.А., Шилов И.Ю. // Журн. физ. химии. 2008. Т. 82. № 11. С. 2049.
Laksmono H., Tanimura S., Allen H.C., Wilemski G. et al. // Phys. Chem. Chem. Phys. 2011. V. 13. P. 5855.
Luck W.A.P., Ditter W. // Ber. Bunsenges Physik. Chem. 1968. V. 72. S. 365.
Osada O., Sato M., Uematsu M. // J. Chem. Thermodyn. 1999. V. 31. P. 451.
Варгафтик Н.Б. Справочник по теплофизическим свойствам газов и жидкостей. М.: Физматгиз, 1963. 708 с.
Müßig S., Frank E.U., Holz M. // Z. Physik. Chem. 2000. V. 214. P. 975.
Craven R.J.B, de Reuck K.M., Wakeham W.A. // Pure & Appl. Chem. 1989. V. 61. № 8. P. 1379.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии