Журнал физической химии, 2020, T. 94, № 4, стр. 602-609
Ионообменное извлечение платины(IV) в присутствии серебра(I) из солянокислых растворов
О. Н. Кононова a, *, Е. В. Дуба a, А. С. Ефимова a, А. И. Иванов a, А. С. Крылов b
a Сибирский федеральный университет, Институт цветных металлов и материаловедения
Красноярск, Россия
b Российская академия наук, Сибирское отделение, Институт физики им. Л.В. Киренского
Красноярск, Россия
Поступила в редакцию 25.05.2019
После доработки 27.08.2019
Принята к публикации 17.09.2019
Аннотация
Исследована ионообменная сорбция хлоридных комплексов платины(IV) в присутствии хлорокомплексов серебра(I) из 2 и 4 М водных растворов соляной кислоты на ряде анионитов марки Purolite с различными функциональными группами. Выявлена высокая селективность изучаемых сорбентов по отношению к платине при ее извлечении как из индивидуальных солянокислых растворов, так и в присутствии хлоридных комплексов серебра. При этом последние практически не сорбируются в присутствии платины(IV), поэтому удается осуществить их разделение на стадии сорбции. Выявлены отличные кинетические свойства исследуемых анионитов, позволяющие осуществить элюирование платины после ее отделения от хлорокомплексов серебра в динамическом режиме.
В настоящее время объем потребления благородных металлов неуклонно возрастает. При этом пополнение сырьевой базы возможно как путем открытия и освоения новых месторождений, так и за счет более широкого использования различных вторичных сырьевых ресурсов и отходов [1, 2].
В связи с этим и открытые новые месторождения металлов платиновой группы, в которых присутствует в промышленных масштабах значительное количество сопутствующих металлов, в частности серебро, и отходы радиоэлектронного лома, а также большое количество отработанных и промывных растворов аффинажного производства требуют переработки с целью извлечения и разделения ценных компонентов [1–7].
Ряд многочисленных проблем в области извлечения благородных металлов из разных технологических растворов создает широкое поле для использования сорбционных методов, отличающихся простотой, избирательностью, экологической безопасностью, а также возможностями обработки больших объемов растворов без изменения их состава [1, 2, 4, 6–9]. Однако по-прежнему актуальным остается для этих целей поиск высокоэффективных сорбентов.
Известно [1, 4, 7, 10], что промышленные растворы платиновых металлов представляют собой в большинстве случаев хлоридные комплексы с различными составом и химической инертностью, а также характеризуются разнообразием степеней окисления и форм нахождения компонентов. Ввиду этого весьма актуально использование селективных ионитов для концентрирования благородных металлов, поскольку такие сорбенты позволяют извлекать ценные компоненты даже в следовых количествах и в присутствии ряда сопутствующих элементов, концентрация которых превышает порой на несколько порядков таковую благородных металлов [1, 2, 4, 6, 9, 11–15].
Следует отметить, что ионное состояние платины в солянокислых и хлоридных средах детально изучено в ряде теперь уже ставших классическими работ [1, 10, 16–19]. Однако отсутствуют литературные данные по сорбционному концентрированию платины из солянокислых растворов в присутствии серебра(I), в которых последнее существует в виде хлоридных комплексов. На сегодняшний день известна только одна работа по сорбции платины и палладия из азотнокислых растворов серебра [20]. Ранее [21, 22] нами исследована как сорбция серебра(I) из солянокислых сред на анионитах, так и извлечение палладия(II) в присутствии серебра(I) из этих растворов. Был установлен аномальный характер ионообменных равновесий в системах анионит–хлоридные комплексы серебра(I)–HCl, влияющий на сорбцию палладия(II). Данная работа посвящена исследованию ионообменного извлечения хлоридных комплексов платины(IV) и серебра(I) при их совместном присутствии в солянокислых растворах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Объектами исследования были выбраны иониты с различными функциональными группами, синтезированные компанией PuroliteLtd, физико-химические свойства которых приведены в табл. 1. После соответствующей подготовки по общепринятым методикам сорбенты были переведены в хлоридную форму.
Таблица 1.
Физико-химические характеристики исследуемых ионитов на основе Ст – ДВБ
| Ионит | Тип | Физическая структура | Функциональные группы | QCl, ммоль/г | Н, % | А, % |
|---|---|---|---|---|---|---|
| Purolite A500 | Сильноосновный анионит типа I | МП | ЧАО, I тип | 1.2 | 57–63 | 20 |
| Purolite A300 | Сильноосновный анионит типа II | Г | ЧАО, II тип | 1.4 | 40–45 | 10 |
| Purogold™ S992 | Комплексообразующий анионит | МП | СА | 4.4 | 47–55 | – |
| Purolite S985 | Комплексообразующий анионит на основе ПА – ДВБ | МП | ПАГ | 2.3 | 52–57 | 20 |
| Purolite A110 | Слабоосновный анионит | МП | Первичные АГ | 2.0 | 60–66 | 50 |
| Purogold™ A193 | Анионит смешанного типа | МП | ЧАO, I тип; ТАГ | 3.8 | 46–56 | 22 |
Обозначения: Ст – стирол; ДВБ – дивинилбензол; МП – макропористый; Г – гелевый; ЧАО – четвертичное аммониевое основание; СА – смешанные амины; ПА – полиакрилат; ПАГ – полиаминные группы; АГ – аминогруппы; ТАГ – третичные аминогруппы, QCl – обменная емкость по хлорид-иону, Н – гигроскопичность, А – набухаемость.
Исходный раствор платины(IV) с концентрацией 10.76 ммоль/л готовили растворением точной навески металлической платины в небольшом объеме “царской водки”. Затем упаривали до влажных солей, прибавляя попеременно три раза концентрированную HCl и дистиллированную воду. Остаток растворяли в 6 MHCl, переводили в мерную колбу на 50 мл и доводили до метки той же кислотой [16, 17]. В работе использовали свежеприготовленные растворы платины(IV) с концентрациями 0.0025–0.25 ммоль/л в 2 и 4 MHCl.
Исходные растворы хлоридных комплексов серебра(I) готовили растворением точных навесок AgNO3 (“ч. д. а.”) в 2 или 4 М HCl. Детальная методика приготовления этих комплексов приведена в [21, 22]. В работе использовали растворы хлоридных комплексов с концентрацией по серебру 0.90–1.0 ммоль/л.
Концентрации Pt(IV) и Ag(I) в контактирующих солянокислых растворах определяли спектрофотометрическим методом соответственно с раствором SnCl2 · 2H2O и бромпирогаллоловым красным [16, 17, 23]. Ионное состояние благородных металлов в исследуемых растворах контролировали путем снятия спектров поглощения в интервале длин волн 190–800 нм на спектрофотометре “Specol 1300” (CarlZeiss, Jena-Analytic).
Выбор исходных концентраций платины и серебра, а также кислотности среды сделан нами на основании приближения условий эксперимента к производственным, имеющим место при извлечении благородных металлов из первичных или вторичных источников [1, 2, 4].
Сорбцию ионов Pt(IV) и Ag(I) из солянокислых сред проводили в статических условиях при соотношении твердой и жидкой фаз 1:100 (навески ионитов составляли 0.1–0.2 г, объем контактирующего раствора – 10.0–20.0 мл) и температуре (20 ± 1)°С. Время установления равновесия, определенное специальным экспериментом, составляло 24 ч.
Сорбционную способность исследуемых ионитов оценивали посредством обменной емкости (ОЕ), степени извлечения благородных металлов (R, %), коэффициентов распределения (D) и коэффициентов разделения (S):
где С0 – концентрация платины или серебра в исходном растворе, ммоль/л; Ср – то же в равновесном растворе; V – объем раствора, л; g – навеска ионита, г; DPt и DAg – соответственно коэффициенты распределения платины(IV) и серебра(I).Изотермы сорбции строили методом вариации молярных отношений ионитов к количеству ионов Pt(IV) или Ag(I) в контактирующем растворе [24, 25]. На основании полученных изотерм рассчитывали коэффициенты равновесия ($\tilde {\tilde {K}}$) согласно закону действующих масс [26, 27]. В соответствии с этим законом, анионообменное равновесие можно записать в следующем виде:
(5)
${{z}_{B}}{{\bar {A}}^{{{{z}_{{\bar {A}}}}}}} + {{z}_{A}}{{B}^{{{{z}_{{\bar {B}}}}}}} \leftrightarrow {{z}_{B}}{{A}^{{{{z}_{{\bar {A}}}}}}} + {{z}_{A}}{{\bar {B}}^{{{{z}_{{\bar {B}}}}}}}.$Тогда коэффициент этого равновесия принимает вид:
(6)
$\tilde {\tilde {K}} = \frac{{{{{\overline {{{C}_{B}}} }}^{{{{z}_{A}}}}}{{C}_{A}}^{{{{z}_{B}}}}}}{{{{{\overline {{{C}_{A}}} }}^{{{{z}_{B}}}}}{{C}_{B}}^{{{{z}_{A}}}}}},$Раман-спектры изучаемых сорбентов снимали на раман-фурье-спектрометре RFS 100/SBruker. Спектры получали в результате 300 сканирований в интервале 100–3500 см–1. Кинетические свойства ионитов исследовали методом “ограниченного объема” [24, 25, 28]. Навески ионитов (0.1 г) перемешивали с 10.0 мл раствора платины (индивидуальные растворы или в присутствии серебра) при (20 ± 1)°С за период от 1 мин до 24 ч. Время насыщения составило 1, 2, 3, 5, 15, 30 и 45 мин; 1, 2, 3, 6 и 24 ч. Суспензии интенсивно перемешивали (800 об./мин). По прошествии соответствующего времени контакта, иониты и раствор быстро разделяли на пористом стеклянном фильтре, а затем определяли в растворах концентрацию платины (или серебра) спектрофотометрическим методом. По результатам определения рассчитывали степень обмена (F):
где ${{Q}_{t}}$ и ${{Q}_{\infty }}$ – соответственно количества (ммоль) платины или серебра, сорбированных к моменту времени $t$ и по достижении равновесия.Затем строили кинетические кривые $F = f(t)$, из которых определяли время полуобмена (${{t}_{{1/2}}}$, с) при $F = 0.5$ и рассчитывали коэффициент диффузии (${{D}_{s}}$, см2/с):
где $r$ – радиус зерна ионита, см.Интерпретацию кинетических данных осуществляли согласно классической модели Бойда [24, 28], используя формальный кинетический коэффициент ($B$):
Если процесс контролируется гелевой диффузией, функция $Bt = f(t)$ должна быть линейной.Кроме статических условий, изучали сорбцию хлоридных комплексов Pt(IV) и Ag(I), а затем их элюирование в динамическом режиме в стеклянных колонках диаметром ∼1 см. Предварительно набухшие иониты в HCl требуемой концентрации помещали в колонку на высоту слоя 1.5 см, после чего пропускали 100.0 мл растворов платины и серебра со скоростью 1 мл/мин. Оптимальные в данных условиях высоту слоя и скорость пропускания раствора устанавливали на основании специальных экспериментов. Вытекающий фильтрат собирали порциями 5.0–10.0 мл, в каждой из которых определяли содержание ионов благородных металлов.
После насыщения ионитов сорбируемыми ионами проводили элюирование ионов платины солянокислым раствором тиомочевины (1 М раствор в 0.5 М HCl), а серебра – 1% раствором аммиака. Элюаты собирали фракциями по 10.0 мл, в каждой из которых определяли концентрации извлекаемых ионов спектрофотометрическим методом: платины в тиомочевинном растворе – по собственной окраске комплексов при длине волны 309 нм [29], а серебра – с рубеановодородной кислотой [23, 29].
Все полученные результаты были подвергнуты статистической обработке. Средняя ошибка для трех параллелей не превышала 6%.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Известно, что ионное состояние платиновых металлов в солянокислых растворах зависит от кислотности среды, концентрации хлорид-ионов и от температуры [1, 16–19]. В растворах с концентрацией HCl 3 моль/л и более доминирует форма [PtCl6]2–. При 0.1 M < CHCl < 3 M наряду с гексахлороплатинатом(IV) присутствует комплекс [Pt(H2O)Cl5]–. Обе формы обладают высокой устойчивостью и кинетической инертностью [1, 18, 19]. Общая константа устойчивости ионов [PtCl6]2– оценивается равной lg β6 = 33.9 [1, 17]. Ступенчатые константы устойчивости комплекса [Pt(H2O)Cl5]– при температуре 25°С и ионной силе раствора 0.5–0.8 составляют lg K5 = 3.70–5.60 [1, 19]. Что касается ионов серебра, то в исследуемых нами растворах 2–4 М HCl наиболее вероятно присутствие его в виде комплекса [AgCl2]– [30, 31]. Общая константа устойчивости этого комплекса оценивается равной lg β2 = 5.04 [32]. В спектрах поглощения исходных солянокислых растворов Pt(IV) и Ag(I), исследуемых нами, максимумы поглощения соответствуют приведенным комплексам, т.е. согласуются с литературными данными.
Предварительно нами были исследованы сорбционные свойства изучаемых ионитов при извлечении платины(IV) и серебра(I) из индивидуальных растворов. Было выявлено, что аниониты обладают отличными сорбционными характеристиками при извлечении платины (степень извлечения превышает 95%), независимо от исходной концентрации HCl. В тех же условиях извлечение хлоридных комплексов серебра происходит на уровне 80–90% и несколько зависит от концентрации кислоты в контактирующем растворе, возрастая в 2 М HCl, что можно объяснить снижением конкурирующего влияния хлорид-ионов.
Далее исследовали сорбционные свойства изучаемых ионитов при извлечении платины(IV) в присутствии хлоридных комплексов серебра(I). Результаты представлены в табл. 2. Из приведенных данных видно, что аниониты практически не снижают свои сорбционные характеристики по отношению в платине, поскольку степень ее извлечения остается на уровне более 95%. При этом серебро в присутствии платины извлекается не более чем на 4%, что находится на уровне ошибки спектрофотометрического метода анализа [23]. Такое поведение ионитов однозначно связано с проявлением ярко выраженной селективности к хлоридным комплексам платины, что можно объяснить существенными различиями в устойчивости хлоридных комплексов [PtCl6]2–, [Pt(H2O)Cl5]– и [AgCl2]–. Из теории селективности известно, что аниониты проявляют более высокую поглощающую способность к более устойчивым комплексам [33, 34]. При этом кислотность контактирующего раствора практически не влияет на сорбционную способность ионитов. Коэффициенты разделения платины и серебра в растворах HCl, приведенные в табл. 2, имеют столь высокие значения, существенно превышающие единицу, что позволяют предположить полное отделение хлоридных комплексов платины(IV) от таковых серебра(I) еще на стадии сорбции.
Таблица 2.
Сорбционное извлечение платины(IV) и серебра(I) при совместном присутствии из солянокислых сред (С0(Pt) = 0.25 ммоль/л; С0(Ag) = 0.90 и 0.95 ммоль/л соответственно в 2 и 4 М HCl)
| Ионит | C0(HCl), моль/л | Платина (IV) | Серебро (I) | S | ||
|---|---|---|---|---|---|---|
| lg D | R, % | lg D | R, % | |||
| Purolite A500 | 4 | 2.44 ± 0.15 | 97 ± 3 | –0.40 | 4.1 | 690 |
| 2 | 2.59 ± 0.16 | 98 ± 2 | –0.40 | 4.2 | 983 | |
| Purolite A300 | 4 | 2.55 ± 0.15 | 97 ± 3 | –0.39 | 4.3 | 903 |
| 2 | 3.33 ± 0.21 | 99 ± 1 | –0.38 | 4.3 | 5383 | |
| Purogold™ S992 | 4 | 2.31 ± 0.14 | 95 ± 5 | –0.38 | 4.3 | 184 |
| 2 | 2.84 ± 0.17 | 98 ± 2 | –0.39 | 4.3 | 1738 | |
| Purolite S985 | 4 | 2.32 ± 0.14 | 95 ± 5 | –0.38 | 4.2 | 180 |
| 2 | 2.58 ± 0.16 | 97 ± 3 | –0.38 | 4.3 | 940 | |
| Purolite A110 | 4 | 2.36 ± 0.14 | 96 ± 4 | –0.39 | 4.3 | 650 |
| 2 | 2.48 ± 0.15 | 97 ± 3 | –0.39 | 4.3 | 752 | |
| Purogold™ A193 | 4 | 2.33 ± 0.14 | 96 ± 4 | –0.39 | 4.3 | 530 |
| 2 | 2.51 ± 0.15 | 97 ± 3 | –0.39 | 4.2 | 805 | |
Далее были получены изотермы сорбции хлоридных комплексов Pt(IV) из индивидуальных растворов и в присутствии Ag(I) на изучаемых анионитах. Из представленных на рис. 1 на примере анионита смешанного типа Purogold™ A193 изотерм следует, что они имеют вид выпуклых кривых, характер которых практически не меняется в присутствии хлорокомплексов серебра(I).
Рис. 1.
Изотермы сорбции платины(IV) на анионите Purogold™ A193 из индивидуальных растворов (а) и в присутствии серебра(I) (б) при концентрации HCl 2 (1) и 4 моль/л (2).

На основании полученных изотерм сорбции нами рассчитаны коэффициенты равновесия, представленные в табл. 3. Согласно общей теории ионообменного равновесия [24, 25, 33, 34], величины этих коэффициентов являются количественными характеристиками селективности ионитов. Для бинарных систем коэффициенты равновесия менее единицы [24, 34], что имеет место в случае извлечения платины из индивидуальных солянокислых растворов. Следует отметить, что присутствие хлоридных комплексов серебра(I) в изучаемых системах не оказывает существенного влияния на селективность сорбции платины(IV), т.е. коэффициенты равновесия остаются по своим значениям меньше единицы. Исключение составляет только сильноосновный анионит PuroliteA500, для которого величины коэффициентов равновесия превышают единицу. Однако, как следует из табл. 2, этот ионит также проявляет высокую селективность при извлечении платины (R = 97–98%), сорбируя хлорокомплексы серебра на уровне ошибки эксперимента.
Таблица 3.
Коэффициенты равновесия при сорбционном извлечении платины(IV) из индивидуальных солянокислых растворов и в присутствии серебра(I)
| Ионит | Индивидуальные растворы Pt(IV) | Pt (IV) в присутствииAg (I) | ||
|---|---|---|---|---|
| 2 M HCl | 4 M HCl | 2 M HCl | 4 M HCl | |
| Purolite A500 | 0.42 ± 0.025 | 0.96 ± 0.058 | 1.23 ± 0.074 | 2.15 ± 0.13 |
| Purolite A300 | 0.18 ± 0.011 | 0.47 ± 0.028 | 0.27 ± 0.018 | 0.58 ± 0.035 |
| Purogold™ S992 | 0.21 ± 0.013 | 0.45 ± 0.027 | 0.16 ± 0.011 | 0.41 ± 0.025 |
| Purolite S985 | 0.37 ± 0.022 | 0.84 ± 0.051 | 0.28 ± 0.017 | 0.30 ± 0.018 |
| Purolite A110 | 0.62 ± 0.037 | 0.74 ± 0.044 | 0.76 ± 0.046 | 0.91 ± 0.055 |
| Purogold™ A193 | 0.31 ± 0.014 | 0.63 ± 0.032 | 0.40 ± 0.024 | 0.43 ± 0.028 |
Далее методом раман-спектроскопии исследовали механизм ионообменных процессов, происходящих при сорбции хлоридных комплексов Pt(IV) и Ag(I). Раман-спектры представлены на рис. 2 для комплексообразующего сорбента PuroliteS985 и сильноосновного анионита PuroliteA500.
Рис. 2.
Фрагменты раман-спектров анионитов PuroliteS985 (а) и PuroliteA500 (б): 1 – в исходной хлоридной форме; 2 – насыщенные раствором платины(IV); C0 (HCl) = 4 моль/л; C0 (Pt) = 0.5 ммоль/л.

Интересно отметить, что в рамановских спектрах обоих ионитов после их насыщения платиной появляются два пика при 317 и 342 см–1, что отвечает колебаниям ионов [PtCl6]2– и [PtCl4]2– в фазе ионита, поглощенных в результате ионного обмена [35]. Таким образом, в фазе исследуемых ионитов платина присутствует в виде хлоридных комплексов Pt(IV) и Pt(II). Выяснение роли функциональных групп и матриц сорбентов в этом процессе является предметом особого изучения.
Нами выявлено, что на изучаемых ионитах основным механизмом сорбции платины является анионный обмен:
Для решения практических задач необходимо знание кинетических свойств ионитов, поэтому нами исследована кинетика сорбции платины из индивидуальных растворов и в присутствии хлоридных комплексов серебра, а также установлен внутридиффузионный тип кинетики согласно классической модели Бойда [24, 25, 28]. Подтверждение кинетики процесса изучаемых систем данной модели следует из прямолинейной зависимости формального кинетического критерия от времени, представленной на рис. 3. Рассчитанные кинетические параметры приведены в табл. 4. Представленные данные свидетельствуют об отличных кинетических характеристиках изучаемых анионитов при извлечении платины, не снижающихся в присутствии конкурирующих хлорид-ионов.
Рис. 3.
Зависимости формального кинетического критерия от времени сорбции при извлечении платины(IV) из индивидуальных растворов (1, 2, 3) и в присутствии серебра(I) (4, 5, 6) на ионитах PuroliteA500 (1, 4), PuroliteS985 (3, 5) и Purogold™ A193 (2, 6).
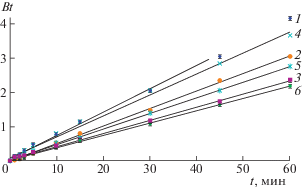
Таблица 4.
Кинетические характеристики исследуемых ионитов при сорбции платины(IV) из индивидуальных растворов и в присутствии серебра(I) в среде 4 М HCl(С0(Pt) = 0.25 ммоль/л; С0(Ag) = 0.95 ммоль/л)
| Ионит | Индивидуальные растворы Pt (IV) | Pt (IV) в присутствии Ag (I) | ||||
|---|---|---|---|---|---|---|
| ${{D}_{S}} \times {{10}^{5}}$, см2/с | ${{t}_{{1/2}}}$, с | $\bar {\nu } \times {{10}^{4}}$, ммоль/(г с) | ${{D}_{S}} \times {{10}^{5}}$, см2/с | ${{t}_{{1/2}}}$, с | $\bar {\nu } \times {{10}^{4}}$, ммоль/(г с) | |
| Purolite A500 | 0.91 | 3.2 | 5.6 | 1.1 | 5.9 | 6.8 |
| Purolite A300 | 1.2 | 7.6 | 5.4 | 1.5 | 6.0 | 6.8 |
| Purogold™ S992 | 15 | 7.3 | 5.2 | 19 | 5.8 | 6.7 |
| Purolite S985 | 0.92 | 7.4 | 5.5 | 1.1 | 5.9 | 6.7 |
| Purolite A110 | 7.6 | 7.3 | 5.5 | 9.5 | 6.0 | 6.1 |
| Purogold™ A193 | 14 | 7.6 | 5.3 | 1.9 | 5.9 | 6.7 |
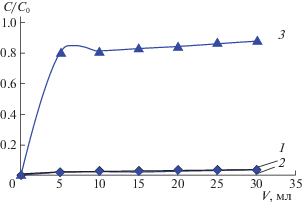
Далее исследовали сорбционное извлечение платины в динамических условиях. Выходные кривые представлены на рис. 4. Как видно из этих кривых, хлоридные комплексы платины извлекаются на уровне ∼100%, что обусловлено как высокой селективностью исследуемых сорбентов, так и более полным использованием в динамике их обменной емкости. При этом хлоридные комплексы серебра в присутствии платины по-прежнему не сорбируются (их извлечение остается на уровне погрешности спектрофотометрического определения), как это наблюдалось и в статических условиях.
Рис. 4.
Фрагменты выходных кривых при сорбции платины(IV) и серебра(I): 1 – индивидуальные растворы Pt(IV); 2 – Pt(IV) в присутствии Ag(I); 3 – Ag(I) в присутствии Pt(IV); C0(Pt) = 0.25 ммоль/л; C0(Ag) = = 0.95 ммоль/л; C0(HCl) = 4 моль/л.
Таким образом, на этапе сорбции удается достичь разделения хлоридных комплексов платины и серебра. Поэтому следующим этапом было элюирование платины, сорбированной на анионитах. Как указывалось выше, для этой цели нами использован 1 М раствор тиомочевины в 0.5 М HCl, образующий с извлекаемыми ионами платины катионные комплексы [4, 6]. В результате за один цикл сорбции–десорбции удалось элюировать платину на уровне 83–85%, что вполне удовлетворительно, учитывая высокую селективность изучаемых анионитов к платине.
Итак, исследуемые сорбенты могут быть рекомендованы к применению в технологических схемах при совместном извлечении платины и серебра из солянокислых растворов.
Авторы выражают глубокую благодарность Московскому представительству компании PuroliteLtd. и лично М.А. Михайленко за любезно предоставленные для исследования образцы ионитов.
Список литературы
Золотов Ю.А., Варшал Г.М., Иванов В.М. Аналитическая химия металлов платиновой группы. М.: Едиториал УРСС, 2003. 592 с.
Букин В.И., Игуменов М.С., Сафонов В.В. Переработка производственных отходов и вторичных сырьевых ресурсов, содержащих редкие, благородные и цветные металлы. М.: Деловая столица, 2002. 224 с.
Чернышов Н.М. // Соросовский образовательный журнал. 1998. Т. 10. С. 72.
Котляр Ю.А., Меретуков М.А., Стрижко Л.С. Металлургия благородных металлов. М.: Руда и металлы, 2005. 432 с.
Минеральное сырье: от недр до рынка. Благородные металлы и алмазы. Золото, серебро, платиноиды и алмазы / Под ред. А.П. Ставского. М.: Научный мир, 2011. 400 с.
Кононов Ю.С., Патрушев В.В., Плеханов В.П. и др. // Цветные металлы. 2012. № 9. С. 41.
Nikoloski A.N., Ang K.L. // Miner. Process. Extr. Metall. Rev. 2014. V. 35. P. 363.
Nikoloski A.N., Ang K.L. // Hydrometallurgy. 2015. V. 159. P. 20.
Miroshnichenko A.A. // Procedia Eng. 2016. V. 152. P. 8.
Rao C.R.M., Reddy C.S. // Trends in Anal. Chem. 2000. V. 19. P. 565.
Paiva A.P., Martins M.E., Ortet O. // Metals. 2015. V. 5. P. 2303.
Печенюк С.И. // Вестн. Кольского научн. центра РАН. 2013. № 14. С. 64.
Адеева Л.Н., Миронов А.В. // Вестн. Омского ун-та. 2013. № 4. С. 128.
Wolowicz A., Hubicki Z. // Chem. Eng. J. 2011. V. 171. P. 206.
Сипкина Е.И. // Изв. вузов. Прикладная химия и биотехнология. 2015. № 4. С. 7.
Гинзбург С.И., Езерская Н.А., Прокофьева И.В. и др. Аналитическая химия платиновых металлов. М.: Наука, 1972. 617 с.
Бимиш Ф. Аналитическая химия благородных металлов. М.: Мир, 1969. 486 с.
Кукушкин Ю.Н. Химия координационных соединений. М.: Высш. школа, 1985. 455 с.
Синицын Н.М., Буслаева Т.М. Химия галогенидных комплексов металлов платиновой группы. М.: Росвузнаука, 1992. 79 с.
Лебедь А.Б., Краюхин С.А., Скороходов В.И. и др. // Химия и хим. технология. 2012. Т. 55. № 3. С. 32.
Кононова О.Н., Дуба Е.В., Медовиков Д.В. и др. // Там же. 2017. Т. 91. № 12. С. 81.
Кононова О.Н., Дуба Е.В., Медовиков Д.В. и др. // Там же. 2018. Т. 92. № 10. С. 1641.
Пятницкий И.В., Сухан В.В. Аналитическая химия серебра. М.: Наука, 1975. 286 с.
Гельферих Ф. Иониты. М.: Изд-во иностр. лит., 1962. 490 с.
Кокотов Ю.А., Пасечник В.А. Равновесие и кинетика ионного обмена. Л.: Химия, 1979. 336 с.
Физическая химия. Теоретическое и практическое руководство / Под ред. Б.П. Никольского. Л.: Химия, 1987. 880 с.
Иванов В.А., Карпюк Е.А. // Сорбционные и хроматографические процессы. 2015. Т. 15. № 1. С. 19.
HelfferichF. // ReactivePolymers. 1990. V. 13. P. 191.
Умланд Ф., Янсен А., Тириг Д., Вюнш Г. Комплексные соединения в аналитической химии. М.: Мир, 1975. 532 с.
Володько В.В.. Кисель Л.Ф., Коляго А.Е. и др. // Вестн. БГУ. Серия 2. 2013. № 1. С. 33.
Таланов В.М., Житный Г.М. Ионные равновесия в водных растворах. М.: Академия естествознания, 2007. 186 с.
Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1986. 448 с.
Ионный обмен / Под ред. Я. Маринского. М.: Мир, 1968. 565 с.
Гриссбах Р. Теория и практика ионного обмена. М.: Изд-во иностр. лит., 1963. 499 с.
Накамото К. ИК-спектры и спектры КР неорганических и координационных соединений. М.: Мир, 1991. 536 с.
Дополнительные материалы отсутствуют.
Инструменты
Журнал физической химии


